INTRODUCCION
La micosis fungoide es el tipo más frecuente de linfoma cutáneo de células T 1. En la actualidad los tratamientos utilizados para la micosis fungoide son múltiples y varían según el estadio de la enfermedad. En muchas ocasiones es necesario individualizar las terapéuticas utilizadas. La fotoquimioterapia (psoraleno y radiación ultravioleta A, PUVA) es un tratamiento utilizado para la micosis fungoide desde hace casi 30 años. La PUVA está especialmente indicada para la micosis fungoide con lesiones en mancha/placa, con unos índices de respuesta de alrededor del 80 % en estadio Ia y del 60 % en estadio Ib 2,3. Habitualmente se realizan 2 o 3 sesiones de PUVA por semana, iniciando el tratamiento con dosis bajas de radiación ultravioleta A (UVA) que posteriormente se incrementan hasta conseguir la dosis máxima tolerada. El esquema terapéutico se mantiene hasta conseguir la desaparición de las lesiones cutáneas o hasta la progresión de la enfermedad. Para evitar el riesgo de cáncer cutáneo no melanoma es preferible no sobrepasar una dosis acumulada de 1.200 J/cm 2 y no se recomienda tratamiento de mantenimiento 4. Las lesiones tumorales no suelen responder a la PUVA dada la limitada capacidad de penetración en la piel de la radiación UVA. Por otra parte, las flexuras y las plantas de los pies son zonas ocultas para la radiación UVA (zonas santuario). Además, es conocido que las células de la micosis fungoide están circulando por toda la economía desde fases muy iniciales de la enfermedad. Estas últimas razones han estimulado el uso combinado de tratamientos sistémicos (acitretino, interferón [IFN] o bexaroteno) para intentar aumentar la eficacia y/o disminuir las dosis acumuladas de PUVA necesarias para el tratamiento de estos pacientes.
El bexaroteno es un agonista selectivo de los receptores nucleares RXR. Atraviesa fácilmente la membrana celular. Una vez en el citoplasma se une a CRABP-I y CRABP-II para entrar en el núcleo, donde interactúa con sus receptores específicos (RXR) que pertenecen a la superfamilia de los receptores intranucleares de hormonas esteroideas, tiroxina (T4), vitamina D y receptor activado de proliferación de peroxisomas. El bexaroteno ha sido recientemente aprobado en Europa para el tratamiento de la micosis fungoide avanzada (estadios IIb a IVb). En monoterapia, los índices de respuesta están alrededor del 55 % en estadios precoces (Ia-IIa) y del 45 % en estadios avanzados (IIb-IVb). La seguridad es elevada, pero la mayoría de los pacientes requieren tratamiento para la hiperlipidemia y el hipotiroidismo central que frecuentemente aparecen. Se usa habitualmente en dosis de 300 mg/m 2/día y se puede continuar de modo indefinido en aquellos pacientes que respondan 5,6. No se conoce bien el mecanismo de acción por el cual el bexaroteno es útil en la micosis fungoide. El bexaroteno en concentraciones clínicamente relevantes causa apoptosis de las líneas de LCCT en asociación con caspasa 3 y rotura de poli-ADP ribosa polimerasa así como inhibición de RXR alfa, RAR alfa y survivina. No causa efecto obvio sobre la expresión de Fas/Fas ligando o bcl2 en líneas celulares. Además, es capaz de inducir expresión de receptores de alta y baja afinidad de interleucina 2 (IL-2) en líneas de micosis fungoide, lo que podría aumentar la sensibilidad de las células al tratamiento con (DAB)/IL-2 (proteína quimérica que fusiona la interleucina 2 con la toxina diftérica) 7,8.
En el momento actual se está llevando a cabo un ensayo clínico comparando PUVA frente a PUVA más bexaroteno. Este ensayo ha sido promovido por el grupo de linfomas de la European Organization for Research and Treatment of Cancer (EORTC) (ensayo 21011 de la EORTC, www.eortc.be) para ver si la combinación es capaz de ahorrar radiación UVA y aumentar el tiempo hasta la recaída. En la literatura especializada existen publicados un total de 24 casos a los que se les ha aplicado de modo combinado estos dos tratamientos de micosis fungoide fuera de ensayos clínicos 9-14. En el presente trabajo presentamos nuestra experiencia en el uso combinado de PUVA y bexaroteno en 6 casos. Aunque nuestro hospital está participando en el ensayo EORTC 21011, en los casos que se presentan el tratamiento ha sido administrado al margen del citado ensayo.
PACIENTES, MATERIAL Y MÉTODOS
La base de datos de micosis fungoide del Hospital 12 de Octubre incluye 240 pacientes de micosis fungoide. En el presente trabajo se revisan de modo retrospectivo las historias de seis de ellos, que habían sido sometidos a tratamiento con PUVA más bexaroteno al margen del protocolo EORTC 21011, que compara PUVA frente a PUVA más bexaroteno. El diagnóstico de micosis fungoide se ha realizado en base a los criterios clínico-patológicos generalmente aceptados (figs. 1 y 2).
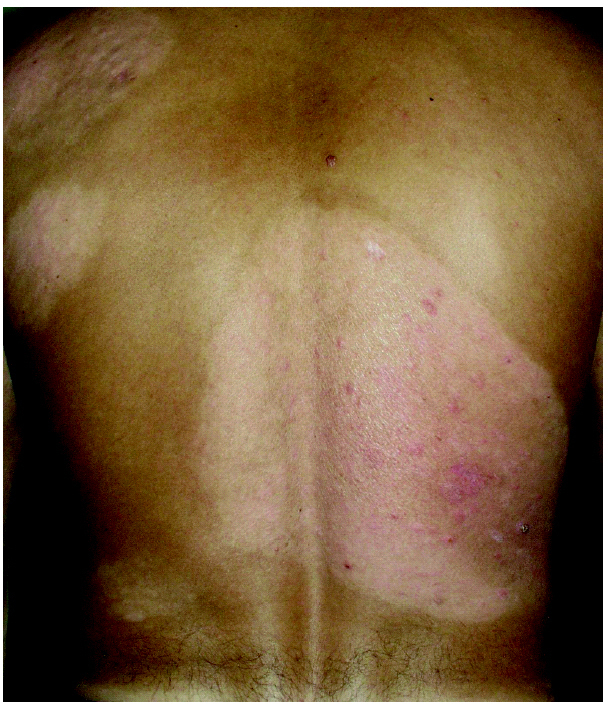
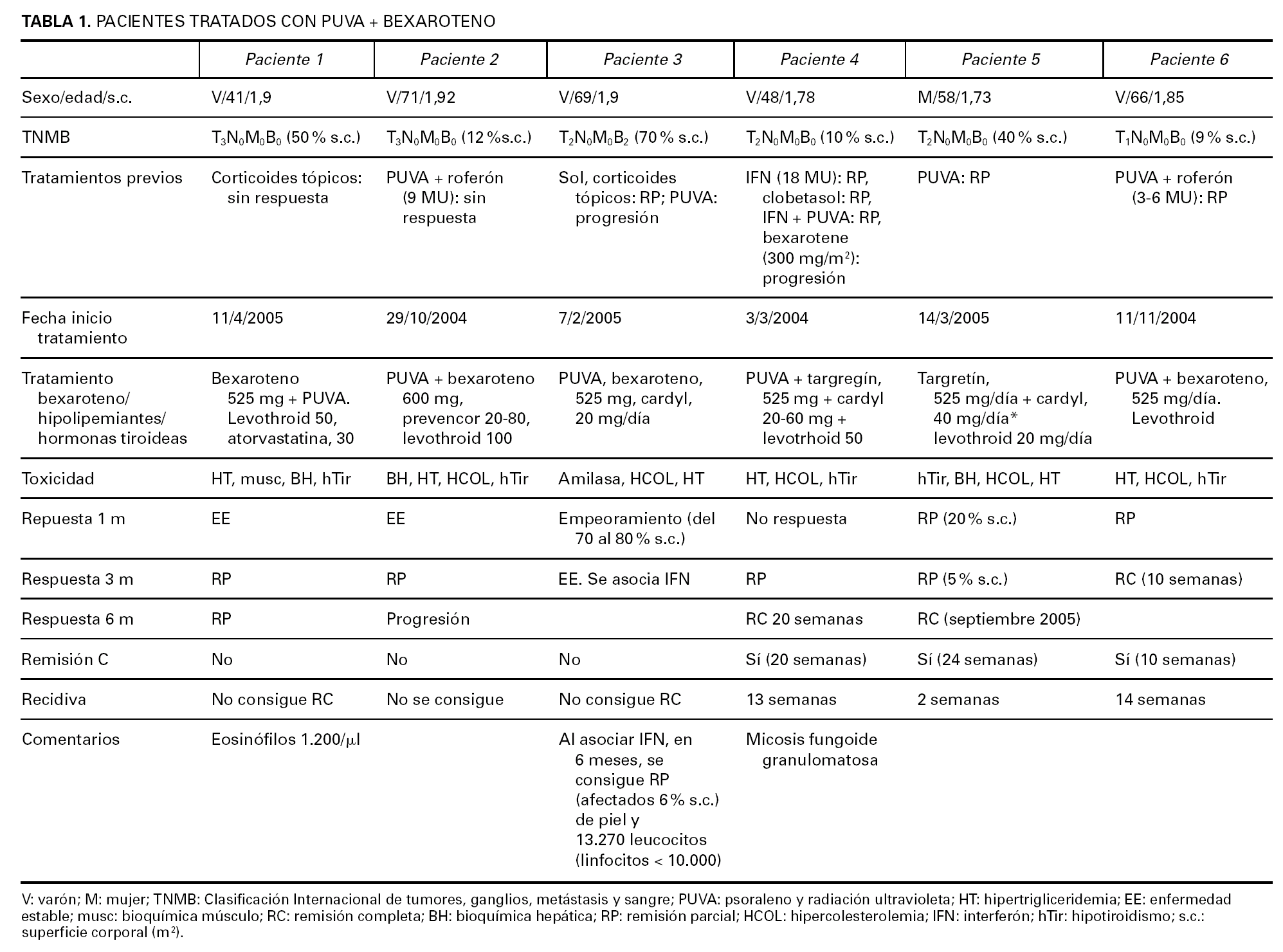
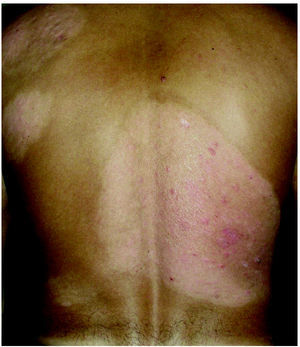
Fig. 1.--Estadio en placas previo al inicio del tratamiento.
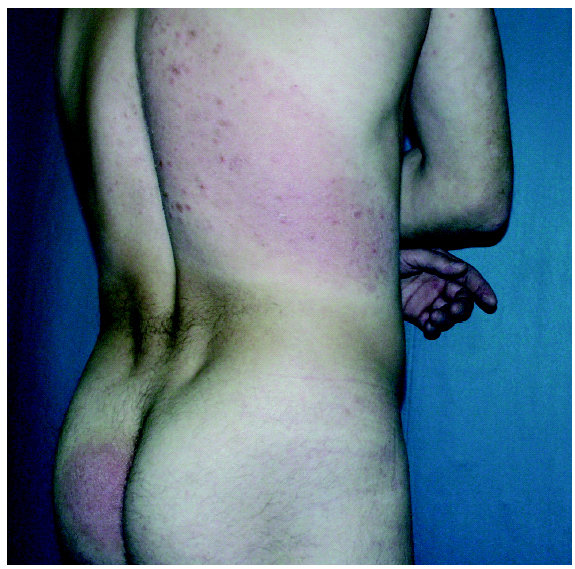
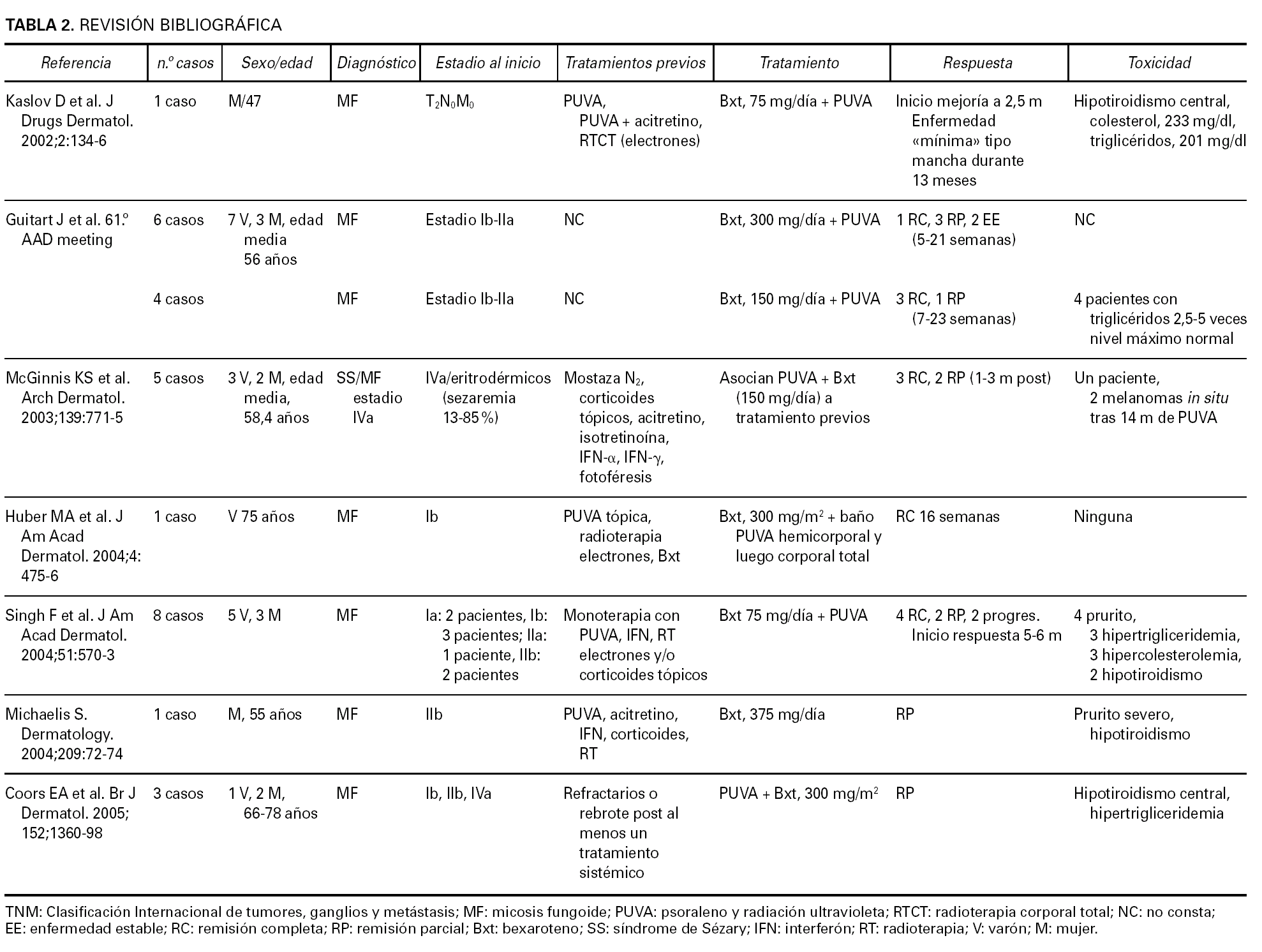
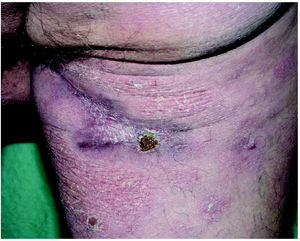
Fig. 2.--Paciente en estadio tumoral.
El bexaroteno se inició en dosis de 300 mg/m 2, con disminuciones sucesivas a 200, 100 o 50 mg/m 2 si se alcanzaban niveles de toxicidad 3 según los CTCAE (common toxicity criteria for adverse events), versión 3.0 (http://ctep.info.nih.gov/reporting/ctc.html, http://ctep.cancer.gov/forms/CTCAEv3.pdf). Antes de iniciar el tratamiento, todos los pacientes tuvieron analíticas normales. En todos los casos se inició tratamiento con atorvastatina 10 mg/12 h aproximadamente una semana antes del inicio del tratamiento con bexaroteno para prevenir hiperlipidemias. La PUVA se aplicó en 3 sesiones semanales. La primera dosis fue de 2,35 J/cm 2, con aumentos progresivos hasta la aparición de eritema o hasta un máximo de 23,5 J/cm 2.
Se definió enfermedad estable como un empeoramiento o mejoría de hasta un máximo del 25 % respecto a la extensión de las lesiones antes del tratamiento, respuesta menor a una mejoría entre el 25 y el 50 %, remisión parcial (RP), a una mejoría de más del 50 % y remisión completa (RC) a la desaparición clínica de lesiones. Se definió la progresión como un empeoramiento de más del 25 % o aparición de lesiones tumorales en aquellos pacientes que no las tuvieran previamente. El índice de respuesta (IR) es la proporción de pacientes que tuvieron RP o RC.
Se realizaron controles analíticos a las 1, 2 y 4 semanas tras el inicio del tratamiento y posteriormente cada mes. Las pruebas de laboratorio incluían análisis sistemático de sangre, bioquímica general con perfil hepático, perfil lipídico, hormona tiroestimulante, T4 libre, amilasa y creatinfosfocinasa (CPK).
RESULTADOS
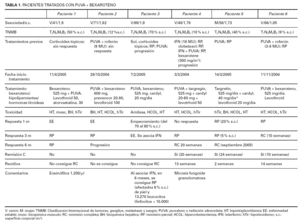
Los datos de nuestros 6 pacientes se encuentran resumidos en la tabla 1. Ninguno había obtenido remisión completa con los tratamientos utilizados previamente. Con la combinación PUVA más bexaroteno, 5 de los 6 pacientes respondieron a tratamiento (IR, 83 %; 3 RC, 2 RP) (figs. 3 y 4). De los que obtuvieron RC, uno alcanzó la remisión a las 10 semanas de tratamiento (paciente 6) y los otros necesitaron 20 y 24 semanas para conseguir RC (casos 4 y 5, respectivamente). El paciente 3 no respondió al tratamiento. Tenía el 70 % de superficie corporal afectada al inicio, con 28.500 leucocitos en sangre periférica, el 90 % de los cuales eran linfocitos atípicos. Tras 3 meses de tratamiento, las lesiones afectaban al 80 % de la superficie corporal (enfermedad estable según el criterio referido en material y métodos), con muy poca mejoría de su afectación hematológica. En este caso, se decidió asociar IFN-α2a al tratamiento (3 MU, 3 días/semana) y 6 meses después tenía alrededor del 5 % de superficie corporal afectada con 13.000 leucocitos (10.000 de ellos atípicos).
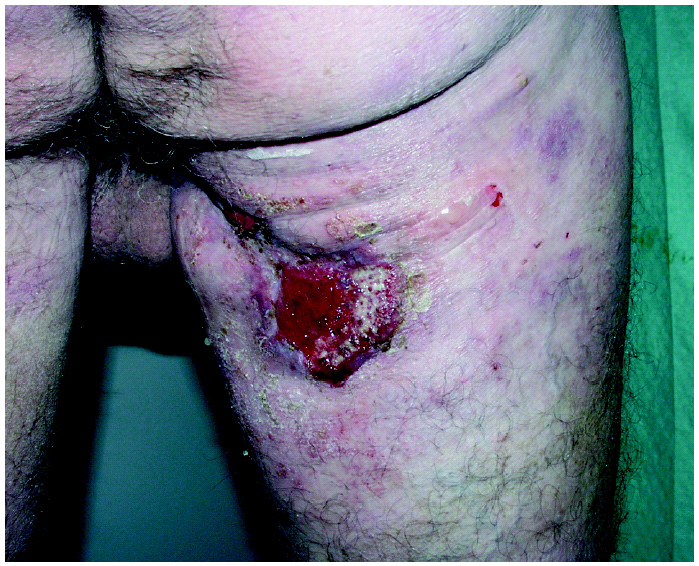
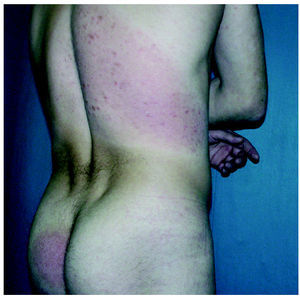
Fig. 3.--Lesiones en remisión parcial tras el tratamiento.
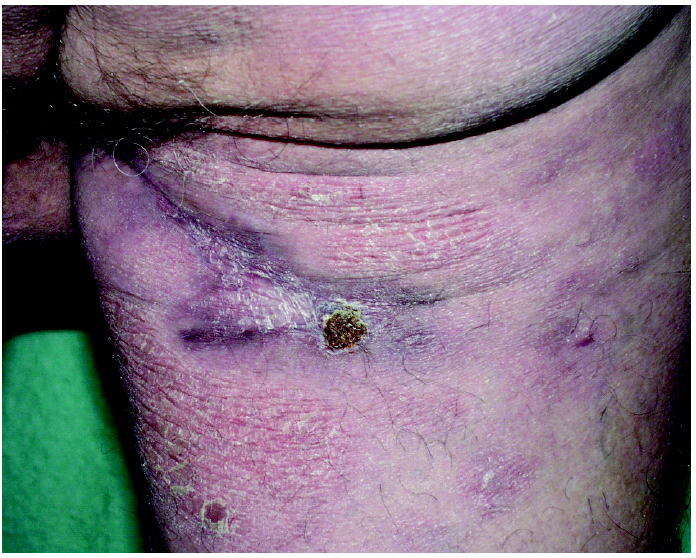
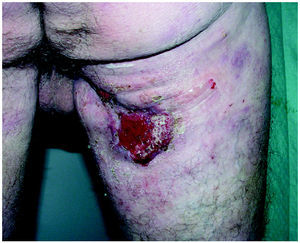
Fig. 4.--Remisión parcial tras 12 semanas de iniciado el tratamiento.
Los 2 pacientes en estadio tumoral respondieron al tratamiento. En uno de ellos la respuesta se inició tras 3 meses de tratamiento y a los 6 meses desaparecieron los tumores y la mayoría de las placas (50 % de superficie corporal afectada antes del tratamiento y 2 % al final del mismo). En el otro, a los 3 meses de tratamiento, algunas placas y tumores estaban regresando (se consideró RP). Tras 6 meses de tratamiento habían desaparecido varios de los tumores, dejando cicatrices residuales y otros se habían transformado en placas. Sin embargo, a la vez que esto ocurría, algunos de los tumores no respondieron al tratamiento y brotaron nuevas lesiones en forma de placa y tumor, lo que llevó a calificarlo como progresión.
La duración de la remisión completa en los 3 pacientes en los que se consiguió varió entre 2 y 14 semanas. El paciente 4 recayó a las 13 semanas de suspender la PUVA, aunque se mantuvo el bexaroteno. La paciente 5 rebrota unas 2 semanas después de que se suspenda o simplemente se disminuya la dosis de bexaroteno.
En cuanto a la toxicidad, todos los pacientes tuvieron hipertrigliceridemia (cifra máxima alcanzada, 1.194 mg/dl), pero sólo en cuatro de ellos fue necesario ajustar la dosis de bexaroteno. Cuando se sobrepasaba el nivel de cinco veces los valores máximos normales de laboratorio, se suspendía el bexaroteno, se aumentaba la dosis de atorvastatina y se repetían análisis semanales hasta que los niveles habían quedado por debajo de 2,5 veces el nivel máximo normal de triglicéridos. Posteriormente, se reintroducía el bexaroteno a una dosis menor (ver material y métodos). Cinco de los pacientes presentaron también hipercolesterolemia, pero los niveles no fueron suficientemente altos como para necesitar ajustar la dosis. En cuatro de los pacientes fue necesario administrar suplementos de hormona tiroidea. Dos de ellos tuvieron alteración de la bioquímica hepática y dos más presentaron elevación de la CPK. Uno de ellos tuvo, además, mialgias no incapacitantes (aldolasa 10,4 U/dl, lactato deshidrogenasa [LDH] normal), que no indujeron modificación de la dosis ni la retirada de atorvastatina. Las mialgias desaparecieron y la analítica muscular se normalizó tras una bajada de bexaroteno justificada por hipertrigliceridemia.
DISCUSION
El impacto de la micosis fungoide sobre la esperanza de vida es escaso o incluso nulo en estadios iniciales (Ia) 15. Ningún tratamiento ha demostrado hasta ahora que aumente la supervivencia de la micosis fungoide, en gran parte debido a lo difícil que resulta organizar ensayos clínicos buscando supervivencia en una enfermedad cuya historia natural es muy prolongada. En la actualidad se recomiendan tratamientos paliativos dirigidos fundamentalmente a mejorar la calidad de vida de los pacientes y a eliminar dentro de lo posible las lesiones que presenten. Los tratamientos agresivos tipo poliquimioterapia deben estar reservados a estadios muy avanzados de la enfermedad 16. El grupo de linfomas de la EORTC ha propuesto una guía de tratamiento de micosis fungoide que está pendiente de ser publicada (Trautinger F, Knobler R, Willemze R, et al. EORTC guidelines for the treatment of mycosis fungoides/Sézary síndrome. Eur J Cancer, in press). En esta guía, el tratamiento con bexaroteno en monoterapia se considera un tratamiento de segunda línea mientras que la PUVA está entre las terapias de primera línea, y una de las más eficaces.
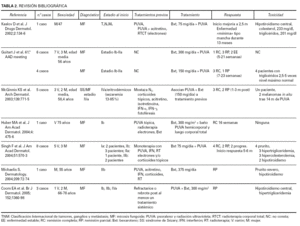
La micosis fungoide es una enfermedad de larga evolución que en la mayoría de los casos acaba rebrotando. Como consecuencia de ello, los tratamientos con PUVA en ocasiones son múltiples, elevando el riesgo de cáncer cutáneo no melanoma y de envejecimiento cutáneo. Este hecho ha llevado a plantear distintas asociaciones de tratamiento que reduzcan estos riesgos, que aumenten la eficacia del tratamiento o prolonguen el tiempo hasta la recaída. La combinación de retinoides más PUVA fue inicialmente utilizada por Thomsen et al 17, demostrando que la asociación ahorraba sesiones de PUVA y disminuía la dosis total acumulada de radiación UVA necesaria para obtener la remisión de la enfermedad, aunque no observaron mejoría significativa de la eficacia comparando con PUVA en monoterapia (RC del 72 y 73 %, respectivamente). La utilización del tratamiento combinado de PUVA más bexaroteno es actualmente experimental. Se está llevando a cabo un ensayo clínico (EORTC 21011) comparando el tratamiento de PUVA frente a PUVA más bexaroteno, con el objetivo principal de ver si la combinación de ambos tratamientos ahorra dosis de radiación UVA. Sin embargo, existen al menos 6 referencias en la literatura médica en las que se ha utilizado dicho tratamiento, incluyendo un total de 24 pacientes 18-21. En 13 de los casos publicados 10,12,14 se han utilizado dosis bajas de bexaroteno (75-150 mg/día) en pacientes que habían sido resistentes a otros tratamientos. Estos autores refieren RC en 7 casos, RP en cuatro, y progresión en 2 pacientes. Los otros 11 casos 10,11,13,14 recibieron tratamiento con mayor dosis de bexaroteno (entre 300 mg/día y 300 mg/m 2/día), obteniendo 2 RC, 5 RP y cuatro no respuesta. Obviamente, la comparación entre ambos tipos de dosis basándonos en casos aislados o series muy cortas no aleatorizadas es puramente especulativa y no se pueden obtener conclusiones definitivas sobre qué tipo de tratamiento es mejor. Nosotros nos decidimos por utilizar la dosis de 300 mg/m 2/día dado que es la dosis recomendada para el bexaroteno en monoterapia.
La eficacia del tratamiento en nuestros casos, con 3 RC, 2 RP sobre 6 casos supone un índice de repuesta del 83 %, que es cercana a la publicada para el tratamiento con PUVA en monoterapia. En el momento actual no hay estudios con significado estadístico suficiente como para comparar la eficacia de la PUVA frente a otros tratamientos. En este sentido está pendiente de publicación un ensayo comparando PUVA frente a PUVA más IFN-α y el ensayo EORTC 21011. En un futuro próximo podrán arrojar algo de luz sobre la comparación entre PUVA y PUVA más bexaroteno.
Resulta interesante comentar el tiempo transcurrido en nuestros pacientes hasta obtener respuesta (tabla 2). Se obtuvo una mejoría del 50 % de lesiones cutáneas (RP) en 2 pacientes en el primer mes y en otros tres tras 3 meses de tratamiento. Por otra parte, un paciente que tenía menos del 10 % de la superficie corporal afectada se mantuvo en RC tras 10 semanas de tratamiento. Los otros necesitaron 20 y 24 semanas, respectivamente, para conseguirlo. En las series publicadas resulta difícil diferenciar el inicio de respuesta y la obtención de RC, y están publicadas respuestas entre 5 semanas y 6 meses. Una de las series más largas 12, con 8 pacientes y dosis baja de bexaroteno, refiere que la respuesta se inicia entre la quinta y sexta semanas después del comienzo del tratamiento.
Al paciente 3 se le administró tratamiento con PUVA más bexaroteno sólo durante 3 meses dada su situación hematológica (sezaremia por encima de 25.000) y cutánea (con aumento del 70 al 80 % de afectación corporal tras 3 meses de tratamiento). Nos planteamos el riesgo de mantener este tratamiento y asociamos IFN-α2a (3 MU, 3 días/semana) al tratamiento previo. No sabemos qué hubiera pasado, teniendo en cuenta que el inicio de la respuesta puede ser más tardío, pero el hecho es que se obtuvo una mejoría clara de su estado, con menos del 6 % de superficie corporal afectada y sezaremia de 10.000/mm 3 tras 6 meses del triple tratamiento. McGinnis et al 19 publicaron la asociación de PUVA más bexaroteno más tratamiento previo en micosis fungoide avanzada y síndrome Sézary que no habían respondido a una combinación de diversos tratamientos (IFN, fotoféresis o bexaroteno). Estos autores obtuvieron remisiones totales (3 de 5 casos) o parciales (2 de 5 casos). En este trabajo, los autores proponen que la asociación de esta combinación tiene un efecto sinérgico con el resto de los tratamientos y piensan que el bexaroteno podría funcionar como un cebador que sensibilizaría las células T malignas a sufrir apoptosis inducida por la radiación UVA 19.
Los efectos secundarios más frecuentes inducidos por bexaroteno en monoterapia son hipertrigliceridemia (82 %), hipercolesterolemia (30 %), hipotiroidismo (74 %), neutropenia (41 %), descamación generalizada (37 %), leucopenia (27 %), elevación de LDH (26 %) cefalea (26 %) e hipercolesterolemia (22 %). Otros efectos secundarios afectan a menos del 20 % de los pacientes 19. La toxicidad relacionada con el tratamiento en nuestros pacientes no parece mayor que en aquéllos a los que se les dan ambos tratamientos por separado. Por otra parte, ninguno de nuestros pacientes sufrió quemaduras por PUVA. La toxicidad por radiación UVA no parece aumentada con el uso de bexaroteno. Talpur et al 20 publicaron fotosensibilidad en 1 de 70 casos tratados con bexaroteno como monoterapia. Sin embargo, Singh y Lebwohl 12 realizaron fototest antes y después de la ingesta de bexaroteno, demostrando que su uso no induce cambios en la respuesta a la luz ultravioleta.
En uno de los pocos estudios aleatorizados publicados sobre micosis fungoide, Stadler et al 21 demostraron que la asociación PUVA más IFN era significativamente más eficaz que la de IFN más acitretino. Se ha publicado que el tratamiento con PUVA más IFN obtiene un índice de respuestas del 90 %, con el 62 % de remisiones completas. De nuevo, las cifras son similares a las de la PUVA sola o la combinación de PUVA más bexaroteno y no hay estudios aleatorizados publicados que nos orienten hacia cuál es el mejor tratamiento de la micosis fungoide. Los efectos secundarios pueden orientarnos en nuestra decisión. La alteración más preocupante del uso de bexaroteno es la hiperlipidemia, con el potencial riesgo de pancreatitis (4 % en el estudio de Talpur et al 20), aunque el uso juicioso de las guías de manejo de bexaroteno, con controles repetidos, probablemente hagan aún más infrecuente esta complicación. En breve se publicará una nueva guía de manejo (C Assaf et al. Minimising Adverse Side Effects of Oral Bexarotene in Cutaneous T-Cell Lymphoma: an Expert Opinion. Br J Dermatol, en prensa). Por el contrario, el tratamiento con IFN produce menos alteraciones en el perfil lipídico y mayor alteración hematológica. La calidad de vida del paciente, con fiebre, mialgias, astenia, etc., se resiente más que con el uso de bexaroteno.
En resumen, consideramos que el tratamiento de micosis fungoide con PUVA más bexaroteno es eficaz y seguro. Será necesario esperar a la publicación de ensayos clínicos para verificar si existen evidencias suficientes para recomendar esta asociación.
Declaración de conflicto de intereses Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Pablo L. Ortiz-Romero. Servicio de Dermatología.
Hospital Universitario 12 de Octubre.
Planta baja Hospital Materno-Infantil. Ctra. de Andalucía, km 5,400. 28041 Madrid. España.
portiz.hdoc@salud.madrid.org
Recibido el 20 de marzo de 2006.
Aceptado el 24 de abril de 2006.