INTRODUCCION
En los últimos años se han incorporado al arsenal terapéutico un nuevo grupo de fármacos mucho más específicos que los empleados tradicionalmente para el tratamiento de diversas neoplasias. Estos medicamentos actúan sobre receptores concretos que sólo expresan algunas células del organismo. El primero de estos fármacos fue imatinib (Gleevec®) que supuso un gran avance en el tratamiento de las leucemias. Imatinib actúa sobre el receptor del factor de crecimiento plaquetario y consiguiendo en último término bloquear la tirosincinasa bcr/abl (que se produce por translocación 9,22 dando lugar al cromosoma Philadelphia). Este medicamento también ha sido utilizado en neoplasias cutáneas como el dermatofibrosarcoma protuberans 1. A este principio activo le han seguido otros muchos como trastuzumab (un inhibidor del erb-B2 utilizado para el cáncer de mama), rituximab (inhibidor del CD20 utilizado para linfomas y enfermedades autoinmunes mediadas por anticuerpos), bevacizumab que bloquea el receptor del factor de crecimiento endotelial vascular (VEGF) y una gran familia de fármacos que bloquean el receptor del factor de crecimiento epidérmico y que se están empleando en la actualidad en multitud de neoplasias. Una diferencia importante entre estos nuevos medicamentos y los clásicos antineoplásicos es que en estos últimos se deben utilizar a la máxima dosis tolerable (MDT). Los nuevos fármacos se utilizan a la dosis óptima biológica que suele ser mucho menor que la MDT y por tanto tiene muchos menos efectos adversos 2-4. Además, la tolerancia de estos medicamentos es mejor que la derivada del uso de los quimioterápicos clásicos, siendo los efectos adversos graves excepcionales 3.
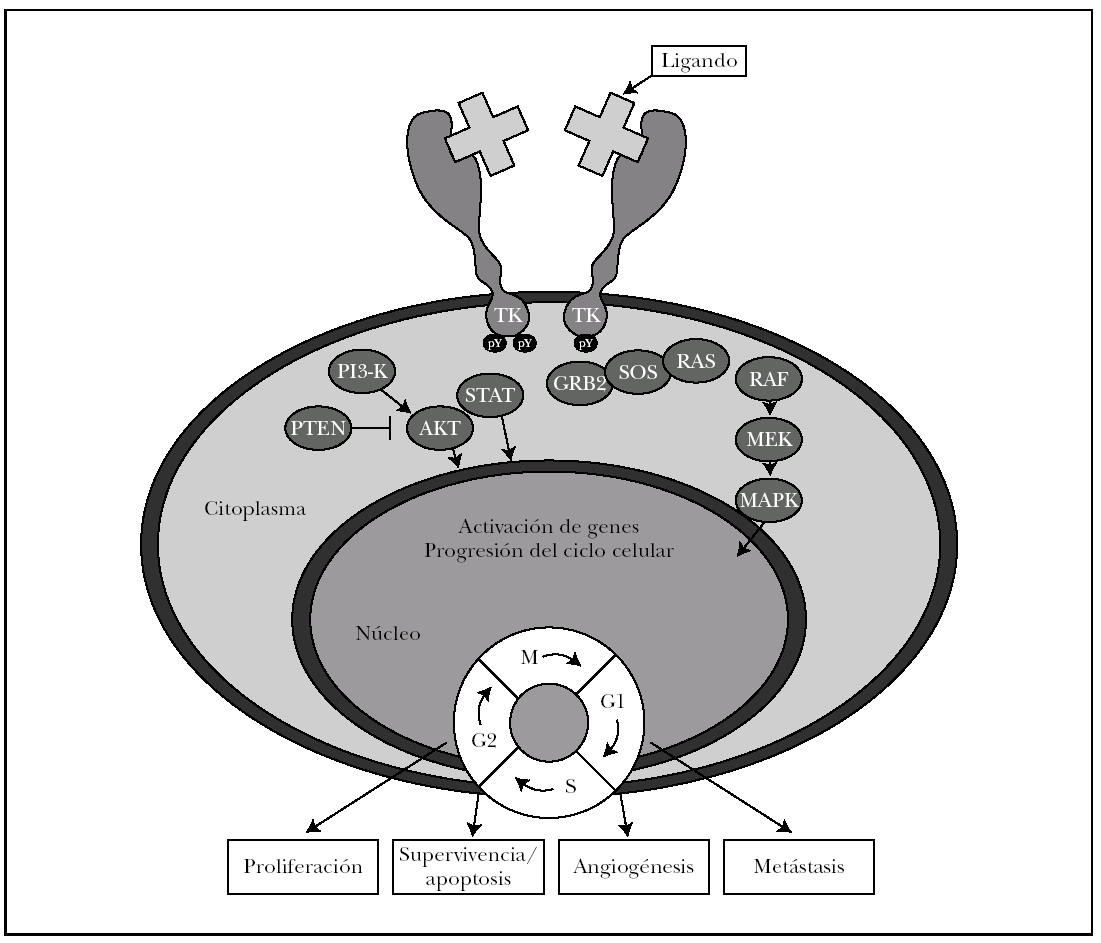
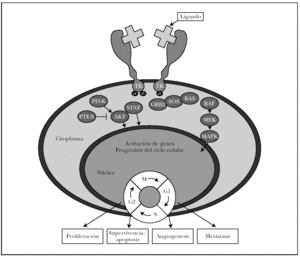
En 1963 Cohen y Elliott 5 aíslan una proteína de la glándula submaxilar del ratón que administrada a cultivos de piel estimulaba la proliferación de los queratinocitos incluso en ausencia de dermis 6, denominándola por ello epidermal growth factor (EGF) o factor de crecimiento epidérmico. Dicha proteína ejerce sus acciones a través de un receptor específico de membrana, denominado receptor del factor de crecimiento epidérmico (EGFR), que se expresa en los queratinocitos basales epidérmicos, la vaina radicular externa del pelo, las glándulas sebáceas, el músculo erector del pelo, las arterias dérmicas y el conducto ecrino 4,7,8. El EGFR desempeña un papel crucial en el funcionamiento normal de la piel y los folículos pilosos 4,9-11. Este receptor consta de tres dominios: uno extracelular al cual se unen sus ligandos (EGF, el factor de transformación alfa, las amfirregulinas, etc. 12), uno transmembrana, que sirve de anclaje, y otro intracelular al que se halla acoplada una tirosincinasa (figs. 1 y 2). Tras la unión a su ligando el receptor se dimeriza, el complejo receptor-ligando se internaliza y se autofosforila 13, desencadenando una cascada de fosforilaciones que conduce a sus acciones biológicas.
Fig. 1.--Estructura y funcionamiento del receptor del factor de crecimiento epidérmico.
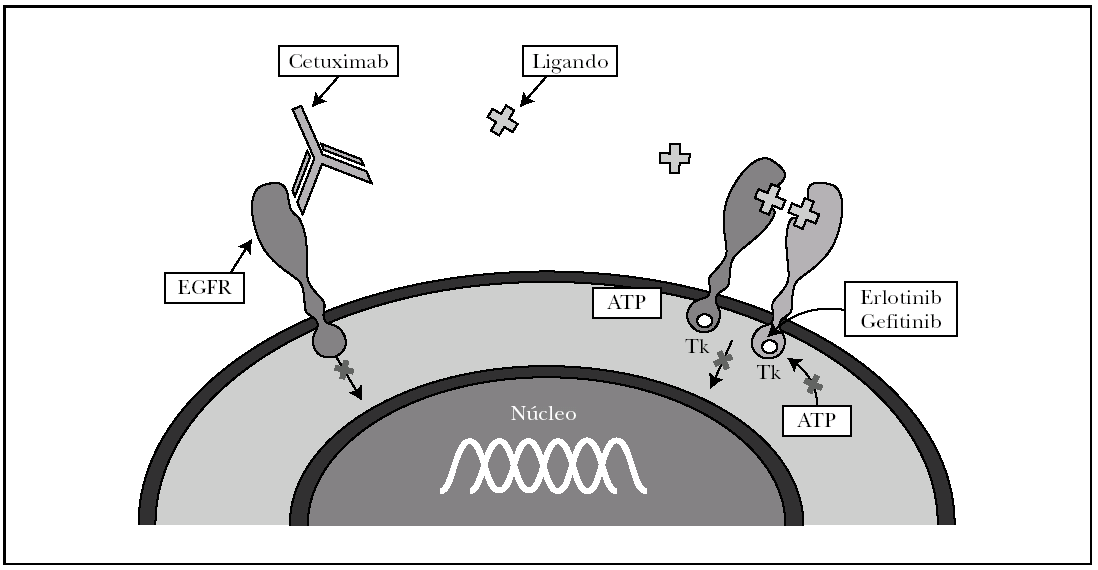
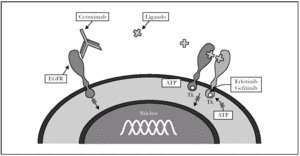
Fig. 2.--Mecanismo de acción de los inhibidores del EGFR.
El receptor no sólo se halla expresado en las células cutáneas sino que su presencia se ha descrito también en un tercio de los tumores humanos 14,15. Entre las neoplasias que lo expresan se encuentran el carcinoma no microcítico de pulmón, el cáncer de colon, carcinomas de cabeza y cuello, glioblastoma, carcinoma renal, pancreático, gástrico, de mama, de ovario, de vejiga, de útero 14,16-18. Sus acciones en las células tumorales son promover la angiogénesis 19, proliferación celular, motilidad celular, adhesión y capacidad metastásica 20-26. En algunos estudios se ha encontrado una supervivencia reducida, un pronóstico pobre, mayor porcentaje de metástasis y un mayor riesgo de recurrencia en tumores que expresan el EGFR 14,23,27. El bloqueo del EGFR conduce a una disminución de la proliferación celular 26, que es mayor en las células tumorales que en las células de la piel, esto parece que se debe a que la supervivencia de las células de la piel depende en menor medida del EGFR que las células tumorales gracias a los efectos paracrinos de las células vecinas 25.
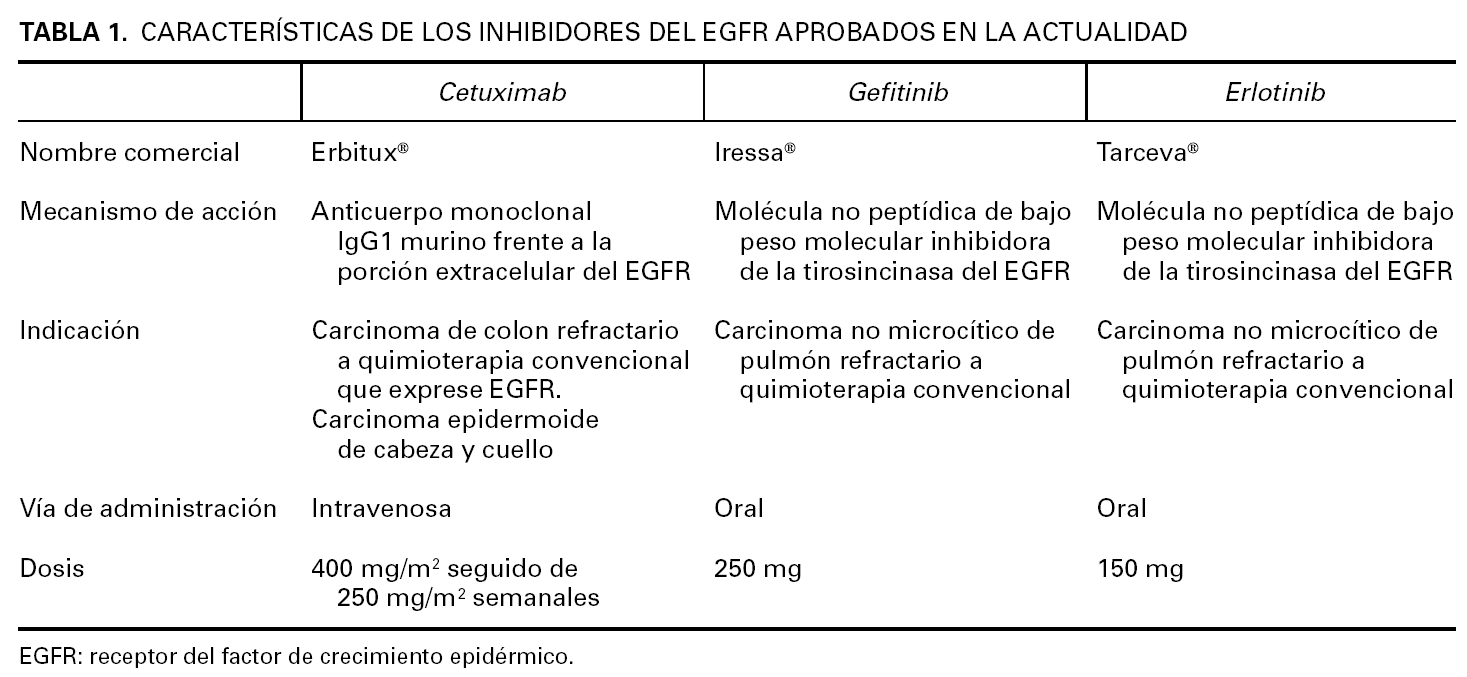
Todos estos hechos han convertido al EGFR en una diana terapéutica en el tratamiento del cáncer. En este momento se hayan aprobados sólo 3 fármacos de esta familia: gefitinib (Iressa®), erlotinib (Tarceva®) y cetuximab (Erbitux®) pero otros muchos se encuentran en fase de investigación.
Gefitinib y erlotinib son dos anilinoquinazolonas de bajo peso molecular que penetran a través de la membrana celular y bloquean la tirosincinasa a la que se encuentra acoplado el EGFR. En este momento gefitinib y erlotinib se hallan aprobados para el tratamiento de pacientes con carcinoma de pulmón localmente avanzado o metastásico refractarios a regímenes quimioterapéuticos convencionales (platinos y taxol) 15,28,29, no habiendo demostrado efectividad combinado con otros quimioterápicos clásicos 28,30-33. De los pacientes tratados hay un grupo que tiene una efectividad muy marcada con supervivencias muy largas constituido por mujeres, asiáticas, nunca fumadoras y con histología de adenocarcinoma 34-36. Estos fármacos se están ensayando en otras múltiples neoplasias 27. En los últimos meses el uso de gefitinib prácticamente se ha abandonado a consecuencia de los resultados de 2 ensayos clínicos en los que no se encuentra aumento de supervivencia con esta medicación 36-38 y sí con erlotinib para el mismo grupo de pacientes 29.
Cetuximab es un anticuerpo monoclonal IgG1 quimérico que bloquea el EGFR en su dominio extracelular 39 (fig. 2). Cetuximab se encuentra aprobado para pacientes con cáncer de colon EGFR positivos refractarios a quimioterapia convencional con irinotecán 39, tras demostrar una mejor supervivencia en los pacientes tratados con cetuximab solo o asociado a irinotecán 40 y recientemente se ha aprobado también para el carcinoma epidermoide localmente avanzado de cabeza y cuello. Además se está ensayando con éxito entre otros en el cáncer de páncreas 39.
Las dosis habituales son de 250 mg/día vía oral de gefitinib 3, 150 mg/día vía oral para erlotinib e infusiones intravenosas semanales con cetuximab a dosis de 400 mg/m 2 la primera semana y 250 mg/m 2 el resto (tabla 1).
Otras múltiples moléculas inhibidoras del EGFR están siendo ensayadas actualmente: pertuzumab, lapatinib, panitumumab (ABX-EGF), matuzumab (EMD72000), PD153035, MAd ICR62, h-R3, EKB-569, etc. 26,27,34,41-43. Todas estas moléculas se están utilizando en numerosos tumores por lo que es probable que en un futuro sean aprobadas y aumente mucho su utilización 44.
El principal inconveniente de esta familia de fármacos es el elevadísimo coste de los mismos, siendo por ejemplo de aproximadamente 36.000 euros anuales para cetuximab. Además como estos medicamentos son selectivos sólo serán útiles para pacientes que tengan tumores «susceptibles», habiéndose postulado que la piel pueda ser una zona accesible para valorar la posible efectividad de uno de estos tratamientos en cada paciente individual dada la presencia del EGFR en la piel 45.
La expresión de este receptor por parte de las células normales de la piel, así como la implicación de dicho receptor y su ligando en el normal funcionamiento de la piel son las causas del gran número de pacientes tratados con inhibidores del EGFR que sufren efectos secundarios cutáneos durante el tratamiento con dichos fármacos. La erupción papulopustulosa localizada en la cara, cuero cabelludo y tronco es la más frecuente. Otros efectos adversos son la xerodermia generalizada, paroniquias y alteraciones del folículo. Estos efectos secundarios cutáneos son comunes a todas estas sustancias 43,46. En esta revisión trataremos de forma conjunta estas alteraciones y de forma específica las relativas a cada fármaco.
Dentro de los efectos secundarios extracutáneos la diarrea es el más frecuente de los inducidos por los inhibidores de la tirosincinasa dado que las células epiteliales del tubo digestivo expresan el EGFR 14,47. El gefitinib se ha descrito asociado a una enfermedad pulmonar intersticial grave siendo ésta una complicación excepcional 41. En el caso de cetuximab la diarrea no se presenta al ser administrado por vía intravenosa evitando el contacto con las vellosidades intestinales 14. Sin embargo, sí son frecuentes la astenia, fatiga, malestar general y letargia que afectan al 56 % de los pacientes 25.
ERUPCION ACNEIFORME
Introducción
La erupción acneiforme es común a prácticamente todos los inhibidores del EGFR, no sólo de los aprobados sino también de los que se encuentran en investigación 42. Es un efecto adverso dependiente de la dosis apareciendo casi en el 100 % de los pacientes tratados con dosis elevadas 14,48-51. Constituye una de las lesiones cutáneas más frecuentes. La erupción acneiforme ha recibido diversas denominaciones a lo largo del tiempo: exantema acneiforme, exantema acné-like, exantema maculopapular, lesiones monomorfas pustulosas y foliculitis entre otras 15, en la actualidad la más común es la de erupción acneiforme. Estos términos a pesar de no ser los más idóneos se hallan actualmente muy extendidos por lo que parece difícil que vayan a ser abandonados próximamente 15,52,53. Algún autor ha empleado el término dermatitis seborreica-like o rosácea-like probablemente para describir el mismo tipo de lesiones 24,44,46,54,55 que tras la fase aguda se transforman en un eritema descamativo de aspecto untuoso 43.
Incidencia
La incidencia de la reacción acneiforme varía con los distintos inhibidores siendo para gefitinib el 37 36-55 % 36,56, para erlotinib el 77-79 % 29,47,57,58, y para cetuximab el 67-86 % 25,40,56 a las dosis terapéuticas habituales. No obstante, la incidencia puede variar puesto que en algunos ensayos todos los efectos adversos se clasifican juntos 15. Las erupciones con severidad grado 3 son raras (en torno al 5 %) 43. La incidencia de grados severos de erupción acneiforme es muy rara, en torno al 10 % 28,43,44, y el 80-90 % de los casos tienen intensidades leves (grado I) 44,53.
Etiología
Se desconoce el mecanismo exacto por el que se produce la erupción acneiforme, en la mayoría de los trabajos se atribuye al bloqueo de los mecanismos fisiológicos del EGF en el folículo piloso 11,15,59, produciéndose una oclusión folicular por ausencia de diferenciación del epitelio que conduce a la formación de mediadores inflamatorios 46,55,60. Otros autores proponen que pueda deberse a la respuesta inflamatoria secundaria a cambios en la microflora de la piel debidas al bloqueo del EGFR 60.
Si se añade EGF a cultivos pilosebáceos humanos se produce una desorganización de los queratinocitos similar a la observada en el acné 61, no obstante, posteriormente el EGF ayuda a la resolución de las lesiones de acné 62. Se propone que la colonización por Propionibacterium acne produce una expresión de EGF que conduce a una inhibición de la secreción sebácea que acaba resolviendo las lesiones de acné 62. En contra de la hipótesis del bloqueo de los mecanismos fisiológicos del EGFR existe un estudio reciente con el fármaco h-R3, un anticuerpo monoclonal contra el EGFR. En él ningún paciente desarrolló erupción acneiforme, y de momento no se ha conseguido explicar este hecho 63.
También se ha propuesto que la erupción acneiforme se deba a un efecto directo de estos fármacos sobre el sistema inmunitario desbloqueando la producción de citocinas cutáneas que resulta en una quimiotaxis de neutrófilos 64.
Sintomatología
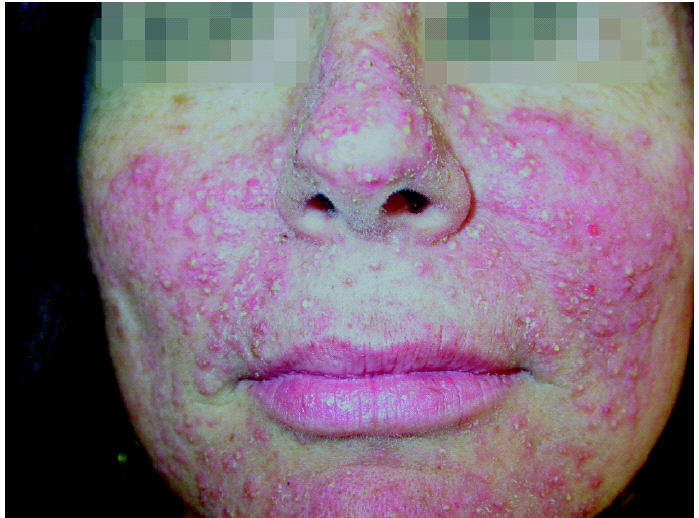
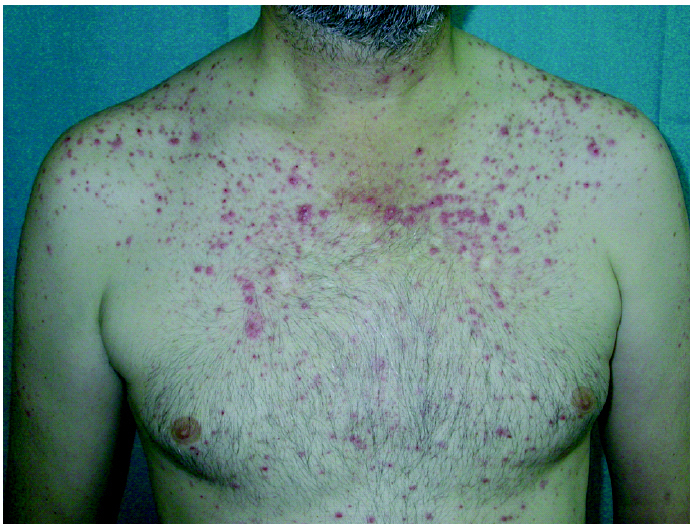
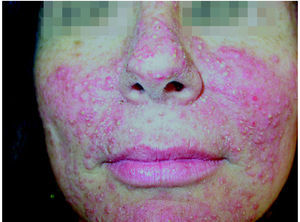
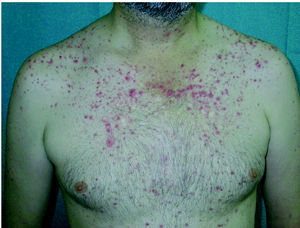
Se caracteriza por lesiones pustulosas monomorfas y papulosas eritematosas 14,54,56,60,65-67, con distribución folicular, que pueden evolucionar a costras amarillentas 43,53,68 (figs. 3 y 4). No existen quistes ni comedones 52,66,67,69. Inicialmente las lesiones pueden ser telangiectasias dispersas en la cara, detrás de las orejas y en el tronco, en general cerca de las pústulas, que según Segaert y Van Cutsem 43 suelen ir desapareciendo dejando hiperpigmentación. De manera ocasional las lesiones son edematosas y calientes simulando una erisipela 44 y más rara vez son de tal intensidad que forman áreas de necrosis con escaras negras y ulceración 43,44.
Fig. 3.--Erupción papulopustulosa localizada en regiones nasal, malares y mentoniana.
Fig. 4.--Erupción papulopustulosa en el tronco, predominantemente en el tercio superior.
La localización más frecuente es la cara, predominantemente en la nariz, surcos nasogenianos, mentón, regiones malares y frontal 56,60,65-67,69-71. Otras localizaciones son el cuero cabelludo, los hombros, y las zonas torácicas y dorsales superiores 51,67 (figs. 1-3). Todas las localizaciones afectadas habitualmente son ricas en glándulas sebáceas 43,52. Nunca se afectan las palmas ni las plantas y las extremidades generalmente se hallan respetadas 56. Localizaciones más raras son las axilas 65. Las lesiones son similares para todos los inhibidores del EGFR, si bien algunos autores comentan que las lesiones son más extensas en el caso de cetuximab 56,70.
La aparición de las lesiones se produce generalmente 1 o 2 semanas después de iniciar el tratamiento 4,14,51,54,60,65,67,70-74. También se han descrito casos de aparición más tardía, 1 o 2 meses tras comenzar el tratamiento 43,69,75. La erupción parece alcanzar una intensidad máxima hacia las 2 semanas de su inicio para luego ir disminuyendo de intensidad 51 a pesar de continuar con el inhibidor del EGFR en la misma dosis 44,50,56,76.
En la literatura especializada se recogen casos en los que la erupción se resuelve por completo en la cuarta semana a pesar de continuar con el tratamiento 51,75. Además se comenta que no se precisa la suspensión del fármaco para que se produzca una resolución completa de las lesiones cutáneas 72. En casos severos es suficiente con interrumpir temporalmente el fármaco durante 2 o 3 semanas 72. Tras suspender el medicamento la erupción acneiforme se resuelve en 1 o 2 semanas sin cicatrices en todos los pacientes 14,57,65,67,68,71,76. Si posteriormente se reintroduce el fármaco la erupción suele reaparecer pero con menor intensidad 65,68,72.
No se ha relacionado la intensidad con el fototipo 56,60 ni con los antecedentes personales de acné 60,72. Tampoco existen diferencias entre sexos 55. Con cetuximab puede observarse un empeoramiento tras cada ciclo 43.
En general los síntomas son mínimos a pesar de la intensidad de las lesiones 25,51,56, si bien en algunos casos existe dolor 65 y con frecuencia las lesiones son pruriginosas 43,44,52,69. Algunos pacientes consideran el aspecto estético de las lesiones inaceptable lo cual conduce a la interrupción del tratamiento en estos casos 51. No se han descrito síntomas generales: fiebre, mialgias o artralgias. Además en los pacientes tratados de forma concomitante con esteroides por motivos oncológicos no se ha observado una menor intensidad del cuadro cutáneo 56, por lo que parece razonable descartar los corticoides como tratamiento de la erupción.
Intensidad
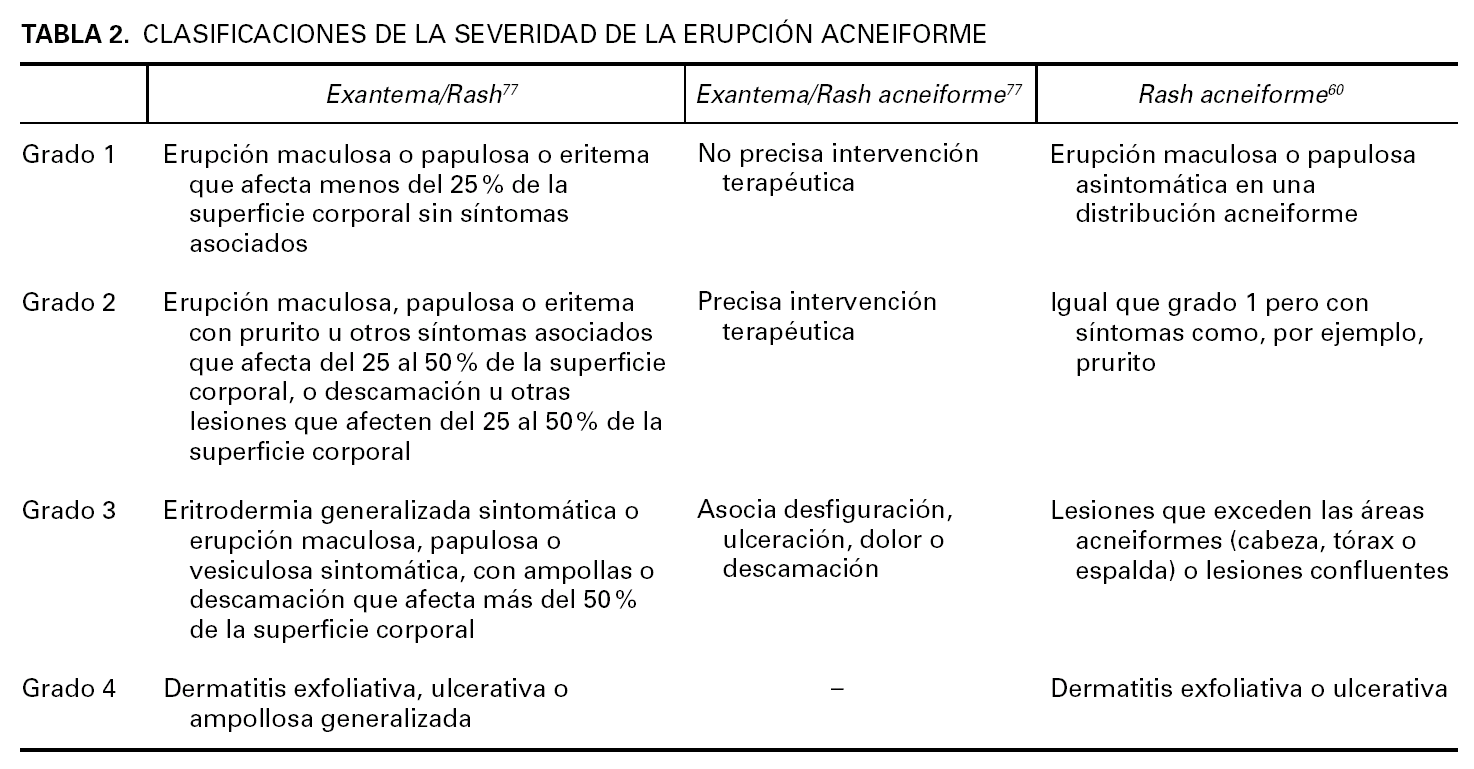
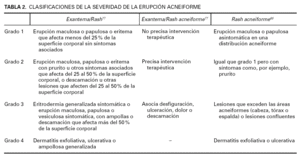
Es difícil valorar la intensidad de la erupción acneiforme; generalmente en los ensayos clínicos se usa la escala del Instituto Nacional del Cáncer de Estados Unidos que clasifica la severidad en cuatro grados (tabla 2) 77 y en la última versión crea una clasificación similar para el acné/erupciones acneiformes 78. Busam et al 60 proponen un sistema de clasificación distinto para estos pacientes. Estos sistemas de clasificación de uso en el ámbito oncológico distan mucho de ser idóneos 43 y se precisan métodos más rigurosos para cuantificar las lesiones cutáneas en los pacientes oncológicos 15 donde deberán tener en cuenta el número de lesiones, el malestar que causen y la extensión de las mismas 53. También se ha propuesto crear un atlas de imágenes para cada grado de intensidad para ayudar a los clínicos a clasificar correctamente a los pacientes 53.
Histología
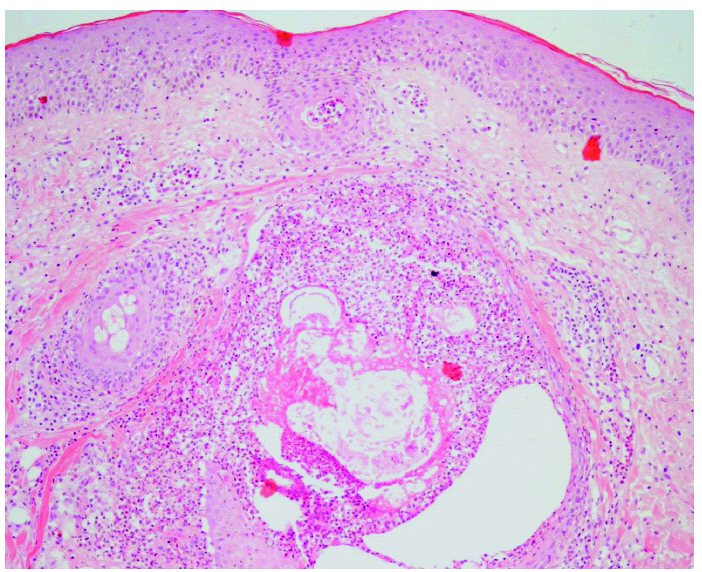
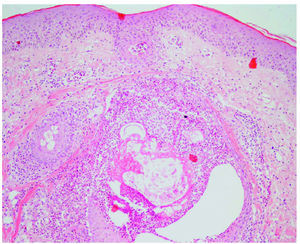
El patrón histológico se caracteriza por una florida foliculitis supurativa neutrofílica superficial 4,56,60,69,70,72 (fig. 5). Existe un denso infiltrado neutrofílico monomorfo predominantemente alrededor del infundíbulo 15,51,54,56,65. En ocasiones hay tendencia a formar microabscesos 72 y células gigantes multinucleadas 67, además puede existir un infiltrado linfohistiocitario acompañante 65,66. La glándula sebácea, a diferencia de lo que cabría pensar por la distribución de las lesiones, no se encuentra afectada 4,15,72,79. La capa córnea se encuentra adelgazada y pierde su aspecto en cesta de mimbre 4,15,48,79,80, aunque algún autor ha encontrado hiperqueratosis ortoqueratósica 67. Con gefitinib existe un mayor número de células apoptóticas en la epidermis y cierta degeneración de la capa basal 4,48,49,67.
Fig. 5.--Foliculitis y perifoliculitis aguda. (Hematoxilina-eosina, ×40.)
Un estudio realizado en pacientes sometidos a tratamiento con gefitinib 4 y otro con 10 pacientes sometidos a cetuximab 60 fueron sometidos a biopsias previas y durante el tratamiento, encontrando un estrato córneo adelgazado que perdía su aspecto en cesta de mimbre y estaba más compacto y eosinofílico, con ocasionales focos de paraqueratosis. En algunas biopsias se observaba un infiltrado mononuclear focal con degeneración focal de la capa basal de la epidermis y queratinocitos necróticos similar a la descrita en las reacciones liquenoides. Los cambios más iniciales eran un infiltrado linfocitario T (CD45RO) alrededor del infundíbulo folicular 60. En algunas biopsias se observaban tapones foliculares sobre unos infundíbulos dilatados similares a comedones 4,60. En otros pacientes se ha observado una acantolisis focal asociada a un infiltrado neutrofílico disperso que afectaba la zona terminal del conducto sudoríparo 60, cuyo significado no está aclarado 43. No se observaban alteraciones de los vasos sanguíneos, glándulas ecrinas ni sebáceas. Estos cambios son similares a los que presentan ratones que no expresan el EGFR (knock-out), si bien en los ratones además de verse un adelgazamiento de la capa córnea también se observa un adelgazamiento de toda la epidermis 9,10.
En estudios de inmunohistoquímica se ha encontrado un aumento importante en la expresión de p27Kip1 que es una proteína que inhibe la proliferación y produce una detención celular en la fase G1, este efecto que también se produce en las células tumorales es la base de su efecto antineoplásico 4,60,76,79. También una inhibición de la proteincinasa mitógena activada (activated mitogen-activated protein kinase) una cinasa que promueve la proliferación celular, un aumento de la tasa de apoptosis 4, así como una disminución de la expresión del EGFR y del marcador de proliferación Ki67 4.
Microbiología
Los cultivos de hongos son negativos al igual que los bacterianos 56,66,67,69,70, si bien en algún caso se aísla Staphylococcus aureus60,68,72,81. En pocos casos se ha encontrado, probablemente de forma casual, P. acnes y Malassezia furfur50,54,67. Se recomienda realizar cultivos cuando las lesiones empeoran para descartar la posible sobreinfección 53.
Diagnóstico diferencial
Los pacientes oncológicos con frecuencia precisan de tratamientos con corticoides sistémicos. Estos son una causa bien conocida de lesiones acneiformes y deben ser diferenciadas de las producidas por los inhibidores del EGFR 53. El acné esteroideo está compuesto de lesiones monomorfas de localización preferente en el tronco, más firmes a la palpación, asocian menos eritema y no drenan material purulento al comprimirlas 53. Otras entidades que pueden confundirse en algunos casos son la rosácea y el acné.
Tratamiento
Las lesiones acneiformes son en ocasiones pruriginosas pero sobre todo causan malestar cosmético y pueden llevar por ese motivo al incumplimiento terapéutico 43. Es importante explicar a los pacientes este efecto adverso tan frecuente y tratar estas lesiones cuando se requiera 43. También es necesario un seguimiento estricto de estos pacientes 43. Como medidas generales se recomienda evitar la fotoexposición, la temperatura excesivamente calurosa así como la humedad ambiental elevada 44. Cuando las lesiones son asintomáticas, pero causan malestar cosmético, se pueden utilizar técnicas de camuflaje 53,70, a ser posible con productos libres de grasa 52. Para el seguimiento de los pacientes puede ser útil la realización de fotografías seriadas 53.
Desgraciadamente en el momento actual no están disponibles ensayos clínicos para el tratamiento de la erupción acneiforme y los datos disponibles son procedentes de casos aislados, series de escasos pacientes y recomendaciones de expertos 15,43,44,53. Además, es difícil valorar la eficacia de los distintos tratamientos sabiendo que la evolución natural de la erupción es hacia la mejoría o resolución 51. Se recomienda para valorar la efectividad de un determinado tratamiento tópico realizarlo sólo en un área concreta para poder comparar con las zonas no tratadas 53.
En el caso del tratamiento tópico de algunos pacientes la administración de peróxido de benzoílo ha conducido a mejorías parciales a pesar de continuar con el inhibidor del EGFR 52,56,65,72, si bien otros autores consideran que no tiene utilidad 57 o que incluso puede empeorar las lesiones de xerodermia 53. Otras opciones tópicas que se han utilizado con escasas mejorías son: ácido fusídico 51,56, eritromicina 51,55-57,72, clindamicina 52,55, metronidazol 73,82, corticoides 51,54,56,60,76, retinoides 51,66,71,76, vitamina A 51, vitamina D 51, crema de sulfuro coloidal al 4 % 83 y ácido salicílico 43,44. Gutzmer et al 82 proponen el uso de permetrina si se encuentra Demodex. El pimecrolimus también se ha empleado con éxito en casos aislados 52 y se están planteando ensayos clínicos para comprobar su hipotética utilidad 53. Algunos autores postulan que los corticoides deben evitarse dado que son una causa conocida de erupciones acneiformes 43,44 y otros desaconsejan los retinoides tópicos por causar xerodermia 52,53. Se recomiendan más las cremas que las soluciones 44. Si el exantema se sobreinfecta, lo cual no parece ser demasiado infrecuente 53,81, se ha propuesto el uso de ciclos cortos de tetraciclinas, amoxicilina-ácido clavulánico, cloxacilina o cefalosporinas 15,65,68,72 o bien adecuar el antibiótico al antibiograma 52. En caso de lesiones limitadas y en los que se aísla S. aureus puede utilizarse mupirocina tópica 53. El ácido fusídico sistémico también ha producido respuestas parciales en algún paciente 56. En 2 pacientes tratados con cetuximab se obtuvieron buenos resultados con isotretinoína oral a las 4 semanas de utilización, quedando tan sólo máculas eritematosas en la cara 73,82. No obstante, la xerodermia y paroniquias en pacientes tratados con inhibidores del EGFR puede empeorar si se utiliza isotretinoína oral, dado que esta es una causa tanto de xerodermia como de paroniquia 43. Una serie de 47 pacientes tratados de forma precoz con a-hidroxiácidos en casos leves y a -hidroxiácido junto con gentamicina y betametasona tópicas en los casos más severos, mostraron resolución en un importante número de los pacientes sin precisar la suspensión del EGFR (gefitinib) 84.
Si existe prurito sobreañadido pueden emplearse soluciones que contengan mentol y antihistamínicos orales (cetirizina, difenhidramina, loratadina e hidroxizina) 43,44,53.
Las tetraciclinas orales constituyen una buena opción terapéutica 66. No está bien definida la duración del tratamiento (algunos recomiendan varios meses 43,70) habiéndose observado que unos pacientes pueden suspenderlas precozmente mientras que otros las deben mantener más tiempo por recidiva al suspenderlas 52. La doxiciclina en una dosis de 100 mg diarios por vía oral suele controlar bien las lesiones papulosas y pustulosas sin hacer desaparecer el eritema facial por completo 85. Otros autores han empleado la minociclina también con buenos resultados 52,66,69,71,82. En general, este tratamiento es muy bien tolerado 70. El mecanismo de acción de las tetraciclinas en este contexto probablemente sea debido a sus propiedades antiinflamatorias y antiangiogénicas 69,86,87, propiedades que entre otras son las responsables de su efectividad terapéutica en enfermedades como el acné y la rosácea 88. Las propiedades antiinflamatorias de la doxiciclina están bien probadas actuando por diferentes vías (inhibición de la proliferación de linfocitos bloqueando la transformación blástica 89, inhibición de la fosfolipasa A290, degradación acelerada de la sintetasa del óxido nítrico 91, inhibición de la expresión de la sintetasa del óxido nítrico 92).
En reacciones severas el tratamiento con inhibidores del EGFR puede interrumpirse temporalmente 70 y utilizar compresas de suero fisiológico si existe exfoliación, así como emplear antihistamínicos sistémicos 43,44. En estos casos también se pueden valorar las dosis elevadas de tetraciclinas sistémicas 44. En severidad grado 4 es conveniente el tratamiento en una unidad de quemados 43,44.
El tratamiento preventivo con eritromicina tópica y ácido fusídico en 2 pacientes produjo eritema facial sin que aparecieran elementos papulosos ni pustulosos 56. También se ha propuesto la posible utilidad del tratamiento profiláctico con mupirocina tópica nasal para minimizar el riesgo de sobreinfecciones por S. aureus53.
Se precisan estudios clínicos bien diseñados para evaluar los posibles tratamientos 15,93. En general, los algoritmos de tratamiento de los efectos adversos proponen un manejo secuencial inicialmente con fármacos tópicos, reservando los sistémicos para los casos más severos, además son muy variables en cuanto a los fármacos que utilizar 43,44,52,94,95. En enero de 2004 un grupo de oncólogos y dermatólogos especializados en estos tratamientos se reunieron en Nueva York en el «HER1/EGFR Inhibitors Rash Management Forum» para crear unas guía de tratamiento que han sido publicadas recientemente 53, las recomendaciones que dan están basadas en las publicaciones disponibles hasta ese momento y en experiencias propias del grupo, pero no en estudios clínicos dado que hasta la fecha no se han realizado 53.
Erupción acneiforme y supervivencia
Se ha propuesto en varios estudios que la incidencia y severidad de la erupción acneiforme se correlaciona con la respuesta tumoral para los pacientes tratados con cetuximab 25,40,96, proponiéndose incluso aumentar la dosis hasta producir erupción acneiforme 25,46. Algo similar sucede con erlotinib 47,57,58 y con el fármaco ABX-EGF aún en desarrollo 40. Con gefitinib este hecho no está del todo claro 3,15 aunque varios estudios sí sugieren mejor pronóstico de los pacientes con erupción 15,97,98. No todos los pacientes con respuesta tumoral tienen erupción acneiforme 3, ni todos los que tienen erupción acneiforme tienen respuesta tumoral 15,44. En general, los pacientes sin erupción acneiforme son los que tienen un peor pronóstico 15. Algunos autores sugieren que la ausencia de erupción tras un determinado tiempo debe ser motivo de retirada del medicamento o bien aumentar la dosis hasta la aparición de lesiones cutáneas, como en los llamados estudios dose to rash que están actualmente en marcha 15,43,46. Otra posibilidad sería valorar la eficacia del fármaco utilizando por su accesibilidad biopsias cutáneas y cuantificar la proteína p27Kip1 que parece ser la molécula más importante en el efecto antitumoral 60,79. Es importante conocer estos hechos de cara a no suspender de manera prematura este tratamiento precisamente en los pacientes que más se están beneficiando de él 15,57.
Se ha sugerido que tanto la incidencia de erupción acneiforme como la supervivencia con estos tratamientos depende del polimorfismo genético del gen del EGFR y así cuanto mayor número de repeticiones de la secuencia genética citosina-adenosina menor incidencia de exantema y menor supervivencia 98.
XERODERMIA/ECZEMA XERODÉRMICO
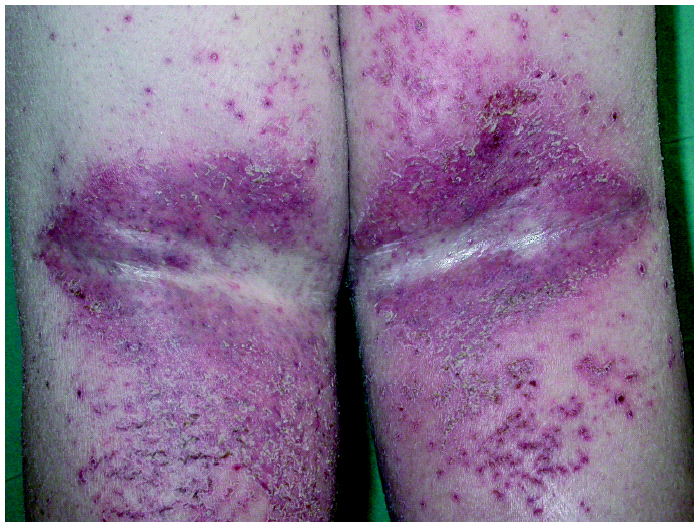
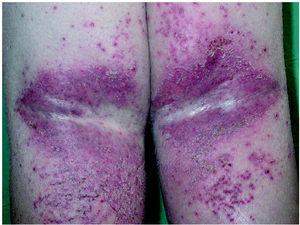
Un efecto frecuente es la aparición o exacerbación de una intensa xerodermia así como prurito de intensidad variable 4,71. Esta xerodermia puede simular un eczema atópico 43. Suele estar localizada en la cara (en las localizaciones afectadas por la erupción acneiforme) 44, tronco, piernas y zonas distales de los dedos 43,55,71, y puede ser intensamente pruriginosa 43 (fig. 6). En ocasiones se producen cuadros eczematosos, eczemas asteatósicos 43,71 (fig. 7), que pueden ser muy intensos. Es posible que además existan factores de riesgo para el desarrollo de estos eczemas: edad avanzada, antecedentes de eczema atópico y uso previo de quimioterapia convencional 43.
Fig. 6.--Eczema xerodérmico en los flancos.
Fig. 7.--Placas eritematodescamativas eczematosas en flexuras de rodillas simulando eczema atópico (el paciente no tenía antecedentes personales de atopia).
La xerodermia aparece generalmente tras 20 días de tratamiento 55. En ocasiones existe sobreinfección por S. aureus con empeoramiento y pueden observarse costras amarillentas 43,44 de las que debe tomarse una muestra para cultivo bacteriano y para tratar según los resultados del antibiograma 43,44. También se ha descrito la sobreinfección por herpes simple con cuadros de vesículas monomorfas diseminadas 43 en cuyo caso será necesario utilizar antivirales sistémicos 43,44.
En una serie dermatológica de 79 pacientes tratados con gefitinib existía xerodermia entre el 11 y el 36 % de los pacientes 36,48,55,84 y prurito en aproximadamente el 8 % 36.
El tratamiento indicado son los emolientes 52,53, en especial si contienen urea 82, y corticoides tópicos y se encontraron mejorías 55 en períodos cortos de 1-2 semanas 43,44. Debe evitarse el exceso de higiene 82, utilizar aceite de ducha en lugar de jabones o geles más agresivos para la piel y regularmente emolientes 43.
Pascual et al 75 han descrito un paciente, tratado desde hacía 4 meses con gefitinib, que presenta un eczema generalizado que evoluciona a eritrodermia exfoliativa con fallo multiorgánico y fallecimiento del mismo. El tratamiento con corticoides tópicos y emolientes no demostró mejoría clínica.
PARONIQUIA
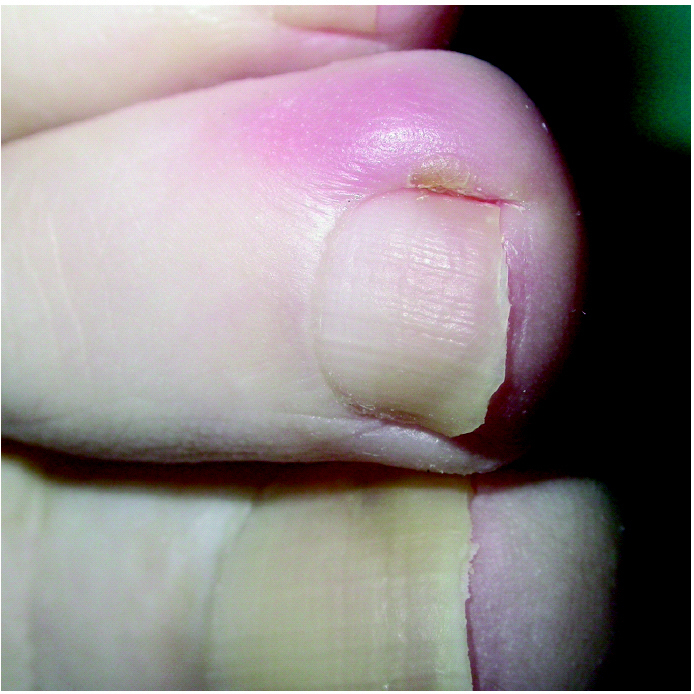
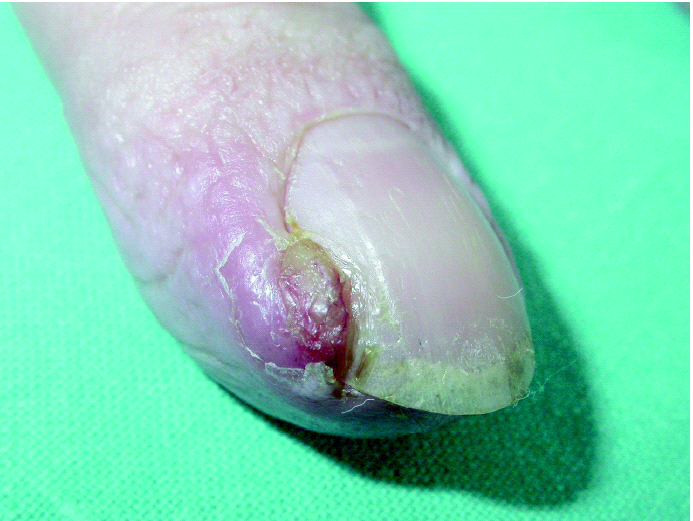
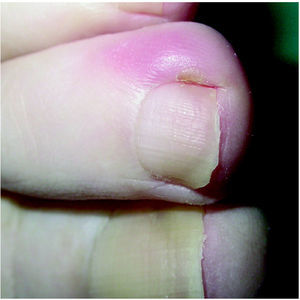
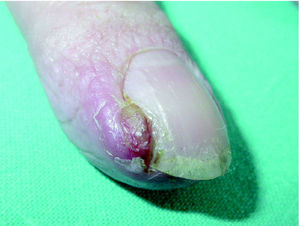
La paroniquia producida por estas lesiones está caracterizada por la inflamación de los márgenes laterales de las uñas con tumefacción local, y con menor frecuencia uñas encarnadas 55 o bien con importante formación de tejido de granulación local 55,100, pseudogranulomas piogénicos 43,44,60,70 o verdaderos abscesos 74 (figs. 8 y 9). En ocasiones existe onicolisis de las uñas afectadas 101. Las uñas con más frecuencia afectadas son las de los pies, sobre todo la del primer dedo 60 aunque en algunos estudios predominan los dedos de las manos 74,100. Se desconoce el motivo por el que unos dedos están afectados y otros no 70. En algunos artículos todos los pacientes con paroniquia tenían erupción acneiforme 74.
Fig. 8.--Paroniquia leve.
Fig. 9.--Paroniquia con tejido de granulación exuberante.
Es un efecto secundario mucho más raro que la erupción acneiforme, ocurriendo en el 6-10 % de los pacientes tratados con gefitinib 36,55, en el 12-50 % con cetuximab 60,102 y no existiendo datos publicados para erlotinib. La aparición de estas lesiones es más tardía que los otros efectos adversos por estas medicaciones, con una media de 2 meses tras iniciar el tratamiento 55,74,100,103. En algunos pacientes incluso aparecen 4-6 meses después de realizar el tratamiento 83,101. Las lesiones se resuelven al suspender el tratamiento 100 e incluso en algunos casos a pesar de mantenerlo 70.
La paroniquia suele acompañarse de dolor 44,70,74 y sangrado 60 y pueden interferir con las actividades de la vida cotidiana así como obligar a los pacientes afectados a utilizar calzado especial 70.
Histológicamente se caracteriza por inflamación constituida por células plasmáticas, linfocitos y neutrófilos asociados a vasos prominentes 74. La infección local no parece tener un papel importante habiéndose cultivado S. aureus tan sólo de forma anecdótica 60,70,74,104,105, nunca se ha encontrado la presencia de Candida70.
La patogenia de estas lesiones no está totalmente aclarada; no obstante, se ha postulado que los cambios epidérmicos producidos por el bloqueo del EGFR, como son la reducción del grosor del estrato córneo y tasas de proliferación queratinocítica disminuida pueden conducir a la paroniquia 101. También se ha postulado que las lesiones se deban a la interferencia entre el EGFR y los ácidos retinoicos 70,93,106. Otra hipótesis es que se deban a una inhibición concomitante del VEGF 43, que se ha implicado en las paroniquias por retinoides.
Los tratamientos para estas lesiones son diversos y los resultados variables. Los fomentos 60,83, mupirocina tópica 103, corticoide asociado a antifúngico tópico 99, nitrato de plata 43,44,70, gel de cloruro de aluminio 83, yodo 82, antisépticos solos 43 o en combinación con corticoide tópico 82 se han empleado con distintos resultados. Recientemente se han publicado buenas respuestas con doxiciclina oral 74,101. Las lesiones tipo granuloma piogénico se pueden tratar con nitrato de plata tópico 43. Lesiones iniciales se han tratado con corticoides tópicos, evitando su progresión 70. Se recomienda evitar la manipulación de los laterales de las uñas en todos los pacientes a los que se está tratando con inhibidores del EGFR 70, así como la utilización de calzado cómodo que evite la fricción 43,70. En casos de uña encarnadas u onicocriptosis pueden ser tratadas mediante matricectomía parcial 55 aunque hay autores que desaconsejan este procedimiento 43,44. Si existe sobreinfección bacteriana contrastada se puede emplear un antibiótico sistémico según antibiograma 43,44,70.
ALTERACIONES DEL PELO
El EGFR participa en el desarrollo y diferenciación del folículo piloso 11, así en ratones con ausencia del receptor existe un pelo rizado, quebradizo, escaso 59 y alopecia 11,59,107. El bloqueo de dicho receptor detiene el crecimiento de los queratinocitos e induce una diferenciación terminal 108 que parece proteger al folículo piloso de las reacciones inmunitarias 59. Existen evidencias de que el EGF es fundamental para el paso de anagén a catagén 109.
En los ensayos clínicos se hace referencia a los otros efectos secundarios sobre el pelo como son la alopecia y el pelo más fino y quebradizo 43,44,71,82,97, incluso rizado, enlentecimiento del crecimiento del pelo de la barba 71 y aparición de pelo facial en las mujeres 43,70,71, pero no existen casos concretos publicados en revistas dermatológicas. Estas alteraciones suelen aparecer a los 2-3 meses de tratamiento 70.
La tricomegalia, si bien parece excepcional, sí está descrita en varias publicaciones 70,110,111, tanto con cetuximab 110 como con gefitinib 111. Suele iniciarse entre 7 y 10 semanas tras comenzar el tratamiento 110,111. Hay que recordar que los inhibidores de las prostaglandinas tópicos oculares producen este efecto adverso en gran cantidad de pacientes 112 y que siempre debe descartarse el uso de ésta debido a su empleo muy extendido y también de otras medicaciones causantes de tricomegalia (ciclosporina, interferón, etc.). El mecanismo fisiopatológico de producción de la tricomegalia no está claro aunque se ha postulado el aumento de diferenciación terminal producida por el bloqueo del EGFR 110, la participación del EGF en el normal desarrollo del pelo 11,59,109,113.
El interferón también produce tricomegalia 114 y se ha observado que el interferón bloquea los sucesos mediados por EGF 115. Además en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH) también se ha descrito la aparición de tricomegalia 88, y se sabe que la proteína gag 1 del VIH modula la expresión del EGFR 116 por lo que se ha propuesto que la tricomegalia de los pacientes con VIH puede ser mediada por EGF 70. La alopecia frontal similar a la androgénica podría ser debida a las interacciones hormonales del EGF 117.
No existe un tratamiento específico de estas lesiones, salvo la depilación con cera del pelo facial que ofrece buenos resultados durante 2 meses 70. La tricomegalia puede resultar molesta al contactar las pestañas con las gafas por lo que en ocasiones puede ser preciso recortar las pestañas con unas tijeras 70.
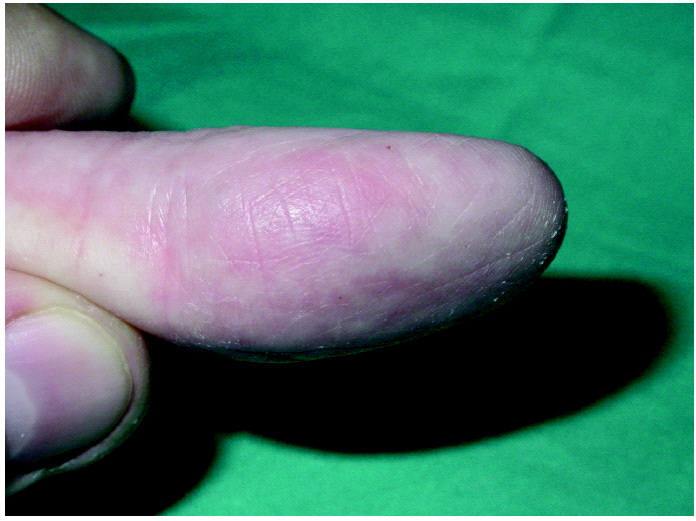
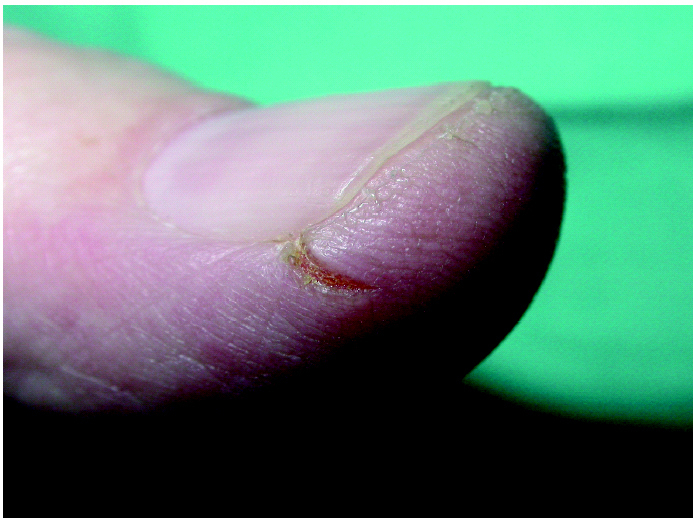
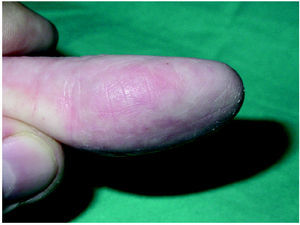
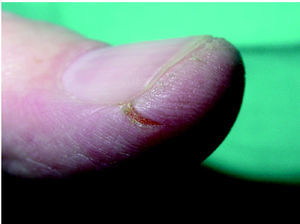
FISURAS EN LOS DEDOS
Aunque rara vez se hace referencia en la literatura especializada acerca de este efecto adverso 52,70,82,, es relativamente frecuente y bastante molesto para los pacientes 70. Se suele acompañar de tumefacción en la zona distal de los dedos y pulpitis seca 43,44,70 (figs. 10 y 11). En la serie de Busam et al 60 sucedió en el 100 % de los pacientes 80.
Fig. 10.--Pulpitis seca.
Fig. 11.--Fisuras en los pulpejos de los dedos.
Para el tratamiento se pueden utilizar soluciones con propilenglicol al 50 % en oclusión con plástico, pomadas/ungüentos con ácido salicílico al 10 % o urea al 5-10 %, apósitos hidrocoloides, apósitos con flurandrenolona, así como adhesivos a base de cianoacrilato 43,44,52,70.
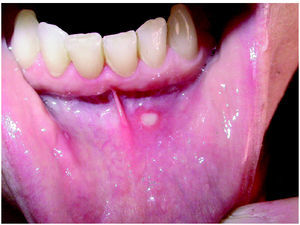
ÚLCERAS/EROSIONES ORALES
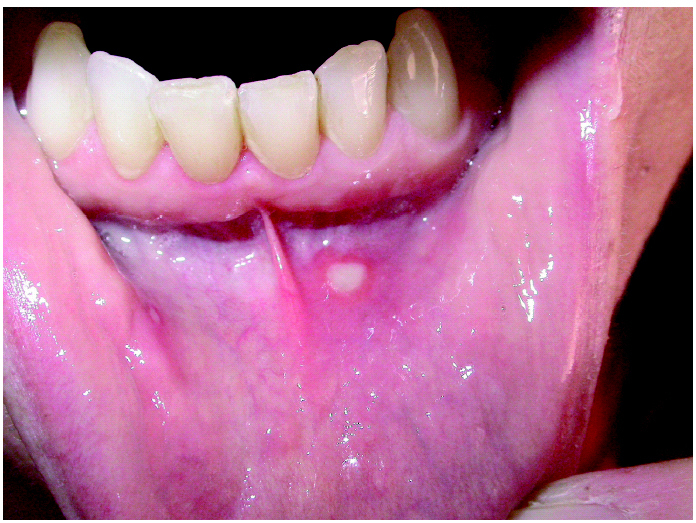
Las úlceras orales son una alteración infrecuente 55,60. Suelen ser lesiones de pequeño tamaño y estar localizadas en la mucosa de la cavidad oral (fig. 12) y en las fosas nasales 55 en ocasiones con epistaxis 52. En una serie de pacientes tratados con gefitinib estaban presentes en el 6 % de los casos 55. También se ha descrito sequedad vaginal 44,52.
Fig. 12.--Erosión en la cavidad oral.
HIPERPIGMENTACION
En general, no se hace referencia a cambios en la coloración de la piel durante el tratamiento con estos fármacos, pero recientemente se ha publicado un artículo que describe la presencia en 2 pacientes de hiperpigmentación facial tras el tratamiento con gefitinib 74. Ambos habían presentado previamente lesiones acneiformes en la misma zona, por lo que no queda claro si esta hiperpigmentación se debe a cambios postinflamatorios tras una reacción acneiforme. Uno de los pacientes fue biopsiado encontrándose aumento de pigmento sobre los queratinocitos basales, así como melanófagos en la dermis 74. Esta hiperpigmentación puede aumentar con la fotoexposición 74. No se ha descrito por el momento el mecanismo patogénico que causa dicha hiperpigmentación ni opciones terapéuticas para el tratamiento de estas lesiones. En cuanto a la prevención se recomienda el uso de fotoprotectores y evitar la fotoexposición 43,53,82. No se recomiendan agentes despigmentantes dado que la hiperpigmentación se va resolviendo progresivamente con el tiempo 43.
OTRAS ALTERACIONES
Glucagonoma like
Están descritas las lesiones tipo eritema necrolítico migratorio en un paciente tratado con gefitinib con histología de necrosis de queratinocitos basales y vasculopatía inespecífica, que se resolvió tras suspender dicho fármaco 118.
Urticaria
En general no se hace referencia a este efecto adverso pero en una serie de pacientes tratados con gefitinib estaba presente en el 4 % de los casos 55.
EGFR Y PATOLOGIA DERMATOLOGICA
El aumento de proliferación de la epidermis producido por el EGF parece estar implicado en la fisiopatología de la psoriasis. En las lesiones de psoriasis la expresión del EGFR se halla aumentada y disminuye cuando la placa de psoriasis mejora 119. Todo ello hace pensar que el bloqueo de este receptor puede constituir en un futuro una nueva modalidad de tratamiento 120.
También podría utilizarse para el tratamiento del carcinoma basocelular avanzado 121, dado que este receptor está expresado de forma fisiológica en la capa basal de la epidermis y que dicha expresión es mayor en el carcinoma basocelular 122. También podrían ser útiles en el carcinoma epidermoide cutáneo 123-125.
Otras patologías en las que el uso de estos fármacos podría ser útil son las alteraciones de la queratinización 4.
Declaración de conflicto de intereses Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Guillermo Guhl. Servicio de Dermatología.
Hospital Universitario de La Princesa. Diego de León, 62. 28006 Madrid. España.
guhl@aedv.es
Recibido el 11 de abril de 2006.
Aceptado el 12 de mayo de 2006.