Recientemente se ha comunicado el éxito del tratamiento con propranolol para hemangiomas infantiles (HI) graves. Existen escasas series publicadas con reducido número de pacientes. El objetivo del presente estudio fue conocer la efectividad y seguridad de propranolol oral para HI graves.
Material y métodoEstudio observacional y descriptivo de una serie de niños con HI graves en fase proliferativa, o en fase involutiva si presentaban importante deformidad residual, que acudieron a la Unidad de Dermatología Pediátrica de nuestro hospital desde junio de 2008 hasta diciembre de 2009 y fueron tratados con propranolol oral (dosis de 2mg/kg/día). Fueron seguidos hasta septiembre de 2010. Se analizaron las características epidemiológicas, la respuesta al mes, 3, 6, 9, 12 y 18 meses y se registraron los efectos adversos.
ResultadosSe trataron 36 HI en 28 pacientes. El tratamiento con propranolol fue efectivo en todos los casos, con respuesta completa o buena en el 88,2% de los casos a los 6 meses de tratamiento. El efecto fue evidente en las primeras horas tras instaurar el tratamiento, siendo útil tanto en fase proliferativa como involutiva. En HI ulcerados el tiempo medio de cicatrización fue de 61 días. Los efectos adversos fueron leves y autolimitados. Sólo dos pacientes discontinuaron el tratamiento por hipotensión.
ConclusionesEl propanol oral induce una mejoría rápida y mantenida en la gran mayoría de los HI, acortando considerablemente su evolución natural y con escasos efectos secundarios. En HI ulcerados no observamos una reducción significativa de la sintomatología o tiempo de cicatrización.
Recent reports have described the successful use of propranolol to treat severe hemangiomas of infancy. The few case series that have been reported, however, have included only a small number of patients. The aim of this study was to describe the results of oral propranolol treatment for severe hemangiomas of infancy in terms of treatment outcome and the occurrence of adverse events.
Patients and methodsA descriptive, observational study was undertaken in a series of children with severe hemangiomas of infancy seen in the pediatric dermatology unit at Hospital Universitario Virgen del Rocío in Seville, Spain between July 2008 and December 2009. Patients were included if they had hemangiomas in the proliferative phase or involuting lesions with substantial residual deformity. All children were treated with oral propranolol (2mg/kg/d) and followed until September 2010. Epidemiologic characteristics were analyzed along with treatment response at 3, 6, 9, 12, and 18 months; adverse events were also recorded at those times.
ResultsThirty-six hemangiomas were treated in 28 patients. Propranolol treatment was effective in all cases, with a good or complete response in 88.2% at 6 months. Effects were apparent within a few hours of treatment, which was effective in both growing and involuting hemangiomas. In ulcerated hemangiomas, the mean healing time was 61days. Adverse events were mild and self-limiting. Only 2 patients discontinued treatment due to hypotension.
ConclusionsIn the majority of cases, oral propranolol produced rapid and sustained improvements in hemangiomas of infancy and shortened the natural course of the disease with few side effects. However, no significant reductions in symptoms or healing time were observed in ulcerated hemangiomas.
Los hemangiomas infantiles (HI) son tumores vasculares benignos y autolimitados con una incidencia estimada del 3 al 10% de los niños hasta el primer año de vida1–5. Sin embargo, un porcentaje significativo de estas lesiones se asocia con una importante morbilidad2–4,6. Actualmente no existe ninguna terapia sistémica aprobada o correctamente estudiada para los HI. La prednisolona oral a dosis de 2 a 5mg/kg/día se considera como la primera línea terapéutica, pero sólo existe un pequeño ensayo clínico aleatorizado y controlado sobre este tratamiento, comparándolo con metilprednisolona intravenosa7–9. Los corticoides sistémicos pueden ser efectivos para HI de alto riesgo, pero su respuesta es variable y los efectos secundarios insidiosos, difíciles de monitorizar y potencialmente graves10. Otros tratamientos que se han usado para tratar HI de alto riesgo conllevan riesgos mayores y efectos secundarios potencialmente más graves, con resultados incluso más inciertos1,5,10. Esta lista incluye vincristina, interferón alfa y ciclofosfamida10–13.
Propranolol es un fármaco bloqueador beta empleado desde hace años en ciertas patologías cardíacas. El hallazgo casual de una rápida regresión de un HI en un paciente con miocardiopatía hipertrófica obstructiva, al que se le administró propranolol oral a 3mg/kg/día, puso en marcha su posible efecto terapéutico sobre los HI14. Recientemente se ha publicado una serie de pacientes pediátricos con HI que experimentaron una mejoría drástica tras recibir tratamiento con propranolol oral14. Esta y otras series han posibilitado que muchos dermatólogos pediátricos traten HI de alto riesgo con propranolol oral. En el momento actual no existe ningún estudio que compare propranolol con otras alternativas, y la mayor serie publicada en la literatura internacional se reduce a 32 pacientes14–19. Hasta el momento no existe ninguna serie de casos publicada en nuestro país. Aunque propranolol es un fármaco bien conocido y con una amplia experiencia en su uso, existen aún muchas dudas sobre su manejo en el tratamiento de los HI, como la dosis óptima, la duración del tratamiento y la recidiva tras su suspensión. En estas circunstancias, hasta que pueda llevarse a cabo un ensayo clínico controlado, es de suma importancia comunicar las series de casos locales y aumentar así la experiencia acumulada.
Los objetivos del presente estudio fueron conocer la efectividad y el perfil de seguridad de propranolol en solución oral para los HI.
Material y métodoRealizamos un estudio observacional y descriptivo en el que se revisaron los pacientes con HI remitidos a la Unidad de Dermatología Pediátrica de nuestro Hospital durante el periodo comprendido entre julio de 2008 y diciembre de 2009 (18 meses). El periodo de seguimiento se prolongó hasta el 30 de septiembre de 2010. Se consideraron criterios para el inicio del tratamiento con propranolol en HI en fase proliferativa: el riesgo de afectación funcional, la presencia de deformidad o complicaciones locales y que el paciente tuviera más de un mes de vida. En el caso de los HI en fase involutiva se pautó tratamiento en lesiones con gran deformidad residual para acelerar la evolución natural antes de la cirugía.
Los pacientes con HI con sospecha de síndrome PHACE fueron hospitalizados mientras se realizaban estudios complementarios (resonancia magnética craneal, angiorresonancia cerebral, ecografía abdominal, ecocardiografía, electrocardiograma [ECG] basal, bioquímica sanguínea, hemograma y valoración por cardiología y oftalmología). Una vez realizados los estudios se inició tratamiento con propranolol en régimen de ingreso hospitalario y se monitorizó la tensión arterial (TA) y la frecuencia cardiaca (FC) cada 8 horas, la glucemia cada 12 horas y el ECG diariamente durante 48 horas. En el resto de pacientes se realizó un estudio previo a la instauración de tratamiento consistente en ECG y valoración por el cardiólogo pediátrico, toma de TA y FC, bioquímica sanguínea y hemograma. Posteriormente se instauró tratamiento de forma ambulatoria, con control de TA y FC cada tres días durante la fase de incremento de dosis (12 días) y posteriormente cada semana. Esta monitorización se realizó en su centro de salud bajo la supervisión de su pediatra de zona.
Tras obtener el consentimiento escrito de los padres se inició tratamiento con propranolol en suspensión oral a una concentración de 5mg/ml. Se comenzó a una dosis de 0,5mg por kg de peso y día (mg/kg/d) repartida en dos tomas, con un incremento de 0,5mg/kg/d cada tres días, hasta alcanzar una dosis de 2mg/kg/d. Los pacientes incluidos en las etapas iniciales del estudio fueron revisados al mes y a los 3, 6, 9, 12 y 18 meses. Los pacientes incluidos en las etapas finales fueron revisados al mes y a los 3, 6 y 9 meses. Se realizó a cada uno de los pacientes un estudio fotográfico digital previo y en cada revisión para evaluar la respuesta al tratamiento. Se analizaron las características epidemiológicas basales, así como la respuesta en cada visita, según la disminución de la intensidad de color y la disminución del volumen, clasificada en: crecimiento, estabilización, respuesta parcial o respuesta completa (tabla 1). Igualmente se registraron los efectos adversos observados. Todos los datos fueron recogidos y procesados mediante el paquete estadístico SPSS (Statistical Package for Social Sciences), versión 17.0. Se calcularon las frecuencias absolutas y relativas (en porcentajes) para las variables cualitativas, y la media y la desviación estándar para las variables cuantitativas. Para detectar la posible relación entre la respuesta al tratamiento y la edad de inicio del mismo (menores o mayores de 6 meses y menores o mayores de 12 meses), así como la relación entre la localización de la lesión y la respuesta al tratamiento se utilizó el test de χ2 de Pearson. Las diferencias entre la duración del tratamiento en menores y mayores de 6 meses y entre menores y mayores de 12 meses se analizaron mediante el test de la «t» de Student aplicando la corrección de Levene. Para contrastar si las variables cuantitativas seguían una distribución normal se empleó el test de Shapiro-Wilk (n<50).
Clasificación de la respuesta al tratamiento
| Respuesta | Color | Volumen |
| Crecimiento | Aumento de la intensidad | Aumento del volumen |
| Estabilización | Mantenimiento o aclaramiento < 25% | Mantenimiento volumen o reducción < 25% |
| Parcial | Aclaramiento parcial | Reducción parcial de volumen |
| Completa | Aclaramiento total o telangiectasias residuales | Aplanamiento completo |
En casos de respuestas distintas de volumen y color se clasificó en la de menor categoría.
En total se incluyeron 28 pacientes con 36 HI. Los datos demográficos se muestran en la tabla 2. La edad media de aparición de los HI fue 1,29 semanas y el número medio de HI por niño fue 1,28 (las características de los HI se muestran en la tabla 3). Un 38,89% de los HI desarrollaron ulceración antes de iniciar el tratamiento. Veintiún niños (27 HI) iniciaron tratamiento antes de los 12 meses de vida. La edad de inicio media del tratamiento con propranolol fue de 3,86 meses (IC 95%: 2,80 - 4,92; rango: 1,43 - 10,23) para los menores de 12 meses y de 20,10 meses (IC 95%: 13,75 - 26,44; rango: 14 - 32,67) para los mayores de 12 meses. La localización y subtipo de los HI se muestra en la tabla 3.
Datos demográficos
| Sexo | |
| Mujer | 16 (57,16%) |
| Hombre | 12 (42,84%) |
| Tiempo medio seguimiento | 9,09 meses (DE 4,9) |
| Edad primera consulta | |
| < 12 meses | 3,86 meses (IC 95% 2,80 - 4,92) |
| > 12 meses | 20,10 meses (IC 95% 13,75 - 26,44) |
| Peso medio al nacimiento | 2951,78g (1.000 - 4.310) |
DE: desviación estándar; IC: intervalo de confianza.
Características de los hemangiomas infantiles
| Edad aparición del hemangioma | 1,29 semanas (0-4 semanas) |
| Número medio de hemangiomas | 1,28 (1-3) |
| Edad media consulta | 5,53 meses (0,5 - 30) |
| Tipo | |
| Focal | 77,78% |
| Segmentario | 22,22% |
| Mixto | 88,89% |
| Superficial | 8,33% |
| Profundo | 2,78% |
| Localización | |
| Focal | |
| Nasal | 5 (13,89%) |
| Labio | 4 (11,11%) |
| Párpado | 4 (11,11%) |
| Mejilla | 4 (11,11%) |
| Cuero cabelludo | 4 (11,11%) |
| Auricular | 3 (8,33%) |
| Tronco | 6 (16,67%) |
| Miembros | 2 (5,56%) |
| Segmentario | |
| Facial | 2 (5,56%) |
| Cervicofacial | 3 (8,33%) |
Cinco pacientes recibieron corticoides orales antes de iniciar propranolol. En 4 pacientes pudo discontinuarse la corticoterapia oral en pocas semanas sin recrecimiento. Todos ellos presentaban HI segmentarios de gran tamaño en la región facial, salvo uno con lesión focal en el párpado superior. En tres de los pacientes con HI segmentarios la lesión continuó creciendo a pesar del tratamiento con prednisolona oral a 3 o 5mg/kg/día. En estos pacientes, con edades de 1,5, 2 y 6 meses se instauró tratamiento con propranolol oral de forma simultánea a una pauta decreciente de prednisolona durante tres semanas. En los dos casos restantes, incluido el focal palpebral, los HI disminuyeron de tamaño con prednisolona a dosis de 3mg/kg/día, pero esta se suspendió en pauta decreciente durante tres semanas mientras se instauró el tratamiento con propranolol oral. Ambas pacientes tenían 4 y 3 meses de vida respectivamente cuando se inició propranolol. Una de estas pacientes, con un HI segmentario mixto en la región parotídea y auricular, precisó tratamiento simultáneo durante 4 meses con corticoides orales a dosis de 3mg/kg/día y propranolol oral a dosis de 4mg/kg/día por recrecimiento al suspender la corticoterapia o reducir la dosis de propranolol. Sólo uno de estos pacientes padecía un síndrome PHACE. Su HI segmentario cervicofacial ocluía la línea media pupilar del ojo derecho y presentaba una persistencia de arteria trigeminal e hipoplasia de segmento largo (más de 1cm) de ambas arterias vertebrales y de la arteria basilar. En este caso no hubo respuesta a la prednisolona oral, por lo que se inició tratamiento con propranolol hasta una dosis de 2mg/kg/día con respuesta completa tras 16 meses de tratamiento y sin desarrollar efectos adversos. Sólo un paciente fue tratado mediante una infiltración local de corticoides previa con respuesta parcial y ninguno recibió vincristina o interferón.
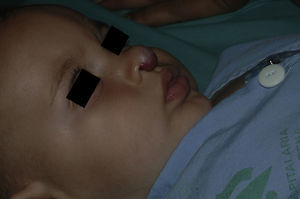
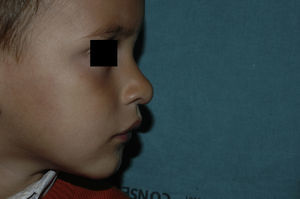
En cuanto a la respuesta a propranolol, en todos los pacientes se evidenció en las primeras 48 horas. En todos los pacientes, tanto mayores como menores de 12 meses, se apreció un cambio de coloración de rojo vivo a más apagado, con disminución de la consistencia de la lesión. La apertura ocular espontánea se objetivó en todos los pacientes con afectación palpebral dentro de los primeros 7 días de tratamiento (rango de 2 a 7 días). Nueve HI que presentaban ulceración (25%) curaron por completo en una media de 61 días (rango de 15 a 120 días). En uno de estos pacientes, que presentaba tres HI ulcerados, el tratamiento se combinó con láser de colorante pulsado por persistencia de la ulceración.
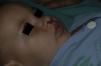
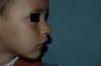
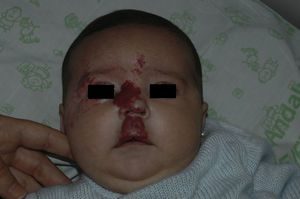
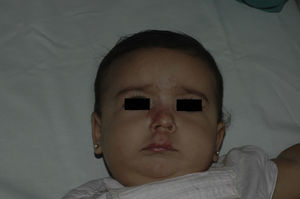
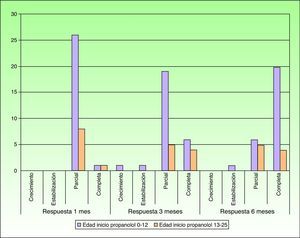
Tras un mes de tratamiento un 6,1% de todos los HI presentó respuesta completa y un 94,4% respuesta parcial. A los tres meses el 27,7% presentó respuesta completa y el 66,6% respuesta parcial. En este momento dos pacientes con sendos hemangiomas requirieron un aumento de la dosis de 2 a 4mg/kg/día por estabilización o crecimiento de la lesión, con gran deformidad. A los 6 meses de tratamiento la respuesta completa fue del 66,6%, la parcial del 30,5%, y se mantuvieron estables un 2,7% de los HI tratados (figs. 1-4). La evolución de esta respuesta según la edad de los pacientes, menores o mayores de 12 meses, se muestra en la figura 5. Las diferencias de respuesta encontradas entre mayores o menores de 6 meses y mayores o menores de 12 meses no fueron estadísticamente significativas (χ2 de Pearson; p=0,261 y p=0,432 respectivamente).
Analizada la respuesta al tratamiento según la localización, los 6 HI con afectación palpebral (4 focales y dos segmentarios) y los 4 focales de cuero cabelludo tuvieron una respuesta completa a los 6 meses. De los 5 localizados en la punta nasal, 4 tuvieron respuesta completa y uno respuesta parcial a los 6 meses.
La media de duración del tratamiento fue de 8,7 meses (rango de 2 a 16 meses). No se apreciaron diferencias estadísticamente significativas en la duración del tratamiento entre menores y mayores de 6 meses ni entre menores y mayores de 12 meses («t» de Student con corrección de Levene, p=0,341 y p=0,643 respectivamente). En todos los casos tratados el criterio para suspender propranolol fue la ausencia de mejoría visible durante al menos un mes y ausencia de recrecimiento al reducir la dosis de propranolol a 1mg/kg/día y tras su suspensión completa. Al reducir la dosis de propranolol de 2 a 1mg/kg/día, en algunos casos fue necesario aumentar nuevamente la dosis a 2mg/kg/día por recrecimiento (4 hemangiomas segmentarios en niños menores de 12 meses, dos focales profundos y uno mixto focal en niños mayores de 12 meses). En el grupo de menores de 12 meses, tras la suspensión completa recrecieron dos HI y otros dos presentaron un discreto aumento de la coloración de las telangiectasias residuales que no precisó reintroducir tratamiento. Sólo un paciente del grupo de pacientes mayores de 12 meses presentó recrecimiento que no precisó reintroducir tratamiento. No encontramos asociación estadísticamente significativa entre la localización de las lesiones y la respuesta al tratamiento (χ2 de Pearson; p=0,412). En cuanto a los efectos adversos sólo dos pacientes presentaron un episodio de hipotensión durante el primer mes de tratamiento (a dosis de 2mg/kg/día). En el primer caso (TA 62/45) fue asintomática y se resolvió espontáneamente en 15 minutos. Se reintrodujo el tratamiento por recrecimiento de la lesión a 1mg/kg/día con repetición de la hipotensión (TA 50/35) asintomática y autolimitada, que motivó la suspensión definitiva del tratamiento. En el segundo caso la hipotensión (TA 60/35) se acompañó de aletargamiento y precisó atención por el Servicio de Urgencias del Hospital Infantil Virgen del Rocío. Se resolvió espontáneamente, sin necesidad de tratamiento, en unos 30 minutos y motivó la suspensión definitiva del tratamiento. Tres pacientes presentaron bronquitis aguda durante el tratamiento, que se resolvió sin complicaciones tras suspender temporalmente propranolol oral y recibir tratamiento con salbutamol inhalado y esteroides orales, sin recrecimiento de los HI.
De los 6 pacientes con afectación ocular (4 hemangiomas focales y dos segmentarios), tan sólo dos casos afectaron a la línea media pupilar. De estos, sólo uno de ellos presentó oclusión palpebral completa después del primer mes de vida y por un periodo corto de tiempo (7 días). Se descartó la existencia de anisometropías en todos los casos realizando refracción mediante retinoscopía bajo dilatación pupilar. La agudeza visual fue valorada en los niños menores de 2 años mediante el reflejo de seguimiento y fijación, que descartó la existencia de ambliopías graves o moderadas. En ningún caso, y según el criterio y seguimiento del oftalmólogo pediátrico, los niños necesitaron realizar tratamiento. No obstante, estos pacientes aún están en seguimiento por la Unidad de Oftalmología Pediátrica.
DiscusiónEn nuestro estudio el tratamiento con propranolol fue efectivo en todos los casos, con respuesta completa en el 66,6% a los 6 meses de tratamiento. Los resultados fueron evidentes en las primeras horas de tratamiento en forma de cambios en el color y la consistencia de las lesiones. Este dato coincide con las series publicadas hasta el momento14–19. Esta acción fue especialmente llamativa en los hemangiomas localizados en el párpado, el cuero cabelludo y la punta nasal. No obstante, no encontramos asociación estadísticamente significativa entre la localización de las lesiones y la respuesta al tratamiento. Esto puede deberse al pequeño tamaño de la muestra. Un dato remarcable es que el propranolol oral no sólo consiguió la estabilización del crecimiento, como ocurre con los corticoides, sino que la mejoría continuó en muchos casos hasta conseguir la regresión completa en edades muy tempranas, acortando considerablemente la evolución natural de estas lesiones. Además esta respuesta rápida y significativa también se objetivó en todos los HI de niños mayores de 12 meses, a diferencia del tratamiento con corticoides sistémicos, que sólo es efectivo en la fase proliferativa4,19. En nuestra serie objetivamos una respuesta mayor a los 6 meses de tratamiento en los pacientes tratados antes de los 12 meses de vida (74 frente a 44,6%). Llama la atención en el grupo de mayores de 12 meses que la respuesta completa y parcial fueron las mismas a los 3 y 6 meses de tratamiento. Esto puede deberse quizás a que a esta edad sea más difícil obtener una respuesta completa sin deformidad residual sólo con tratamiento médico. En aquellos casos que fueron tratados de forma precoz la remisión completa se obtuvo a una media de edad de 8,7 meses, lo que sugiere que el tratamiento con propranolol debe instaurarse durante la fase proliferativa, y antes de que la mayoría de las lesiones alcancen su tamaño máximo en torno a los 5 meses de vida15,16,18,19. Consideramos que en los HI en fase involutiva (tratamientos tardíos) el tratamiento debe mantenerse empíricamente hasta que se obtenga el mejor resultado posible.
Consideramos que no debe usarse el propranolol oral como primera elección en pacientes con HI y anomalías vasculares intracraneales. Sin embargo, en nuestro paciente con síndrome PHACE decidimos instaurar tratamiento con propranolol oral, ya que presentaba un hemangioma segmentario de gran tamaño que ocluyó por completo la línea media pupilar a pesar del tratamiento con esteroides orales, y las anomalías vasculares cerebrales no afectaban a la arteria carótida interna, con la que se han relacionado todos los casos de accidentes vasculocerebrales asociados a PHACE20. Por otro lado, este fue el paciente que precisó el tratamiento de más larga duración, hasta los 18 meses de vida, entre los pacientes que iniciaron propranolol de forma precoz (16 meses de tratamiento).
En nuestra experiencia es aconsejable suspender propanolol de forma paulatina, ya que en algunos casos puede observarse una recoloración o recrecimiento de las lesiones al reducir la dosis que hace que el tratamiento se deba prolongar. De este modo, en nuestra casuística, tras su suspensión completa no fue necesaria su reintroducción.
En el caso de la ulceración los resultados obtenidos con propranolol oral hasta el momento en la literatura son variables19,21,22. La media de curación de los HI ulcerados en nuestra serie fue de 61 días, y en uno de los pacientes se combinó con láser de colorante pulsado. Consideramos que la presencia de ulceración no indica por sí sola el uso de propranolol, debido a que en nuestra serie no observamos diferencia en la mejoría de la sintomatología o el tiempo de curación con respecto a otros tratamientos22–30. Harán falta estudios comparativos aleatorizados para aclarar este punto.
En nuestra serie la mayor parte de los efectos adversos fueron leves y previsibles a la dosis empleada, aunque uno de los casos que desarrolló hipotensión precisó atención urgente. En el presente estudio no se monitorizaron los niveles de glucemia durante el tratamiento. Dado que uno de los posibles efectos adversos del propranolol oral es la hipoglucemia, se advirtió a los progenitores que administraran el tratamiento cada 12 horas coincidiendo con las comidas, y que lo suspendieran temporalmente en caso de vómitos, si bien ninguno de los pacientes suspendió el tratamiento por este motivo durante el tiempo de seguimiento.
Una limitación de este estudio es el tamaño de la muestra. Esto puede haber condicionado que las diferencias detectadas no hayan alcanzado la significación estadística. No obstante, nuestro tamaño es similar a otros estudios, y añade algo más de evidencia a la experiencia clínica mundial de propanolol en el tratamiento de los HI.
En conclusión, según el presente estudio, el tratamiento con propranolol en solución oral a 2mg/kg/día es efectivo, seguro y bien tolerado en el tratamiento de los HI. El efecto es evidente en las primeras horas tras instaurar el tratamiento, el cual ha de mantenerse durante varias semanas, generalmente hasta 6 meses, para obtener una importante mejoría, acortando considerablemente su evolución natural. Este tratamiento parece ser más efectivo en aquellos HI en fase proliferativa, mientras que en nuestra experiencia no reduce significativamente la sintomatología o el tiempo de cicatrización cuando existe ulceración.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente estudio ha recibido el Premio Dr. José Salvador Gallardo 2010 de la Real Academia de Medicina de Sevilla.