Exponemos el caso de una paciente de 17 años que presentó una micosis fungoide de evolución rápida y agresiva, con múltiples tumores cutáneos y transformación fenotípica celular a linfoma de células grandes. Fue tratada inicialmente con 3 ciclos de quimioterapia en dosis altas (MEGA-CHOP) sin respuesta, por lo que se decidió realizar un trasplante autólogo de progenitores hematopoyéticos. Este tratamiento consiguió una remisión parcial de la enfermedad, y con la posterior introducción del bexaroteno oral se logró la remisión completa, que se ha mantenido durante más de 3 años con muy buena tolerancia al bexaroteno oral.
Analizamos las ventajas y desventajas de la utilización del trasplante autólogo de progenitores hematopoyéticos y del uso de bexaroteno oral.
We describe the case of a 17-year-old patient with rapidly progressing and aggressive mycosis fungoides, with multiple cutaneous tumors and large cell transformation. She was initially treated with 3 cycles of high-dose chemotherapy with mega-CHOP (cyclophosphamide, doxorubicin, vincristine, and prednisone) without response, leading to the decision to undertake autologous hematopoietic stem cell transplantation. Partial remission of the disease was achieved with this treatment and subsequent introduction of oral bexarotene led to complete remission, which has been maintained for more than 3 years with good tolerance of oral therapy. We discuss the advantages and disadvantages of autologous hematopoietic stem cell transplantation and the use of oral bexarotene.
La micosis fungoide supone el 50% del total de los linfomas cutáneos primarios, siendo el más frecuente de los de tipo T. Su incidencia aproximada es de 0,4 casos por cada 100.000 habitantes y año1. Es una enfermedad que predomina en adultos entre la quinta y la sexta década de la vida, aunque en ocasiones aparece en adolescentes e incluso enniños. En el caso de pacientes jóvenes, hay que hacer un seguimiento estrecho, ya que la enfermedad tiende a evolucionar con mayor rapidez o agresividad; por ejemplo, transformándose en un linfoma de células grandes. Esta transformación se define como un infiltrado tumoral compuesto en más del 25 % por células cuyo tamaño es superior o igual a 4 veces el tamaño de los linfocitos sanos. Tiene una incidencia variable del 8-39%, y se asocia con un peor pronóstico2.
Caso clínicoNuestra paciente tiene 26 años en el momento actual. En el año 1996 comenzó con un cuadro de manchas cutáneas hiperpigmentadas extensas en los muslos, clínica e histológicamente inespecíficas. Durante 3 años, en los cuales su seguimiento fue perdido, presentó lesiones similares de aparición progresiva año. En el año 1999 desarrolló varios tumores cutáneos sobre lesiones tipo placa y adenopatías generalizadas en el plazo de un mes. El estudio anatomopatológico de una de las lesiones tumorales mostró una infiltración linfoide difusa dérmica con epidermotropismo, ulceración focal, paraqueratosis, pérdida y atrofia de anejos, presencia de microabscesos de Pautrier y frecuentes eosinófilos. El infiltrado era muy denso y estaba constituido por células linfoides de doble fenotipo: células pequeñas de núcleo hipercromático y contorno marcadamente indentado y células linfoides de mayor tamaño de aspecto blástico. Por técnicas de inmunohistoquímica se observó que la mayoría de los linfocitos eran de tipo T, CD3 y CD4 positivos, con una población acompañante de linfocitos B CD20 positivos y de linfocitos T CD8 positivos, así como de células dendríticas. Por técnicas de imagen (tomografía axial computarizada [TAC]) se apreciaron adenopatías axilares bilaterales voluminosas e inguinales de menor tamaño, confirmando el estudio histológico de un ganglio axilar la infiltración por linfoma. Sin embargo, la biopsia de médula ósea fue normal (estadio TNMB IV-A).
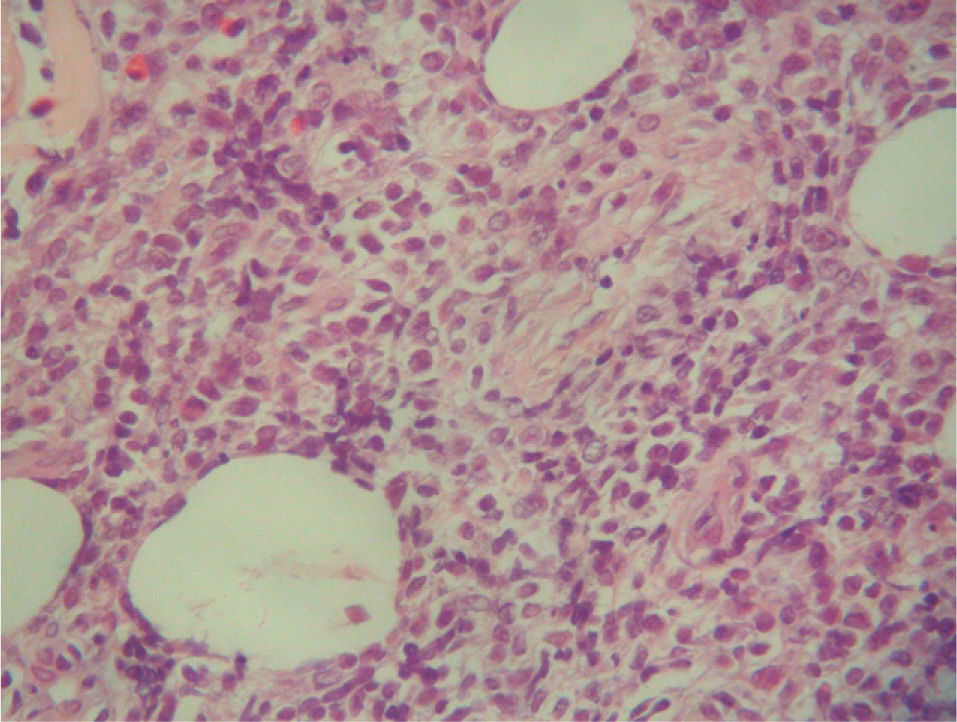
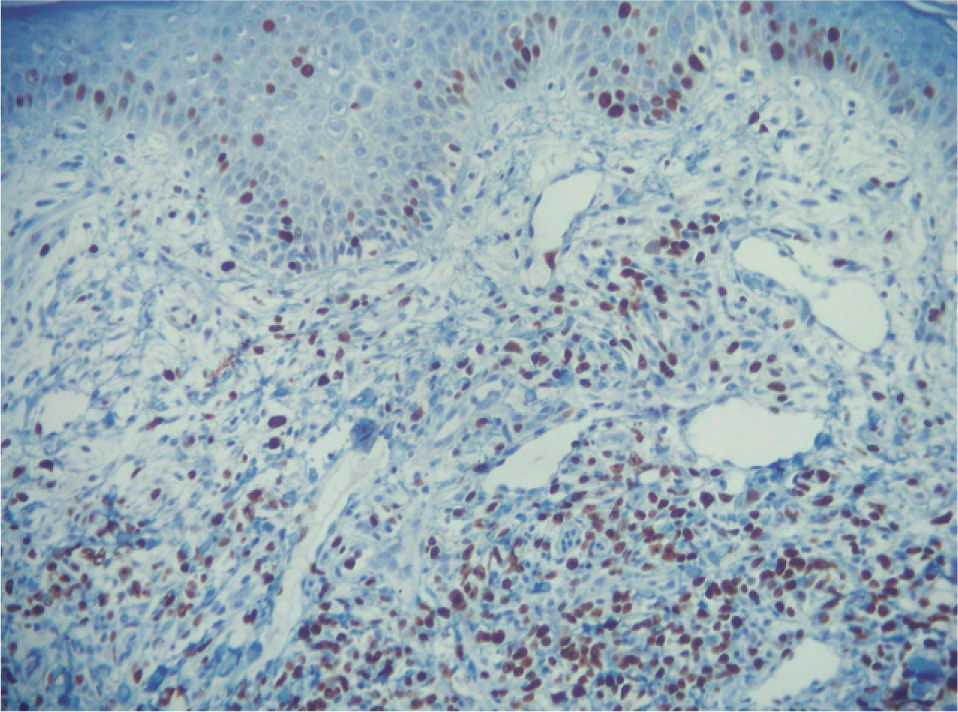
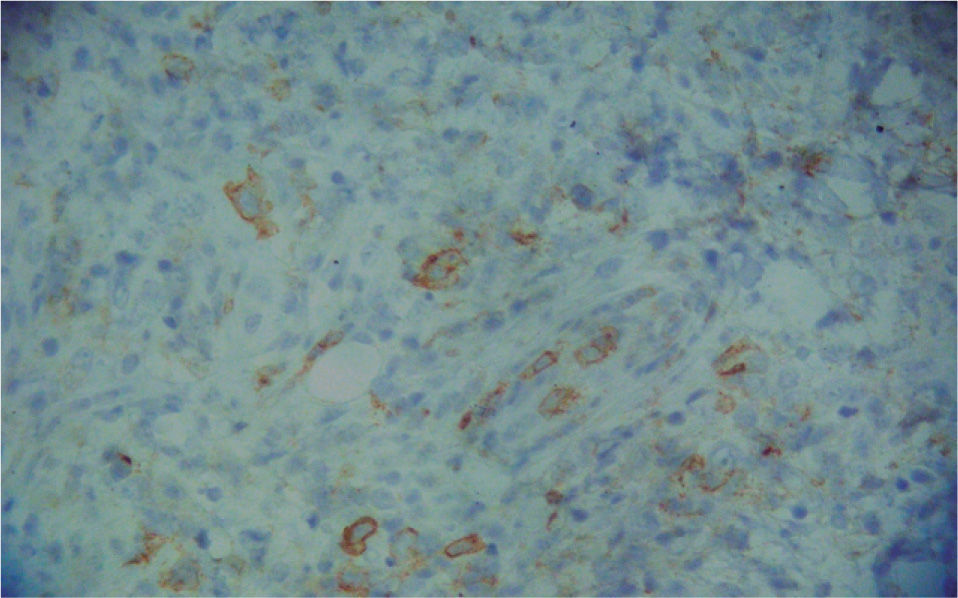
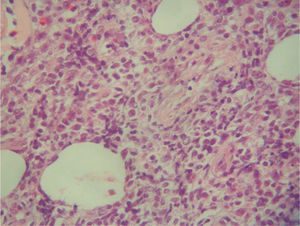
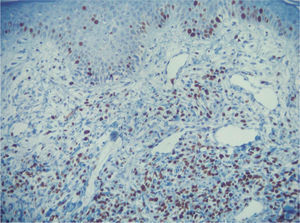
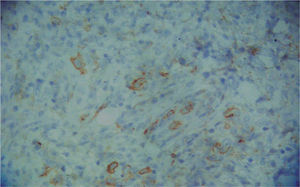
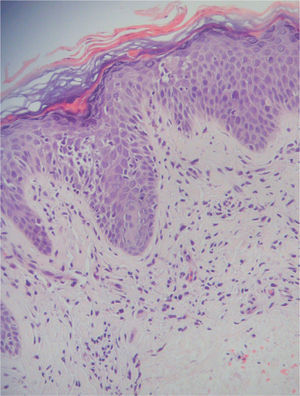
Cuatro meses después se realizó un nuevo estudio histológico de una lesión tumoral de nueva aparición en la región lumbar. El resultado fue de linfoma cutáneo de células T (LCCT) tipo micosis fungoide en transformación a linfoma T de célula grande, y pérdida de fenotipo periférico diferenciado (CD3+, CD4-, CD20-, CD30+ en grupos aislados de células). Las células grandes constituían el 80% del infiltrado, y el 60 % de ellas expresaban Ki67. El resto del infiltrado estaba constituido por células pequeñas CD4+ y CD8(figs. 1, 2 y 3). Asimismo, el reordenamiento del gen del receptor de células T realizado mediante técnica de reacción en cadena de la polimerasa (PCR) fue positivo para la cadena γ-1 tanto en sangre como en piel. El inmunofenotipo linfoide obtenido de la sangre periférica presentó cambios no concluyentes de LCCT.
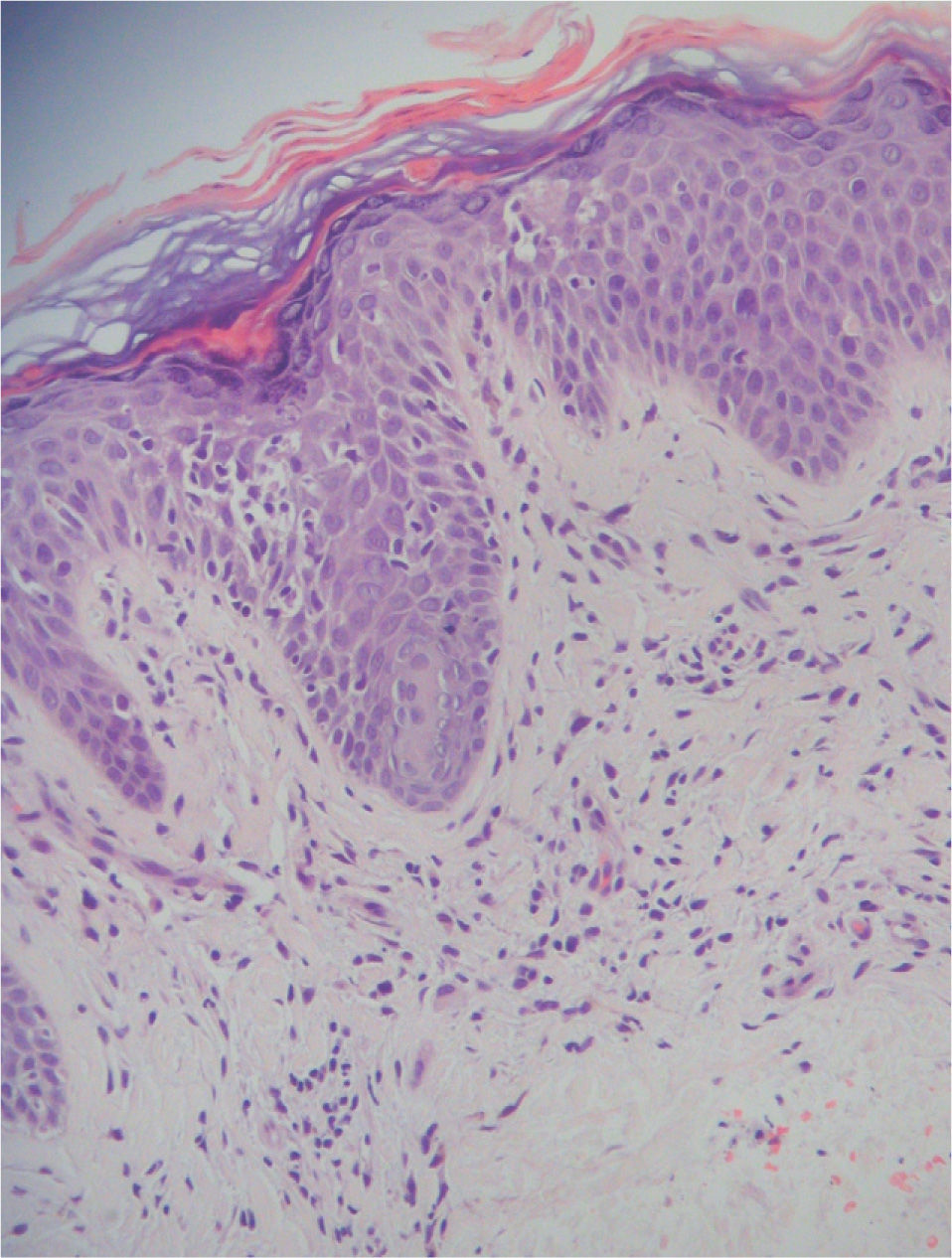
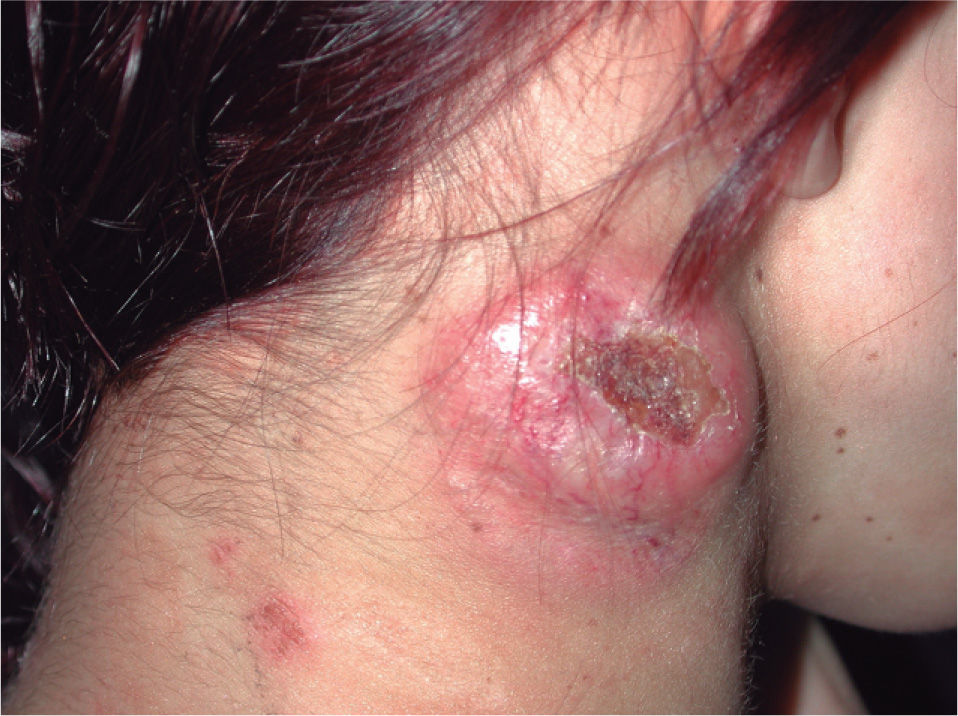
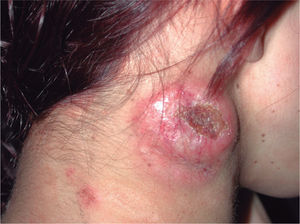
Dada la rápida evolución de la enfermedad, en abril de 1999 la paciente inició un tratamiento quimioterápico con 3 ciclos de MEGA-CHOP (ciclofosfamida, adriamicina, vincristina y prednisona) asociado a la administración de G-CSF (factor estimulador de colonias de granulocitos), obteniéndose una escasa respuesta al mismo. Debido a las características de la paciente y a la gran agresividad del linfoma se decidió realizar un trasplante autólogo de progenitores hematopoyéticos (TAPH), procedimiento que fue llevado a cabo en noviembre de 1999. Previamente fue sometida a tratamiento de rescate siguiendo el esquema ESHAP (etopósido, citarabina en dosis elevadas, cisplatino y metilprednisolona) en un total de 4 ciclos. Se recogieron progenitores autólogos tras la movilización con ciclofosfamida y G-CSF. El tratamiento de acondicionamiento del TAPH siguió el esquema BUCY2 (busulfán y ciclofosfamida). Se realizó profilaxis con mesna y fenitoína para prevenir la aparición de cistitis hemorrágica y crisis comiciales, respectivamente. La paciente presentó una buena tolerancia y una buena respuesta al tratamiento, a pesar de lo cual, las lesiones reaparecieron en forma de placas en enero de 2000, pero sin asociar adenopatías clínicamente ni por técnicas de imagen (estadio I-B) (fig. 4). Estas lesiones se trataron con mostaza nitrogenada y corticoides tópicos, seguidos de PUVA e interferón (IFN) alfa-2b hasta un máximo de 4,5 MU 3 veces por semana. Asimismo, fue precisa la aplicación de radioterapia local, en varias ocasiones, debido al rápido crecimiento de las lesiones tumorales de predominio en la región cefálica (año 2001) (estadio II-B) (fig. 5).
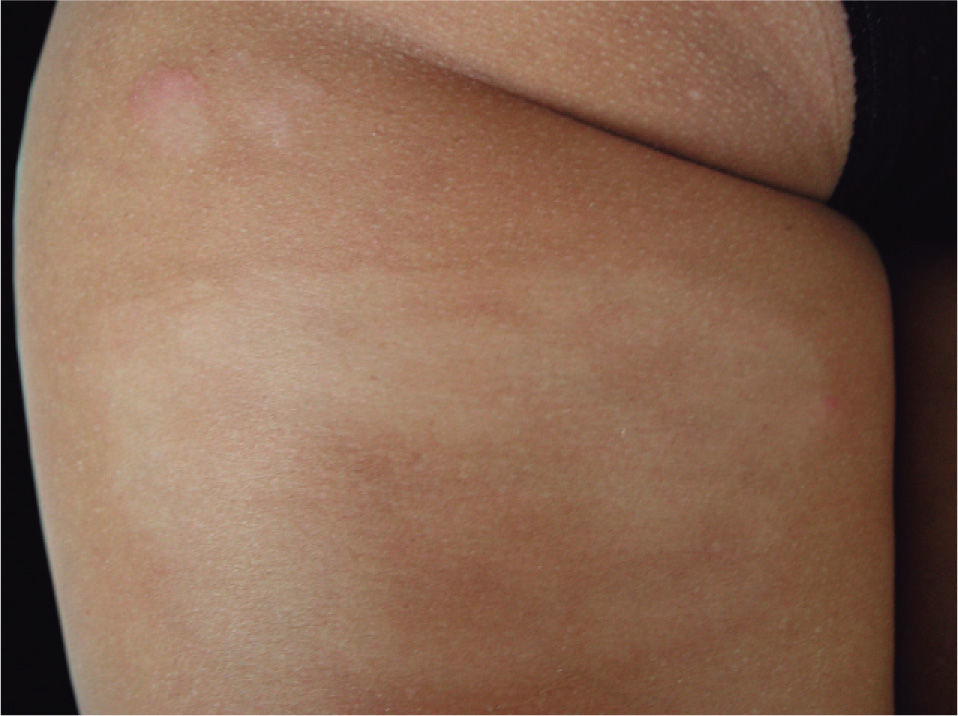
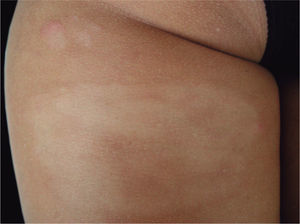
Ante la evidente progresión cutánea de la enfermedad, iniciamos un tratamiento con bexaroteno oral (TARGRETIN®) a principios del año 2003. Su tolerancia fue buena, y la respuesta clínica fue espectacular, presentando únicamente lesiones hipopigmentadas residuales, no infiltradas, que han permanecido estables, por lo cual, consideramos que la paciente se encuentra en remisión completa hasta el momento actual con 42 meses de seguimiento (fig. 6).
DiscusiónEl TPH, después de la aplicación de quimioterapia mieloablativa y/o radioterapia, ha demostrado ser una terapia curativa en varios trastornos mielo-linfoproliferativos; sin embargo, hay pocas publicaciones en relación con el tratamiento del LCCT. Está especialmente indicado en pacientes menores de 60 años sin comorbilidad ni disfunciones orgánicas graves (sobre todo de tipo cardíaco, renal o pulmonar), con neoplasias avanzadas o rápidamente progresivas resistentes, al menos, a un tratamiento sistémico.
El TAPH consiste en la utilización de quimioterapia mieloablativa, seguida de la infusión de progenitores hematopoyéticos previamente obtenidos del propio paciente. Tiene la ventaja de ser un proceso seguro, con tasas de morbimortalidad bajas, y de ser relativamente accesible, ya que puede realizarse en edades avanzadas de la vida, y no requiere donantes histocompatibles. En la mayoría de los casos se consigue una remisión completa pero poco duradera. Se cree que las recidivas puedan ser debidas tanto a la reinfusión de células tumorales junto con el injerto del propio paciente, como a la dificultad que presenta un deteriorado sistema inmunológico, ineficaz para combatir la enfermedad residual. Otra posibilidad a tener en cuenta sería el fallo de la quimioterapia en la erradicación de la enfermedad, probablemente formada por clones residuales quimiorresistentes, responsables en último término de la recidiva.
Las altas tasas de recidiva de los LCCT después de aplicar quimioterapia y realizar el TAPH son superponibles a las altas tasas que se observan en otros linfomas de bajo grado en los que hay más experiencia en este tipo de tratamientos.
El trasplante alogénico de PH también es capaz de inducir remisiones completas en linfomas de bajo grado. El índice de recidiva es menor que con el trasplante autólogo (18 frente a 46 %) y el tiempo de supervivencia libre de enfermedad se ve aumentado en meses e incluso años. Aunque todavía hay pocos casos, los resultados obtenidos en el tratamiento del LCCT son superponibles a estos datos. El uso de progenitores alogénicos no solo elimina la contaminación por células malignas del injerto, sino que ejerce un efecto antitumoral (efecto conocido como injerto contra linfoma) que suele ser directamente proporcional a la reacción injerto contra huésped sufrida. Sin embargo, a diferencia del TAPH, la mortalidad del procedimiento es alta (aproximadamente un 20%), sobre todo teniendo en cuenta que se realiza en pacientes en estadios avanzados de su enfermedad y generalmente muy tratados. En este sentido, se están produciendo avances tanto en el manejo de la enfermedad injerto contra huésped mediante nuevas terapias inmunosupresoras como con la realización de los denominados minitrasplantes, que consistirían en la aplicación de tratamientos de acondicionamiento menos intensivos, disminuyendo la mortalidad tóxica y buscando así un mayor efecto injerto contra linfoma. Por ello, estos trasplantes pueden ser realizados en un espectro más amplio de pacientes, algunos de ellos en edades avanzadas de la vida. Desgraciadamente estas terapias todavía se encuentran en fase de desarrollo3,4.
El bexaroteno fue aprobado por la FDA (Food and Drug Administration) a finales de 1999 para el tratamiento del LCCT refractario, al menos, a un tratamiento sistémico previo. Es un fármaco que forma parte del grupo de los rexinoides, siendo un agonista selectivo de los receptores nucleares RXR. Estos receptores modulan la expresión de genes que actúan en la inhibición de la proliferación de células tumorales y en la inducción de la diferenciación celular y de la apoptosis, aunque su mecanismo de acción exacto es desconocido. La dosis diaria recomendada es de 300mg/m2 al día y los efectos adversos más frecuentes son la hipertrigliceridemia y el hipotiroidismo central, ambos reversibles y dosis-dependientes5.
Nuestra paciente es una mujer joven, con una micosis fungoide inicialmente agresiva. En el curso de la enfermedad presentó una transformación fenotípica celular a un linfoma de células grandes, y una escasa respuesta al tratamiento quimioterápico. El TAPH consiguió revertir el cuadro adenopático y sistémico, limitando la enfermedad a la piel (probablemente controlando la variación fenotípica del linfoma de células grandes). El efecto inmunomodulador del TAPH no solo logró frenar la enfermedad en un momento crítico y atenuar su ulterior agresividad, sino que al reducir la masa tumoral de la que partía, favoreció la buena respuesta posterior al bexaroteno oral, haciendo posible que la paciente actualmente se encuentre en remisión completa después de más de tres años. El hecho de que se hayan publicado varios trabajos que describen combinaciones exitosas de bexaroteno con PUVA6-8, IFN-alfa9, fotoféresis10 y denileukin diftitox (ONTAK®)11,12 avala esta hipótesis. En este último caso, incluso estudios realizados in vitro han demostrado un efecto sinérgico del empleo conjunto de bexaroteno y denileukin diftitox. En el caso que presentamos, se combinó la realización del TAPH con el tratamiento posterior con bexaroteno. El uso de estas dos terapias, consecutivamente, no ha sido descrito previamente en la literatura, y pensamos que pudiera tratarse de una opción a tener en cuenta en el tratamiento de los LCCT, sobre todo en aquellos que presentan una evolución agresiva al linfoma de células grandes.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.