Telaprevir es un fármaco que administrado junto a interferón y ribavirina incrementa de forma significativa la respuesta al tratamiento de la infección por el virus de la hepatitis C. Sin embargo, su empleo incrementa también la probabilidad de desarrollar efectos adversos, en muchos casos cutáneos que pueden condicionar el mantenimiento del tratamiento.
ObjetivoConocer la incidencia, características clínicas y evolutivas y respuesta al tratamiento de las toxicodermias por telaprevir en el contexto del tratamiento de la infección por el virus de la hepatitis C.
Material y métodosEstudio prospectivo observacional realizado entre mayo de 2012 y julio de 2013 en el que se incluyeron aquellos pacientes que iniciaron tratamiento con telaprevir durante ese periodo. En aquellos en los que se detectaron toxicodermia se recogieron los datos demográficos de los pacientes, las características clínicas de las lesiones y la evolución tras la aplicación de las recomendaciones de las guías clínicas.
ResultadosDe un total de 43 pacientes que recibieron tratamiento triple un 46% presentó toxicodermia atribuible a telaprevir. En el 90% de los casos esta fue leve o moderada (grados 1 o 2) y consistió en un exantema constituido por pápulas y placas eritematoedematosas y descamativas. En alrededor de un tercio de los pacientes se comprobó la progresión de la toxicodermia, principalmente en extensión, durante el curso del tratamiento. En 2 casos (4,6%) las lesiones cutáneas condicionaron la suspensión del fármaco. Un 79% de los tratados (34 pacientes) alcanzó una respuesta viral sostenida tras el tratamiento.
ConclusionesLas toxicodermias asociadas a telaprevir son frecuentes en el curso del tratamiento y a menudo progresivas. Sin embargo, solo de forma excepcional condicionan su suspensión.
When co-administered with interferon and ribavirin, the prescription drug telaprevir significantly improves treatment response in patients with chronic hepatitis C virus (HCV) infection. Its use, however, also increases the likelihood of adverse effects that may lead to discontinuation of treatment. Cutaneous adverse effects are particularly common.
ObjectiveTo determine the frequency and clinical characteristics of drug eruptions induced by telaprevir in patients receiving HCV treatment and to analyze the clinical course of lesions and response to treatment.
Material and methodsWe performed a prospective observational study of all patients who started a treatment regimen that included telaprevir between May 2012 and July 2013. We recorded the demographic characteristics of the patients who developed telaprevir-induced eruptions, and analyzed the clinical characteristics of the lesions and their clinical course following the application of guideline-based treatment recommendations.
ResultsTwenty (46%) of the 43 patients who received triple therapy with interferon, ribavirin, and telaprevir during the study period developed drug reactions attributable to telaprevir. The reaction was classified as mild or moderate (grades 1 or 2) in 90% of cases and consisted of an exanthem with erythematous-edematous scaling plaques and papules. The rash worsened, mainly by spreading, in about one-third of cases. The skin lesions led to discontinuation of treatment in 2 patients (4.6%). Sustained viral response was achieved in 34 patients (79%).
ConclusionsTelaprevir-induced eruptions are common and often progress, but they rarely require patients to discontinue treatment.
La infección crónica por el virus de la hepatitis C (VHC) representa en la actualidad la primera causa de cirrosis, carcinoma hepatocelular, trasplante hepático y muerte por causa hepática en el mundo occidental1. El tratamiento estándar, basado en la combinación de interferón pegilado (IFN) y ribavirina ofrece modestas tasas de respuesta viral sostenida (RVS), definida como la ausencia de carga viral en sangre 24 semanas después de haber completado el tratamiento. La obtención de RVS se ha asociado a una clara mejoría en el pronóstico de la enfermedad hepática de base y en la supervivencia de estos pacientes2, por lo que es considerada el principal objetivo del tratamiento de la hepatitis C. Durante los últimos años se han realizado esfuerzos por desarrollar nuevas moléculas que mejoren las perspectivas terapéuticas de estos enfermos; así es como recientemente han aparecido nuevos fármacos, llamados agentes antivirales directos.
En el año 2011 la Food and Drug Administration (FDA) y la European Medicines Agency (EMA) aprobaron la utilización del telaprevir para el tratamiento de la infección crónica por el genotipo 1 del VHC3. El telaprevir es un agente antiviral directo que disminuye rápidamente los niveles de ARN del VHC al unirse a la proteasa de serina NS3/4A, enzima esencial para la replicación del virus4. Al administrar el telaprevir junto a IFN y ribavirina (triple terapia), se observa un aumento significativo de la frecuencia de RVS en pacientes infectados por el genotipo 1 del virus5. De este modo los porcentajes de RVS obtenidos con telaprevir alcanzan un 75% en pacientes no tratados6 y hasta un 70% en pacientes previamente tratados7, frente a las tasas más modestas de alrededor de RVS del 50% para el tratamiento con INF pegilado y rivabirina8.
La pauta recomendada de tratamiento incluye 12 semanas con telaprevir, IFN y ribavirina, seguidas de 12 a 36 semanas más de IFN y ribavirina en función de la respuesta viral y de la presencia o ausencia de cirrosis hepática.
Sin embargo, la adición de telaprevir al tratamiento estándar del VHC incrementa el riesgo de efectos adversos, entre los que destacan las manifestaciones cutáneas. Se ha demostrado además que los pacientes que reciben telaprevir suspenden el tratamiento con mayor frecuencia que los que siguen el tratamiento estándar9.
Aunque existen referencias procedentes de los ensayos clínicos respecto a las manifestaciones cutáneas asociadas al telaprevir, e incluso se han elaborado documentos guía para su manejo, desconocemos en gran medida la incidencia, magnitud, expresión clínica y evolución de estas toxicodermias en la práctica diaria.
La evaluación prospectiva por parte de dermatólogos de los efectos adversos cutáneos asociados a telaprevir podría favorecer su rápido reconocimiento y manejo. Con esta premisa se ha diseñado este estudio, cuyo objetivo es conocer la incidencia de las reacciones adversas cutáneas relacionadas con la triple terapia para la infección por VHC, así como sus características clínicas, momento de aparición tras el inicio del tratamiento, evolución y respuesta al tratamiento indicado.
Material y métodosSe realizó un estudio prospectivo observacional de todos los pacientes del Hospital Universitari Germans Trias i Pujol diagnosticados de infección por VHC de genotipo 1 que iniciaron tratamiento con triple terapia con telaprevir más IFN y ribavirina durante el período comprendido entre mayo de 2012 y julio de 2013.
Antes de iniciar del tratamiento antiviral se llevó a cabo una visita basal en las consultas de dermatología; en ella se registraron antecedentes de enfermedades dermatológicas preexistentes, historia de tratamientos anti-VHC con IFN y ribavirina, y la existencia o no de efectos adversos cutáneos relacionados con estas pautas previas de tratamiento. En esta visita basal se entregaron además recomendaciones destinadas principalmente al cuidado e hidratación habitual de la piel durante el tratamiento con telaprevir, y se insistió en la necesidad de consultar precozmente ante la aparición de lesiones cutáneas en el transcurso de la terapia antiviral.
Todos los pacientes realizaron sus controles médicos en la unidad de hepatología de nuestro hospital. En dichas visitas se observó la tolerancia al tratamiento y se realizaron análisis seriados para valorar tanto la efectividad de la terapia (RVS), como la aparición de anemia u otras alteraciones. Ante la aparición de lesiones cutáneas los pacientes eran remitidos al servicio de dermatología para su evaluación en el plazo de 24-48h.
La imputabilidad del telaprevir en la toxicodermia se realizó utilizando el algoritmo de causalidad de Naranjo et al.10.
En los casos clínicamente compatibles con toxicodermia su clasificación fue definida tomando como referencia la propuesta reflejada en el documento de recomendaciones para el tratamiento de la infección por VHC con triple terapia del Ministerio de Sanidad (tabla 1)11. Esta evaluación se acompañó de una detallada descripción de las lesiones cutáneas y de iconografía. Para las recomendaciones terapéuticas también se tuvo en cuenta como referencia el documento del Ministerio de Sanidad.
Clasificación de las toxicodermias por telaprevir según gravedad y protocolo de actuación recomendado en los ensayos clínicos en fase iii
| Clasificación | Características clínicas | Protocolo de actuación recomendado |
|---|---|---|
| Grado 1 (leve) | Erupción cutánea localizada con o sin prurito asociado | Hidratación. Limitar la exposición sol/calorCremas/lociones emolientesCorticoides tópicosAntihistamínicos sistémicos |
| Grado 2 (moderado) | Erupción cutánea difusa que afecta a menos del 50% de la superficie corporal, con o sin descamación, prurito o afectación mucosa pero sin ulceración | Igual a grado 1Si empeoramiento suspender telaprevirSi a los 7 días no mejora suspender ribavirina |
| Grado 3 (severo) | Exantema que afecta a más del 50% de la superficie corporal o exantema que presenta: vesículas o ampollas, ulceración superficial de las mucosas, desprendimiento epidérmico | Suspender telaprevir de forma inmediataSi a los 7 días no mejora suspender ribavirina y secuencialmente interferón |
| Grado 4 (SCAR) | Síndrome de Stevens-JohnsonSíndrome de DRESSNecrólisis epidérmica tóxicaEritema multiformePustulosis exantematosa generalizada | Suspensión permanente de todos los fármacos (telaprevir, ribavirina, interferón)Valorar la hospitalización |
DRESS: drug rash with esosinophilia and systemic symptoms; SCAR: reacciones cutáneas adversas graves a fármacos.
En todos los casos de toxicodermia se diseñó un circuito personalizado de seguimiento con controles personalizados en los servicios de dermatología y hepatología. Estos controles se realizaron bien hasta la resolución del cuadro cutáneo, bien hasta recomendar la suspensión del telaprevir. En aquellos casos en los que el cuadro clínico cutáneo persistía tras la suspensión del telaprevir el paciente continuaría realizando controles en dermatología para valorar la retirada secuencial de ribavirina e interferón.
ResultadosSe incluyeron un total de 43 pacientes, 29 hombres y 14 mujeres, con edades comprendidas entre los 27 y los 67 años. Del total de pacientes estudiados 16 (37%) tenían antecedentes de dermatosis preexistentes: 6 pacientes presentaban dermatitis seborreica, 3 presentaban angiocapilaritis, 3 psoriasis, 2 urticaria, uno presentaba dermatitis atópica y otro paciente presentaba liquen plano; 25 pacientes (58% del total) habían recibido previamente tratamiento antiviral estándar (tabla 2). De estos 25 pacientes 6 (24% de los previamente tratados) habían presentado reacciones cutáneas al tratamiento con IFN y ribavirina, todas de carácter leve.
Veinte pacientes (46% del total) presentaron una erupción cutánea considerada como toxicodermia en relación con la triple terapia. La edad, sexo y otras características demográficas de interés de estos 20 pacientes se recogen en la tabla 3.
Características clínicas de los pacientes que presentaron toxicodermia por telaprevir
| Paciente | Edad | Sexo | Terapia previa anti-VHC | Grado de toxicodermia | Tratamiento realizado | Evolución cutánea | Evolución virológica |
|---|---|---|---|---|---|---|---|
| Paciente 1 | 52 | H | No | Grado 1 | Tópico | Curado | RVS |
| Paciente 2 | 49 | H | Sí | Grado 1 | Tópico | Curado | No RVS |
| Paciente 3 | 64 | H | No | Grado 1 | Tópico | Curado | RVS |
| Paciente 4 | 61 | M | No | Grado 2 | Corticoides orales y tópicos | Evoluciona a grado 3a | RVS |
| Paciente 5 | 44 | H | No | Grado 1 | Tópico | Curado | No RVS |
| Paciente 6 | 63 | H | Sí | Grado 1 | Tópico | Curado | RVS |
| Paciente 7 | 57 | H | No | Grado 1 | Tópico | Curado | RVS |
| Paciente 8 | 51 | H | Sí | Grado 1 | Tópico | Evoluciona a grado 2 y luego cura | RVS |
| Paciente 9 | 34 | M | No | Grado 1 | Tópico | Curado | RVS |
| Paciente 10 | 55 | H | Sí | Grado 1 | Tópico | Curado | RVS |
| Paciente 11 | 58 | M | No | Grado 2 | Tópico | Evoluciona a lesiones tipo prurigo nodularb | RVS |
| Paciente 12 | 57 | M | No | Grado 4 | Suspensión inmediata telaprevir | Curado | No RVS |
| Paciente 13 | 63 | M | No | Grado 1 | Tópico | Evoluciona a grado 2 y luego cura | RVS |
| Paciente 14 | 62 | H | No | Grado 2 | Tópico | Curado | RVS |
| Paciente 15 | 65 | M | No | Grado 1 | Tópico | Curado | RVS |
| Paciente 16 | 62 | H | Sí | Grado 1 | Tópico | Curado | RVS |
| Paciente 17 | 42 | M | No | Grado 1 | Tópico | Curado | RVS |
| Paciente 18 | 65 | M | No | Grado 1 | Tópico | Curado | RVS |
| Paciente 19 | 51 | H | Sí | Grado 1 | Tópico | Curado | RVS |
| Paciente 20 | 62 | H | No | Grado 1 | Tópico | Curado | RVS |
RVS: respuesta viral sostenida.
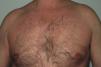
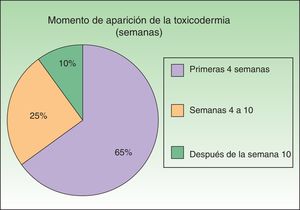
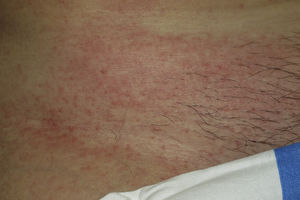
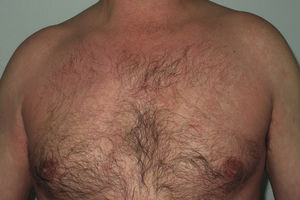
En nuestro estudio la mayoría de las toxicodermias (13/20) se iniciaron de forma precoz, dentro de las 4 primeras semanas de tratamiento (fig. 1). En la mayor parte de los casos las lesiones se presentaron como un exantema constituido por pápulas y placas eritematoedematosas y descamativas, mal delimitadas y de pequeño tamaño; el cuadro fue inicialmente localizado y se extendía secundariamente de manera más o menos simétrica, principalmente por el hemicuerpo superior (fig. 2) sin afectación facial ni palmo-plantar. Las lesiones casi siempre asociaron prurito, xerosis cutánea y signos de excoriación. Solo en un caso se observó compromiso de la mucosa oral en forma de erosiones milimétricas.
Para descartar otros procesos cutáneos y realizar la correlación clinicopatológica, se realizó una biopsia cutánea en un total de 7 pacientes. Desde el punto de vista histológico la mayoría de las lesiones biopsiadas (6/7) mostraron un patrón de dermatitis espongiótica o de interfase, asociado a un infiltrado inflamatorio perivascular superficial y profundo con presencia de eosinófilos. En un caso se observó un patrón de vasculitis leucocitoclástica caracterizado por un infiltrado perivascular de predominio polimorfonuclear, infiltración de las paredes de los vasos y la presencia de leucocitoclastia.
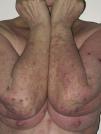
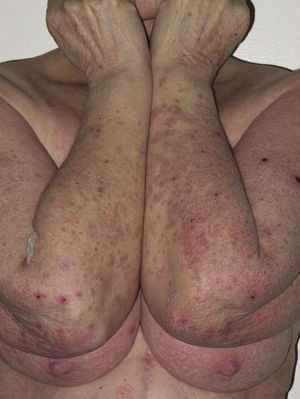
La mayoría de las toxicodermias (16/20) fueron inicialmente de carácter leve (grado 1). Sin embargo, en un tercio de los casos (33%) evolucionaron durante el seguimiento hacia formas más graves o extensas, fundamentalmente a expensas de un aumento de la superficie cutánea afecta (figs. 3 y 4). Es así como 6 pacientes evolucionaron desde grado 1 a grado 2 y un paciente evolucionó desde grado 2 a grado 3.
En cuanto al tratamiento 19 de los 20 pacientes con toxicodermia (95%) recibieron corticoides tópicos de mediana potencia asociados a emolientes. Los pacientes que recibieron corticoides tópicos siempre los utilizaron hasta la resolución del cuadro cutáneo. En caso de prurito se asociaron además antihistamínicos orales según la recomendación en las pautas de manejo.
La pauta recomendada de telaprevir pudo completarse en todos los pacientes excepto en 2 (4,6% del total de tratados). En el primer caso el tratamiento debió suspenderse por la aparición, prácticamente desde el comienzo del tratamiento, de una vasculitis cutánea extensa. En el segundo caso telaprevir se suspendió casi al final de la semana 11 de tratamiento, por progresión desde grado 2 a grado 3 de las lesiones, sin que esto repercutiera en la efectividad de la terapia antiviral. Ambos pacientes en los que se suspendió el telaprevir eran pacientes no tratados con el tratamiento antiviral y no tenían antecedentes de dermatosis previas. Ninguno de los 20 pacientes diagnosticados de toxicodermia requirió hospitalización por este motivo.
Finalmente la terapia antiviral fue efectiva en lograr una RVS a las 24 semanas de haber finalizado el tratamiento en 34 de los 43 pacientes estudiados (79%).
DiscusiónEn nuestro estudio casi la mitad de los pacientes tratados con la triple terapia presentó un cuadro clínico compatible con toxicodermia; este porcentaje fue similar al descrito en la literatura. En la mayor parte de los casos la toxicodermia fue de carácter leve o moderada y, aunque en un 33% de los casos mostró progresión en el curso del proceso, salvo en 2 pacientes pudo ser controlada con terapia adyuvante sin necesidad de suspender el tratamiento.
A diferencia de otros estudios, en los que se describe la aparición de estas reacciones indistintamente al inicio o hacia el final de la triple terapia12, en nuestra serie la gran mayoría de las reacciones cutáneas fueron reportadas precozmente, dentro de las primeras 4 semanas tras el inicio del tratamiento. Es probable que el diseño prospectivo de nuestro estudio, con un seguimiento cercano y proactivo del paciente, haya podido facilitar un más rápido reconocimiento de las toxicodermias.
Si bien se ha demostrado que en el contexto de la terapia triple más del 90% de las reacciones cutáneas se deben al telaprevir, debe tenerse en cuenta que interferón y ribavirina también pueden asociarse a efectos adversos cutáneos, muchas veces indistinguibles de los producidos por este fármaco13. En nuestro trabajo se llevó a cabo una valoración basal de los enfermos. Esta visita basal, además de permitir la entrega de recomendaciones destinadas principalmente al cuidado e hidratación habitual de la piel durante la triple terapia, y motivar a los pacientes a consultar precozmente ante la aparición de lesiones, sirvió para reconocer la presencia de dermatosis previas que pudieran condicionar un mayor riesgo de toxicodermias o que pudiesen ser confundidas con ellas, y permitió investigar acerca de la historia previa de toxicodermias por tratamientos anti-VHC en aquellos pacientes previamente tratados. Es así como se desprende que de la visita basal 25 pacientes (58% del total) habían sido tratados previamente con IFN y ribavirina, y que 6 de estos pacientes (24% de los previamente tratados) habían presentado una reacción cutánea previa, en todos los casos leve.
De todas formas en nuestra serie ni la presencia de dermatosis preexistentes ni el antecedente de toxicodermias previas condicionó un mayor riesgo de reacciones cutáneas por la triple terapia.
Las reacciones cutáneas por telaprevir se presentan en aproximadamente la mitad de los pacientes tratados14. Se desconoce su mecanismo de producción y los estudios realizados al respecto no han podido demostrar una susceptibilidad genética ni variaciones farmacocinéticas que condicionen una mayor probabilidad de presentarlas; ciertas características clínicas, como la edad superior a 45 años, la obesidad, la raza blanca y no haber recibido ningún tratamiento previo aparecen como factores de riesgo15.
Aunque la mayoría de las toxicodermias por telaprevir son de carácter leve o moderado, se ha descrito la aparición de reacciones graves e incluso potencialmente mortales en algunos casos16. Esta circunstancia ha justificado la elaboración de un protocolo de diagnóstico y manejo de las toxicodermias por telaprevir, con el objetivo de minimizar su impacto en el curso del tratamiento. Para ello se ha realizado una clasificación de las toxicodermias según su intensidad, basándose principal, aunque no exclusivamente, en el porcentaje de superficie corporal afecta (tabla 1).
En nuestra serie la mayoría de las toxicodermias consistieron en una erupción ertiematosa constituida por máculas y placas eritematoedematosas y descamativas. Del total de casos de toxicodermia 14 presentaron inicialmente lesiones de grado 1, 5 pacientes presentaron inicialmente lesiones de grado 2 y un solo paciente presentó desde el comienzo lesiones de grado 3 (tabla 3), porcentajes coherentes con los descritos por otros autores. Desde el punto de vista histológico la mayoría de las lesiones biopsiadas (6 de 7) mostraron un patrón microscópico compatible con toxicodermia, si bien el diagnóstico de toxicodermia es fundamentalmente clínico.
Por otra parte, a diferencia de lo descrito en la literatura en que casi el 90% de las toxicodermias permanecieron estables, sin progresión en cuanto a severidad, hasta la finalización del tratamiento con telaprevir12, en nuestro estudio un 33% de los pacientes con dermatosis progresó hacia grados más severos, condicionando la suspensión del tratamiento en uno de los casos. Esta observación permite evidenciar que las toxicodermias por telaprevir, como es habitual en las reacciones adversas a fármacos, deben entenderse como procesos dinámicos, capaces de evolucionar en el tiempo en las que las características clínicas de las lesiones cutáneas sean más importantes que la extensión de las mismas. En este sentido, la clasificación propuesta en la que se relaciona la gravedad a la extensión podría resultar poco adecuada en la evaluación pronóstica, en sintonía con la reciente propuesta de Rojeau et al.15.
En cuanto al tratamiento de las lesiones en prácticamente todos los casos se indicaron corticoides tópicos de moderada potencia, los cuales se aplicaron casi siempre asociados a la utilización de emolientes. En caso de prurito se añadieron antihistamínicos orales. Se pautaron corticoides sistémicos solamente en los 2 casos en que el telaprevir se suspendió antes de tiempo. En los demás casos de toxicodermia se evitó su prescripción, pues se ha descrito que su utilización en el contexto de la triple terapia puede alterar la eficacia del telaprevir y elevar los niveles del ARN viral, por la interacción de ambos fármacos a través de la vía de metabolización hepática del CYP3A417. Sin embargo Garcias-Ladaria et al. describen en su serie el uso de prednisona oral en erupciones extensas que no habían respondido a las medidas tópicas, sin interacción en la respuesta virológica, permitiendo así el cumplimiento de la pauta establecida de triple terapia18.
En nuestra serie el telaprevir se mostró como un fármaco eficiente y seguro, con un elevado porcentaje de RVS (79%), un discreto porcentaje de reacciones adversas severas (4,9%) y ninguna reacción cutánea grado 4.
Si bien nuestro estudio es de tipo prospectivo, presenta algunas limitaciones inherentes a su diseño: se ha desarrollado en el ámbito clínico de un único centro hospitalario e incluye un número limitado de pacientes. Además estos pacientes han sido vigilados estrecha y proactivamente, lo que difiere de las condiciones habituales en las que se realizan los controles de los pacientes que realizan tratamiento para la infección por el VHC.
El desarrollo de protocolos conjuntos entre dermatología y hepatología ha permitido un más rápido diagnóstico y tratamiento de estos pacientes. En este sentido, las diferencias con respecto a otras publicaciones en el momento de aparición de las lesiones y el carácter evolutivo podrían reflejar el reconocimiento más precoz y mejor monitorización de las lesiones cutáneas.
En definitiva, las reacciones cutáneas adversas a telaprevir son frecuentes en el curso del tratamiento con triple terapia, casi siempre se presentan en forma de exantemas maculopapulares eritemato-edematosos y descamativos; aparecen a menudo de forma precoz y pueden progresar durante las siguientes semanas. El tratamiento recomendado en las guías clínicas parece adecuado para su control y solo de forma excepcional es necesaria la suspensión del fármaco; para el manejo adecuado de las reacciones cutáneas por telaprevir es imprescindible la vigilancia dermatológica19.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.