El objetivo principal de este estudio es identificar factores predictivos de la afectación metastásica del ganglio centinela (GC).
Pacientes y métodoSe trata de un estudio de cohortes retrospectivo realizado en 2 centros hospitalarios de tercer nivel. Se incluyeron un total de 818 pacientes. La medida de resultado principal fue la afectación del GC. La valoración de predictores independientes de esta afectación se realizó mediante una regresión logística múltiple y un árbol de clasificación y regresión (CART).
ResultadosEl análisis de regresión logística múltiple mostró que la ulceración, el grosor tumoral y un alto índice mitótico (IM) (≥6 mitosis/mm2) se relacionaron con la afectación metastásica del GC de forma independiente. El CART mostró que el grosor de Breslow fue el factor más importante como predictor de la afectación linfática. Para los melanomas gruesos (>2mm) las variables predictoras fueron la ausencia de infiltrado inflamatorio, la edad y la localización. Para los melanomas menores de 2mm las variables predictoras fueron el IM (>6 mitosis/mm2), la ulceración y el grosor. El grosor tumoral, la edad, la localización y el IM fueron predictores de la supervivencia de estos pacientes.
ConclusiónUn alto IM se asocia con una mayor afectación metastásica del GC y una peor supervivencia. Con la metodología CART es posible una mejor predicción de la afectación metastásica regional con vistas al mejor manejo clínico de estos pacientes o su inclusión en ensayos clínicos.
The main aim of this study was to identify predictors of sentinel lymph node (SN) metastasis in cutaneous melanoma.
Patients and methodsThis was a retrospective cohort study of 818 patients in 2 tertiary-level hospitals. The primary outcome variable was SN involvement. Independent predictors were identified using multiple logistic regression and a classification and regression tree (CART) analysis.
ResultsUlceration, tumor thickness, and a high mitotic rate (≥6 mitoses/mm2) were independently associated with SN metastasis in the multiple regression analysis. The most important predictor in the CART analysis was Breslow thickness. Absence of an inflammatory infiltrate, patient age, and tumor location were predictive of SN metastasis in patients with tumors thicker than 2mm. In the case of thinner melanomas, the predictors were mitotic rate (>6 mitoses/mm2), presence of ulceration, and tumor thickness. Patient age, mitotic rate, and tumor thickness and location were predictive of survival.
ConclusionsA high mitotic rate predicts a higher risk of SN involvement and worse survival. CART analysis improves the prediction of regional metastasis, resulting in better clinical management of melanoma patients. It may also help select suitable candidates for inclusion in clinical trials.
Actualmente el factor predictivo más importante de la supervivencia de los pacientes con melanoma es la presencia de metástasis en el ganglio centinela (GC)1. Aunque no se ha demostrado que la resección ganglionar precoz de los ganglios afectados mejore la supervivencia global2, se acepta que el conocimiento del grado de afectación regional proporciona un pronóstico más preciso y, por ello, puede ayudar a establecer una actuación terapéutica adecuada3.
El índice de Breslow y la presencia de ulceración son los factores que sistemáticamente se han relacionado con una mayor probabilidad de afectación del GC4–7.
En los últimos años el índice mitótico (IM) ha adquirido un protagonismo creciente, tanto como factor pronóstico como factor predictivo de la afectación metastásica del GC, especialmente tras establecerse el método mejor para su evaluación8–11. A pesar de ello, en la última versión de la estadificación de la American Joint Committee on Cancer (AJCC) su papel pronóstico actual queda formalmente establecido exclusivamente en el caso de los melanomas finos1.
En medicina, en la toma de decisiones es importante buscar metodologías que sean precisas y nos ayuden a resolver los problemas que surgen a la hora de clasificar, estratificar o pronosticar a nuestros pacientes12. Una de estas herramientas, cada vez más utilizadas, son los árboles de decisión, más concretamente los árboles de clasificación y regresión (también conocidos como CART, del inglés Classification And Regression Trees)13. Este modelo tiene como ventajas respecto a la regresión logística la simplicidad en su utilización e interpretación, y además el hecho de que tiene un carácter no paramétrico que no requiere ninguna hipótesis relativa a la distribución de los predictores y la respuesta ni a la respuesta entre estos y sus posibles interacciones.
El objetivo principal de este estudio ha sido identificar los factores predictivos de la afectación metastásica del GC usando la metodología CART y la regresión logística. Como objetivos secundarios se ha evaluado el papel de estos factores en la recurrencia y la supervivencia global de estos pacientes.
Material y métodoSe diseñó un estudio observacional retrospectivo.
Población de estudioLos participantes en el estudio fueron seleccionados de las bases de datos de pacientes con melanoma del Hospital Virgen de la Victoria (HVV) de Málaga, España, y del Instituto Valenciano de Oncología de Valencia (IVO), España. El uso de ambas bases de datos se realiza de acuerdo con la regulación ética vigente. Las bases de datos han sido descritas previamente en detalle en otros trabajos14–16.
Con motivo del estudio se seleccionaron todos los pacientes con un solo melanoma cutáneo y un estadio clínico i o ii a los que se les había realizado la biopsia selectiva del GC, y que habían sido incluidos de forma prospectiva en las bases de datos anteriormente mencionadas entre el 1 de enero de 2000 y el 31 de diciembre de 2012 para el IVO y entre el 1 de octubre de 2001 y el 31 de diciembre de 2012 para el HVV. Los pacientes a los que se les realizó la técnica, pero en los que no se pudo identificar el GC, fueron excluidos del estudio.
El estudio fue aprobado por el comité ético de ambas instituciones.
La variable dependiente del estudio fue el estado del GC, que fue definido como positivo o negativo cuando había presencia o ausencia de células de melanoma en el GC, respectivamente.
Estado del ganglio centinelaEl estudio histológico del GC es bastante similar en ambos centros y se describe de la siguiente forma:
HVV. El estudio comienza con la identificación macroscópica del GC y, si es necesario, la limpieza de la grasa periganglionar. Una vezidentificada la adenopatía se sumerge en formaldehído al 10% para la fijación y posterior inclusión en un bloque de parafina. Se realizan tandas cada 250mμ de 3 secciones en serie, la primera y la última sección para la tinción con hematoxilina-eosina y la segunda para la tinción inmunohistoquímica con HMB-45 hasta agotar el bloque.
IVO. Primeramente se lleva a cabo una identificación macroscópica del GC y, si es necesario, la limpieza de la grasa periganglionar. Una vez identificada, la muestra adenopática se coloca en 10% de formaldehído para la fijación y posterior incrustación en un bloque de parafina. Se obtienen secciones transversales en serie cada 250mμ a partir de todo el ganglio linfático incluido en parafina. Tres secciones transversales se obtienen en cada sección, una de las cuales se tiñe con hematoxilina-eosina, y las otras están reservadas para la tinción inmunohistoquímica con S-100 y HMB-45, que se realiza solo después de verificar que no hay metástasis en las secciones de hematoxilina-eosina.
Variables independientesComo variables independientes se seleccionaron las siguientes características clínicas e histológicas:
Factores clínicos: el sexo, la edad (≤65 vs >65 años) y la localización anatómica. Esta última variable fue dicotomizada como «axial» (cabeza, cuello, tronco, superficies volar o subungueal) o en «extremidad». Usamos la clasificación de Kruper et al.8 para clasificar a los melanomas volares y subungueales como axiales debido a que presentan un peor pronóstico que, en parte, pudiera deberse a alteraciones genéticas que lo diferencien del resto17.
Factores histológicos: el espesor de Breslow (categorizado de acuerdo con la AJCC en ≤1,00, 1,01-2, 2,01-4 y >4mm), la ulceración (presente vs. ausente), la regresión (presente vs. ausente), el IM (expresado como el número de mitosis por milímetros cuadrados [0,1-5,>6])10 y los linfocitos infiltrantes de tumor (LIT) (ausente, no intenso, intenso)18.
Análisis estadísticoLa variable «respuesta» fue la positividad del GC. Las variables fueron incluidas como variables binarias (sexo, edad, ulceración, localización y regresión) o como variables categóricas (espesor de Breslow, LIT e IM).
En el análisis de regresión logística primero se analizó la asociación de la positividad del GC con las variables a estudio usando el test de la chi cuadrado, o un análisis de regresión logística univariante. Basado en el método de Wald se calcularon los cocientes de riesgo con sus intervalos de confianza (IC 95%) de todas las variables. Se realizó una regresión logística múltiple para identificar los predictores independientes de la positividad del GC y se analizaron las posibles interacciones entre las variables. Se comprobó la bondad de ajuste mediante el test de Hosmer-Lemeshow.
En el desarrollo del árbol de clasificación se utilizó la metodología denominada CART19 que permite construir árboles de decisión mediante una serie de reglas sobre las decisiones tomadas para asignar un valor de salida a una determinada entrada, mediante divisiones binarias sucesivas. Esto es, se divide cada nodo madre en 2 nodos hijos homogéneos mediante la aplicación de respuestas sí/no en cada nodo de decisión. Las etapas para la generación del modelo son: a) construcción del árbol; b) parada del proceso de crecimiento del árbol (se construye un árbol máximo que sobreajusta la información contenida en la base de datos); c) podado del árbol haciéndolo más sencillo y dejando solo los nodos más importantes; y por último d) selección del árbol óptimo con capacidad de generalización20.
Se utilizó el software SSPS 20.0 (SPSS, Illinois, Inc; EE. UU.), método de crecimiento por medio de CART, con análisis de sensibilidad basado en el método de Gini20 y sistema de validación cruzada. En el árbol final cada grupo tenía al menos 20 casos (10 casos en análisis de subgrupos).
Para la elaboración de las curvas COR y el cálculo del área bajo la curva de ambos se utilizó el paquete estadístico MedCalcStatistical Software versión 14.8.1. La comparación de ambas curvas se realizó siguiendo el método de DeLong21.
Para el estudio de supervivencia libre de enfermedad (SLE) y supervivencia específica por melanoma (SEM) se elaboraron las curvas mediante el método de Kaplan-Meier, y para la comparación univariada entre los grupos definidos se utilizó la prueba de los rangos logarítmicos. El análisis multivariante se realizó usando el modelo de los riesgos proporcionales de Cox. Se consideró una p<0,05 como significativa. Para la realización de las pruebas estadísticas se usó el software SSPS 20.0 (SPSS, Illinois, Inc; EE. UU.).
ResultadosParticipantesDe acuerdo con los criterios de selección un total de 855 pacientes cumplían los criterios histológicos, a los que se les proporcionó un consentimiento informado y se les sometió a la biopsia selectiva del GC. Se identificó el GC en 818 casos (95,6%). De esos 818 pacientes incluidos en el análisis 434 (53,1%) fueron mujeres y 384 hombres (46,9%). La mediana de edad fue de 53 años (rango intercuartílico 43-66). En la tabla 1 se resumen las características clínicas e histológicas de la población de estudio estratificada por el estado del GC.
Características clínicas y patológicas de los pacientes en función de la afectación de la biopsia selectiva del ganglio centinela (n=818)
| Variable | BSGC negativo (%) | BSGC positivo (%) | Valor p |
|---|---|---|---|
| Edad (años) | |||
| ≤65 | 479 (75) | 130 (74,3) | N.S. |
| >65 | 160 (25) | 45 (25,7) | |
| Género | |||
| Mujer | 330 (51,5) | 104 (58,8) | N.S. |
| Hombre | 311 (48,5) | 73 (41,2) | |
| Localización | |||
| Axial | 136 (21,4) | 30 (16,9) | N.S. |
| Extremidades | 501 (78,6) | 147 (83,1) | |
| Grosor tumoral de Breslow (mm) | |||
| ≤1 | 184 (29) | 11 (6,2) | <0,001 |
| 1,01-2 | 254 (40,1) | 41 (23,2) | |
| 2,01-4 | 119 (18,8) | 70 (39,5) | |
| >4 | 77 (12,1) | 55 (31,1) | |
| Ulceración | |||
| Presente | 145 (23,2) | 85 (48,9) | <0,001 |
| Ausente | 479 (76,8) | 89 (51,1) | |
| Regresión | |||
| Presente | 91 (15,8) | 13 (8,3) | 0,01 |
| Ausente | 486 (84,2) | 144 (91,7) | |
| Índice mitótico (mitosis/mm2) | |||
| 0 | 80 (17,4) | 7 (5,3) | <0,001 |
| 1-5 | 305 (66,4) | 76 (57,6) | |
| ≥6 | 54 (16,2) | 49 (37,1) | |
| Infiltrado inflamatorio | |||
| Intenso | 41 (8,1) | 4 (3) | 0,057 |
| No intenso | 208 (41,4) | 51 (38) | |
| Ausente | 254 (50,5) | 79 (59) | |
BSGC: biopsia selectiva del ganglio centinela; N.S.: no significativo
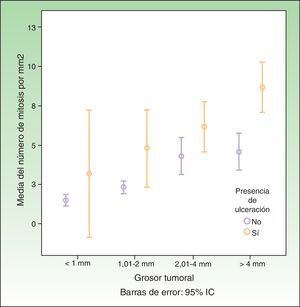
La afectación del GC se asocia con un incremento en el espesor de Breslow, la presencia de ulceración, la ausencia de regresión, un mayor IM y la ausencia de infiltrado inflamatorio. Por otro lado, no se relacionó con el sexo, la edad ni la localización. Entre las variables gráficamente se comprueba que existe una asociación entre el IM y un mayor espesor y la presencia de ulceración (fig. 1).
Estado del ganglio centinelaEl análisis univariante mostró que las siguientes variables se relacionaron con la afectación del GC: el espesor tumoral, la ulceración, la ausencia de regresión, un mayor IM y la ausencia de LIT (tabla 2). Después de incluir estas variables en un análisis de regresión logística múltiple solo la ulceración, el espesor tumoral y un IM elevado (≥6 mitosis/mm2) se relacionaron con la afectación metastásica del GC de forma independiente.
Análisis univariante y multivariante de los factores predictivos de la positividad de la biopsia selectiva del ganglio centinela en 818 pacientes con melanoma cutáneo localizado
| Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|
| Variable independiente | Valor p | Odds ratio (IC 95%) | Valor p | Odds ratio (IC 95%) |
| Edad (años) | ||||
| ≤65 | 1 | … | … | |
| >65 | N.S. | 1,1 (0,6-1,5) | … | … |
| Género | ||||
| Mujer | 1 | … | … | |
| Hombre | n.s. | 1,3 (0,9-1,9) | … | … |
| Localización | ||||
| Axial | N.S. | 0,7 (0,5-1,2) | … | … |
| Extremidades | 1 | … | … | |
| Grosor tumoral de Breslow (mm) | ||||
| ≤1 | 1 | 1 | ||
| 1,01-2 | 0,005 | 2,7 (1,1-4,9) | 0,029 | 18 (1,4-240) |
| 2,01-4 | <0,001 | 9,8 (3,9-16,5) | 0,001 | 66,2 (5,3-830) |
| >4 | <0,001 | 12,4 (6-26) | <0,001 | 247,7 (17,4-35,34) |
| Ulceración | ||||
| Presente | <0,001 | 3,2 (2,1-4,7) | 0,003 | 12,3 (2,3-65) |
| Ausente | 1 | 1 | ||
| Regresión | ||||
| Presente | 0,01 | 2,1 (1,1-3,8) | … | … |
| Ausente | 1 | … | … | |
| Índice mitótico (mitosis/mm2) | ||||
| 0 | 1 | … | … | |
| 1-5 | 0,01 | 2,8 (1,2-6,3) | … | … |
| ≥6 | <0,001 | 7,5 (3,2-17,5) | 0,046 | 2,6 (1,1-6,6) |
| Infiltrado inflamatorio | ||||
| Intenso | 1 | |||
| No Intenso | N.S. | 2,5(0,8-7,3) | … | … |
| Ausente | 0,03 | 3,2 (1,1-9,2) | … | … |
| Grosor tumoral de Breslow (mm)*ulceración | ||||
| 1,01-2 * ulceración | 0,06 | 0,16 (0,02-1,05) | ||
| 2,01-4 * ulceración | 0,03 | 0,15 (0,02-0,9) | ||
| >4 * ulceración | 0,005 | 0,07 (0,01-0,5) | ||
N.S.: no significativo.
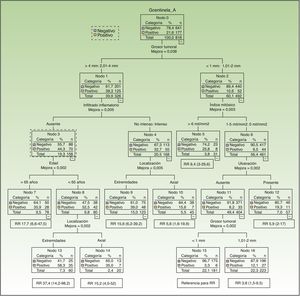
Tras la inclusión de las 8 variables de estudio el árbol utilizó 6 de ellas. El espesor de Breslow fue el factor más importante dicotomizando la muestra en 2mm. Para los melanomas de espesor mayor de 2mm en orden de importancia las variables utilizadas fueron el infiltrado inflamatorio (ausencia vs. resto), la edad y la localización. Para los melanomas menores de 2mm las variables utilizadas en orden de importancia fueron el índice mitótico (>6 mitosis/mm2 vs. ≤6 mitosis/mm2), la ulceración y el espesor (fig. 2). De esta forma el grupo de mayor riesgo de afectación del GC fueron los melanomas de más de 2mm con ausencia de LIT, en pacientes menores de 65 años y de localización en las extremidades (58% positividad en GC; n=60), mientras que el grupo de menor riesgo de afectación del GC fueron aquellos con ≤6 mit/mm2, no ulcerados y ≤1mm de grosor (3,3% positividad en GC; n=181).
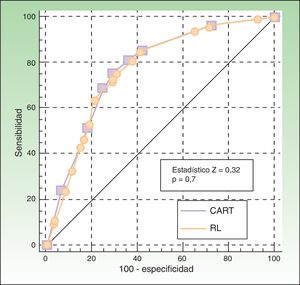
Las curvas COR para ambos modelos no mostraron diferencias entre ellos (p=0,7), con un área bajo la curva de 0,77 (IC 95%: 0,73-0,81) para el modelo CART y de 0,78 (0,74-0,82) para la regresión logística (fig. 3).
Supervivencia libre de enfermedad y supervivencia específica por melanomaTras una mediana de seguimiento de 58 meses (intervalo: 1-157), 104 pacientes fallecieron de melanoma en el seguimiento y 172 sufrieron alguna recaída (no censurados en el análisis de los riesgos proporcionales de Cox). El factor pronóstico más importante tanto para la SLE como para la SEM fue la afectación metastásica del GC.
La SEM para los pacientes con GC negativo fue de 93,1%, mientras que para los pacientes con GC positivo fue de 68,1%. El modelo de riesgos proporcionales de Cox se ajustó para las variables significativas en el análisis univariante. La afectación del GC fue el factor pronóstico más importante tanto para la SLE (cociente de riesgo: 2,3; IC 95%: 1,5-3,6) como para la SEM (cociente de riesgo: 3,5; IC 95%: 1,9-6,3).
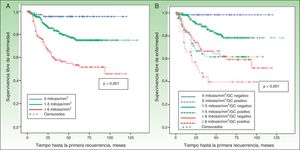
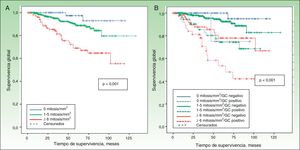
El resto de las variables significativas para la SLE se detallan en la tabla 3 y fueron: el espesor de Breslow, la edad, la localización y el IM (fig. 4). Igualmente, para la SEM (tabla 4) el IM fue una variable pronóstica independiente junto con la edad, la localización y el espesor tumoral (fig. 5).
Análisis univariante y multivariante para la supervivencia libre de enfermedad de los pacientes con melanoma cutáneo (n=818)
| Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|
| Variable independiente | Valor p | Riesgo proporcional (IC 95%) | Valor p | Riesgo proporcional (IC 95%) |
| Edad (años) | ||||
| ≤65 | 1 | … | 1 | |
| >65 | 0,001 | 1,5 (1,1-2,2) | 0,032 | 1,5 (1,1-2,2) |
| Género | ||||
| Mujer | 0,8 (0,6-1,1) | … | … | |
| Hombre | N.S. | 1 | … | … |
| Localización | ||||
| Axial | <0,001 | 1,5 (1,2-1,8) | 0,001 | 1,4 (1,2-1,7) |
| Extremidades | 1 | … | 1 | |
| Grosor tumoral de Breslow (mm) | ||||
| ≤1 | 1 | 1 | ||
| 1,01-2 | 0,01 | 3,2 (1,3-7,7) | 0,006 | 5,1 (1,2-22) |
| 2,01-4 | <0,001 | 9,9 (4,2-23,1) | <0,001 | 10,4 (2,4-44,1) |
| >4 | <0,001 | 15,4 (6,6-36,1)) | <0,001 | 9,5 (2,2-41,7) |
| Ulceración | ||||
| Presente | <0,001 | 3,6 (2,6-5,2) | … | … |
| Ausente | 1 | … | … | |
| Regresión | ||||
| Presente | 1 | … | … | |
| Ausente | 0,007 | 2,3 (1,3-4,3) | … | … |
| Índice mitótico (mitosis/mm2) | ||||
| 0 | 1 | 1 | ||
| 1-5 | 0,007 | 4,9 (1,5-15,6) | … | … |
| ≥6 | <0,001 | 12,5 (3,9-40,2) | 0,03 | 2,7 (1,1-6,7) |
| Infiltrado inflamatorio | ||||
| Intenso | 1 | |||
| No intenso | N.S. | 1,7 (0,7-4) | … | … |
| Ausente | N.S. | 1,8 (0,8-4) | … | … |
| Estatus de la BSGC | ||||
| Positivo | <0,001 | 3,5 (2,5-5) | 0,001 | 2,3 (1,5-3,6) |
| Negativo | 1 | 1 | ||
BSGC: biopsia selectiva del ganglio centinela; IC: intervalo de confianza; N.S.: no significativo.
Análisis univariante y multivariante para la supervivencia específica por melanoma de los pacientes con melanoma cutáneo (n=818)
| Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|
| Variable independiente | Valor p | Riesgo proporcional (IC 95%) | Valor p | Riesgo proporcional (IC 95%) |
| Edad (años) | ||||
| ≤65 | 1 | 1 | ||
| >65 | <0,001 | 2,2 (1,3-3,4) | <0,001 | 2,9 (1,6-5,1) |
| Género | ||||
| Mujer | 1 | … | … | |
| Hombre | N.S. | 0,7 (0,6-1,5) | … | … |
| Localización | ||||
| Axial | <0,001 | 1,5 (1,2-1,8) | 2,6 (1,6-4,4) | |
| Extremidades | 1 | <0,001 | 1 | |
| Grosor tumoral de Breslow (mm) | ||||
| ≤1 | 1 | 1 | ||
| 1,01-2 | 0,027 | 3,5(1,1-12) | … | … |
| 2,01-4 | <0,001 | 9,9 (4,2-37,7) | 0,039 | 4,9 (1,1-21,8) |
| >4 | <0,001 | 15,1 (4,5-50) | 0,024 | 5,8 (1,3-26) |
| Ulceración | ||||
| Presente | <0,001 | 3,5 (2,2-5,6) | … | … |
| Ausente | 1 | … | … | |
| Regresión | ||||
| Presente | N.S. | 1 | … | … |
| Ausente | 1,5 (0,8-3) | … | … | |
| Índice mitótico (mitosis/mm2) | ||||
| 0 | 1 | 1 | ||
| 1-5 | 0,032 | 4,8 (1,2-17,8) | 0,029 | 4,2 (0,9-18,7) |
| ≥6 | <0,001 | 14,3 (3,5-59) | 0,004 | 9,1 (2,1-41,6) |
| Infiltrado inflamatorio | ||||
| Intenso | 1 | |||
| No intenso | N.S. | 1,2 (0,5-4) | … | … |
| Ausente | N.S. | 1,5 (0,4-3,3) | … | … |
| Estatus de la BSGC | ||||
| Positivo | <0,001 | 4,6 (2,9-7,3) | <0,001 | 3,5 (1,9-6,3) |
| Negativo | 1 | 1 | ||
BSGC: biopsia selectiva del ganglio centinela; IC: intervalo de confianza; N.S.: no significativo.
En este trabajo hemos mostrado en una serie de 818 de pacientes con melanoma que el IM, junto con el espesor tumoral y la ulceración, tienen un papel significativo en la predicción de la afectación metastásica del GC. Además, el IM tiene un valor pronóstico independiente para la supervivencia de los pacientes con melanoma.
El índice mitótico no es un factor que se haya observado uniformemente como predictivo de la afectación metastásica del GC, a diferencia de lo que ocurre con la ulceración y, sobre todo, con el espesor tumoral14.
En nuestro estudio el IM se ha mostrado como predictivo con respecto al basal en el grupo≥6 mitosis/mm2 en la regresión logística. Por otro lado, en el análisis CART las mitosis se muestran como el factor más importante después del espesor tumoral, pero solo en los tumores con un espesor menor de 2mm, el cual se dicotomiza entre los melanomas≥6 mitosis/mm2 y el resto.
Con las mismas variables se pueden construir distintas aproximaciones para una clasificación. Sin embargo, entre la regresión logística y el método CART, el segundo ofrece una ventaja en la interpretación de los resultados debido a que es mucho más intuitivo, dado que permite identificar variables predictivas que influyen de forma diferente en grupos específicos de pacientes20. Los modelos no tienen que ser excluyentes entre sí ya que, ante un mismo problema, deben barajarse distintas metodologías que pueden colaborar en la búsqueda de un resultado óptimo22.
El espesor de Breslow está considerado como el factor predictivo de la afectación metastásica del GC más importante23. En nuestra muestra el punto de corte diferencial se encuentra en los 2mm en el método CART. Parece que este espesor diferencia de forma máxima el riesgo de metástasis ganglionar24.
La ulceración es otro factor predictivo importante en los diferentes estudios14. En el nuestro también se ha confirmado esta independencia como factor predictivo de la afectación metastásica. Sin embargo, en el método CART solo tiene relevancia para los melanomas menores de 2mm y un IM menor de 6 mitosis/mm2.
Con el modelo CART lo que se sugiere es que para melanomas con un espesor mayor de 2mm ni el número de mitosis ni la ulceración pueden discriminar grupos de mayor riesgo de afectación metastásica en el GC. Sin embargo, la ausencia de infiltrado inflamatorio confiere una mayor probabilidad de afectación metastásica del GC. Taylor et al.7 fueron los primeros en describir una relación significativa entre la ausencia de LIT y la presencia de metástasis regionales. Al igual que en nuestro estudio, tampoco encontraron diferencias en la supervivencia con respecto al infiltrado inflamatorio. Estos autores encuentran además que los pacientes con ausencia de LIT presentaron mayor frecuencia de recurrencias en los ganglios linfáticos regionales, pero tienen una proporción similar de recurrencias a distancia que aquellos casos con presencia de infiltrado inflamatorio, lo que podría explicar, al menos en parte, este fenómeno.
Otras variables que aparecen en los nodos finales en el método CART y que pueden discriminar subgrupos son: la edad y la localización, variables que no alcanzan la significación estadística en la regresión logística.
La localización axial produce una menor afectación relativa del GC que los melanomas en extremidades en tumores gruesos y en melanomas menores de 2mm con presencia de ulceración. Sin embargo, se relacionan con una peor SLE y supervivencia global en algunos trabajos. Este hecho, corroborado por otros autores, no deja de ser intrigante25. Se ha achacado a un aumento de la vascularización en tumores de localización axial, sobre todo en la región de la cabeza y el cuello, por tanto con una mayor probabilidad de metástasis hematógenas o, en el sentido opuesto, existe una menor proporción de GC afectados por la complejidad del sistema linfático a este nivel, lo que dificulta su localización26.
En este mismo sentido, para los melanomas gruesos localizados en las extremidades, la edad por debajo de 65 años se asocia con una mayor afectación metastásica del GC y paradójicamente presenta una mejor supervivencia.
En el grupo de melanomas finos ≤1mm la frecuencia de afectación del GC es del 5,6%, que baja al 3,3% en caso de ausencia de ulceración y un número de mitosis<6 mitosis/mm2. Existe una amplia literatura para identificar subgrupos de pacientes con mayor riesgo de afectación del GC y un peor pronóstico en los melanomas finos revisados por Venna et al.27. La ulceración se identifica como un factor predictivo importante en los trabajos más recientes28,29. Por el contrario, los factores predictivos que con más frecuencia se relacionan con la afectación del GC son el grosor tumoral, el IM, el nivel de Clark y la ausencia de LIT. En menor medida se han descrito asociaciones con la edad, el género, la fase de crecimiento vertical o la invasión linfovascular27.
Por otro lado, el IM se ha mostrado como un factor pronóstico importante, tras la afectación del GC y el espesor de Breslow tanto para la SLE como la SEM. Esto está en consonancia con los hallazgos de Azzola et al.10 y revalidado recientemente por su grupo, con un mayor número de casos donde el IM como factor pronóstico se muestra claramente superior a la ulceración30.
En conclusión, el IM se asocia con una mayor afectación metastásica del GC en melanomas de menos de 2mm, aunque su papel más relevante se encuentra en el efecto sobre la supervivencia de estos pacientes. Después de la afectación regional linfática y el espesor de Breslow es el factor pronóstico más importante, incluso por encima de la ulceración. Por otro lado, el infiltrado inflamatorio del melanoma se ha demostrado predictor de la afectación metastásica del GC para melanomas de más de 2mm, aunque no tiene relevancia en el pronóstico de estos pacientes.
Las implicaciones prácticas de este estudio son que con la metodología CART es posible una predicción más práctica e intuitiva de la afectación metastásica del GC con vistas al manejo clínico de estos pacientes o su inclusión en ensayos clínicos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.