La proteína p16 es una proteína supresora tumoral. El objetivo del estudio era comprobar si la tinción p16 se relaciona con la presencia de papilomavirus (subtipos mucosos o α, VPH-mc) en carcinomas epidermoides (CE) extragenitales (como ocurre en el cérvix y en CE genitales).
Material y métodoSe realizó tinción inmunohistoquímica con p16 a diversas lesiones incluidas en parafina del área genital (8 condilomas, tres CE intraepidérmicos y 7 CE invasores) y del área extragenital (20 CE intraepidérmicos tipo enfermedad de Bowen [EB] y 10 CE invasores). La detección de VPH-mc se realizó mediante reacción en cadena de la polimerasa (PCR).
ResultadosEn el área genital la tinción p16 fue negativa en los condilomas y positiva en los tres CE intraepidérmicos y en dos CE invasores (29%). Se detectó VPH-mc en 6 condilomas y dos CE intraepidérmicos (100%, excluyendo tres lesiones que no se pudieron estudiar con PCR) y en los dos CE invasores positivos para p16. En el área extragenital la tinción p16 fue positiva en 19 EB (95%) y en dos CE invasores (20%). Se detectó VPH-mc en 4 EB (tinción p16 positiva) y en un CE invasor (p16 negativa). En los CE intraepidérmicos la tinción p16 fue útil para objetivar si existían focos de microinfiltración dérmica o invasión de estructuras anexiales normales.
ConclusionesSegún nuestros resultados la positividad de p16 es independiente de la detección de VPH en los CE extragenitales, al contrario de lo observado en CE genitales. En el área extragenital la pérdida de proteína p16 en los CE invasores respecto a los CE intraepidérmicos indicaría progresión tumoral.
Positive immunostaining for the tumor suppressor protein p16 is associated with the presence of mucosal or αsubtypes of human papillomavirus (HPV) in cervical and genital squamous cell carcinoma (SCC). The aim of this study was to determine whether p16 immunostaining is also associated with mucosal HPV in extragenital SCC.
Material and methodsParaffin sections of lesions located in the genital region (8 genital warts, 3 intraepidermal SCCs, and 7 invasive SCCs) and extragenital area (29 intraepidermal SCCs corresponding to Bowen disease and 10 invasive SCCs) were stained for p16 by immunohistochemistry. Mucosal HPV was detected by polymerase chain reaction (PCR).
ResultsIn the genital area, p16 immunostaining was negative in genital warts and positive in all 3 intraepidermal SCCs and 2 invasive SCCs (29%). Mucosal HPV was detected in 6 genital warts and 2 intraepidermal SCCs (100% after exclusion of 3 lesions that could not be analyzed by PCR) and in the 2 invasive SCCs that were positive for p16. In the extragenital area, 19 intraepidermal SCCs (95%) and 2 invasive SCCs (20%) were immunopositive for p16. Mucosal HPV was detected in 4 intraepidermal SCCs (p16 immunopositive) and 1 invasive SCC (p16 immunonegative). In intraepidermal SCCs, p16 immunostaining facilitated the identification of dermal microinfiltration or invasion of normal skin appendages.
ConclusionsAccording to our results, unlike in genital SCCs, p16 immunopositivity is independent of the presence of HPV in extragenital SCCs. Compared with intraepidermal SCCs, the absence of p16 protein in invasive SCCs in the extragenital area would indicate progression of the disease.
El gen retinoblastoma (gen Rb) regula el punto G1-S del ciclo de división celular. Una disfunción en el gen Rb permitiría la progresión del ciclo celular, aunque existan alteraciones en el ADN que aún no hayan sido reparadas1–3. En el cromosoma 9p21 (locus CDKN2A) se codifican dos proteínas supresoras tumorales, p16INK4a y p14ARF. La proteína supresora p16INK4a (p16) inhibe las quinasas 4 y 6 dependientes de ciclina D1 (CDK4/6, ciclina D1), cuya función es regular la actividad de la proteína retinoblastoma (Rb) mediante la fosforilación de la misma. La pérdida de función de p16 genera una inactivación de Rb por hiperfosforilación y, por tanto, una disregulación y progresión prematura del ciclo celular1–3.
Se han descrito alteraciones en esta proteína p16 en relación con las radiaciones ultravioleta4,5, por transmisión genética (como ocurre en la predisposición familiar al melanoma)2 como consecuencia de mutaciones espontáneas, y también provocadas por la acción de papilomavirus (VPH)6–8: los subtipos de VPH mucosos o α (VPH 6, 11, 16, 18, 31, 33, 35..) actuarían sobre el gen Rb y, en consecuencia, se provocaría una sobreexpresión de p16. En concreto, la proteína E7 de estos subtipos de VPH se uniría al gen Rb impidiendo la acción de los factores de transcripción del mismo6,9–11.
En los carcinomas de cérvix uterinos y en sus lesiones precursoras se ha demostrado que la positividad con la tinción para p16 se relaciona con la existencia de VPH mucosos o α (VPH-mc) de alto grado de oncogenicidad (subtipos 16, 18, 33, 35…). Algo similar ocurriría en los carcinomas epidermoides del área genital (vulva, pene, periné, etc.)6–9.
En el área extragenital la tinción para p16 sería positiva en el 80-90% de los carcinomas intraepidérmicos tipo enfermedad de Bowen (EB)12–15; también se ha descrito positividad con la tinción para p16 (en porcentajes mucho menores) en queratosis actínicas (QA) y en carcinomas epidermoides (CE) invasores, aunque los diversos estudios presentan resultados muy variables e incluso contradictorios1,2,15–18.
Nos planteamos comprobar si la positividad para p16 en el área extragenital se relaciona con la existencia de VPH-mc oncogénicos, tal como ocurre en el cérvix uterino y en CE del área genital6–8. Aunque existen estudios similares, se trataría del primero realizado en pacientes de nuestro país, lo que nos permitiría valorar si existen diferencias entre la población española y la de otros trabajos previos. Hemos estudiado diversas lesiones del área genital en cuya etiopatogenia están implicados VPH-mc tales como condilomas acuminados y CE de vulva y pene6,7, y en CE del área extragenital en los que la implicación etiopatogénica de estos subtipos de VPH-mc es discutible, como sería el caso de los CE intraepidérmicos tipo EB12–15, o prácticamente inexistente, caso de las QA y CE invasores (en la patogenia de estas lesiones se ha implicado a los VPH tipo epidermodisplasia verruciforme o β, pero no a los VPH tipo mucoso o α10,11).
Material y métodoTodas las preparaciones histológicas fueron obtenidas del archivo de Anatomía Patológica del Hospital Universitario «Virgen de la Arrixaca», Murcia; todas las muestras estaban incluidas en parafina. Se realizó un estudio descriptivo, observacional, sobre la tinción inmunohistoquímica p16 en 48 lesiones:
- 1.
Lesiones genitales: 8 condilomas acuminados y 10 CE de vulva y pene.
- 2.
Lesiones del área extragenital: 20 CE intraepidérmicos tipo EB, 8 localizados en la cabeza, dos en las extremidades superiores, 6 en las extremidades inferiores y 4 en el tronco, y 10 CE invasores, todos ellos localizados en cabeza.
Todas estas lesiones fueron examinadas de nuevo para confirmar el diagnóstico. Posteriormente se les realizó la tinción inmunohistoquímica con p16 mediante la técnica de inmunoperoxidasa (anticuerpos anti-p16: mtm laboratorios AG, CINtec Histology Kit, Clon E6H4). Se consideró positividad para p16 cuando existía tinción de los núcleos celulares, independientemente de que también existiese tinción citoplasmática. Se consideró positividad difusa cuando la tinción p16 era positiva en más del 50% de células y/o en todas las células de varias capas epidérmicas, positividad focal cuando la tinción era positiva en células aisladas, más de un 10% y negatividad cuando la tinción era negativa o solamente era positiva en células aisladas, menos del 10%.
Como control de la tinción inmunohistoquímica p16 se realizó la técnica de inmunoperoxidasa, pero sin añadir anticuerpos anti-p16; también se utilizaron las glándulas ecrinas y las células de la matriz de la glándula sebácea y del folículo piloso normales, que habitualmente son positivas para la tinción p16.
Análisis estadísticoLos datos fueron procesados mediante el paquete estadístico SPSS 12.0 para Windows.
Los resultados obtenidos se estudiaron mediante un análisis de tablas de contingencia con la prueba de Chi-cuadrado de Pearson, considerando significativos los riesgos de error inferiores al 5% (p<0,05). Cuando existían pocos casos se realizó la prueba exacta de Fisher.
Estudio de virus del papiloma humano mediante reacción en cadena de polimerasaLos bloques de parafina objeto de este estudio se cortaron en 5 secciones de 4μm, empleando una cuchilla nueva por caso. La extracción del ADN se realizó empleando el sistema automático Maxwell 16 (Promega, Madison, USA) y el kit Case Work DNA extraction (Promega, Madison, USA); 100 ng/l de ADN se usaron para realizar dos amplificaciones por reacción en cadena de la polimerasa (PCR): una empleando los cebadores GP5+/6+ y otra empleando el sistema de cebadores SPF. Se empleó como control endógeno la amplificación de un fragmento del gen humano TBXAS119.
Los casos se consideraron negativos para VPH cuando no se obtuvo producto de PCR en ninguna de las amplificaciones en las que se emplearon los cebadores GP5+/6+ y SPF, y la amplificación del gen humano TBXAS1 resultó positiva. Los casos amplificados con GP5+/6+ y/o SPF se tiparon empleando el kit de tipaje Hybribio HPV genoarray kit (Hybribio, Hong Kong, China). Este kit detecta los genotipos de VPH 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 (alto riesgo), 6, 11, 42, 43, 44 (bajo riesgo), 53 y CP8340 (genotipos de riesgo indeterminado). Los casos que fueron negativos para este tipaje se secuenciaron empleando el Abi Prism 3130 Genetic Analyzer (Applied Biosystems, EE. UU.).
ResultadosLos principales resultados se pueden observar en las tablas 1 y 2.
Tinción para p16 en lesiones del área genital
| VPH + | VPH - | Comentario | ||
| Condilomas acuminados | P16 + | 3 (f) | - | Negatividad, sólo positividad en células aisladas. Positividad focal en 3 condilomas con un área de positividad difusa (CE in situ en una de estas áreas) |
| P16 − | 3 | - | ||
| CE intraepid. | P16 + | 2 | - | Tinción positiva en focos de microinfiltración en dermis (2 de los 3 CE intraepidérmicos) |
| P16 − | - | - | ||
| CE invasores | P16 + | 2 | - | CE invasores negativos para tinción p16 (positividad sólo en células aisladas)Los dos casos en que se detecto VPH correspondían a los dos casos p16+ |
| P16 − | - | 5 |
CE: carcinoma espinocelular; (f): positividad focal; VPH +: detección de VPH mediante reacción en cadena de polimerasa (PCR).
Tinción para p16 en carcinomas espinocelulares del área extra-genital (%)
| VPH + | VPH − | Comentario | ||
| Enf Bowen | P16 + | 4 | 15 | Positividad difusa e intensa en todas las capas epidérmicas de la EB4 casos con VPH (predominio de VPH-16) |
| P16 − | - | 1 | ||
| CE invasores | P16 + | - | 2 | En los 8 casos p16 negativos, positividad focal en la epidermis adyacente al CE invasor (zonas con displasia y/o QA). Un caso con VPH-16 |
| P16 − | 1 | 7 |
+/total: Casos en que se detectó VPH/total de lesiones correctamente analizadas con PCR; CE: carcinoma espinocelular; EB: enfermedad de Bowen; PCR: reacción en cadena de la polimerasa; QA: queratosis actínica.
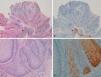
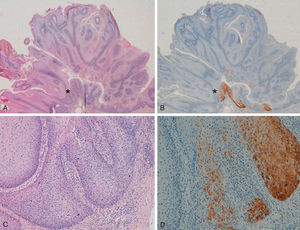
La tinción inmunohistoquímica con p16 fue negativa en 5 de los 8 condilomas acuminados (positividad sólo en células aisladas, menos del 10%) (figs. 1A y 1B). En los otros tres condilomas observamos positividad focal (en células aisladas y positividad más intensa y difusa en un área del condiloma) (figs. 1C y 1D); en una de estas áreas con mayor positividad se evidenció una zona de displasia severa-CE in situ (fig. 2).
A y B: Tinción para p16 negativa en condilomas acuminados (positividad solamente en algunas células aisladas) (A: p16x16, H-E x16 en recuadro inferior izquierdo. B: p16x40). C-D: condiloma de vulva con un área positiva para p16, sin signos histológicos de carcinoma (D y E: H-E x100, p16x100. Panorámica x40 en recuadros).
Hubo dos condilomas que presentaban el ADN alterado o degradado, «muestra inhibida», por lo que no se pudo estudiar si existían VPH o no. Los otros 6 condilomas sí se pudieron analizar y se detectó VPH-mc de bajo riesgo en todos ellos: en 4 casos VPH-6 y en dos VPH-11. En los tres casos con un área de mayor positividad para p16 (positividad focal) se detectó VPH-6 en dos de ellos, y VPH-11 en el caso en que se evidenció un CE in situ. En el resto de los condilomas, p16 negativos, se detectó VPH-6 en dos casos, VPH-11 en un caso y dos muestras con el ADN alterado.
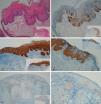
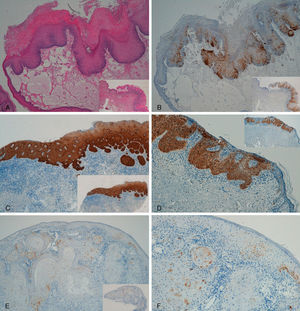
Respecto a los 10 CE, tres CE se consideraron intraepidérmicos y fueron positivos para p16 (figs. 3A-3D); se detectó VPH-33 y VPH-6 en dos de ellos, mientras que en el tercero el ADN estaba degradado. En dos de estos CE intraepidérmicos se observó algún foco de microinfiltración en la dermis que también fue positivo para p16 (fig. 3C).
A y B: Carcinoma intraepidérmico de pene (PeIN). Tinción positiva para p16 en tercio inferior de epidermis (PeIN-I) (A y B: H-E x40, p16x40, panorámica x16 en recuadros). C: Carcinoma intraepidérmico de vulva (VIN), positivo para p16 en toda la epidermis (VIN-III), con algún foco microinfiltrante en dermis (p16x40, panorámica x16 en recuadro). D: Carcinoma intraepidérmico de pene. Tinción positiva en toda la epidermis (PeIN-III) (p16x40, panorámica x16 en recuadro). E-F: Carcinoma epidermoide invasor de vulva, tinción p16 negativa en el tumor (E: p16x40, panorámica x16 en recuadro. F: p16x100).
Los otros 7 CE eran CE invasores, 5 negativos para p16, positividad sólo en células aisladas, menos del 10%, (figs. 3E y 3F) y dos casos positivos. Se detectó VPH-mc de alto riesgo, VPH-33 y VPH-16, en los dos casos positivos con p16; en los otros 5 CE invasores, negativos para p16, no detectamos VPH-mc.
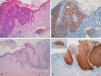
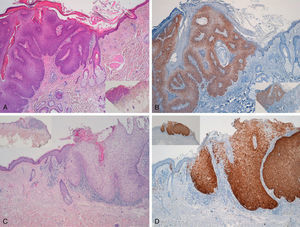
Lesiones extragenitalesObservamos positividad de forma difusa en 19 de los 20 CE intraepidérmicos tipo EB (tinción p16 positiva en todas las capas epidérmicas afectas por el CE intraepidérmico) (fig. 4); la positividad era similar en toda la lesión de CE intraepidérmico, independientemente de que existiese en la misma un mayor o menor grado de displasia.
Detectamos VPH-mc de alto riesgo en 4 EB: en dos casos VPH-16 y en otros dos una infección mixta, VPH 16 y 11 en uno y VPH 35 y 11 en otro, todos positivos para p16. Tres de estos 4 CE intraepidérmicos tipo EB que presentaban VPH estaban localizados en la cabeza y el cuello y el otro en la pierna.
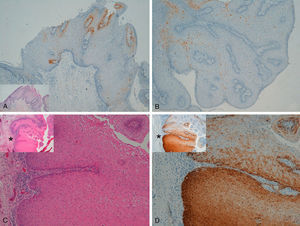
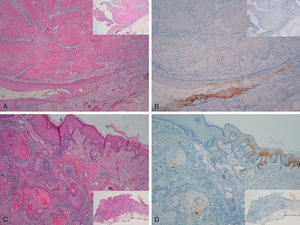
La tinción p16 fue negativa en 8 de los 10 CE invasores; esta negatividad se observaba en la zona invasora de estos 8 CE, mientras que en la epidermis adyacente a los carcinomas se observaba positividad focal (se trataba de áreas fotodañadas, con displasia severa y/o lesiones de CE intraepidérmico tipo QA) (fig. 5). Detectamos VPH-mc sólo en un caso, VPH-16, negativo para la tinción con p16 (este caso estaba localizado en el pabellón auricular).
Carcinoma epidermoide invasor de área extragenital. Tinción focalmente positiva para p16 en epidermis adyacente al carcinoma con displasia severa y/o queratosis actínica, negativa en el área invasora del tumor (A-C: H-E x40, panorámica x16 en recuadros. B-D: p16x40, panorámica x16 en recuadros).
Respecto al estudio estadístico, en lesiones del área extragenital no hemos encontrado relación entre la positividad o negatividad con p16 y la existencia de VPH-mc, ni en CE intraepidérmicos tipo EB ni en CE invasores. En el área genital sí que existe relación entre la positividad con p16 en CE y la existencia de VPH-mc (prueba exacta de Fisher, p=0,008).
Por otro lado, la tinción p16 es positiva en los CE intraepidérmicos (considerando la totalidad de CE intraepidérmicos, genitales y extragenitales) y negativa en los CE invasores (p<0,0001). Si diferenciamos entre CE localizados en el área genital y extragenital esta relación sólo persiste en los CE extragenitales (p<0,0001).
DiscusiónEn el CE del cérvix y de la región genital la positividad con la tinción p16 se relaciona con VPH oncogénicos (subtipos mucosos o α, VPH-mc)6–9. Sin embargo, esta relación con VPH-mc no está tan clara en los CE extragenitales (sobre todo en los CE intraepidérmicos tipo EB12–15). En nuestro estudio no hemos encontrado relación entre VPH-mc y la tinción p16 en el área extragenital, ya que esta es positiva o negativa independientemente de que detectemos VPH-mc o no). En el área extragenital la tinción p16 es positiva en la mayoría de CE intraepidérmicos tipo EB, 19 de 20 EB en nuestro estudio, en concordancia con los estudios previos sobre p16 en EB12–15. Hemos comprobado que existen VPH-mc de alto riesgo en 4 EB, 20%, los 4 positivos con la tinción p16. Sin embargo, la tinción p16 es positiva en casi todas las EB, se detecten VPH-mc o no. Willman et al14 obtienen unos resultados similares, y concluyen que la tinción p16 es positiva en la mayoría de los CE intraepidérmicos tipo EB, independientemente de que exista VPH (aunque sólo encuentran VPH-mc en 3 de 20 casos [15%] analizados14). Algunos estudios de finales de los años 90 detectan VPH-mc en un porcentaje muy alto de EB extragenitales: Clavel et al20 detectan VPH-mc en 78 de 94 EB, un 83%; otros autores encuentran porcentajes de VPH-mc similares en EB localizadas en las manos21,22. Por el contrario, otros estudios sobre EB no detectan VPH-mc o lo hacen en porcentajes mucho más bajos, en torno al 15-30%11,23–25. Esta gran variabilidad de resultados podría deberse a diversos motivos: los subtipos de VPH estudiados, las distintas técnicas empleadas de PCR e hibridación in situ, la localización de las lesiones (en lesiones de manos podría deberse a autoinoculación), el tipo de muestra (en fresco, congeladas o en parafina; la detección de VPH mediante PCR es menor en muestras en parafina por una posible degradación del ADN), así como la existencia de falsos positivos11. También podría ser que el VPH provoque cambios oncogénicos hasta un «punto de no retorno» y después «desaparezca» o sea eliminado por el sistema inmune, con lo que sería indetectable26,27. Por último, puede que sólo exista relación entre los VPH-mc y la EB extragenital en algunos casos aislados.
Por otra parte, en el área extragenital la positividad para p16 en las EB podría deberse no al efecto de VPH-mc, sino al efecto de la radiación ultravioleta o a alteraciones en el ciclo celular5,14,17.
En nuestro estudio hemos podido comprobar que existen VPH-mc de alto grado de oncogenicidad como el VPH-16 en algunos de estos CE tipo EB y en CE invasores extragenitales, aunque se trate de lesiones aisladas (4 EB y un CE invasor; 4 de estas 5 lesiones estaban localizadas en la cabeza y el cuello y otra en la pierna). Se ha relacionado a los VPH tipo epidermodisplasia verruciforme o β (VPH-ev) con la aparición de CE en piel extragenital. Sin embargo, estos VPH-ev no actuarían sobre el gen Rb-proteína p16, ya que la proteína E7 tiene muy poca afinidad por el gen Rb, y sus mecanismos oncogénicos son distintos a los de los VPH-mc11. Es posible que existan VPH-ev en algunos de los CE extragenitales de nuestro trabajo, ya que la técnica de PCR utilizada sólo detecta VPH-mc.
Desde un punto de vista meramente práctico, la tinción p16 es positiva difusamente en la mayoría de los CE intraepidérmicos, por lo que puede ser útil en el estudio de estos CE, tanto en el área genital como en el área extragenital. En los casos que son positivos la tinción p16 ayuda a delimitar bien estas lesiones, así como a objetivar si existe invasión de estructuras anexiales normales o si existe algún foco de microinfiltración en la dermis (en el área extragenital, aunque la piel perilesional fotodañada también puede ser positiva para p16, se trataría de positividad focal, en células aisladas, mientras que en la EB se observa positividad difusa en todas las capas afectas por la EB).
En los CE invasores extragenitales la tinción p16 es negativa en la zona invasora del CE (negatividad en 8 de 10 CE invasores extragenitales) y positiva focalmente en la epidermis adyacente al CE (áreas fotodañadas, con displasia severa y/o lesiones de queratosis actínica, QA). Esta pérdida de la proteína p16 en los CE invasores respecto a los CE intraepidérmicos o a la epidermis adyacente al tumor podría indicar progresión tumoral o la evolución hacia una fase invasora, tal como concluyen estudios previos3,16, y de forma similar a lo que ocurre en algunos melanomas28.
Por otra parte, no hemos encontrado diferencias entre los resultados de nuestro trabajo, referentes a población española, y los de otros estudios previos realizados en otros países.
Respecto a los resultados sobre CE del área genital, en nuestro trabajo, la mayoría de CE invasores de vulva o pene son negativos para tinción p16, un resultado que nos sorprendió. Parece ser que casi la totalidad de CE de cérvix se originan a través de una única vía oncogénica, asociada con VPH-mc, y tanto los CE intraepiteliales (CIN) como los CE invasores se relacionarían con VPH-mc oncogénicos y serían p16 positivos9,29. Sin embargo, en la vulva y el pene podrían existir otras vías oncogénicas no relacionadas con los VPH-mc. En la vulva se detectan VPH-mc de alto grado de oncogenicidad, mayoritariamente VPH-16 en el 75-80% de los CE intraepiteliales (VIN); se trataría de lesiones multifocales, en pacientes jóvenes, asociadas sobre todo al subtipo histológico verrucoso y basaloide, y que no suelen progresar a CE invasor. El 20-25% restante suelen ser lesiones unifocales, en pacientes de más edad, asociadas al subtipo histológico diferenciado, que progresan a CE invasor más frecuentemente y en cuya etiopatogenia no estarían implicados los VPH-mc. La mayoría de CE invasores de vulva derivarían de estos VIN diferenciados, y sólo se detectan VPH-mc oncogénicos en un 20% de estos CE invasores29. La tinción p16 es positiva en aquellos CE relacionados con VPH-mc oncogénicos, la mayoría de VIN, y negativa en los CE en que no existe relación con VPH-mc, la mayoría de CE invasores9. Esto explicaría nuestros resultados: aunque hemos estudiado muy pocos casos, de los 7 CE invasores sólo dos eran positivos para p16: en estos dos casos positivos detectamos VPH-mc de alto grado, mientras que en los 5 casos negativos para p16 no detectamos VPH-mc. Los tres CE intraepidérmicos eran positivos con la tinción p16 y detectamos VPH-mc en dos de ellos (el otro no se pudo estudiar porque el ADN estaba degradado).
En condilomas acuminados la tinción p16 suele ser negativa30, en concordancia con nuestros resultados (positividad sólo en algunas células aisladas en todos los casos, junto a positividad focal en tres condilomas que presentaban un área difusamente positiva). El desarrollo de CE en el interior de condilomas acuminados se relaciona con áreas intensamente positivas para la tinción p1630. En uno de nuestros casos la tinción p16 nos permitió diagnosticar cambios hacia displasia severa o CE in situ (un área con positivividad para p16 más intensa y difusa; se puede valorar en la figura 2). Existían otros dos condilomas con un área positiva para p16, pero sin signos evidentes de CE in situ; estas áreas podrían corresponder a cambios preneoplásicos (se detectarían más precozmente los cambios bioquímicos o genéticos que los cambios citológicos e histológicos). Es decir, la tinción p16 podría ser útil para detectar cambios neoplásicos en los condilomas acuminados; no debemos olvidar que el VPH-6 y el VPH-11, implicados en la mayoría de condilomas y en los casos de nuestro estudio, aunque con bajo potencial oncogénico, continúan siendo oncogénicos27.
Como conclusión, en nuestro estudio no hemos encontrado relación entre la positividad con p16 y la existencia de VPH-mc en CE extragenitales; en CE genitales, aunque se trata de un número reducido de lesiones, sí que existe relación entre positividad para p16 y VPH-mc oncogénicos, en concordancia con estudios previos6–9. Pensamos que nuestro trabajo, al analizar distintos carcinomas de piel genital y extragenital, aporta una «visión global» de la tinción p16.
Hemos detectado VPH-mc de alto grado de oncogenicidad, como el VPH-16, en algunos carcinomas aislados, la mayoría localizados en la cabeza y el cuello. Por otra parte, hemos comprobado cómo la tinción inmunohistoquímica con p16 puede ser útil en el estudio de CE intraepidérmicos, tanto en el área genital como extragenital. Aunque serían necesarios más estudios con un número mayor de casos, la pérdida de la proteína p16 en los CE extragenitales indicaría progresión tumoral o evolución a una fase invasora.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.