El carcinoma basocelular (CBC) es el tumor maligno más frecuente en seres humanos, y tiene la capacidad de causar una significativa morbilidad asociada a su potencial de destrucción local. El tratamiento del CBC demanda altos costes de atención para los sistemas de salud, por la gran incidencia de esta enfermedad, especialmente en pacientes mayores. El tratamiento estándar para la mayoría de los CBC consiste en la resección quirúrgica con márgenes y control histológico de los bordes de sección, o mediante cirugía micrográfica de Mohs. Sin embargo, en algunos pacientes con contraindicación para cirugía, que tienen comorbilidades importantes o altas expectativas estéticas, existen en la actualidad nuevas alternativas terapéuticas no quirúrgicas, con las cuales se puede lograr muy buen control local, preservar la función y obtener un excelente resultado cosmético.
Basal cell carcinoma (BCC) is the most prevalent malignant tumor in humans and the local destruction of tissue that can result from excision has a significant impact on well-being. Treating BCC is costly for health care systems given the high incidence of this tumor, especially in older patients. Standard treatment involves either resection with histologic assessment of margins or Mohs micrographic surgery. Surgery is sometimes contraindicated, however, due to the presence of significant comorbidity or high cosmetic expectations. For such patients, nonsurgical treatments have become available. These alternatives can offer good local control of disease, preserve function, and achieve excellent cosmetic results.
El carcinoma basocelular (CBC) es el cáncer más frecuente en los seres humanos1,2. Aunque rara vez resulta en enfermedad metastásica, puede llegar a causar una importante morbilidad relacionada con la invasión y la destrucción de las estructuras anatómicas vecinas3.
Australia es el país que presenta la incidencia más alta de cáncer de piel no melanoma (CPNM) en el mundo, con una tasa estandarizada de 213 casos por 100.000 varones y 113 por 100.000 mujeres4,5. En España la incidencia cruda para CBC es de 113,05 casos/100.000 habitantes/año (IC 95%: 89,03-137,08)6–8. En Estados Unidos se estimó que más de 2 millones de casos de CPNM se diagnosticaron en el año 20139,10.
El coste anual para los tratamientos de CPNM se tasa en más de 420 millones de dólares en la población estadounidense11,12. En Inglaterra, según datos publicados en 2009, los importes por esta enfermedad alcanzaron un valor estimado de 240 millones de libras en el año 200213,14.
La cirugía se considera el tratamiento de elección de los CBC por 2 motivos principales: permite obtener los más altos porcentajes de curación y facilita el control histológico de los márgenes de resección7. No obstante, en el subgrupo de pacientes con CBC de bajo riesgo de recurrencia o con contraindicaciones médicas para la cirugía, las nuevas alternativas de tratamiento no quirúrgico pueden ofrecer un excelente resultado oncológico y cosmético. El objetivo del presente artículo fue revisar la literatura asociada con el tratamiento no quirúrgico del CBC.
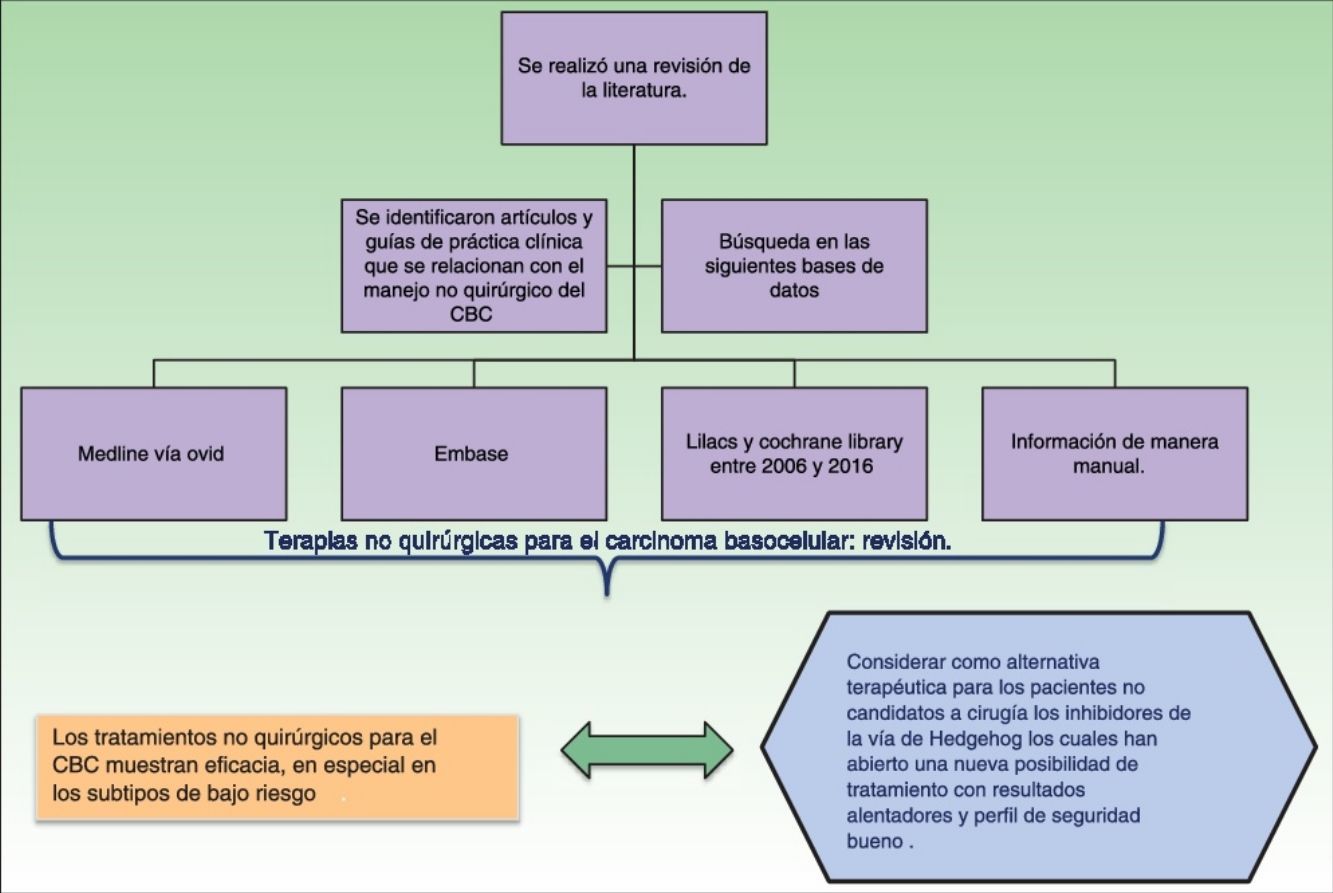
MetodologíaSe realizó una revisión de la literatura con el objetivo de identificar artículos y guías de práctica clínica que se relacionaran con el manejo no quirúrgico del CBC, se hizo una búsqueda en las siguientes bases de datos: Medline vía Ovid, Embase, Lilacs y Cochrane Library entre 2006 y 2016. Además se buscó información de manera manual.
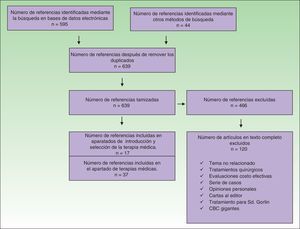
Se incluyeron estudios en los cuales los pacientes hubieran sido sometidos a terapias no quirúrgicas para el tratamiento del CBC. Se excluyeron todos los artículos en los cuales el tratamiento no hubiese sido en humanos, evaluaciones económicas, serie de casos, opiniones personales y cartas al editor (fig. 1).
Se identificaron 639 referencias de las cuales se excluyeron 466 (fig. 1). Las referencias que cumplieron los criterios de inclusión se revisaron de forma independiente por 2 autores, en caso de alguna discrepancia un tercer autor actuó como árbitro para la selección.
Treinta y siete referencias se usaron para la elaboración del apartado sobre terapias médicas; 20 de estas correspondieron a 4 revisiones sistemáticas, 2 de las cuales incluyeron metaanálisis, 7 ensayos clínicos, 6 artículos de revisión y 2 guías de manejo en los que se evaluaron las diferentes terapias para el CBC. Las 17 referencias restantes contenidas en esta sección fueron evaluadas en las revisiones sistemáticas incluidas. Al examinar la calidad de las revisiones sistemáticas a través de la herramienta Amstar se encontró que 3 de estas fueron de alta calidad y una de aceptable calidad (tabla 1). Las características de los ensayos clínicos evaluados se muestran en la tabla 2.
Características de las revisiones sistemáticas y metaanálisis incluidas en la revisión
| Autores | Título | Año | Tipo de estudio | Nivel de evidencia según evaluación con la herramienta AMSTAR |
|---|---|---|---|---|
| Bath-Hextall et al.39 | Interventions for basal cell carcinoma of the skin | 2007 | Revisión sistemática | Alta calidad |
| Roozeboom et al.20 | Overall treatment success after treatment of primary superficial basal cell carcinoma: A systematic review and meta-analysis of randomized and nonrandomized trials | 2012 | Revisión sistemática y metaanálisis | Alta calidad |
| Charlotte et al.12 | Basal cell carcinoma: An evidence-based treatment update | 2014 | Revisión sistemática | Alta calidad |
| Hongfei et al.36 | Photodynamic therapy in the treatment of basal cell carcinoma: A systematic review and meta-analysis | 2015 | Revisión sistemática y metaanálisis | Aceptable calidad |
Datos relacionados con los ensayos clínicos no incluidos en las revisiones sistemáticas
| Autores | Título | Tipo de estudio | Fecha de publicación (año) | Terapias incluidas | Interpretación/conclusión |
|---|---|---|---|---|---|
| Beutner et al.19 | Therapeutic response of basal cell carcinoma to the immune response modifier imiquimod 5% cream | Aleatorizado, doble ciego | 1999 | Imiquimod | 100% de aclaramiento histológico con regímenes de 2v/día, 1v/día y 3v/semana |
| Imiquimod 5% crema muestra eficacia clínica en el tratamiento del CBC. | |||||
| Bath-Hextall et al.30 | Surgical excision versus imiquimod 5% cream for nodular and superficial basal-cell carcinoma (SINS): A multicenter, non-inferiority, randomised controlled trial | Multicéntrico, de grupos paralelos, pragmático, de no inferioridad, aleatorizado y controlado | 2014 | Resección quirúrgica frente a imiquimod 5% crema | TR a los 3 años de 178 (84%) frente a 185 (98%) en el grupo de imiquimod y cirugía respectivamente |
| Imiquimod es una opción de tratamiento útil para los CBC superficiales o nodulares, pequeños de bajo riesgo. | |||||
| Avril et al.43 | Basal cell carcinoma of the face: Surgery or radiotherapy? Results of a randomized study | Ensayo aleatorizado | 1997 | Cirugía frente a radioterapia (RT) | La TRC a los 4 años fue de 0,7% y de 7,5% en los grupos de cirugía y RT respectivamente La cirugía debe ser preferida respecto a la RT en CBC de la cara menores de 4cm |
| Sekulic et al.48 | Efficacy and safety of vismodegib in advanced basal-cell carcinoma | Estudio multicéntrico, de 2 cohortes, internacional, no aleatorizado | 2012 | Vismodegib | RG en el 43% de los pacientes con CBCla y en el 30% de los CBCm |
| Basset-Seguin et al.49 | Vismodegib in patients with advanced basal cell carcinoma (Stevie): A pre-planned interim analysis of an international, open-label trial | Ensayo abierto multicéntrico | 2015 | Vismodegib | 302 (66,7%) de 453 pacientes con CBCla tuvo una RG (153 completas y 149 parciales); 11 (37%) de 29 pacientes con CBCm tuvo una RG (2 completas y 9 parciales) |
| Migden et al.51 | Treatment with two different doses of sonidegib in patients with locally advanced or metastatic basal cell carcinoma (BOLT): A multicentre, randomised, double-blind phase 2 trial | Estudio multicéntrico en curso, aleatorizado, doble ciego, de fase ii | 2015 | Sonidegib | Las TR objetivas para los grupos de 200mg/día y 800mg/día con CBCla fueron 43% y 38%, respectivamente; para aquellos con CBCm las TR objetivas fueron 15% y 17%, respectivamente |
| Rodon et al.52 | A phase I, multicenter, open-label, first-in-human, dose-escalation study of the oral smoothened inhibitor Sonidegib (LDE225) in patients with advanced solid tumors | Estudio fase i | 2014 | Sonidegib | Las dosis máximas toleradas de sonidegib fueron 800mg al día y 250mg 2 veces al día |
CBCla: carcinoma basocelular localmente avanzado; CBCm: carcinoma basocelular metastásico; RT: radioterapia; TR: tasa de respuesta; TRC: tasa de recurrencia.
Para la elección de la terapia médica en el manejo del CBC es importante conocer los distintos factores de riesgo de recurrencia local, con el fin de poder categorizar el riesgo de recurrencia de una lesión individual (tabla 3).
Clasificación del carcinoma basocelular según riesgo de recurrencia
| CBC de bajo riesgo |
| Localizacióna |
| Zona H: menor a 6mm |
| Zona M: menor a 10mm |
| Zona B: menor a 20mm |
| Subtipo histológico |
| Nodular |
| Superficial |
| Tumor primario |
| Invasión perineural negativa |
| Bordes del tumor bien definidos |
| CBC de alto riesgo |
| Localización |
| Zona H: mayor o igual a 6mm |
| Zona M: mayor o igual a 10mm |
| Zona B: mayor o igual a 20mm |
| Subtipo histológico |
| Micronodular |
| Infiltrante |
| Morfeiforme |
| Basoescamoso |
| Mixto |
| Tumor recurrente |
| Invasión perineural positiva |
| Bordes pobremente o mal definidos |
Según la localización se clasifican en carcinomas basocelulares (CBC) de bajo, mediano y alto riesgo. Los tumores de alto riesgo se localizan en la llamada zona H de la cara: región centrofacial, periorbitaria inferior, temporal, pre y retroauricular. Los tumores de mediano riesgo (zonaM) se ubican en la zona no H de la cara, la cabeza y el cuello y, finalmente, los de bajo riesgo (zonaL) se localizan en el resto del cuerpo (el tronco y las extremidades).
Fuente: Rueda et al.17.
Los CBC se pueden clasificar de acuerdo con la histología en 2 categorías: los CBC de crecimiento indolente (subtipos nodular y superficial) y los de crecimiento agresivo e infiltrativo (morfeiforme, infiltrante, micronodular y basoescamoso). Las combinaciones de estos patrones histopatológicos pueden estar presentes en un solo tumor, denominándose de histología mixta3,15–17.
Una categoría significativa la constituyen los CBC localmente avanzados. Estos casos se caracterizan por una larga evolución, historia de múltiples recurrencias e importantes deformidades faciales producto de la progresión del tumor y las cirugías previas. La expectativa de curación con cirugía es baja o nula en estos tumores.
Terapias médicas dirigidas al carcinoma basocelularSe han descrito diferentes modalidades terapéuticas para el manejo médico del CBC. Entre estas se incluyen el imiquimod tópico, el 5-fluorouracilo (5-FU), la terapia fotodinámica (TFD), el interferón intralesional, la radioterapia y los medicamentos inhibidores de la vía de Hedgehog (tabla 4).
Opciones de terapias no quirúrgicas para el carcinoma basocelular
| Modalidad terapéutica | Subtipo de CBC tratado | Resultados a corto plazo (<1 año) | Perfil de seguridad | Nivel de evidencia | Referencias |
|---|---|---|---|---|---|
| Imiquimod tópico | Nodular y superficial de bajo riesgo | TR: 73-92,7% | Bueno | Moderada/alta | 20, 27, 28 |
| 5-FU tópico | Superficial de bajo riesgo | TR: 80,1-93% | Bueno | Moderada/alta | 32, 33 |
| Terapia fotodinámica (MAL) | Superficial de bajo riesgo | TR: 66,8-86,5% | Bueno | Moderada | 20, 33 |
| Interferón intralesional | Nodular | TR: 86% | Bueno | Moderada | 41 |
| Radioterapia | Nodulares y superficiales | RC: 2% (2 años) 7,5% (4 años) | Bueno | Moderada | 43 |
| Vismodegib | Localmente avanzado y metastásico | TR: 27-46% | Bueno | Moderada | 50 |
| Sonidegib | Localmente avanzado y metastásico | TR: 15-47% | Bueno | Moderada | 52 |
MAL: metilaminolevulinato; RC: recurrencia; TA: tasa de aclaramiento; TR: tasa de respuesta.
El imiquimod al 5% es un agonista de los receptores similares a los Toll, que está aprobado por la Food and Drug Administration (FDA) y por la Agencia Europea de Medicamentos (EMA) para el tratamiento de CBC primarios superficiales de menos de 2cm. Se cree que el imiquimod puede inducir interferón-alfa, factor de necrosis tumoral-alfa y otras citoquinas para activar los linfocitos T helper tipo 1 de la inmunidad que estimulen una respuesta antitumoral18.
El primer trabajo que evaluó el imiquimod en el tratamiento de CBC superficial se publicó en 199919. En este ensayo clínico se plantearon 3 regímenes terapéuticos: imiquimod 2 veces al día, una vez al día y 3 veces a la semana, en estos 3 grupos se obtuvo respuesta completa al terminar el tratamiento con verificación histológica. El 60% de los pacientes que se dosificaron 2 veces por semana con imiquimod mostró respuesta completa. En los pacientes que recibieron imiquimod una vez a la semana solo el 50% mostró remisión completa19.
Una revisión sistemática publicada en el 2012 por Roozeboom et al. reportó, tras un periodo de seguimiento entre 6 y 19 semanas, una estimación de tasa de respuesta completa al tratamiento con imiquimod del 86,2% (IC 95%: 82-90). Con respecto a la supervivencia libre de tumor a un año, las estimaciones agrupadas derivadas de 23 estudios fueron de 87,3% (IC 95%: 84-91). Los autores concluyen que el imiquimod es eficaz en el tratamiento del CBC superficial (tamaño máximo de 2cm de diámetro)20.
Las guías de la Asociación Británica de Dermatólogos otorgaron un nivel de evidencia i y un grado de recomendación A para el tratamiento de CBC superficiales con imiquimod21. En los artículos revisados para la elaboración de estas guías se confirmó la respuesta al tratamiento mediante estudio histológico22–26, y contaron con seguimiento de hasta 5 años27–29, lo que proporciona mayor garantía a la eficacia del imiquimod en el tratamiento del CBC superficial; los informes finales de los estudios realizados por Gollnick et al.27,28 muestran una tasa de respuesta con confirmación histológica a los 5 años de seguimiento del 85,4% y 86,9%, para pacientes con CBC superficiales tratados con imiquimod 5 veces por semana y 7 veces por semana durante 6 semanas respectivamente.
En 2014 un ensayo clínico multicéntrico con 501 participantes con CBC superficial o nodular (excluyendo nariz, sien, párpados y orejas) fueron asignados aleatoriamente a tratamiento con imiquimod diariamente por 6 semanas (n=254) o escisión quirúrgica (n=247)30. Tras 3 años de seguimiento clínico se halló que en el tercer año el 84% de los pacientes en el grupo que recibió imiquimod no había presentado recurrencia tumoral, en comparación con el 98% de los pacientes tratados con cirugía.
En definitiva, imiquimod puede considerarse una alternativa terapéutica eficaz para pacientes con CBC primarios, superficiales, pequeños, en localizaciones anatómicas de bajo riesgo, cuando existan contraindicaciones para cirugía o que rechazan la posibilidad del tratamiento quirúrgico31.
5-Fluorouracilo tópicoEl primer tratamiento tópico aprobado por la FDA para el manejo de los CBC superficiales fue el 5-FU al 5% tópico. Sin embargo, este medicamento ha sido poco estudiado para el CBC. El 5-FU interfiere con la síntesis de ADN mediante el bloqueo de metilación del ácido desoxiuridílico y la inhibición de la timidilato sintetasa y, posteriormente, la proliferación celular. El estudio con el que se obtuvo la aprobación por la FDA del 5-FU incluyó 113 lesiones de CBC superficial en 54 pacientes y reportó una tasa de éxito del 93%32.
Una investigación multicéntrica publicada en Holanda en 2013 evaluó la eficacia de 3 tratamientos para el manejo del CBC superficial con un seguimiento de 12 meses (5-FU tópico 2 veces al día durante 4 semanas, imiquimod una vez al día, 5 veces a la semana durante 6 semanas y TFD 2 sesiones con intervalos de una semana cada una con metilaminolevulinato). El resultado del estimado global de éxito, el cual fue calculado según los porcentajes de pacientes tratados libres de recurrencia de enfermedad en el seguimiento a los 3 meses y a los 9 meses posteriores, fue para el 5-FU del 80,1%, el imiquimod del 83,4% y para la TFD de 72,1%33.
En resumen, el 5-FU tópico es una opción terapéutica eficaz para pacientes con CBC superficiales primarios en zonas de bajo o mediano riesgo, no candidatos a cirugía o con una amplia expectativa estética32.
Terapia fotodinámicaLa TFD es otra alternativa médica para el manejo del CBC. Consiste en la activación de un medicamento fotosensibilizante, que puede ser el ácido aminolevulínico o el metilaminolevulinato (MAL), por luz visible para producir especies reactivas de oxígeno que destruyen las células tumorales a través de un producto intracelular que es la protoporfirina ix34. En estudios que comparan la eficacia y el resultado estético de la TFD con MAL frente a la escisión quirúrgica convencional para CBC superficiales durante un periodo de un año, los porcentajes de curación se sitúan alrededor del 75%31,35.
En una revisión sistemática publicada en el 2012, que incluyó 1.583 pacientes con CBC superficiales, se reportó que la eficacia de la TFD puede depender en gran medida del número de ciclos utilizados. Cuando se manejan tratamientos repetitivos de TFD, la estimación de la respuesta tumoral completa aumentó del 76,6% al 79% (IC 95%: 62-90). Así mismo la supervivencia libre de tumor se incrementó del 76,2% al 84%20.
Cuando se cotejó la eficacia relacionada con el resultado estético y la seguridad de la TFD con otros procedimientos, incluyendo la cirugía para el tratamiento de CBC primario, se encontró que la tasa de respuesta completa fue inferior para la TFD (RR: 0,93; IC 95%: 0,89 a 0,98), con una mayor probabilidad de recurrencia a uno y 5 años (RR: 12,42, IC 95%: 2,34 a 66,02; RR: 6,79, IC 95%: 2,43 a 18,96) en comparación con la cirugía.
La TFD tiene una tasa de respuesta completa superior al placebo, pero con resultados similares, aunque inferiores (porcentaje de recurrencia a un año) al tratamiento farmacológico (imiquimod y 5-FU tópico)36.
La recurrencia a corto plazo comunicada para la TFD varía entre el 6% y el 44%, aunque puede disminuir con múltiples tratamientos (2 o más ciclos: día uno y 8) y situándose los porcentajes de curación entre el 76% y el 79%36.
La TFD puede considerarse como opción de tratamiento para los CBC de bajo riesgo, principalmente en tumores superficiales, pequeños, en áreas anatómicas de bajo riesgo y particularmente en pacientes que prefieren un resultado estético favorable, con voluntad de aceptar un mayor riesgo de recurrencia o en los cuales existan contraindicaciones médicas para la cirugía36.
Interferón intralesionalEl interferón forma parte de las quimioterapias intralesionales actualmente empleadas en el manejo del CBC. Este medicamento estimula los macrófagos, las células NK y la citotoxicidad mediada por linfocitos generando una respuesta inmune antitumoral37.
El primer ensayo clínico con interferón incluyó 172 pacientes con CBC nodulares ulcerados o superficiales, confirmados por biopsia, tratados de forma intralesional con interferón alfa-2b o placebo. El grupo tratado con interferón alfa-2b recibió 1,5 millones de unidades internacionales 3 veces a la semana durante 3 semanas, para una dosis total acumulada de 13,5 millones de unidades internacionales. El 86% de los pacientes tratados con interferón presentó curación38.
Una revisión sistemática publicada en 2014, que tuvo como objetivo proporcionar un análisis de la evidencia actual para el tratamiento del CBC, presentó aclaramiento histológico del 85% con interferón alfa-2b. El 83% de los participantes evidenció excelentes desenlaces cosméticos con esta terapia. Los eventos adversos más frecuentes comunicados por todos los pacientes fueron síntomas similares a un estado gripal con cefalea, mialgias y náuseas12,37.
El interferón intralesional puede ofrecer ventajas sobre las técnicas tradicionales en el tratamiento de CBC, en particular cuando la intervención quirúrgica es inapropiada o para tumores que ocurren en áreas cosméticamente difíciles39.
RadioterapiaLa radioterapia es una técnica clásica que fue utilizada como primera línea de tratamiento del CBC hace varios años, pero que por algunas razones se emplea con menos frecuencia en la actualidad7,31. Esta técnica está indicada como segunda opción de tratamiento en tumores de alto riesgo o en los pacientes con contraindicaciones para la cirugía40,41.
Un análisis retrospectivo que incluyó 712 CBC (631 nodulares y 81 superficiales) tratados con 5 sesiones de terapia superficial de rayos X para una dosis total de 35Gy, demostró tasas de recurrencia del 2% a los 2 años y del 4,2% a los 5 años42. En un ensayo aleatorizado que comparó la escisión quirúrgica de 174CBC (primarios, localizados en la cara, menores de 4cm de diámetro y tipos histológicos no agresivos) con radioterapia de 173CBC de similares características, se encontró que la tasa de recurrencia a los 4 años fue de 0,7% en el grupo tratado con cirugía y de 7,5% en el grupo tratado con radioterapia43.
Los resultados de la radioterapia varían considerablemente en la literatura, quizás porque difieren en los regímenes de tratamiento utilizados y el esquema óptimo todavía necesita ser definido44.
Sin embargo, la radiación como terapia tiene varias desventajas: la falta de verificación histológica, el tratamiento prolongado que requiere de muchas visitas, el resultado cosmético que tiende a empeorar con el tiempo (atrofia cutánea y telangiectasias) y el riesgo de nuevos CBC radioinducidos31.
En resumen, la radioterapia es una opción de tratamiento valiosa en pacientes con CBC de alto riesgo de recurrencia que no son candidatos para el tratamiento quirúrgico, mayores de 60 años (debido a las probables complicaciones a largo plazo), en tumores primarios o recurrentes o después de un tratamiento quirúrgico o como terapia adyuvante cuando se informa de invasión perineural o compromiso de los bordes quirúrgicos.
Inhibidores de la vía HedgehogVismodegibEn el año 2012 la FDA y en el 2013 la EMA aprobaron una nueva clase de medicamento para el tratamiento del CBC localmente avanzado o metastásico, el vismodegib. Los estudios moleculares y genéticos demuestran que casi todos los CBC contienen alteraciones genéticas en la vía de señalización Hedgehog, que resulta en su activación aberrante, y como consecuencia en una proliferación no controlada de los queratinocitos. Más comúnmente, estas alteraciones causan pérdida de función del homólogo de patched 1, que en general actúa como inhibidor del smoothened (SMO) transductor de la señal, que a su vez activa la cascada efectora del complejo proteico GLI (familia de factores de transcripción del oncogén asociado a glioma). Más del 90% de los CBC esporádicos, y la gran mayoría de los que aparecen en el síndrome de Gorlin, presentan mutaciones del gen PTCH-145. El vismodegib es una pequeña molécula que se une e inactiva específicamente al SMO, evita la activación de la vía suprimiendo la proliferación y el crecimiento tumoral46–48.
El vismodegib está indicado en el tratamiento de los adultos con CBC localmente avanzado o metastásico no candidatos a tratamiento quirúrgico y en los que haya fracasado el tratamiento con radioterapia.
En el estudio pivotal de vismodegib, fase ii (Erivance®), en 104 pacientes con CBC localmente avanzado o metastásico, se obtuvo una respuesta global en el 43% de los pacientes con CBC localmente avanzado y en el 30% de los CBC metastásicos48. Después de 30 meses de seguimiento la tasa de respuesta global fue del 60% en el grupo de CBC localmente avanzado (evaluada por los investigadores) y del 48,5% en el grupo de CBC metastásico, resultados comparables a los del análisis primario. La duración de la respuesta objetiva fue de 26,2 meses para el grupo de pacientes con CBC localmente avanzado y de 14,8 meses para el grupo de CBC metastásico, siendo la supervivencia libre de enfermedad de 12,9 y 9,3 meses respectivamente48.
El estudio clínico multicéntrico con el mayor número de pacientes tratados con vismodegib hasta la fecha (Stevie) fue diseñado para valorar la seguridad del medicamento. Sus resultados preliminares en los primeros 499 pacientes que contaron con un año de seguimiento (468 CBC localmente avanzado y 31 CBC metastásico) muestran una mediana de la duración de la exposición al vismodegib de 36,4 semanas. Según la evaluación realizada por los investigadores, 302 (66,7%) de 453 pacientes con CBC localmente avanzado presentaron respuesta: 153 respuesta completa (34%), 149 respuesta parcial (33%) y 118 presentaron enfermedad estable (26%). Once de 29 pacientes con CBC metastásico (37,9%) respondieron, 2 de forma completa (7%) y 9 parcial (31%). Diez pacientes (34%) presentaron enfermedad estable. Los eventos adversos reportados con los inhibidores de SMO ocurren aproximadamente en el 98% de los pacientes (491 de 499) (tabla 5). Por orden de frecuencia estos son espasmos musculares (64%), alopecia (62%), disgeusia (54%), pérdida de peso (33%), astenia (28%), hiporexia (25%), ageusia (22%), diarrea (17%), náuseas (16%) y fatiga (16%).
Registro de eventos adversos con los inhibidores del smoothened vismodegib/sonidegib
| Eventos adversos | Vismodegib (150mg) | Sonidegib (200mg) | Sonidegib (800mg) |
|---|---|---|---|
| N=499 | N=79 | N=150 | |
| Espasmos musculares | 64% | 49% | 67% |
| Alopecia | 62% | 43% | 55% |
| Disgeusia | 54% | 38% | 59% |
| Pérdida de peso | 33% | 27% | 38% |
| Astenia | 28% | 8% | 5% |
| Hiporexia | 25% | 29% | 36% |
| Ageusia/hipogeusia | 22% | 0% | 5% |
| Diarrea | 17% | 24% | 22% |
| Fatiga | 16% | 29% | 36% |
| Náuseas | 16% | 33% | 45% |
Un 22% de los pacientes presentaron eventos adversos graves, los más comunes fueron neumonía, deterioro del estado general, carcinoma escamocelular y deshidratación. Hubo un 6% de fallecimientos, 21 atribuidos a eventos adversos, 5 a progresión de la enfermedad y 5 a otras razones49. Un análisis reciente con datos del estudio Stevie prueba que suspensiones temporales de 2, 3 o 4 semanas (hasta 8 semanas según protocolo) del tratamiento con vismodegib no compromete la eficacia del tratamiento en términos de supervivencia libre de progresión y la tasa de respuesta50.
El tratamiento con vismodegib añade una nueva modalidad terapéutica para el grupo de pacientes con CBC avanzado o metastásico que han recaído tras la radioterapia y/o en los cuales la cirugía no es apropiada o está contraindicada49.
SonidegibRecientemente la FDA y la EMA han aprobado otro inhibidor de la vía Hedgehog denominado sonidegib. En el estudio multicéntrico, aleatorizado, doble ciego, de fase iiBasal cell carcinoma outcomes in LDE225 trial (ensayo sobre los resultados de LDE225 en el carcinoma basocelular), con el cual se obtuvo la aprobación del medicamento51,52, los pacientes fueron asignados a recibir el tratamiento en 2 grupos de acuerdo con la dosis 200mg y 800mg al día, vía oral. En total, 230 pacientes fueron incluidos: 193 pacientes con CBC localmente avanzado y 37 pacientes con CBC metastásico51.
Las tasas de respuesta objetiva para los grupos de 200mg/día y 800mg/día con enfermedad localmente avanzada fueron 43% y 38%, respectivamente. Para aquellos con enfermedad metastásica las tasas de respuesta objetiva fueron 15% y 17%, respectivamente. La mediana de duración del tratamiento fue mayor con el régimen de dosis baja (8,9 frente a 6,5 meses), y esta diferencia se atribuyó a una menor incidencia de eventos adversos con las dosis más bajas de sonidegib. Las toxicidades más comunes fueron similares a las de vismodegib (tabla 5)51.
En función de estos resultados sonidegib fue aprobado con dosis de 200mg una vez al día para los pacientes con CBC localmente avanzado que han tenido recidiva después de la cirugía o radioterapia, o que no son candidatos para estas terapias53.
ConclusionesLos tratamientos no quirúrgicos para el CBC muestran eficacia, en especial en los subtipos de bajo riesgo, y pueden considerarse como una alternativa terapéutica para los pacientes no candidatos a cirugía o que no desean ser operados. En el raro subgrupo de pacientes con CBC avanzado, los inhibidores de la vía de Hedgehog han abierto una nueva posibilidad de tratamiento con resultados alentadores y buen perfil de seguridad, aunque se requieren más estudios para determinar cuáles son los esquemas de tratamiento más apropiados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor principal declara haber recibido honorarios de productos Roche-Colombia por conferencias sobre vismodegib.
Los coautores declaran no tener ningún conflicto de intereses.
A la división de investigación de la Fundación Universitaria de Ciencias de la Salud (FUCS), en especial a Diana Buitrago por su empeño y colaboración en la elaboración del presente manuscrito.