INTRODUCCION
La fotoquimioterapia, es decir, la combinación de sustancias químicas y luz, ha sido una práctica habitual en el tratamiento de las enfermedades cutáneas. Dentro de esta se incluye la terapia fotodinámica (TF), una modalidad terapéutica basada en la fotooxidación de materiales biológicos inducida por un fotosensibilizante, el cual se localiza selectivamente en determinadas células o tejidos tumorales, de forma que al ser iluminadas con una luz de adecuada longitud y en dosis suficiente, dichas células resultan destruidas.
El término «fotodinámica» fue acuñado por Tappeiner en 1904 para describir las reacciones químicas consumidoras de oxígeno inducidas por una fotosensibilización, que se producen en biología. Sin embargo, habría que esperar a la década de 1970 cuando Dougherty, pionero en el uso de la TF, aplicó con éxito estas reacciones biológicas al tratamiento del cáncer, tanto cutáneo como de otros aparatos y sistemas 1. Además, no olvidemos que el método fotodinámico no es útil únicamente como tratamiento sino también como método diagnóstico, ya que mediante la fluorescencia emitida por el fotosensibilizante se pueden detectar tejidos tumorales diferenciándolos de los sanos.
Se puede decir que la TF es «ideal» en el tratamiento de lesiones cutáneas, pues la accesibilidad de la piel hace que las técnicas de iluminación sean relativamente sencillas y proporciona unos excelentes resultados cosméticos, especialmente comparados con la cirugía o la crioterapia en patología oncológica. Esto ha llevado al mayor uso de la TF en dermatología frente a otras especialidades médicas. El presente artículo revisa a fondo los aspectos más relevantes de la TF en nuestra especialidad. Para ello hemos contado con profesionales que en nuestro país han trabajado en diversas facetas de la misma. En primer lugar se hará una revisión de los fundamentos básicos del tratamiento fotodinámico; posteriormente se expondrán sus aplicaciones clínicas en dermatología, tanto las oncológicas como todos aquellos procesos dermatológicos en los que la TF puede tener un papel en su manejo, sin olvidar su prometedora aplicación cosmética en el tratamiento del fotoenvejecimiento. Finalizaremos la revisión con el fotodiagnóstico y las diferentes formas de monitorización no invasiva de la efectividad de la TF.
FUNDAMENTOS BASICOS DE LA TERAPIA FOTODINAMICA
La TF requiere de la presencia de tres elementos: el fotosensibilizante, la luz y el oxígeno. A continuación hablaremos de cada uno de estos tres elementos, centrándonos especialmente en el campo de la dermatología.
Fotosensibilizantes utilizados en la terapia fotodinámica
Las cualidades del fotosensibilizante son importantes para la efectividad del tratamiento fotodinámico. Las características que debe reunir son 2: a) capacidad de localizarse específicamente en el tejido o las células que hay que tratar; b) distribución homogénea en el tejido diana; c) alta lipofilia para difundir a través de las membranas biológicas; d) espacio de tiempo lo más breve posible entre su administración y la acumulación máxima en dichos tejidos; e) vida media corta y rápida eliminación de los tejidos normales; f) activación a longitudes de onda con penetración óptima tisular; g) alto rendimiento en la producción de oxígeno singlete ( 1O2), o en general de especies reactivas del oxígeno, y h) ausencia de toxicidad en la oscuridad.
Se han utilizado diversos fotosensibilizantes, tanto in vitro como in vivo, en TF (tabla 1). A continuación se describen los más empleados, centrándonos en sus aplicaciones dermatológicas.
Porfirinas
Fueron las primeras sustancias utilizadas en TF, en concreto el derivado de hematoporfirina y su compuesto purificado, el porfímero sódico (Photofrin). El uso de Photofrin está aprobado en algunos países para el tratamiento del cáncer de vejiga, cáncer de pulmón, tanto en fase precoz como de forma paliativa, y en el cáncer obstructivo de esófago 3. Estos fotosensibilizantes deben ser administrados por vía intravenosa y se acumulan en el estroma vascular del tumor. Su remanencia cutánea así como su lento aclaramiento da lugar a una prolongada fotosensibilidad cutánea que obliga al paciente a una rigurosa fotoprotección durante 4-6 semanas tras su administración 4.
Porfinas
La porfinas son porfirinas sintéticas con alto poder fotosensibilizante de tumores y tejidos normales. La TPPS4 (tetra-sodio-meso-tetrafenilporfina-sulfonato) es un compuesto hidrófilo que se activa a 630 nm y se localiza preferentemente en el estroma tumoral. TPPS4 se ha utilizado de forma tópica o intralesional en el tratamiento de carcinomas basocelulares, queratosis actínicas, enfermedad de Bowen, verrugas vulgares, queratoacantomas y linfoma cutáneo de células T con buenos resultados clínicos y cosméticos 5. La mayor limitación de la TPPS4 es su neurotoxicidad.
Porficenos
Los porficenos son isómeros sintéticos de las porfirinas constituidos por 4 anillos pirrólicos. Estos porficenos reúnen los principales requerimientos para ser útiles en la TF tópica: pureza química, gran absorción de luz a 630 nm, produciendo 10 veces más oxígeno singlete que el derivado de hematoporfirina. Una gran ventaja añadida es la posibilidad de modificar químicamente su cadena lateral para acelerar la captación celular y aumentar su actividad fotodinámica 6.
Phthalocianinas (PC)
Son derivados tetrapirroles que difieren de las porfirinas naturales en que las distintas subunidades están ensambladas mediante átomos de nitrógeno y la estructura macrocíclica se extiende en las cuatro unidades pirrólicas por anillos benzoicos. Típicamente las phthalocianinas tienen un pico de mayor absorción entre 650 y 700 nm (banda Q), lo que les permite una mayor penetración en los tejidos superior a la de las porfirinas 7. Las PC producen una gran cantidad de especies reactivas del oxígeno, y alcanzan la concentración selectiva y máxima en el tejido tumoral a las 3 h de su administración intravenosa. Producen una fotosensibilidad sistémica mínima.
Se está evaluando la cloroaluminio phthalocianina tetrasulfonatada (AIPcTS) en el tratamiento del carcinoma basocelular, el sarcoma de Kaposi y estadios precoces de cáncer de pulmón.
Clorinas
Las clorinas son un grupo heterogéneo de compuestos derivados ya sea de la porfirina o de la clorofila. Poseen elevados coeficientes de extinción a longitudes de ondas superiores a 650 nm. El más importante de este grupo es el derivado benzoporfirínico anillo A monoácido (BPD-MA), cuya principal aplicación es el tratamiento de la degeneración macular retiniana 8.
La N-aspartilclorina e6 (Npe6) es un fotosensibilizante sistémico muy hidrosoluble, cuyo pico de absorción es 664 nm, que se acumula en los lisosomas. Su periodo de incubación es de 4-6 h tras su administración intravenosa, habiéndose realizado un ensayo clínico en fase I demostrando su eficacia en carcinomas basocelulares y espinocelulares con tan sólo una sesión de tratamiento 9.
Dentro de este grupo el fotosensibilizante más prometedor para dermatología es la ATX-S10 (Na), con un espectro de absorción de 670 nm, el cual permite una mayor eficacia en lesiones profundas y es eficaz aplicado tópicamente. Tras un periodo de incubación de 4 h, se han obtenido buenos resultados en el tratamiento de la enfermedad de Bowen, el carcinoma basocelular, la psoriasis, e incluso superior al ácido d -aminolevulínico (ALA) en carcinoma espinocelular 10.
Lutetium texapirina (Lu-Tex)
Lu-Tex son unos compuestos sintéticos, hidrosolubles, que se localizan en las lesiones malignas y en las placas de ateroma. Se administran por vía intravenosa, su máxima acumulación en los tejidos que se han de tratar es a las 2-4 h y su espectro de absorción óptimo es 732 nm. Este último aspecto es lo que ha permitido tratar con éxito metástasis subcutáneas de melanoma sin daño significativo de la piel circundante 11.
Ácido δ-aminolevulínico
El ALA, aplicado tópicamente, ha sido el fotosensibilizante más utilizado en el tratamiento de lesiones cutáneas. Kennedy et al 12 fueron los primeros en aportar la idea de realizar una «fotosensibilización endógena» del tejido tumoral. En este caso, en lugar de administrar el fotosensibilizante se aplica un precursor del mismo, el ALA, el cual es preferentemente convertido en el fotosensibilizante activo, la protoporfirina IX (PpIX), por determinadas células o tejidos 13. El ALA tiene la ventaja de que es efectivo tanto si se administra tópico como oral, a diferencia de la mayoría de los fotosensibilizantes que requieren administración intravenosa. Otro aspecto ventajoso es que, a las 24-48 h de su administración, el fotosensibilizante ha sido totalmente eliminado de los tejidos 14.
El espectro de absorción de la PpIX tiene un pico de absorción máximo a 410 nm y otro menor alrededor de 630 nm. El primero proporciona la mayor inactivación celular, mientras que si precisamos tratar lesiones de profundidad superior a 2 mm deberemos emplear el segundo, aunque sea menos potente que el primero 14.
Para entender la transformación de ALA en PpIX hay que seguir la vía de síntesis del hemo, presente en las células de mamíferos y bacterias fotosintéticas 15. El ALA es el primer compuesto intermedio en la síntesis de las porfirinas y se forma dentro de la mitocondria a partir de glicina y succinil-CoA mediante una reacción catalizada por la enzima ALA-sintasa, la cual se localiza en la membrana mitocondrial interna y es el principal regulador de la vía 16. El ALA difunde entonces al citosol y tras varios pasos enzimáticos se transforma en coproporfirinógeno III, el cual entra de nuevo en la mitocondria donde es oxidado para formar protoporfirinógeno IX (fig. 1). Éste al perder 6 hidrógenos se transforma en PpIX, estructura tetrapirrólica lista para la incorporación de un ion ferroso, reacción catalizada por la ferroquelatasa, completándose así la síntesis del grupo hemo.
Fig. 1.--Vía de síntesis del hemo. Los pasos de síntesis se representan por flechas continuas y los procesos reguladores con discontinuas. Los signos + y - indican efectos estimulante e inhibidor, respectivamente. La mitocondria está representada en gris claro, el núcleo en gris oscuro y el citosol en blanco. Rtf: receptor de transferrina.
La vía biosintética del hemo está regulada por la disponibilidad del sustrato y por un sistema de retroalimentación negativo, el cual inhibe a la enzima ALA-sintasa directamente e inhibe también la transcripción, traslación y el transporte de esta proteína dentro de la mitocondria, regulando así su propia síntesis (fig. 1) 17. Si se administra ALA de forma exógena este control es rebasado, dando origen a una sobreproducción de porfirinas, particularmente de PpIX, ya que ninguna de las enzimas de la vía de síntesis del hemo está limitada salvo la actividad de la ferroquelatasa. De esta forma las células desarrollarán fluorescencia debida a la acumulación de PpIX convirtiéndose así en células fotosensibilizadas. Además, la enzima porfobilinógeno desaminasa posee también un papel regulador, pues la administración exógena de ALA aumenta su actividad 18. Esta acumulación intracelular de PpIX se produce en la mitocondria, la membrana citoplasmática, la envoltura nuclear y los lisosomas.
El mecanismo de la captación intracelular del ALA es principalmente un transporte activo a través de las membranas, aunque no se pueden excluir otros mecanismos adicionales en dependencia del tipo de célula 19. Por otro lado, el aumento de permeabilidad en aquellas áreas con el estrato córneo alterado, también parece contribuir a la selectividad de la TF con ALA tópico en las lesiones cutáneas.
Sin embargo, el ALA es una molécula hidrofílica, es decir, que presenta baja lipofilia por lo que atraviesa pobremente las barreras biológicas como el estrato córneo cutáneo y, por tanto, para alcanzar niveles clínicamente relevantes de PpIX es preciso aplicar dosis relativamente altas (ALA 20 %) y mantener un tiempo largo de aplicación antes de iluminar (4-8 h), suficiente para la completa transformación y máxima acumulación de PpIX en los tejidos que hay que tratar 20. Estas limitaciones fueron las que llevaron a desarrollar un derivado, en concreto un éster metílico, el 5-metilo aminolevulinato (MAL), mucho más lipofílico que el anterior 14,21. Dicha propiedad le proporciona una elevada especificidad por las células neoplásicas 2. En concreto, el MAL presenta una alta especificidad por las células del carcinoma basocelular en comparación con las células sanas, con una tasa de 9:1, frente al ALA que posee una tasa de 2:1 22.
Entre las ventajas del MAL sobre el ALA están la mayor penetración tisular, aumentando la producción de PpIX intracelular y obteniendo así un rendimiento fotodinámico superior y una localización más selectiva en el tejido tumoral 23. En cuanto al mecanismo de acción parece que parte se hidroliza a ALA, pero también existe evidencia de incorporación directa de MAL a la ruta sintética de las porfirinas, e incluso de efectos estimulantes del MAL en la ruta porfirínica 24. Por último, otras ventajas clínicas que ofrece el MAL sobre el ALA son que requiere un tiempo más corto de incubación desde su aplicación hasta la iluminación (3 h), y que los pacientes refieren menor dolor durante la iluminación.
Fuentes de luz utilizadas en la terapia fotodinámica
En general, cualquier fuente de luz visible adecuada a las características del espectro de excitación del fotosensibilizante, capaz de penetrar lo necesario en los tejidos y con la potencia suficiente puede ser utilizada en TF. Nuevamente nos centraremos en los aspectos más importantes en el tratamiento de lesiones dermatológicas.
Penetración de la luz en los tejidos
La penetración de la luz a través del espesor tumoral depende de las características del tejido que hay que tratar y de la longitud de onda de la misma (a mayor longitud de onda, mayor penetración tisular). La penetración está influida por: a) la absorción óptica debida a los cromóforos tisulares endógenos, principalmente la hemoglobina; b) la dispersión óptica dentro del tejido, y c) la sustancia fotosensibilizante, este fenómeno se ha denominado «autoprotección» 25. Así, longitudes de onda inferiores a 600 nm son absorbidas mayormente por la hemoglobina, mientras que el agua absorbe longitudes de onda superiores a 1.200 nm, por lo que la ventana terapéutica de la TF en las lesiones cutáneas está entre 600 y 1.200 nm. Por otro lado, tanto la dispersión como la absorción óptica son diferentes para cada tejido. En general, la penetración de la luz es alrededor de 1-2 mm para una longitud de onda de 400-500 nm, entre 5-10 mm para 630 nm y aproximadamente el doble para longitudes de onda entre 700-850 nm. Sin embargo, debido a la alta dispersión de la luz en la piel la penetración de una luz de 630 nm es de 1-3 mm 26.
Dosimetría de la luz
El producto de la potencia de la fuente luminosa por el tiempo nos da la dosis de energía (J/m 2). Hay que considerar que la intensidad de la luz en el tejido disminuye de forma exponencial a la distancia que recorre.
En cuanto a la dosis de luz que hay que administrar en cada lesión, se debe considerar que con dosis de luz demasiado bajas se produce un daño tisular subletal que es reparado, mientras que a dosis demasiados altas se produce una depleción de oxígeno que disminuye la eficacia terapéutica. Por tanto, es necesario ajustar la dosis de luz para cada fuente utilizada y tipo de patología. De hecho fraccionar la iluminación, es decir, una iluminación discontinua podría mejorar la efectividad del tratamiento fotodinámico ya que permite la reoxigenación del tejido en los periodos sin luz, aunque esto no ha sido estudiado en la TF con ALA.
Fuentes de luz más utilizadas en dermatología
En dermatología los sistemas de iluminación utilizados en TF son más simples, que los láseres equipados con fibras ópticas necesarios para acceder a órganos internos. Entre las fuentes utilizadas para tratar lesiones cutáneas están tanto láseres como lámparas de luz no coherente: lámparas de arco de xenón, lámparas con filamentos incandescentes y diodos emisores de luz.
Los láseres permiten seleccionar con exactitud la longitud de onda correspondiente al espectro de absorción del fotosensibilizante así como la aplicación precisa de la luz en una pequeña área. El láser de colorante de argón sintonizable emite una luz continua que puede ajustarse a las propiedades de absorción de distintos fotosensibilizantes (350-700 nm), por lo que es uno de las láseres más utilizados en TF.
Las luces incoherentes poseen las ventajas de permitir tratar áreas cutáneas más amplias y ser más baratas 19. Los diodos emisores de luz, pequeños semiconductores con una banda de longitud de onda estrecha de 20 a 50 nm y sin emisión de luz infrarroja, son una de las lámparas más utilizadas en TF dermatológica en la actualidad.
Existen pocos estudios comparativos entre distintas fuentes de luz, pero uno demostró una respuesta equivalente del carcinoma basocelular a la TF con ALA utilizando tanto un láser de vapor de cobre como una lámpara halógena incandescente de amplio espectro 27. Por el momento, no existe una única lámpara ideal; por tanto, su elección se debe realizar según la indicación clínica, número y tamaño de las lesiones a tratar, su portatibilidad, flexibilidad, tiempo de tratamiento y coste.
Mecanismo de la destrucción tisular inducida por la terapia fotodinámica
La TF está basada en la fotooxidación de materiales biológicos en determinados tejidos. El mecanismo del daño celular fotodinámico implica complejas interacciones entre fotones de luz visible, el fotosensibilizante localizado en el tejido que se debe tratar, el oxígeno molecular, determinados barredores intracelulares de las diversas especies reactivas del oxígeno y diversos procesos reparadores celulares.
La eficacia de la TF se basa en la conjunción de la muerte celular directa, el daño vascular, la inflamación y la respuesta inmunitaria del huésped.
A continuación analizaremos, a distintos niveles, el mecanismo de acción de la TF, dedicando especial atención al mecanismo del ALA y sus derivados.
Fotoquímica
La acción fotodinámica ocurre, de forma resumida, de la siguiente manera: tras la absorción de luz, el fotosensibilizante es transformado desde su estado base a un estado electrónicamente excitado e inestable (estado singlete), con una vida media de 106 a 109 s. El fotosensibilizante excitado puede volver a su estado basal, lo que resulta en emisión de luz en forma de fluorescencia. Otra posibilidad es que el sensibilizante en estado triplete interaccione con las moléculas circundantes dando lugar a dos tipos de reacción foto-oxidativa: reacción tipo I por transferencia de electrones, originando radicales libres del oxígeno (ROS) (peróxidos, anión superóxido y radicales hidroxilo), los cuales inician reacciones en cadena de radicales libres 28 y reacción tipo II, mediada por la transferencia de energía, dando lugar a la formación de oxígeno singlete y el retorno del fotosensibilizante a su estado basal 29. Ambas reacciones ocurren simultáneamente y en competición, sin embargo, parece que el oxígeno singlete es el mayor responsable del daño tisular producido durante la TF. El oxígeno singlete tiene una vida corta (< 0,04 μs) y un radio de acción de 5 a 20 nm, un tiempo corto si tenemos en cuenta el diámetro de una célula tumoral (± 10 μm). Además, es una molécula muy reactiva que rápidamente reacciona con muchos tipos de biomoléculas, especialmente en las membranas celulares; los lípidos insaturados, el colesterol y algunos aminoácidos, como el triptófano, la histidina y la metionina, son especialmente vulnerables 30.
Durante la TF el fotosensibilizante es fotodestruido durante la exposición a la luz, proceso denominado fotoblanqueamiento 31. Asimismo, este fotoblanqueamiento es un mecanismo de interrupción de la reacción fotodinámica, lo que es importante tanto para restringir el daño tisular de la TF al tejido tumoral como para eliminar la fotosensibilidad cutánea residual después del tratamiento. Por otro lado, hay que considerar que existe una dosis umbral de TF para producir necrosis tisular, si el fotoblanqueamiento tiene lugar antes de que se alcance este umbral no ocurrirá daño en el tejido.
Dianas de la terapia fotodinámica
La TF produce unos daños directos sobre las células como resultado del daño fototóxico y unos efectos indirectos que también parecen tener un papel importante en la destrucción tisular final.
Daño directo: dianas celulares. Las dianas del daño fotodinámico están en estrecha relación con la localización del fotosensibilizante en el momento de la fotoactivación. Esta citotoxicidad varía, por tanto, con el tipo de fotosensibilizante utilizado y probablemente con el tipo de célula.
En general, las porfirinas con cadenas laterales catiónicas se localizan en la mitocondria, mientras aquellas con un carácter más aniónico se localizan preferentemente en los lisosomas, siendo las primeras más fototóxicas. Cuando administramos ALA la producción endógena en exceso de PpIX se concentra en la mitocondria. Su baja hidrosolubilidad y gran afinidad por los lípidos de las membranas a pH fisiológico favorecen que la PpIX sea retenida dentro de la mitocondria produciendo sus efectos fotodinámicos primarios en ese sistema mitocondrial 32. Así, a nivel histológico se ha observado que en los tumores tratados con ALA el daño inicial se produce en la mitocondria de las células tumorales y endoteliales de la microvasculatura del tumor 33.
En cuanto a la forma de inducción de la muerte celular parece que los fotosensibilizantes que se localizan en la mitocondria inducen apoptosis 34 mientras que los que se localizan en la membrana plasmática causan necrosis con la exposición a la luz 35. No obstante, también influyen el tipo de célula, su estado de energía y el protocolo de tratamiento. En cuanto a la dosis de luz administrada, si se administran dosis bajas de luz la muerte celular in vitro se produce por apoptosis, mientras que si la dosis es alta se produce por necrosis 36. Otro factor que parece influir es el tiempo de incubación del fotosensibilizante. Así, en el caso de las Zinc phthalocianinas (ZnPc), tras 2 h de incubación se localizan preferentemente en el aparato de Golgi y menos en la membrana plasmática; sin embargo, tras 24 h la localización mitocondrial es clara. Si la iluminación se realiza tras 2 h la forma más prevalente de muerte celular es la necrosis, mientras que si se hace a las 24 h es por apoptosis 36.
La TF también induce diversos cambios bioquímicos y microscópicos. Desde el punto de vista bioquímico, la peroxidación lipídica y la inactivación de las proteínas parecen ser las dianas principales de las especies reactivas del oxígeno producidas en el proceso fotodinámico 37. En el caso de los fotosensibilizantes que se localizan en la mitocondria, la TF induce la inactivación de las enzimas unidas a la membrana mitocondrial, lo que resulta en la rotura de la cadena respiratoria celular 36. Además, se produce un aumento de la concentración de Ca++ intracelular y una disminución de la concentración de trifosfato de adenosina. Por otro lado, el aumento de la permeabilidad de las membranas inhibe el transporte de aminoácidos, nucleósidos e hidratos de carbono.
Desde el punto de vista microscópico, algunas horas después de la TF se pueden observar burbujas y estructuras balonizadas que protruyen en la membrana plasmática, seguido de la detención de la división celular y su muerte 38.
Según Dougherty et al 35, la TF tiene, en general, un bajo potencial de causar daño en el ADN, ya que la mayoría de los fotosensibilizantes no se acumulan de forma significativa en el núcleo celular y, por tanto, el daño nuclear no parece ser un factor importante en su citotoxicidad. De ello se deduce que la TF posee un bajo potencial de inducir mutaciones o carcinogénesis 39. Además, en el caso de la TF con ALA se ha observado un retraso de la fase S del ciclo celular y una disminución de la expresión de los genes que intervienen en la proliferación celular 40.
Efectos indirectos.Regulación de la angiogénesis. La vasculatura parece ser la diana más crítica del fotodaño indirecto. Como un resultado del daño directo inducido por la TF al endotelio vascular se produce hipoxia, anoxia y deprivación de nutrientes al tumor. Sin embargo este efecto es absolutamente dependiente del fotosensibilizante utilizado, ya que, por ejemplo la TF con Photofrin aumenta la formación de factor de crecimiento de endotelio vascular (VEGF) y da lugar a vasoconstricción, formación de trombos y destrucción tumoral por necrosis, mientras que las phthalocianinas inducen la salida del contenido de los vasos 41.
Regulación de la matriz extracelular. Se ha observado que la TF, en concreto con Photofrin, aumenta la expresión y activación de metaloproteinasas (MPP) 1, 3, 8 y 9 y disminuye la expresión de sus inhibidores (TIMP-1), proteínas que regulan el metabolismo de la matriz extracelular 36. La acción sobre las MMP puede contribuir a frenar la diseminación tumoral, por un lado, así como al excelente resultado cosmético de la TF.
Efecto inmunológico de la TF. El tratamiento de tumores sólidos mediante TF pone en marcha una serie de efectos «antitumorales» que contribuyen a su erradicación. Estos hechos son: la actividad antitumoral de las células inflamatorias y la reacción inmune específica frente al tumor.
Las lesiones fotooxidativas de los lípidos de las membranas inician una rápida activación de las fosfolipasas membranosas, lo que conlleva una degradación acelerada de los fosfolípidos y la liberación masiva de fragmentos lipídicos y ácido araquidónico 36. Todo ello inducirá la liberación de potentes mediadores de la inflamación como sustancias vasoactivas, componentes del complemento, reactantes de fase aguda, proteinasas, peroxidasas, factores de crecimiento y otros inmunorreguladores. Así, se ha demostrado la producción de interleucinas (IL-6, IL-1b, IL-2), factor de necrosis tumoral a (TNF-α) y factor estimulador de colonias granulocíticas (G-CSF) con fotosensibilizantes porfirínicos 35. Estas señales inflamatorias iniciarán un reclutamiento de neutrófilos, los cuales al liberar ROS y enzimas lisosomiales inducen daño en los vasos y destruyen las células tumorales. Posteriormente se produce la llegada de mastocitos, potentes mediadores de la respuesta inflamatoria, que junto a los primeros, constituyen la respuesta efectora inmune no específica. Más tarde acuden monocitos y macrófagos que eliminan los remanentes celulares tumorales, procesan los antígenos específicos del tumor y los presentan en el contexto de moléculas clase complejo mayor de histocompatibilidad tipo II (MHC II). Esto permite el reconocimiento de epítopos específicos tumorales por los linfocitos CD4, lo que a su vez lleva a la producción de clones de linfocitos T citotóxicos específicos frente al tumor 42. Todo ello inducirá una respuesta inmune específica sistémica frente al tumor, caracterizada por la síntesis de células inmunes con memoria, lo que representa una ventaja sobre otras terapias tumorales como la radioterapia, la quimioterapia o la cirugía.
APLICACIONES CLINICAS DE LA TERAPIA FOTODINAMICA CON ACIDO δ -AMINOLEVULINICO
En 1990 Kennedy et al 12 trataron con éxito 80 carcinomas basocelulares mediante TF con ALA tópico. Desde entonces las publicaciones sobre tratamientos de cáncer y precáncer cutáneo mediante TF con ALA o su derivado MAL han ido aumentando. Estos estudios han permitido establecer unas guías de aplicación de la TF tópica, como la publicada por el grupo británico de fotodermatología 26 y protocolizar el tratamiento, como ocurre con el MAL 22. A continuación se exponen los procedimientos clínicos de los dos fotosensibilizantes tópicos utilizados en dermatología, el ALA y el MAL, y posteriormente se comentarán sus aplicaciones clínicas (tabla 2).
Procedimiento clínico de la terapia fotodinámica con ácido δ -aminolevulínico tópico
Se prepara una emulsión O/W (oil/water) de ALA y se aplica sobre la lesión que se ha de tratar cubriéndolo con un apósito opaco para protegerla de la luz. La concentración de ALA más utilizada es 20 % y el tiempo de aplicación oscila entre 4-6 h aunque se han utilizado tiempos entre 3 y más de 12 h, este último especialmente en lesiones tumorales de mayor grosor. En Estados Unidos está comercializado como Levulan® Kerastick con un aplicador que permite la aplicación exacta de una solución de ALA al 20 % sobre la queratosis actínica, única indicación aprobada en este país, y la aplicación de luz tras 14-18 h de incubación 43. La lámpara utilizada en este país es de luz azul a 417 nm y la dosis de 10 J/cm 2. Sin embargo, si se quieren tratar lesiones más profundas son necesarias otras fuentes de luz que garanticen una mayor penetración, lámparas de luz roja, con una longitud de onda aproximada de 630 nm. En nuestro país también está comercializado el 5-ALA.
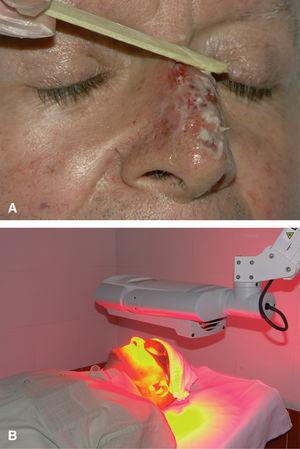
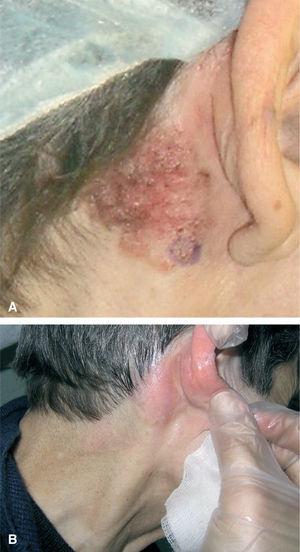
En Europa está comercializada la crema de metil-éster del 5-ALA, a una concentración de 160 mg/g (Metvix®). Las indicaciones aprobadas son queratosis actínicas y carcinoma basocelular, salvo el morfeiforme y el pigmentado. El procedimiento del tratamiento consiste en: a) raspado de la lesión eliminando la hiperqueratosis y las costras o la reducción del tumor en caso del carcinoma basocelular nodular; b) aplicación en cura oclusiva del MAL en la lesión, con 1 mm de espesor y 1 cm alrededor, dejándolo 3 h de incubación; c) limpiar el área con suero y exposición a una luz roja (630 nm) administrando una dosis de 75 J/cm 2, siendo una de las fuentes de luz más empleadas la lámpara de diodos (fig. 2). En la tabla 3 se recoge en 10 pasos el procedimiento clínico que ha de seguirse para realizar la TF dermatológica tanto con ALA como con MAL. La respuesta al tratamiento se evalúa clínicamente a los 3 meses.
Fig. 2.--A) Procedimiento de aplicación del MAL. B) Iluminación con lámpara de diodos Aktilite®.
Las principales ventajas de la TF con ALA o MAL son que no es un tratamiento invasivo, se tolera bastante bien por los pacientes, se pueden tratar varias lesiones en la misma sesión, se puede realizar el tratamiento tantas veces como sea necesario y los resultados cosméticos son excelentes independientemente del tamaño de la lesión tratada 43. La principal desventaja es la falta de confirmación histológica de curación tumoral y el dolor durante la iluminación, que se ha demostrado es menor con el MAL que con el ALA 44.
Tratamiento de cáncer y precáncer cutáneo
El uso de la TF en dermatología está aumentando en los últimos años debido a los numerosos estudios que confirman su eficacia, seguridad, comodidad y excelentes resultados cosméticos. La mayoría de estudios van dirigidos al tratamiento del cáncer y precáncer cutáneo. Actualmente las únicas indicaciones aprobadas en Europa para el uso de la TF en dermatología son las queratosis actínicas no hipertróficas y el carcinoma basocelular no morfeiforme, puesto que existen múltiples estudios que avalan su eficacia y seguridad 45.
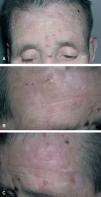
Actualmente, las queratosis actínicas representan una de las mejores indicaciones de la TF en dermatología (fig. 3). En muchos estudios clínicos los porcentajes de curación de estas lesiones oscilan del 80 al 100 % usando ALA en una concentración del 20 % 19. Una única sesión de TF con ALA fue tan eficaz como la aplicación durante 3 semanas de 5-fluorouracilo tópico en lesiones de queratosis actínicas en el dorso de las manos, aunque la comodidad del tratamiento y tolerancia de los pacientes fue mejor en el grupo tratado con TF 46. Un estudio aleatorizado multicéntrico comparó la eficacia de una única sesión de TF con MAL frente a crioterapia en queratosis actínicas no hipertróficas localizadas en la cara. Las respuestas globales en ambos grupos fueron similares (69 % TF frente a 75 % crioterapia) pero los resultados cosméticos fueron superiores en el primer grupo 47. Foley et al encontraron mayor eficacia usando dos ciclos de TF con MAL (91 % de respuestas) frente a crioterapia (68 % de respuestas) en el tratamiento de queratosis actínicas y, de nuevo, con mejores resultados cosméticos 48. En otro estudio americano, se demostró la eficacia de la TF con MAL (89 % de respuestas) frente a placebo (38 % de respuestas) evaluando la curación de las lesiones a los 3 meses y con unos resultados cosméticos excelentes en más del 90 % de los pacientes tratados con TF 49. En otro estudio se destaca el incremento en la tasa de curación de queratosis actínicas cuando se emplean dos sesiones de TF con ALA (99 % de curaciones) frente a una única sesión (77 % de curaciones) 50.
Fig. 3.--Queratosis actínicas múltiples antes (A) y tras dos sesiones con una semana de intervalo (B y C) de TF con metilaminolevulinato (Metvix®) y una dosis total de 37 J/cm 2 de luz roja (630 nm) (lámpara Aktilite®).
Aunque actualmente la TF no está aprobada para el tratamiento de la enfermedad de Bowen, existen trabajos que demuestran su utilidad. Un estudio ha comparado la eficacia de la TF con ALA frente a 5-fluorouracilo tópico en el tratamiento de la enfermedad de Bowen. Inicialmente la TF resolvió el 88 % de las lesiones frente al 67 % del grupo tratado con 5-fluorouracilo tópico, aunque tras 12 meses de seguimiento los porcentajes de curación descendieron al 82 y 48 %, respectivamente 51. Comparando la crioterapia con una única sesión de TF empleando ALA para el tratamiento de la enfermedad de Bowen, se mostró más eficaz el grupo tratado con TF (75 % de curación) que el grupo tratado con crioterapia (50 % de curación). Las molestias producidas por el tratamiento fueron menores en el grupo tratado con TF 52. En otro trabajo se concluye que el 60 % de las lesiones que se trataron una sola vez con TF usando ALA obtuvieron curación y que el porcentaje de curaciones ascendía al 80 % si se aplicaba en dos ocasiones dicho tratamiento. Los resultados cosméticos y la tolerancia de los pacientes fue buena 50.
Existen pocos estudios publicados del uso de la TF en el tratamiento del carcinoma espinocelular. Con ALA, los porcentajes de curación para los carcinomas espinocelulares superficiales oscilan del 67 al 92 % según distintas publicaciones. Cuando se tratan carcinomas espinocelulares nodulares los porcentajes de curación son del 0 al 67 % 19. Por tanto serían necesarios más estudios para poder considerar a la TF como un tratamiento seguro y eficaz en los carcinomas espinocelulares.
En cuanto al uso de la TF para el tratamiento del carcinoma basocelular, recientemente se ha aprobado en Europa su indicación con MAL, tanto del carcinoma basocelular superficial como del nodular, aunque este último precisa previamente la reducción de la masa tumoral hasta dejarla a la misma superficie de la piel adyacente para que pueda penetrar bien el MAL (fig. 4). Rhodes et al 22 compararon la eficacia de la TF con MAL frente a cirugía en el tratamiento del carcinoma basocelular nodular. Las tasas de respuesta fueron del 98 % en los tratados mediante cirugía frente al 91 % en el grupo tratado con TF. A los 12 meses de seguimiento las tasas se redujeron al 96 y 83 %, respectivamente. En otro trabajo, se compara la diferencia entre uno y dos tratamientos con TF utilizando ALA. Los porcentajes de curación fueron del 82 % en el grupo tratado con un solo ciclo de TF frente al 95 % del grupo tratado con dos sesiones, aunque de los 62 carcinomas basocelulares superficiales tratados, 11 recurrieron a los 12 meses 50.
Fig. 4.--Carcinoma basocelular antes (A) y a los 6 meses (B) de tratamiento con dos sesiones de TF con MAL e iluminación con lámpara Aktilite® (37 J/cm 2) con un intervalo de una semana entre ambas.
Se han publicado casos aislados de buena respuesta de la TF con ALA en linfomas cutáneos de células T, sobre todo micosis fungoide 19,26,53; sin embargo, son necesarios futuros estudios que permitan establecer conclusiones.
Aunque in vitro la TF con ALA es eficaz para destruir células de melanoma, los estudios en animales de experimentación no han proporcionado buenos resultados 54,55. El principal problema es que la melanina de los melanomas, cuyo espectro de absorción es entre 250 y 1.200 nm, ejerce una absorción competitiva de la luz con las porfirinas, minimizando la eficacia de la TF. Las phthalocianinas poseen un coeficiente de extinción óptica mayor que las porfirinas y han proporcionado, tanto in vitro como en el animal de experimentación, resultados prometedores en el tratamiento del melanoma 56.
Aplicaciones no oncológicas de la terapia fotodinámica en dermatología
La TF es útil en el tratamiento de enfermedades inflamatorias de la piel, así como en lesiones inducidas por virus 57. Dependiendo de la dosis y tipo de luz aplicada, los efectos citotóxicos resultan en destrucción tumoral y los efectos inmunomoduladores resultarían en mejoría de los trastornos inflamatorios 58.
Se ha demostrado la efectividad de la TF en enfermedades inflamatorias como psoriasis y acné; así como en lesiones víricas tales como condilomas o verrugas vulgares. Existen series de pacientes tratados con TF diagnosticados de fotoenvejecimiento, liquen escleroso y atrófico, esclerodermia, alopecia areata y leishmaniasis. Hay casos aislados de enfermedad de Darier, enfermedad de Haley-Haley, nevo sebáceo, sarcoidosis y liquen plano 26.
A continuación se revisarán aquellas dermatosis no oncológicas en las que existe una experiencia más amplia y/o prometedora con la TF.
Psoriasis
En 1937 Silver 59 informó de la marcada mejoría de placas psoriásicas tras la administración sistémica del derivado de hematoporfirina (DHP). Varias décadas más tarde, diversos estudios confirmaron las observaciones de Silver, utilizando DHP junto con luz visible o ultravioleta (UVA) 60-64.
Recientemente ha crecido el interés por la TF tópica en el tratamiento de la psoriasis. La combinación de ALA 10-20 % con UVA resultó en respuesta parcial y completa de lesiones psoriásicas 64. También se ha empleado ALA 10 % con exposiciones repetidas a luz de 600 a 700 nm para el tratamiento de placas crónicas de psoriasis, obteniéndose resultados similares al ditranol 65.
Los datos clínicos apoyan el potencial antipsoriásico de la TF. La citotoxicidad directa sobre los queratinocitos y los efectos inmunomoduladores pueden tener un papel importante en la reducción de las lesiones psoriásicas por TF 66.
Sin embargo, en un estudio muy reciente 67 se han incluido 29 pacientes con psoriasis en placas tratados primero con queratolíticos y posterior aplicación de ALA 1 % en gel durante 4-6 h, seguido de iluminación con luz roja (5, 10, 20 J/cm 2); tras 12 sesiones de TF se observó una reducción del PASI del 59 % con la dosis de 20 J/cm 2, pero ya se había producido una reducción del 25 % sólo con queratolíticos. Debido a la respuesta clínica insuficiente así como la frecuencia del dolor durante y después de la irradiación, no se considera, en la actualidad, a la TF como una opción adecuada para el tratamiento de la psoriasis.
Morfea
En la actualidad, los tratamientos disponibles para la esclerodermia localizada son poco satisfactorios, con eficacia limitada y/o considerables efectos secundarios. La TF con ALA, a dosis inferiores a las utilizadas para tratar tumores, parece ser un prometedor tratamiento para esta enfermedad. Se ha realizado un ensayo clínico 68 en el que se trataron 5 pacientes con morfea progresiva resistente a tratamiento convencional, en los que se aplicó ALA 3 % en forma de gel durante 6 h con posterior irradiación con Waldmann PDT 1200L (580-740 nm, 40 mW/cm 2, 10-20 J/cm 2). Los tratamientos se efectuaron 1-2 veces por semana durante 3-6 meses. En todos los pacientes, el tratamiento fue altamente satisfactorio para las placas escleróticas, según una escala clínica y la puntuación cuantitativa del Durometer. El único efecto secundario fue la hiperpigmentación transitoria de las lesiones tratadas.
El liquen escleroso y atrófico también parece responder satisfactoriamente a la TF con ALA tópico 69.
Los efectos antiescleróticos de la TF con 5-ALA observados in vivo podrían deberse a que in vitro70 se ha demostrado que el 5-ALA y la luz roja inducen la expresión de MMP 1 y 3, tanto en fibroblastos normales como de esclerodermia, reacción ésta dependiente de oxígeno singlete; además, también disminuye la expresión de ARNm de colágeno tipo I. Estos fenómenos podrían ser inducidos por las citocinas liberadas por los queratinocitos tras la TF, las cuales inducirían de forma paracrina la producción de metaloproteinasas de matriz en los fibroblastos 71.
Sarcoidosis
Existe un caso publicado 72 en el que se trató una paciente con sarcoidosis cutánea de 17 años de evolución, con ALA al 3 % en gel junto con dimetilsulfóxido al 40 % para favorecer su penetración e irradiación posterior con luz roja (580-740 nm, 40 mW/cm 2, 10-20 J/cm 2). Tras 22 sesiones de tratamiento se obtuvo una respuesta completa.
Acné
El ALA se convierte en PpIX en los folículos pilosos humanos y en las glándulas sebáceas, lo que sirvió de base para buscar los posibles beneficios de la TF con ALA en el acné. En un ensayo abierto prospectivo 73, se incluyeron 22 sujetos con acné en la espalda que fueron tratados con ALA 20 % durante 3 h junto con luz de banda ancha (550-700 nm, 150 J/cm 2). Diez pacientes fueron tratados una vez y 10 cuatro veces. Se observó mejoría clínica estadísticamente significativa durante al menos 20 semanas tras múltiples tratamientos y 10 semanas tras un único tratamiento.
En otro estudio 74 se trataron 13 pacientes que presentaban acné facial con ALA 20 % durante 4 h más luz policromática (600-700 nm, 17 W/cm 2, 13 J/cm 2). Todos los pacientes mejoraron y se redujo la aparición de nuevas lesiones de acné tras 1, 3 y 6 meses de la TF. En ambos estudios se produjeron efectos secundarios: dolor o quemazón durante el tratamiento, eritema agudo y edema, ampollas e hiperpigmentación transitoria.
En otro estudio 75 se incluyeron 10 pacientes con acné leve a moderado en espalda, se marcaron cuatro áreas a ser tratadas con TF-ALA, luz sola, ALA y control. Se aplicó crema ALA 20 % durante 3 h y se iluminó con luz roja (láser diodo 635 nm, 15 J/cm 2). Los pacientes fueron tratados tres veces por semana con un máximo de nueve tratamientos. Hubo un descenso estadísticamente significativo del recuento de lesiones inflamatorias de acné en las zonas tratadas con TF-ALA (descenso de 11,6 a 3,6). No hubo reducción de P. acnes ni de la excreción sebácea en ninguna zona, incluida la tratada con TF-ALA.
En otro ensayo clínico 76 se incluyeron 20 pacientes con acné moderado-severo de la cara, en los que se aplicó ALA 20 % (Levulan Kerastick®, Dusa Pharmaceuticals) durante 1 h e iluminación con luz intensa pulsada de banda ancha (430-1110 nm, 3-9 J/cm 2). Se redujo la media de lesiones en el 50,1 % tras 4 semanas de tratamiento, el 68,5 % 4 semanas más tarde y el 71,8 % 3 meses tras la finalización del tratamiento. La tolerancia fue buena.
Infecciones cutáneas
Lesiones víricas. Existen resultados controvertidos sobre el uso de TF en infecciones primarias y secundarias por el virus del herpes simple 77. Hoy en día, se está prestando gran atención al potencial de la TF como esterilizante sanguíneo frente a diversos microorganismos patogénicos 78. Stendler et al 79 trataron verrugas recalcitrantes con 1 o 3 sesiones de TF con ALA frente a crioterapia, hasta 4 aplicaciones en 2 meses, obteniendo tasas de curación entre el 40-73 % la primera y del 20 % la segunda. Además, estudios preliminares han mostrado su utilidad en el tratamiento de esta patología en pacientes trasplantados renales 80. También se ha utilizado la TF con ALA 10 % en gel para el tratamiento de condilomas acuminados vaginales y vulvares con tasas de curación del 66 %, similares al láser de CO2 81.
Micosis. La TF con diversos fotosensibilizantes, entre ellos la PpIX-ALA inducida, ha demostrado ser eficaz en el tratamiento de las micosis superficiales, siendo éste un tratamiento selectivo frente al hongo, sin genotoxicidad ni efectos mutagénicos, y a dosis inferiores a las utilizadas para destruir a los queratinocitos. Uno de los pocos estudios clínicos existentes utiliza TF con ALA en el tratamiento de tinea pedis (ALA 20 % y 75 J/cm 2), obteniendo un efecto terapéutico bueno aunque con rápidas recurrencias 82.
Lesiones vasculares
Orenstein et al 83 demostraron que la TF es capaz de destruir los capilares dérmicos sin afectar la epidermis, sugiriendo que éste podría ser un tratamiento más seguro que los láseres para el tratamiento de las malformaciones vasculares. Se ha utilizado el PSD-007 intravenoso, una mezcla de siete porfirinas, e irradiación con láser de 578 nm en 130 pacientes con malformaciones vasculares capilares obteniendo con un solo tratamiento una resolución completa en 37,8 % de los casos y una notable mejoría en el 53,7 % 84. También se ha utilizado el derivado de benzoporfirina intravenoso para el tratamiento de angiosarcomas cutáneos en el animal de experimentación, obteniendo una erradicación selectiva de estos tumores 85.
Como conclusión, se necesitan más estudios prospectivos controlados para establecer las indicaciones de la TF en patologías dermatológicas inflamatorias o infecciosas, basándose en el mecanismo de acción a dosis bajas, o en lesiones vasculares, utilizando fotosensibilizantes intravenosos.
Aplicaciones cosméticas de la terapia fotodinámica: el rejuvenecimiento fotodinámico
El «Rejuvenecimiento Fotodinámico» se ha convertido, sobre todo en Estados Unidos, en una técnica habitual para la prevención y tratamiento del fotoenvejecimiento. Los signos visibles del fotoenvejecimiento son la aparición de hiperpigmentaciones, telangiectasias, arrugas superficiales, pérdida de elasticidad de la piel y, en algunos casos, la aparición de queratosis actínicas. La luz pulsada intensa (IPL) ha demostrado su eficacia en el tratamiento de todos esos signos de envejecimiento, excepto en las queratosis actínicas.
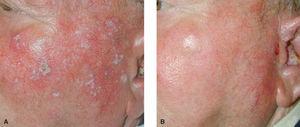
En un estudio se utilizó IPL como fuente de luz para realizar TF en pacientes que iban a realizar fotorrejuvenecimiento y que presentaban queratosis actínicas 86. Los autores realizaron dos tratamientos usando ALA al 20 % sobre las queratosis actínicas, durante 4 h, e irradiación posterior con IPL de toda la piel de la cara. Se utilizó un filtro de 615 nm para incluir los dos últimos picos de absorción de la PpIX y conseguir así mayor penetración. Los resultados fueron de una eliminación de 34 queratosis actínicas de un total de 38, en 17 pacientes, con un seguimiento de 3 meses (fig. 5). La técnica fue muy bien tolerada, con eritema y formación de costra en la región de la queratosis actínica que se resolvió en una semana. Los resultados estéticos fueron excelentes, sin cambios en la pigmentación ni formación de cicatriz. Los autores denominaron a la técnica «rejuvenecimiento fotodinámico».
Fig. 5.--Paciente con daño actínico intenso antes (A) y a los 3 meses (B) de dos sesiones de TF con ALA 20 % e IPL, con un intervalo de un mes entre ambas.
Otros autores 87 posteriormente comenzaron a utilizar ALA no sólo en la zona de la queratosis actínica sino en toda la cara aumentando así la mayor mejoría de los signos de envejecimiento. Alster et al 88 realizaron un estudio comparativo en 10 pacientes con fotoenvejecimiento leve-moderado utilizando IPL en una hemicara frente a ALA-IPL en la otra. Este trabajo demostró que la combinación ALA-IPL es segura y más efectiva en el tratamiento del fotoenvejecimiento que sólo IPL. Marmur et al 89 realizaron el primer estudio ultraestructural, demostrando un incremento del colágeno tipo I en pacientes tratados con IPL sólo y con ALA-IPL, pero con un mayor incremento de este colágeno en estos últimos.
En relación al tiempo de incubación del ALA todavía no existe un protocolo estandarizado, pero la tendencia actual es a acortarlo a 1 h en los casos de rejuvenecimiento.
En conclusión podemos afirmar que el ALA-IPL es una técnica efectiva, simple y bien tolerada para el rejuvenecimiento de la piel. ALA-IPL obtiene mejores resultados que sólo IPL. El «rejuvenecimiento fotodinámico» puede tener un papel importante en la profilaxis del cáncer de piel no melanoma en pacientes que, por su fototipo y su exposición solar previa, sean propensos a padecerlo. El uso de nuevas fuentes de luz y nuevos fotosensibilizantes puede aumentar, en el futuro, la eficacia de esta técnica.
EVALUACION NO INVASIVA IN VIVO DE LA TERAPIA FOTODINAMICA EN LESIONES NEOPLASICAS
Uno de los inconvenientes de la TF frente al tratamiento quirúrgico de los tumores es la ausencia de un tejido histológico que permita establecer la desaparición completa de la lesión tras el tratamiento. Considerando por otro lado, que una de las mayores ventajas de la TF es precisamente su excelente resultado cosmético, sin cicatrices, se han utilizado dos técnicas no invasivas para evaluar su efectividad: el diagnóstico por fluorescencia o diagnóstico fotodinámico, que permite una evaluación macroscópica y de superficie de la tumoración; y la microscopia confocal, que proporciona un control microscópico y en profundidad de la misma.
Evaluación macroscópica: diagnóstico por fluorescencia
Desde el desarrollo de un sistema de luz ultravioleta filtrada muchas han sido sus aplicaciones en diferentes campos de la medicina debido a la capacidad de ciertas sustancias de emitir fluorescencia de diferentes colores al ser expuestas a dicho estímulo. Hasta la fecha, las indicaciones clásicas de la luz ultravioleta en dermatología han sido la identificación de alteraciones de la pigmentación, el diagnóstico de infecciones fúngicas y la detección de porfirinas 90. Es en esta última indicación, gracias al advenimiento de la TF, en la que la luz ultravioleta se está convirtiendo en una ayuda inestimable en el diagnóstico y seguimiento no invasivos del carcinoma basocelular.
Actualmente, como se ha comentado previamente, los fotosensibilizantes que se emplean son el ALA y el MAL. Este último induce una acumulación más selectiva de porfirinas fotoactivas en el tejido neoplásico. De hecho, como claro inconveniente del ALA se ha citado su escasa especificidad, no observándose en algunos trabajos diferencias en la intensidad de fluorescencia entre el epitelio displásico y el normal 91.
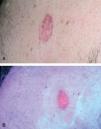
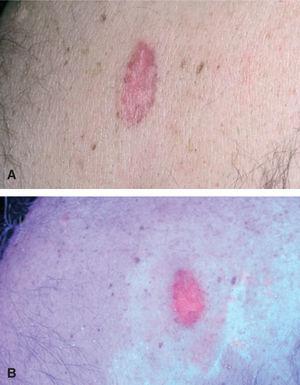
Una vez el fotosensibilizante induce la acumulación selectiva de PpIX en el tejido neoplásico de modo paulatino, emite una fluorescencia roja característica cuando se expone a luz ultravioleta. Esta fluorescencia permite una clara delimitación del tejido tumoral e inflamatorio del tejido sano circundante (figs. 6A y 6B). La determinación de la fluorescencia y su distribución espacial y temporal in vivo muestran correlación en estudios histológicos con la cantidad de PpIX presente en el tejido dañado. De esta manera podemos afirmar que la intensidad de fluorescencia se correlaciona positivamente con la cantidad de PpIX presente en el tejido tumoral, con diferencia estadísticamente significativa respecto a la cantidad de PpIX presente en el tejido perilesional 92.
Fig. 6.--A) Epitelioma basocelular superficial. B) Fluorescencia roja característica cuando el carcinoma basocelular se expone a luz ultravioleta, a las 4 h de la aplicación del fotosensibilizante (Me-ALA). (Fotografía cortesía del Dr. Antonio Harto. Hospital Ramón y Cajal.)
Según distintos autores, la máxima acumulación de PpIX y, por tanto, la mayor intensidad de fluorescencia en el tejido neoplásico, tiene lugar de 3 a 6 h tras la aplicación tópica del fotosensibilizante 93. Es en este rango de tiempo cuando el diagnóstico de carcinoma basocelular y su delimitación con el tejido sano mediante luz ultravioleta será más eficaz y específico.
Esta técnica permite, por tanto, detectar el carcinoma basocelular en estadios muy iniciales, delimitar su extensión, evaluar la respuesta a diversos tratamientos químicos, físicos o quirúrgicos y diagnosticar una posible recidiva o respuesta incompleta a la terapia. La fluorescencia debe desaparecer si la lesión ha sido correctamente eliminada. En este último punto consideramos de vital importancia la realización de fotografías de la fluorescencia emitida con tal de contar con un registro gráfico de la extensión del carcinoma basocelular en ese momento y permitir así su seguimiento en el futuro, bien para establecer su curación tras la aplicación de cualquier técnica terapéutica o para diagnosticar la persistencia del carcinoma 94,95.
Actualmente contamos con la posibilidad de realizar dichas fotografías con cámaras digitales a las que se adaptan flashes emisores de luz ultravioleta, pudiéndose observar los resultados de forma inmediata y en color, indispensable para la observación de los cambios cromáticos inducidos por la fluorescencia. Las cámaras digitales permiten trabajar sin la necesidad de estar totalmente a oscuras, dada la intensidad de la fuente de luz ultravioleta que utilizamos mediante flashes. Las fotografías pueden visualizarse de forma inmediata y archivarse mediante programas específicos, para poder comparar su evolución 95.
Como es evidente, la limitación de la técnica es que no aporta información alguna sobre la profundidad de la lesión, sino sólo sobre la extensión superficial de la misma. A pesar de ello, puede ser de gran ayuda en técnicas como la cirugía de Mohs, especialmente si se combina con la microscopia confocal 96.
Evaluación microscópica: la microscopia confocalin vivo
La microscopia confocal escaneada con láser de reflectancia in vivo (MCR) es una de las tecnologías más prometedoras y mejor documentadas para la evaluación microscópica no invasiva de la piel, con una resolución comparable a la histología convencional 97; sin embargo, esta técnica no requiere procesamiento del tejido permitiendo la visualización dinámica de los cambios en la microanatomía cutánea in vivo y durante un tiempo ilimitado 98-102.
Los primeros estudios con MCR se realizaron para describir las características de la piel sana 97,98. Posteriormente se han ido describiendo las características de otros muchos procesos cutáneos como angiomas 100, dermatitis de contacto 102-104, psoriasis 105, infecciones bacterianas 106 y fúngicas 107 y, por supuesto, patología tumoral cutánea, como el carcinoma basocelular 108-110, el melanoma 111-113, las queratosis actínica y el carcinoma espinocelular 114. En este sentido la MCR ha demostrado ser una buena herramienta para el diagnóstico no invasivo y el seguimiento del tratamiento del cáncer y precáncer cutáneo, y en concreto de la efectividad de la TF.
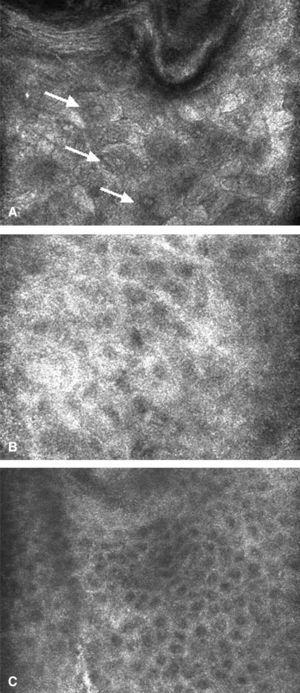
Nuestro grupo ha estudiado la utilidad de la MCR para evaluar la respuesta de las queratosis actínicas a la TF con 5-ALA, así como para describir los cambios histopatológicos que en dicho tratamiento se producen. La MCR demostró una progresión desde la hiperqueratósica paraqueratósica y el pleomorfismo y desarreglo arquitectural epidérmico típico de la queratosis actínica, antes de la TF (fig. 7A), a la apariencia monomorfa del patrón en panal de abejas típico de la piel normal, tras varias semanas del tratamiento (fig. 7C), pasando por la presencia de queratinocitos necróticos e inflamación, inmediatamente tras el tratamiento. Estos hallazgos se correlacionaron perfectamente con la histología convencional de las muestras obtenidas por biopsia de las áreas tratadas.
Fig. 7.--MCR de queratosis actínica. A) Corte virtual a nivel superficial que ilustra la presencia de corneocitos nucleados (flechas) hiperqueratosis paraqueratósica. B) Corte virtual a nivel del estrato espinoso que demuestra pleomorfismo y desorganización de arquitectura epidérmica. C) MCR de queratosis actínica a las 4 semanas de tratamiento con TF con 5-ALA demostrando una reorganización arquitectural de la epidermis.
Este estudio demuestra el potencial de la MCR para la evaluación microscópica no invasiva in vivo de la TF; el principal inconveniente es que en la actualidad se trata de una técnica experimental, al alcance de muy pocos centros.
EFECTOS ADVERSOS DE LA TERAPIA FOTODINAMICA EN DERMATOLOGIA
En general, la TF tiene pocos efectos adversos comparada con otros tratamientos utilizados en el cáncer.
Efectos adversos locales
El más frecuente y relevante es la sensación de quemazón, dolor, durante la exposición a la luz. Estas molestias comienzan unos minutos tras el inicio de la misma y desaparecen al poco de su finalización. Hay que decir que su aparición depende de la zona que se trata el cuero cabelludo, la nariz o los pabellones auriculares son zonas en las que los pacientes refieren más dolor, pero no cabe duda de que existe una gran variabilidad individual. En cuanto a la causa de este dolor se piensa que pueda ser por una despolarización fototóxica en las fibras nociceptivas aferentes 58. Entre los métodos para aliviar este dolor están la aplicación de ventiladores o agua fría durante la iluminación, el fraccionamiento de la dosis luz, lo que a su vez quizás aumente la efectividad del tratamiento ya que permite la oxigenación de los tejidos durante el tiempo de oscuridad, o la administración de algún analgésico oral o anestesia local previa a la iluminación; la aplicación de EMLA está contraindicada.
La aparición de eritema y un moderado edema son frecuentes tras la iluminación y no suelen requerir tratamiento. En las lesiones tratadas suelen aparecer algunas costras o descamación seguido de curación entre las 2 y 8 semanas siguientes 58. La aparición de ampollas, intensa necrosis o ulceración son excepcionales y pueden ser signos de una sobredosis de luz.
Fotosensibilidad cutánea
La fotosensibilidad cutánea generalizada u ocular durante varios días o semanas es el efecto adverso más importante de la TF con fotosensibilizantes sistémicos. Esta fotosensibilidad está en el rango de la luz visible, por lo que los fotoprotectores convencionales no suelen proporcionar gran protección. Los pacientes deben, por tanto, permanecer en su casa, debiendo hacer la reexposición a la luz del sol de forma gradual 115.
La fotosensibilidad cutánea local tras la TF con ALA o MAL también existe, pero tan sólo en la zona de aplicación de la crema y dura 24-48 h, por lo que se recomienda a los pacientes llevar la zona tratada cubierta con un apósito durante ese tiempo.
Otros efectos adversos
La TF tiene un excelente resultado cosmético. Sin embargo, en algún caso puede dejar una hipopigmentación o hiperpigmentación que, afortunadamente, suele resolverse en unos meses.
Aunque son excepcionales, pueden ocurrir reacciones alérgicas frente al ALA o el MAL 116,117. Además, se ha comunicado un caso de melanoma aparecido en la zona de tratamiento con TF con ALA de una queratosis actínica y una enfermedad de Bowen; de momento, al ser sólo un caso es difícil determinar se existe una relación causa-efecto o se trata sólo de una coincidencia 118.
En el caso de los fotosensibilizantes sistémicos pueden presentarse múltiples efectos adversos como náuseas, vómitos, diarreas, cefalea, prurito, o síntomas de toxicidad hepática o neurológica, esto último, en concreto, puede ocurrir por la administración oral de ALA 58.
FUTURO DE LA TERAPIA FOTODINAMICA EN DERMATOLOGIA
La TF tiene un prometedor futuro. Durante años hemos esperado que la TF abandonara los laboratorios y formara parte de nuestra práctica clínica diaria. Un tratamiento con excelentes tasas de curación en oncología cutánea, pero también de utilidad en el ámbito cosmético. Una técnica con esperanzadores resultados en patologías inflamatorias y una novedosa forma de tratar las infecciones sin crear resistencias antibióticas.
En la actualidad, la principal limitación está en su capacidad para tratar lesiones cutáneas profundas. La aparición de fotosensibilizantes que se exciten en una mayor longitud de onda, como el ya comentado ATX-S10 (Na), o nuevos vehículos (liposomas, adenovirus, anticuerpos monoclonales conjugados con el fotosensibilizante, etc.)30 que permitan una mayor penetración en la piel podrán permitir, en el futuro, el tratamiento efectivo de estas lesiones. En el caso de la TF con ALA, el uso de quelantes del hierro, como el CP94 (1,2-dietil-3-hidroxipiridina-4-1), que aumentan la cantidad acumulada de PpIX, o permitir la reoxigenación de las células hipóxicas tumorales mediante el fraccionamiento de la iluminación podrían mejorar la eficacia de este tratamiento 119. Por último, es posible que la combinación de varios fotosensibilizantes que actúen sobre diferentes dianas celulares, sea una vía para aumentar el efecto fotodinámico y, por tanto, la efectividad de la TF.
Pero además, la TF se puede administrar en adyuvancia con otros tratamientos. La TF realizada inmediatamente tras la resección de un tumor podría ayudar a la erradicación de las células malignas residuales; por otro lado, aplicada antes de la cirugía puede disminuir el tamaño del tumor y que la resección sea menos mutilante 58. Por último, puede utilizarse como técnica paliativa en aquellos casos en que la edad y condiciones del paciente no permitan el uso de procedimientos más agresivos.
En conclusión, la TF es hoy ya una opción terapéutica muy ventajosa para tratar a muchos de nuestros pacientes, pero todavía muchas de sus posibles aplicaciones clínicas son experimentales. La realización de ensayos clínicos y la continua investigación básica permitirán aumentar sus indicaciones clínicas dermatológicas y mejorar su efectividad en las ya existentes.
FE DE ERRORES
En el artículo titulado «Tratamiento de linfomas cutáneos de células T con bexaroteno» publicado en Actas Dermosifiliogr. 2005;96(10):669-73, apareció por error en la página 671 referenciada la tabla 3, cuando la referencia correcta es la que aparecía en la página 672.
Correspondencia:
Yolanda Gilaberte. Hospital General San Jorge.
Sección de Dermatología.
Avda. Martínez de Velasco, 34. 22004 Huesca. España.
ygilaberte@salud.aragon.es
Recibido el 13 de octubre de 2005.
Aceptado el 21 de febrero de 2006.