El síndrome de hipersensibilidad inducido por fármacos (DIHS) se engloba dentro de los cuadros toxicodérmicos con afectación sistémica, cuya sospecha obliga a la retirada lo más precoz posible del fármaco que consideremos pueda estar implicado, que puede haber sido introducido hasta tres meses antes.
Es importante el despistaje de la reactivación del virus herpes humano (VHH) 6, tanto por su valor diagnóstico como por el pronóstico de gravedad que supone. Por otro lado, esta reactivación no contraindica que el tratamiento pueda llevarse a cabo con corticoides sistémicos, que además, deberán retirarse lentamente para evitar recaídas. Debería pensarse asimismo en la posibilidad de la presencia de anticuerpos antifofolipídicos en los casos en que apareciera trombopenia, alteración en la hemostasia o cuadros trombóticos asociados, como también tener en cuenta el desarrollo de procesos autoinmunes como secuela del cuadro, que requiere de monitorización y seguimiento a medio-largo plazo, a pesar de la resolución completa del cuadro.
Describimos un nuevo caso donde se muestra la reactivación del VHH-6, la activación de anticuerpos anticardiolipina y la inducción de anticuerpos anti-tiroperoxidasa (anti-TPO).
Drug-induced hypersensitivity syndrome is a toxicoderma with systemic involvement. Suspicion of this disorder obliges rapid withdrawal of the suspected drug, which may have been introduced up to 3 months earlier. Screening for human herpesvirus (HHV) 6 reactivation is important both for its diagnostic value and for its association with a poor prognosis. Reactivation of this virus is not a contraindication for systemic corticosteroid treatment, which should be tapered slowly in order to avoid recurrence. The possible appearance of antiphospholipid antibodies must also be considered in those cases associated with thrombocytopenia, altered hemostasis, or thrombotic events. Autoimmune disorders may also develop as a sequela of the condition. Medium-to-long-term follow-up is required even after complete resolution of the condition. We describe a new case of sulfasalazine-induced hypersensitivity syndrome associated with HHV-6 reactivation and the induction of anticardiolipin and anti-thyroid peroxidase antibodies.
El síndrome de hipersensibilidad inducido por fármacos (DIHS), conocido también como reacción a fármacos con eosinofilia y síntomas sistémicos (DRESS)1 o hipersensibilidad multiorgánica retardada inducida por fármacos (DIDMOHS)2, es un síndrome que se engloba dentro de los cuadros de hipersensibilidad a fármacos que debe sospecharse ante todo paciente que presente fiebre, exantema, hepatitis, linfadenopatías, leucocitosis con o sin eosinofilia y antecedente de la toma de un fármaco concreto entre dos semanas y tres meses antes de comenzar con los síntomas del cuadro (tabla 1).
Criterios diagnósticos para el síndrome de hipersensibilidad inducido por fármacos
| 1. Exantema eritemato-morbiliforme tras 3 semanas de inicio con una nueva medicación |
| 2. La persistencia de los síntomas un mínimo de dos semanas tras la retirada de la medicación |
| 3. Fiebre (> 38°C) |
| 4. Alteraciones hepáticas (GPT > 100 U/l), renales o pulmonares |
| 5. Alteraciones de la serie blanca: leucocitosis (> 11.000/mm3), linfocitosis atípica (> 5%) y/o eosinofilia (> 1.500/mm3) |
| 6. Linfadenopatías |
| 7. Reactivación del virus humano herpes 6 |
*El diagnóstico se confirma por la presencia de estos criterios (DIHS típico) o con 5 de ellos (1-5) (DIHS atípico).
Tomada de Shiohara T et al9.
La implicación del virus herpes humano (VHH)6ha sido descrita por diferentes grupos de trabajo, e incluso se consideró un factor de riesgo para desarrollar un cuadro severo3. Esta relación de la reactivación del VHH-6 con la severidad del cuadro hizo considerarla dentro de los criterios diagnósticos4.
Por otro lado, también en estos cuadros se ha observado la activación de anticuerpos antifosfolípido5 y anti-tiroperoxidasa (anti-TPO)6, aunque se desconoce su incidencia en la gravedad y no se incluye en el diagnóstico.
Presentamos el caso de un paciente diagnosticado de DIHS en el que pudimos demostrar la reactivación del VHH-6 y la presencia de anticuerpos antifosfolípido.
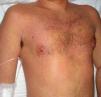
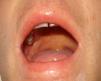
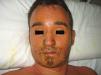
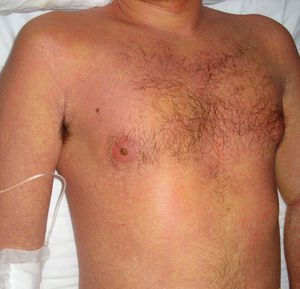
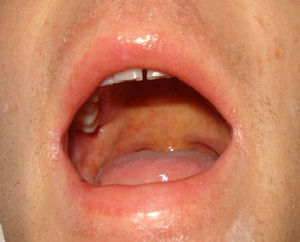
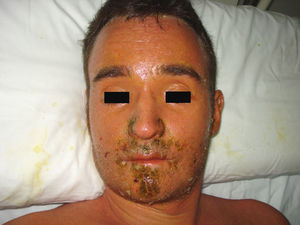
Caso clínicoSe trata de un varón de 27 años que ingresó en nuestro centro remitido desde otro hospital ante la sospecha de un síndrome linfoproliferativo agudo. Como único antecedente personal relevante refería la toma de sulfasalazina desde hacía un mes por una condromalacia rotuliana. En el momento del ingreso presentaba fiebre de 40°C, un exantema máculo-papular confluente sin signo de Nikolsky (fig. 1), dispepsia, vómitos biliares y faringoamigdalitis con exudado blanquecino, un enantema purpúrico en el paladar blando (fig. 2) y una lengua depapilada de una semana de evolución. Por este proceso había recibido tratamiento antibiótico con cefuroxima y paracetamol desde hacía una semana sin mejoría. A la exploración se objetivó hepatoesplenomegalia, ictericia de mucosas (fig. 3) y edema purpúrico distal de los miembros inferiores y superiores, así como adenopatías laterocervicales e inguinales, de unos 2-3cm, móviles y dolorosas. Las pruebas de laboratorio revelaron una leucocitosis de 34.700/mcl con desviación izquierda, neutrófilos de 14.650/mcl, linfocitos 12.750/mcl, hemoglobina 12,5g/dl, plaquetas 384 x 109/l, TP 20,1 seg, Quick 58%, proteínas totales 4,6g/dl, urea 90mg/dl, creatinina 1,55mg/dl, Na 126 mEq/l, K 5,5 mEq/l, bilirrubina 10,1mg/dl, GOT/GPT 628/521 UI/l y LDH 2219 UI/l. No se detectó eosinofilia.
Enantema de Nagayama. Enantema purpúrico en el paladar blando y la base de la úvula, característico de la infección por VHH-610.
El estudio de hormonas tiroideas reveló una T4 libre de 1,01 ng/dl y una TSH de 0,066 mUI/l. La detección de anticuerpos anti-TPO fue de 0,3 UI/ml.
El estudio por citometría no mostró alteración, sugiriendo un origen reactivo del cuadro.
En la biopsia cutánea se observó en la epidermis la presencia de algún queratinocito necrótico con degeneración vacuolada de la capa basal, y en la dermis superficial la presencia de infiltrados inflamatorios de predominio linfoide, compatible con toxicodermia. En la tomografía axial computarizada de cuello, torácica, abdominal y pélvica se objetivaron múltiples adenopatías bilaterales.
Se realizó una serología por el método de ELISA para VEB (VCA), VHS, CMV, VHA, VHB, VHC, parvovirus B19, sarampión, toxoplasma, Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci, Coxiella burnetti, Legionella, Mycoplasma pneumoniae y VIH. Resultó positivo la IgG de CMV, VEB (VCA) y la IgM y la IgG del VHH-6. Posteriormente se observó la positividad de anticuerpos anticardiolipina-IgM.
En este contexto, y con el antecedente de la toma de sulfasalazina, se diagnosticó de DIHS y se inició tratamiento con metilprednisolona intravenosa a dosis de 1mg/kg/día. La suspensión progresiva del fármaco tras la reducción de la dosis, una vez comprobada una marcada mejoría inicial, condicionó la reaparición del proceso, por lo que se decidió la reinstauración de las dosis previas y un descenso más paulatino de las mismas.
En un control al cabo de 12 semanas el paciente se encontraba con un marcado efluvio telogénico, aunque por lo demás asintomático. Se titularon los niveles de anticardiolipina IgG e IgM, encontrándose ambos dentro de los valores normales. No así el estudio tiroideo, siendo la T4 libre de 0,41 ng/dl, la TSH de 144,952 mU/l y los anticuerpos anti-TPO de 57,36 U/ml.
DiscusiónPresentamos un caso de DIHS, un cuadro toxicodérmico grave y poco frecuente, cuya etiopatogenia y pronóstico está asociado con la reactivación del VHH-64, que en algunos de estos pacientes puede provocar la inducción transitoria de anticuerpos anticardiolipina y, en ocasiones, un síndrome antifosfolípido5. También es relativamente frecuente la aparición posterior de cuadros autoinmunes tras periodos asintomáticos7.
La severidad de la clínica está relacionada con el tiempo de exposición al fármaco una vez se ha iniciado el cuadro8 (tabla 2). Recientemente también se ha incluido la reactivación del VHH-6 dentro de los criterios diagnósticos9 (tabla 1), relacionándose con la severidad del cuadro, ya que en algunas series se asociaba con la prolongación del cuadro febril, asociado a la gravedad del cuadro de hepatitis o de fallo renal, y siendo un hallazgo corriente en los casos de desenlace fatal3,4. Nuestro caso presentaba además lesiones pápulo-eritematosas en el paladar blando y la base de la úvula (fig. 2), conocido como enantema de Nagayama, que se observa hasta en un 65% de pacientes con infección por VHH-6. Aunque muchos pediatras lo utilizan como marcador de infección precoz, su especificidad y valor predictivo siguen siendo controvertidos10.
Fármacos descritos hasta la actualidad como causantes de DIHS
| Anticonvulsivantes |
| Carbamazepina, fenitoína, fenobarbital, lamotrigina, zonisamida |
| Alopurinol |
| Dapsona |
| Antimicrobianos |
| Minociclina y doxiciclina, vancomicina, trimetoprim-sulfometoxazol, betalactámicos, metronidazol, carbapenem, abacavir y nevirapina |
| Salazosulfapiridina |
| Espironolactona |
| Carbimazol |
| Fluindiona |
| AINE |
| Bloqueadores beta |
| IECA |
| Talidomida |
| Ranitidina |
| Metildopa |
| Calcio-antagonistas |
| Quinina |
| Eritropoyetina alfa |
| Bupropión |
| Terapia biológica: |
| Imatinib, efalizumab |
Por otro lado, se ha descrito el posible papel patogénico de este virus en la inducción de un síndrome antifosfolípido5,11. En muchos casos, como en el presentado, la presencia de estos anticuerpos es transitoria y desaparecían al cabo de dos a tres meses11. En nuestro paciente, a pesar de no haber podido encontrar una clínica de trombosis compatible con este síndrome, sí que se detectaron estos anticuerpos al comienzo del cuadro. Es por ello que propugnamos la solicitud de los anticuerpos anticardiolipina, ANA y ENA, así como marcadores de hemostasia para el control en la evolución de esta dermatosis.
Es importante reseñar que con relativa frecuencia se pueden desarrollar enfermedades autoinmunes tras la resolución del cuadro agudo, asociadas en su patogenia con la disfunción de linfocitos T supresores, la activación y proliferación de linfocitos T citotóxicos y la aparición de autoanticuerpos, sobre todo si es precedido de la reactivación viral7. En particular, la función tiroidea debe ser monitorizada hasta meses después de resolverse el cuadro, ya que suele ser asintomático en su fase inicial, pero con una inducción precoz de anticuerpos anti-TPO, aumento progresivo de la TSH y descenso de la T4 libre, compatibles con un hipotiroidismo severo6.
El tratamiento de elección, además de la supresión del fármaco implicado, consiste en corticoides administrados por vía sistémica. Sin embargo, el DIHS puede ser fatal hasta en un 20% de los casos12. A pesar de la controversia que pudiera surgir del uso de la corticoterapia considerando la posible implicación viral, los casos descritos en la literatura tienen una evolución favorable tras la instauración de este tratamiento4,13. También debería enfatizarse el hecho de que, como en nuestro caso, hay que prestar especial atención a la bajada progresiva y paulatina de la dosis de corticoides para prevenir potenciales recidivas14,15.
Así, ante la sospecha de DIHS debe procederse a la retirada lo más precoz posible del fármaco que consideremos pueda estar implicado. Además, este puede haberse introducido hasta tres meses antes de iniciarse el proceso. Es importante también realizar el despistaje de la reactivación VHH-6, ya que aparte de ser un criterio diagnóstico tiene valor pronóstico. Por otro lado, esta reactivación no sólo no contraindica el tratamiento con corticoides sistémicos, sino que, de hecho, representan el tratamiento de elección, y además deben retirarse lentamente para evitar recaídas. Por otro lado, deberíamos pensar en la posibilidad de la presencia de anticuerpos antifofolipídicos en los casos en que apareciera trombopenia, alteración en la hemostasia o cuadros trombóticos asociados. Finalmente, no puede olvidarse el desarrollo de procesos de naturaleza autoinmune como secuela del cuadro, que requiere de monitorización y seguimiento a medio-largo plazo, a pesar de su resolución completa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.