El síndrome hipereosinofílico (SHE) se define por la presencia de una eosinofilia en sangre periférica superior a 1.500 cél/μL acompañada de un daño o una disfunción orgánica no atribuible a otras causas1–4.
Dentro de los SHE se encuentra la forma linfoproliferativa (SHE-L), en la que existe una población anormal de linfocitos T (LT) en sangre periférica, con un reordenamiento clonal del receptor de células T (TCR), que producen citocinas eosinofilopoyéticas. Por ello, a diferencia de la variante mieloproliferativa de carácter clonal, el SHE-L es una mezcla entre un proceso clonal (LT clonales) y reactivo (la eosinofilia deriva de la secreción de citocinas de estos LT)1,2,4–6.
El estrecho seguimiento de estos pacientes es esencial, pues un 10-20% pueden progresar a un linfoma cutáneo de células T (LCCT) de muy mal pronóstico7,8. Distinguir ambas entidades es imperativo, debido a la evolución indolente que suelen presentar los pacientes con SHE-L frente al peor pronóstico del LCCT.
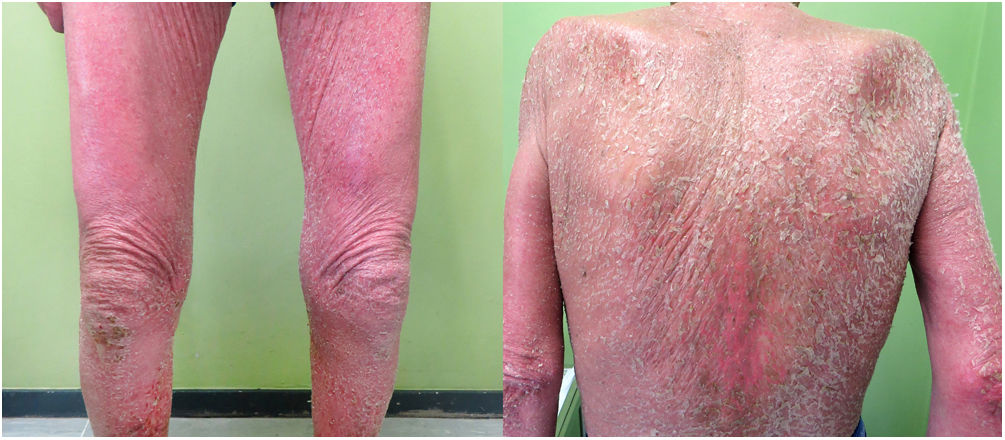
Un varón de 67 años consultó por un cuadro de tres meses de evolución de poliartralgias, múltiples infiltrados pulmonares bilaterales de carácter migratorio, una erupción cutánea maculopapular generalizada muy pruriginosa y un síndrome constitucional con astenia, anorexia y pérdida ponderal (fig. 1).
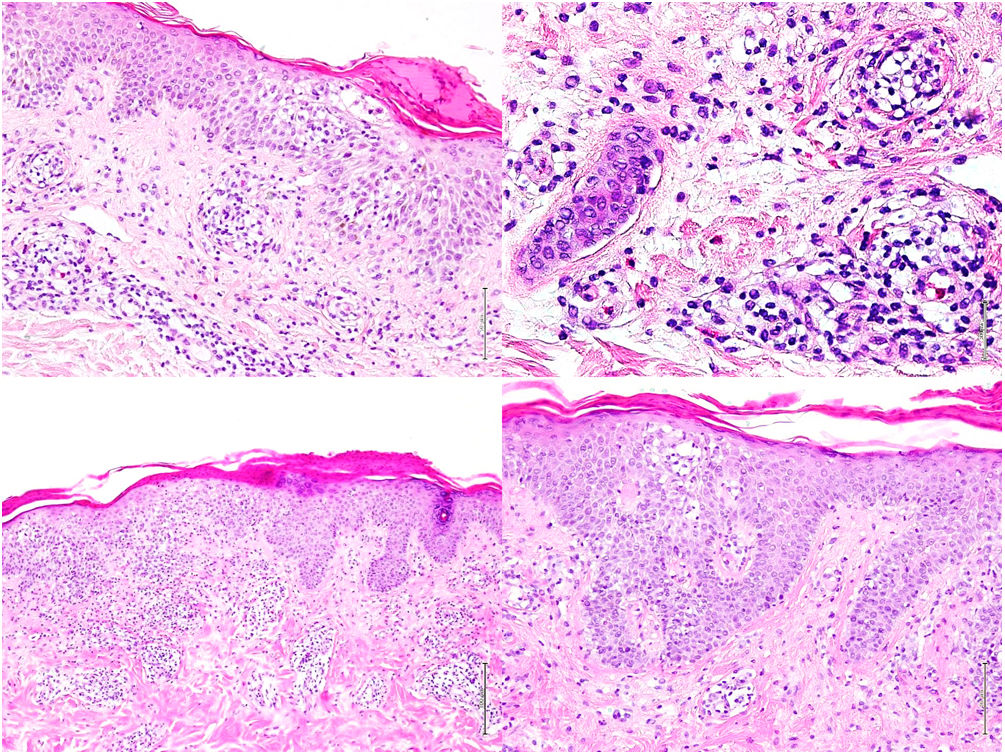
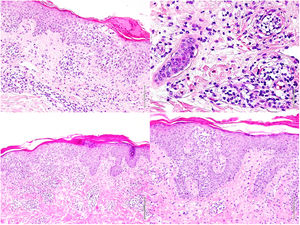
La analítica mostró una leucocitosis de 58.600/μL con neutrofilia de 11.100/μL y una eosinofilia de 44.100/μL, con reactantes de fase aguda elevados (PCR: 147,5 mg/L, VSG: 46 mm/h, LDH: 335 U/L). El estudio de orina, alergias, ecocardiograma, autoinmunidad, serologías y parásitos fue negativo. Se descartó la mutación FIP1L1-PDGFRA mediante la realización de una hibridación fluorescente in situ (FISH) en sangre periférica. El estudio de médula ósea demostró un aumento de eosinófilos con un elevado porcentaje de linfocitos con inmunofenotipo atípico (CD3−, CD4− y CD8−). El estudio histológico de una biopsia en sacabocados reveló una dermatitis espongiótica con eosinófilos y afectación folicular (fig. 2).
Biopsias cutáneas. Imágenes superiores (1° Biopsia): Epidermis con marcada espongiosis, exocitosis de celularidad inflamatoria formando vesículas intraepidérmicas y focos de paraqueratosis con un infiltrado inflamatorio perivascular e intersticial constituido por linfocitos y numerosos eosinófilos. Imágenes inferiores (2° Biopsia): Epidermis con moderada acantosis y paraqueratosis focal. En dermis papilar se observa un infiltrado linfoide con marcado epidermotropismo y formación de un microabsceso de Pautrier.
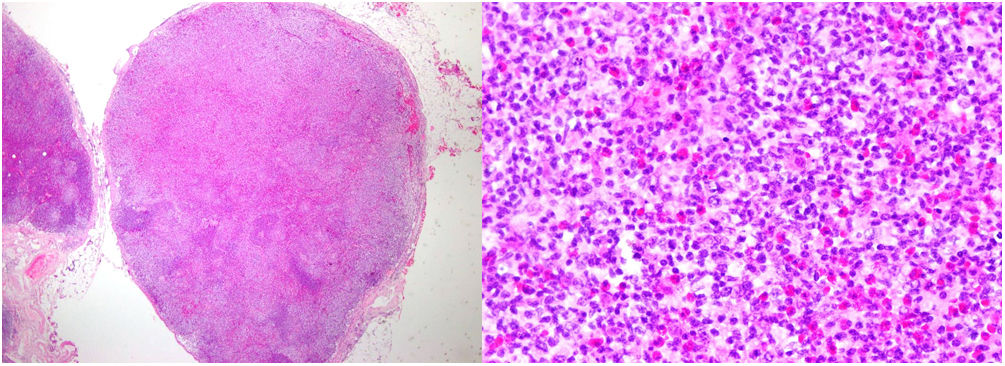
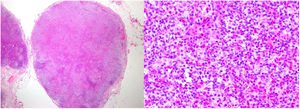
Con estos resultados se sospechó la presencia de un SHE-L y se administró prednisona 60 mg/24 h, hidroxiurea 500 mg/24 h y metotrexato 20 mg/semana. Un mes después el paciente presentó un empeoramiento manifiesto, con la aparición de macroadenopatías inguinales derechas. Una nueva biopsia cutánea (fig. 2) mostró un infiltrado linfoide T con epidermotropismo y abundantes eosinófilos y una biopsia ganglionar reveló una pérdida completa de la arquitectura (fig. 3). Estas células fueron positivas para CD3, CD4 y CD5, con pérdida de CD7 y negatividad para CD8, CD20 y CD30, presentando una monoclonalidad para TCR beta y gamma. Asimismo, se descartó la presencia de células de Sézary en sangre periférica, así como una afectación sistémica. Con estos datos el diagnóstico fue de una micosis fungoide eritrodérmica con afectación ganglionar (estadio IVA2). Acorde con el diagnóstico, se administró prednisona 45 mg/24 h, interferón alfa 2a 3 MUI (3 inyecciones semanales), bexaroteno 300 mg/24 h y metotrexato 20 mg semanal. Debido a la pobre respuesta terapéutica y con la sospecha de un síndrome de Sézary subyacente, se reevaluó el fenotipo linfoide y la presencia de células de Sézary, con resultado de un 2,2% de LT atípicos y un cociente CD4/CD8 de 9,09, siendo un 5% positivos para CD3, CD2, CD5 y negativos para CD7, CD4, CD8 y CD26 y una eosinofilia de 62% en la citometría de flujo. El diagnóstico final fue de síndrome de Sézary (estadio IVA2). Se programó inicio de quimioterapia con esquema CHOP, falleciendo el paciente a los cuatro días del inicio.
El análisis del caso cuestiona si el paciente padecía un LCCT desde el inicio y la hipereosinofilia era reactiva a esta entidad o si fue una mala evolución de un SHE-L. Mediante el análisis del transcriptoma se han determinado biomarcadores específicos de cada entidad en algunos estudios, lo que permitiría distinguir ambas entidades precozmente6,9. Nuestra impresión es que el caso presentado, probablemente, fuera un síndrome de Sézary desde un inicio y la hipereosinofilia fuera reactiva y se manifestara como un SHE-L.
La eosinofilia tiene un importante papel pronóstico en los LCCT, reduciéndose la mediana de supervivencia global en tres años en pacientes con más de 700/μL eosinófilos. Hay autores que han considerado a la eosinofilia al diagnóstico la única variable pronóstica asociada a progresión de la enfermedad y a muerte relacionada con la enfermedad10. Además, los eosinófilos podrían ser un marcador indirecto de la carga tumoral, ya que su nivel aumenta debido a la síntesis de citocinas eosinofilopoyéticas por parte de las células neoplásicas y, por tanto, podrían ser útiles como marcadores de respuesta al tratamiento antitumoral. La realización de nuevos estudios para confirmar esta hipótesis podría ayudar en el tratamiento de estos pacientes5,10.
En resumen, podemos concluir que es extremadamente difícil saber ni nos encontramos ante la evolución natural de una enfermedad o ante un linfoma no diagnosticado, lo que muestra la necesidad de tener marcadores más fiables para dilucidar esta cuestión. Lo que sí podemos afirmar, en consonancia con la literatura, es que la eosinofilia es un signo de alerta en los pacientes con LCCT, siendo de vital importancia el seguimiento a largo plazo de los pacientes que padecen un SHE-L.