La dermatitis atópica (DA) se ha convertido en un problema de salud en nuestro medio debido al aumento de su prevalencia, la alteración de la calidad de vida, los gastos que ocasiona y su implicación en la progresión a otras enfermedades atópicas. Además no tiene una cura definitiva, por lo que sería interesante la aplicación de medidas preventivas. En este artículo se revisan los últimos avances implicados en su prevención, tanto primaria (disminución de incidencia), como secundaria (disminución de morbilidad, evitar la progresión de la marcha atópica). Se abordan las diversas estrategias implicadas, entre las que se encuentran la modificación del sistema inmune mediante exposición microbiana, la inducción de tolerancia inmunológica por exposición antigénica y la restauración de la función barrera para frenar la marcha atópica. Estas medidas deberían ser conocidas por los dermatólogos para aplicarlas cuando sea posible, y poder informar adecuadamente a los pacientes y familiares, evitando actuaciones inadecuadas y/o erróneas.
Atopic dermatitis has become a health problem in our setting due to its rising prevalence, impact on quality of life, associated costs, and role in the progression to other atopic diseases. Furthermore, atopic dermatitis has no definitive cure and therefore preventive measures are important. In this article, we review the latest advances in both primary prevention (reduction of the incidence of atopic dermatitis) and secondary prevention (reduction of associated morbidity and reduction of the atopic march). We analyze the different preventive strategies available, including modification of the immune system through microbial exposure, induction of immune tolerance through antigen exposure, and restoration of skin barrier function to halt the atopic march. Dermatologists need to be familiar with these strategies in order to apply them where necessary and to accurately inform patients and their relatives to prevent misguided or inappropriate actions.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica cuya prevalencia ha aumentado de forma considerable en los últimos años, suponiendo una importante alteración en la calidad de vida de los pacientes y unos gastos muy elevados. Por otra parte, se ha visto que suele ser la primera manifestación de la denominada «marcha atópica», y que un porcentaje importante de pacientes con DA terminan desarrollando alergia a alimentos, asma y/o rinitis alérgica. Aproximadamente 1/3 de pacientes con DA terminarán desarrollando asma y 2/3 rinitis alérgica, mientras que no hay datos concluyentes del porcentaje que desarrollarán alergia alimentaria1,2. Por todo ello se ha convertido en un verdadero problema de salud en nuestro medio. Por tratarse de una enfermedad crónica, sin un tratamiento curativo, resultaría del máximo interés contar con medidas preventivas efectivas. El presente artículo pretende, mediante la revisión crítica de la evidencia científica disponible, incluyendo los niveles de evidencia (NE)3 de algunas intervenciones (tabla 1) responder a la pregunta ¿existen medidas preventivas eficaces para la DA?
Sistema de jerarquización de los niveles de evidencia
| Nivel de evidencia | |
|---|---|
| 1a | Metaanálisis de ensayos clínicos controlados, aleatorizados, bien diseñados |
| 1b | Ensayo controlado aleatorizado individual |
| 2a | Revisión sistemática de estudios de cohortes |
| 2b | Ensayo clínico aleatorizado controlado de baja calidad individual. Estudio de cohortes individual |
| 3a | Revisión sistemática de estudio de casos y controles |
| 3b | Estudio de casos y controles individual |
| 4 | Series de casos, estudios de cohortes y casos control de baja calidad |
| 5 | Documentos u opiniones de expertos |
Fuente: Sackett y Wennberg3.
Cuando hablamos de prevención puede hacerse en varios niveles. En este artículo se revisarán las intervenciones en el nivel de prevención primaria y secundaria. Entendemos por prevención primaria el conjunto de actuaciones orientadas a evitar la aparición de una enfermedad, mientras que la prevención secundaria hace referencia a proporcionar un diagnóstico y tratamiento precoz que permita disminuir la morbilidad y/o mortalidad. En el primer caso trataríamos de disminuir la incidencia de la DA, y en el segundo gravedad y complicaciones.
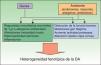
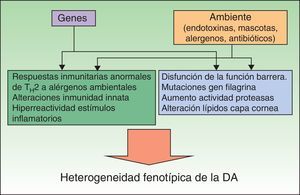
Las medidas preventivas deben basarse en un adecuado conocimiento de la etiopatogenia de una enfermedad, lo que representa una limitación debido a que en el caso de la DA esta no es del todo conocida. Existen una serie de factores genéticos, entre los que destacan las mutaciones o pérdida de función del gen de la filagrina, que interactúan con unos factores ambientales, interacción que resultará en las distintas manifestaciones clínicas de la DA (fig. 1)4,5. Estos factores genéticos no pueden explicar por sí mismos el aumento de prevalencia de la DA, como demuestra el hecho de que los inmigrantes de países en vías de desarrollo adquieren la prevalencia del país que los acoge, o el gradiente rural/urbano dentro de un mismo país6. Así pues, hay una serie de factores ambientales que favorecerán el desarrollo de un fenotipo atópico, mientras que otros serán protectores. Dichos factores actúan básicamente en etapas muy precoces del desarrollo (últimos meses del embarazo y primer año de vida), como demuestra el hecho de que más del 60% de las DA se manifiesten en el primer año de vida: es en estos momentos donde deberían centrarse las medidas preventivas.
Prevención primariaExposición microbiana. Teoría higienistaLa teoría higienista postula que una exposición reducida a ciertos microorganismos, en periodos clave del desarrollo, conduce a una modificación inmunológica que favorece la adquisición o mantenimiento de un fenotipo atópico7. En este sentido destaca el papel de la flora intestinal, pues el tubo digestivo contiene al menos el 60% de los linfocitos, y resulta crucial en el desarrollo de sensibilizaciones y en la tolerancia inmunológica.
Pro(pre)bióticosEl intestino en el útero es estéril, pero se coloniza rápidamente tras el parto. En los niños con DA hay una menor diversidad de la flora intestinal, con disminución de Bifidobacterium spp. y aumento de S. aureus8. Podríamos hacernos la pregunta de si la adición de pro(pre)biótico podría cambiar la flora intestinal modulando la reactividad del sistema inmune para prevenir la DA. A este respecto hay numerosa literatura, con resultados contradictorios y con una gran heterogeneidad entre los diversos estudios (criterios diagnósticos, metodología, cepas, dosis, etc.) de forma que resulta muy difícil la comparación entre ellos y las conclusiones de los metaanálisis. Así, actualmente, la posición de numerosos autores y de la Organización Mundial de Alergia es que son necesarios más estudios, por lo que resultaría prematuro emitir recomendaciones en este sentido9–11. No obstante, es un camino en el que continúa investigándose. Cabe destacar un trabajo reciente12, en el que se revisan 26 estudios aleatorizados (nivel de evidencia [NE] 1a) que llega a la conclusión de que los probióticos son útiles en la prevención de la DA, pero solo si se administran de forma secuencial, en los últimos meses del embarazo y en los primeros meses de vida. No serían útiles si se administran únicamente tras el parto.
EndotoxinasExisten ciertas situaciones que diversos estudios epidemiológicos han ligado a un efecto protector frente a la DA. Como se comentó anteriormente, se caracterizan por una exposición (sobre todo durante el embarazo y en el primer año de vida) a determinados microorganismos que pueden disminuir el riesgo de DA por modificación del sistema inmune. Esta disminución del riesgo puede deberse a endotoxinas, un grupo de lipopolisacáridos presentes en las paredes de las bacterias gram negativas.
Animales de granja y leche no pasteurizadaSe ha postulado que los niños que viven en granjas tienen menos riesgo de DA, aunque no hay evidencia de que simplemente el hecho en sí de vivir en granjas sea protector5. Posiblemente se deba a la toma de leche no pasteurizada (rica en lactobacilli) y el contacto con animales de granja, máxime si la exposición se da tanto durante el periodo prenatal como posnatal. Este efecto protector se ha visto incluso en personas en ambiente urbano que toman leche no pasteurizada (NE 3b)13.
MascotasLa presencia de mascotas durante el primer año de vida puede tener un efecto protector frente a la DA. Diversos trabajos muestran un efecto protector uniforme con el perro (NE: 2a)14, sin embargo con el gato es menos claro, con resultados contradictorios15. Si se tienen en cuenta las mutaciones en el gen de la filagrina se ha visto un riesgo mayor en aquellos niños con mutación, lo que sugiere que la alteración de la función barrera puede facilitar la sensibilización al epitelio de gato y el desarrollo de DA16,17.
Infección por helmintosAlgunos artículos muestran una asociación inversa entre DA e infección por helmintos, lo que podría explicar, al menos en parte, las diferencias entre países desarrollados-subdesarrollados y el gradiente rural-urbano (NE 3b)18,19. Una mayor evidencia de esta asociación la proporcionan diversos estudios intervencionistas donde se demuestra una aumento del riesgo cuando se trata a las mujeres embarazadas con antihelmintos en zonas endémicas (NE 1b)20. Las bases inmunológicas para este efecto protector no están claras, aunque se cree que puede ser por el efecto antiinflamatorio debido a un aumento de producción de IL-1021.
Infecciones y vacunasHay varios trabajos con respecto a diferentes infecciones (virales o bacterianas) antenatales o durante la infancia con resultados contradictorios. Algunos encuentran un aumento leve del riesgo para DA22, otros un papel protector23 y otros no encuentran asociación, relacionando el posible incremento de riesgo con el uso de antibióticos24.
Lo mismo sucede con las vacunas; mientras que algunos estudios sugirieron un leve aumento del riesgo, estudios más modernos no han encontrado asociación con DA.
AntibióticosAunque puede resultar difícil discriminar entre el uso de antibióticos y la infección por la que se pautan, son varios los trabajos que han unido el uso de antibióticos con un riesgo aumentado de DA. Recientemente Tsakok et al. han realizado una revisión sistemática de 20 estudios, encontrando una asociación positiva entre el uso de antibióticos y el riesgo subsiguiente de desarrollar DA, sobre todo si se administraban antibióticos de amplio espectro25. Esta asociación se ha mantenido tanto en los 7 estudios transversales como en los 13 longitudinales analizados. El riesgo estaba presente cuando se administraba tanto durante el periodo prenatal como posnatal, siendo el riesgo acumulativo, es decir, cuantos más ciclos de antibióticos recibían mayor era el riesgo de desarrollar una DA. Una vez más se postula que este incremento del riesgo pueda deberse a una alteración de la microflora, que conduciría a una alteración del sistema inmune. De este modo, y hasta disponer de una evidencia más robusta, parece razonable recomendar que los antibióticos, sobre todo los de amplio espectro, sean prescritos con cautela (NE 2a, 3a).
Modificaciones dietéticasEn este apartado podrían incluirse las siguientes recomendaciones o actuaciones descritas en la literatura:
- -
La modificación de la dieta materna, con reducción de supuestos alimentos «alergénicos», suplementos de omega-3 y de ácidos grasos y de vitamina D.
- -
La modificación de las fórmulas infantiles, con fórmulas hidrolizadas, leche de soja, suplementos minerales o vitamínicos (vitamina D), etc.
- -
La promoción de la lactancia materna.
De nuevo hay estudios controvertidos y contradictorios, en parte debido a la gran heterogeneidad en los diseños, y continúa investigándose en este campo. No es extraño que en las consultas los pacientes, o los padres, nos pregunten qué alimentos deben evitar, o si pueden tomar algún suplemento que les ayude a mejorar su enfermedad. De acuerdo con lo expresado anteriormente, y hasta que no haya más ensayos, una vez más, y tal y como demuestran los metaanálisis, con sus sesgos inherentes, no pueden hacerse recomendaciones de rutina9,26.
Lactancia maternaTradicionalmente se ha considerado la lactancia materna como un pilar frente al desarrollo de DA y alergias, de hecho la Organización Mundial de la Salud recomienda alimentación exclusiva con lactancia materna los 6 primeros meses de vida. No obstante, estudios recientes y diversos metaanálisis han mostrado que este planteamiento, con respecto a la reducción de DA y alergias puede ser erróneo. Los datos de la fase 2 del International Study of Asthma and Allergies in Childhood (ISAAC), sobre más de 51.000 niños, no encontraron evidencia de que la alimentación basada en lactancia materna exclusiva prevenga la DA27. De modo similar, un metaanálisis de 27 estudios prospectivos tampoco encontró protección frente a la DA28. La lactancia materna se considera el alimento más completo, por sus propiedades nutricionales y sobre el sistema inmune, y estos estudios no cambian esta noción, únicamente destacan que no es una estrategia útil frente a la prevención de atopia, y así hay que tenerlo en cuenta a la hora de informar a los pacientes (NE 2a). La razón puede ser, una vez más, la mayor colonización e infecciones intestinales con lactancia artificial, pero otra explicación podría encontrarse en mecanismos de tolerancia inmunológica. Una idea arraigada en nuestro medio es la introducción tardía de alimentos sólidos para prevenir alergias. Pero por contra, diversos trabajos nos muestran que una introducción precoz, en contraposición a una evitación alergénica estricta, puede inducir fenómenos de tolerancia inmunológica más que sensibilizaciones29,30. En este sentido están en marcha diversos ensayos clínicos para comprobar el efecto de lactancia materna exclusiva frente a lactancia e introducción precoz de alimentos, cuyos resultados probablemente resultarán esclarecedores a este respecto31.
Polvo domésticoUn porcentaje significativo de pacientes con DA están sensibilizados al polvo doméstico, y algunos presentan brotes tras su exposición32. No obstante, una revisión sistemática no ha encontrado evidencia de mejoría cuando se reducen sus niveles33. Incluso algunos estudios encuentran un aumento paradójico del riesgo de DA en aquellas familias que lo evitan, de forma similar a lo que ocurre cuando se evitan las endotoxinas34,35. Así pues, de forma práctica no debe recomendarse la evitación estricta del polvo doméstico como estrategia de prevención o de tratamiento, pues resulta difícil, poco práctico y posiblemente erróneo.
Prevención secundariaPueden considerarse como prevención secundaria aquellas medidas encaminadas a la disminución del número e intensidad de los brotes, y las encaminadas a evitar o disminuir la marcha atópica. Probablemente estas estrategias influyan la una en la otra. Además, en ocasiones estas medidas también pueden estar implicadas en estrategias de prevención primaria, pues los factores de riesgo, genéticos y ambientales están presentes antes y después del desarrollo de la enfermedad.
Modificación de la marcha atópicaSe entiende por marcha atópica la historia natural de las manifestaciones atópicas, de las cuales la DA suele ser la primera, con la aparición posterior de alergia a alimentos, asma y rinitis alérgica. Esta evolución es un fenómeno real, pero existe cierto debate con respecto a si es causal o se trata de comanifestaciones de un fenotipo atópico que comparte factores de riesgo ambientales y genéticos36,37. Con el descubrimiento del gen de la filagrina, y su pérdida de función como factor de riesgo en la DA, ha tomado gran importancia el papel de la pérdida de la función barrera de la epidermis en la DA. Se ha visto que la mutación en este gen se asocia a asma en pacientes con DA, pero no en aquellos en los que el gen está mutado pero no sufren DA38,39. Esto sugiere la importancia de la función barrera de la capa córnea en la sensibilización a alérgenos. La asociación de la gravedad de la DA con una mayor alteración de la función barrera y con un mayor porcentaje de sensibilizaciones posteriores va a favor de un mecanismo causal37,40–42. Se postula que una epidermis con una función barrera defectuosa permite el paso de microorganismo y alérgenos, produciéndose una sensibilización epicutánea que inicia la marcha atópica36,39,43.
Si asumimos que la marcha atópica es causal y que se debe, al menos en parte, a una barrera cutánea defectuosa, si fuésemos capaces de restaurarla se podría evitar o al menos disminuir. Pero ¿cómo puede conseguirse esto?
Restauración de la barrera cutánea defectuosaLos 2 pilares básicos en este campo son los emolientes y el control de la inflamación. La inflamación en la DA produce una serie de citoquinas que van a influir negativamente en la expresión de filagrina y en la síntesis de ciertos lípidos presentes en la capa córnea, conduciendo a una mayor eliminación de agua transepidérmica y a una mayor pérdida de la función barrera44–46. Por ello resulta importante a la hora de restaurar la barrera epidérmica el control de los brotes.
Disminución de la intensidad/severidad de los brotesSe sabe que en la DA existe una inflamación subclínica, con alteraciones histológicas e inmunológicas en la piel no afecta de estos individuos con DA47. Varios estudios muestran una disminución del número e intensidad de los brotes cuando se trata esta inflamación subclínica mediante tacrolimus tópico, tanto en adultos como en niños, en pautas de 2-3 días por semana (NE 1b)48,49. Este denominado «tratamiento proactivo» no es exclusivo de los inhibidores de la calcineurina, sino que también se ha visto con corticoides tópicos usados 2 días en semana (NE 1b)50,51. Quedaría por dilucidar cuál sería la pauta más conveniente siguiendo criterios clínicos y económicos, lo cual no es el objetivo de esta revisión. Con respecto a la modificación de los síntomas respiratorios con dichos tratamientos apenas existen trabajos. Hay 2 publicaciones que hacen referencia al mismo grupo de pacientes, con DA moderada-severa, tratados con tacrolimus pomada durante un año ante mínimos síntomas y hasta una semana después de la curación del brote y evaluados a los 4 y 10 años52,53. Los autores encuentran una disminución de la gravedad de las manifestaciones cutáneas y una mejoría en los síntomas respiratorios. No obstante, no es un trabajo carente de sesgo, pues es un estudio abierto que carece de un grupo control, por lo que no se pueden sacar conclusiones claras (NE 4). Además, se estudian pacientes adultos con DA y síntomas respiratorios ya establecidos. Lo ideal sería estudiar pacientes pediátricos y valorar la influencia de estos tratamientos precoces en las subsiguientes manifestaciones de la enfermedad atópica. Hubo un ensayo con pimecrolimus tópico con dicho diseño, pero desgraciadamente el estudio finalizó precozmente por pérdida de pacientes y no se pudieron sacar conclusiones54. Dicho ensayo clínico coincidió con la alerta de la FDA del riesgo de neoplasias asociadas a inhibidores de la calcineurina, y es una posible explicación a la pérdida de pacientes y la finalización prematura del estudio.
EmolientesLa hidratación cutánea con emolientes es clásicamente la piedra angular en el manejo de la DA55. Además de reducir la pérdida de agua transepidérmica disminuyen el prurito, aumentan la eficacia de los corticoides tópicos y reducen su uso56,57. Esto ha cobrado todavía más importancia tras el descubrimiento del papel de la filagrina y de otras proteínas de la capa córnea y del mayor conocimiento de la composición lipídica de dicha capa córnea. Al igual que la inflamación influye en una mayor alteración de la función barrera, una correcta hidratación puede disminuir la inflamación observada en la piel xerótica de los pacientes con DA40,58,59.
Cuando utilizamos emolientes podemos elegir entre aquellos denominados «no fisiológicos», es decir, no presentes de forma natural en la piel (vaselina, lanolina…) o «emolientes fisiológicos». Estos últimos están compuestos por lípidos presentes en la capa córnea, y que se han mostrado defectuosos en pacientes con DA, como las ceramidas, colesterol o ácidos grasos libres. Estos podrían penetrar el estrato córneo, ser captados por los queratinocitos, procesados en cuerpos lamelares y ser resecretados a la capa córnea de una manera más natural. Pero esto es la teoría, pues son pocos los estudios disponibles, los cuales incluyen un número no muy elevado de pacientes y con un seguimiento no demasiado largo. Además, a día de hoy apenas hay resultados de ensayos comparativos aleatorizados entre los distintos emolientes, aunque existen numerosos estudios en marcha con estos productos.
Emolientes como prevención primariaActualmente los esfuerzos en el desarrollo de emolientes están centrados en la restauración de la función barrera y la mejoría de los síntomas de la DA, siendo escasos los trabajos en prevención primaria. Simpson et al.60 estudiaron 22 neonatos de familias de alto riesgo para el desarrollo de DA en los cuales utilizaron un emoliente (o/w) desde el nacimiento. No usaron grupo control, por lo que no pueden sacarse conclusiones claras, pero sugieren una disminución de la incidencia al compararlos con controles históricos (NE 4). Más recientemente, Inoue et al. estudiaron 147 neonatos, en esta ocasión con grupo control, no encontrando diferencias en cuanto a incidencia, pero sí en cuanto a severidad, la cual resultó menor en los niños tratados con emolientes 2 veces al día61. No obstante, realizan una única medida a los 4 meses de edad, lo que debe considerarse un periodo insuficiente en una enfermedad como la DA (NE 3b). En cualquier caso es un camino que está siendo investigado con algunos ensayos clínicos en marcha, aunque será necesario más tiempo y un mayor número de estudios para sacar conclusiones.
Conclusiones y reflexionesResulta imposible prevenir el desarrollo de una enfermedad tan compleja y multifactorial como la DA eliminando un solo factor de riesgo. Es imprescindible un abordaje integral en el que estén incorporados diversos profesionales sanitarios y las autoridades públicas, y que permita la promoción de las distintas estrategias de prevención. Por desgracia, estas estrategias todavía no están bien establecidas y no se pueden recomendar hoy en día de forma rutinaria, dado que no hay el suficiente nivel de evidencia (tabla 2). Esto no significa necesariamente que no funcionen, únicamente que pueden ser necesarios más estudios, muchos de los cuales ya están en marcha. El ejemplo más claro es el uso de pro(pre)bióticos como prevención primaria, el cual ha mostrado resultados esperanzadores en algunos ensayos clínicos. Otras medidas simplemente resultan poco prácticas y no son aplicables en el ámbito poblacional. Aunque la infección por helmintos o las endotoxinas de ciertas bacterias disminuyen el riesgo de DA, resulta inconcebible infectar a las mujeres embarazadas o a los niños con este propósito. En su lugar se están tratando de aislar los componentes de la pared de los helmintos y diversos lipopolisacáridos bacterianos para administrarlos de forma exógena. Algunos estudios han mostrado resultados, tanto en ratones como en humanos, pero estos son todavía escasos, aunque es un camino a estudiar62,63.
Estrategias implicadas en la prevención de la dermatitis atópica
| Prevención primaria |
| Exposición microbiana |
| Pro(pre)bióticos |
| Endotoxinas |
| Mascotas |
| Leche no pasteurizada |
| Reducir el uso de antibióticos de amplio espectro |
| Tolerancia inmunológica |
| Alérgenos ambientales |
| Alimentos |
| Prevención secundaria |
| Control eficaz de los brotes |
| Reestablecimiento de la barrera epidérmica |
| Tratamiento de la inflamación subclínica |
| Emolientes |
Resulta muy interesante tratar de frenar la marcha atópica; se ha visto una clara correlación temporal y una plausibilidad biológica. Quedan pendientes, no obstante, estudios de intervención que confirmen la causalidad y la posibilidad real de frenarla. Si se consiguiese evitar dicha progresión mediante el control de la inflamación (clínica y subclínica) y la restauración de la función barrera se lograría una auténtica modificación del curso de la enfermedad.
Otro punto de controversia sería en quién focalizamos las medidas preventivas. La elevada prevalencia de la DA y sus implicaciones en el desarrollo de otras enfermedades atópicas justificarían medidas en la población general. No obstante, como se ha comentado, estas medidas no están bien definidas y muchos de los ensayos clínicos se han centrado en pacientes de riesgo (familiares de primer grado de individuos atópicos). Por otra parte, es a estos individuos a los que los dermatólogos tenemos más fácil acceso, y en los cuales podremos establecer las medidas adecuadas, o al menos, a través del conocimiento de la etiopatogenia y los avances en epidemiología informar adecuadamente y evitar la desinformación y medidas inadecuadas y erróneas.
Por último, probablemente con el desarrollo de los estudios genéticos y la aparición de nuevos biomarcadores puedan establecerse distintos subtipos o fenotipos de pacientes con DA, y así establecer de manera más personalizada no solo medidas terapéuticas, sino también preventivas.
Conflicto de interesesEl autor declara que no tiene ningún conflicto de intereses.