La urticaria crónica es una enfermedad de la piel difícil de tratar que presenta un alto impacto negativo en la calidad de vida de los pacientes. La última actualización de la guía europea para el manejo del paciente con urticaria se publicó en 2018. Con el actual contexto, presentamos un enfoque multidisciplinar para la aplicación del nuevo algoritmo de tratamiento propuesto por la guía en el territorio español, más concretamente, en la comunidad autónoma de Andalucía.
Chronic urticaria is a difficult-to-treat skin disorder that has a major impact on patient quality of life. The latest update of the European guideline on the management of urticaria was published in 2018. In this consensus statement, produced in the autonomous community of Andalusia, Spain, we describe a multidisciplinary approach for applying the new treatment algorithm proposed by the European guideline in our region.
La urticaria crónica (UC) es una afección cutánea grave caracterizada por la aparición espontánea de habones con o sin angioedema y que persiste durante 6 o más semanas1. Se estima que afecta al 0,5%-1% de la población general, y que la incidencia anual es del 1,4%2. En Europa, más de 5millones de personas sufren de síntomas persistentes de la urticaria3.
La UC se asocia con depresión, estrés y problemas de sueño4-6. Debido al impacto negativo en la calidad de vida del paciente y en los costes sanitarios, es crucial proporcionar a los pacientes con urticaria un rápido y completo control de los síntomas y establecer un tratamiento correcto y precoz6,7.
La gran heterogeneidad regulatoria de la región y el elevado impacto económico y en la calidad de vida que presenta la UC generan la necesidad de que tanto el diagnóstico como el manejo y el tratamiento sean consensuados para evitar diferencias entre centros y entre especialistas. Por esta razón, el objetivo de este trabajo es elaborar un documento de consenso actualizado y adaptado a la práctica clínica sobre el proceso asistencial del paciente con UC en Andalucía, con la finalidad de unificar las líneas de tratamiento y el manejo de estos pacientes en todos los centros de la región y entre los especialistas de dermatología y alergología.
MetodologíaPara elaborar el presente documento se revisaron las publicaciones de la base de datos MEDLINE entre los años 2000 y 2018, usando combinaciones de las siguientes palabras clave: «angioedema», «urticaria», «urticaria crónica», «paciente no respondedor», «manejo», «ciclosporina», «actividad», «antihistamínicos», «omalizumab», «urticaria crónica espontánea», «sintomatología», «diagnóstico», «comorbilidades», «herramientas», «guías» y «Andalucía». Posteriormente, se celebró una reunión participativa en Antequera (Andalucía) patrocinada por Novartis Farmacéutica SA con un grupo multidisciplinar de expertos en el manejo y el tratamiento de UC en Andalucía formado por 4 alergólogos y 6 dermatólogos, que discutieron y consensuaron por unanimidad todos los aspectos contenidos en el presente documento mediante la técnica del metaplan. Los resultados se expresan en porcentajes, teniendo en cuenta que el grupo estaba formado por 10 personas.
El metaplan se basa en la interacción y participación de las personas implicadas para la búsqueda colaborativa de mejoras o soluciones a una situación común8. Durante la sesión, un moderador acompaña al grupo en la discusión enfocando el proceso para lograr el objetivo establecido. Así, la discusión se genera utilizando tarjetas que se irán colocando en paneles a la vista de todas las personas participantes. De esta manera se llega a consensos, analizando la información de forma colaborativa e in situ.
Agentes causantes, agravantes y comorbilidadesLas causas y los agravantes asociados a la UC son diversos y pueden ser desde estímulos físicos, agentes infecciosos y uso de fármacos, hasta estrés físico o emocional1.
Coincidiendo con la literatura9-16, se enumeraron como comorbilidades asociadas a la urticaria crónica espontánea (UCE) la ansiedad, la depresión, la dermatitis atópica, el asma, la rinoconjuntivitis, la asociación con la UC inducible y la disminución del rendimiento laboral. Como factores exacerbantes de la UCE se indicaron: el uso de fármacos antiinflamatorios no esteroideos, el estrés, las infecciones víricas y el consumo de alcohol, entre otros.
DiagnósticoSegún la última actualización de la guía clínica europea de UC1, el diagnóstico debe ser sencillo, útil, rentable y debe basarse en la anamnesis y la exploración. Como pruebas complementarias la guía incluye exclusivamente el hemograma y uno de los 2factores de fase aguda: la velocidad de sedimentación globular o la proteína C reactiva. En cuanto a la anamnesis, se deben resaltar factores clínicos de mal pronóstico, como la asociación con angioedema, las UC inducibles, la asociación o empeoramiento con antiinflamatorios no esteroideos y la respuesta inadecuada o el fracaso terapéutico previo.
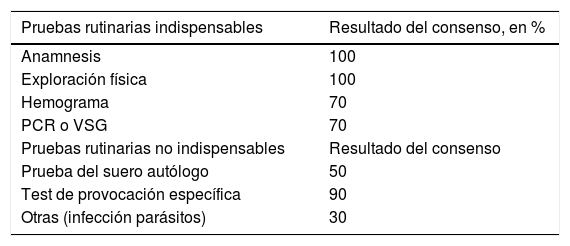
Los resultados del presente estudio muestran que el 100% de los expertos consideran la anamnesis y la exploración física como pruebas indispensables de diagnóstico. El 70% de los expertos incluye el hemograma y la proteína C reactiva o velocidad de sedimentación globular como prueba indispensable, mientras que el 90% no considera como indispensable los test de provocación para pacientes con UCE (tabla 1).
Pruebas rutinarias que considerar en pacientes con UCE
| Pruebas rutinarias indispensables | Resultado del consenso, en % |
|---|---|
| Anamnesis | 100 |
| Exploración física | 100 |
| Hemograma | 70 |
| PCR o VSG | 70 |
| Pruebas rutinarias no indispensables | Resultado del consenso |
| Prueba del suero autólogo | 50 |
| Test de provocación específica | 90 |
| Otras (infección parásitos) | 30 |
Como pruebas rutinarias indispensables están la anamnesis, la exploración física, el hemograma y el PCR o VSG. Mientras que las pruebas rutinarias que no se consideran indispensables para el diagnóstico son la prueba del suero autólogo, el test de provocación específica y otras como las pruebas para detectar infección por parásitos.
PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Diferentes estudios evidencian la demora diagnóstica, la falta de utilización de escalas validadas para calificar a los pacientes y el impacto negativo en la calidad de vida y en las actividades diarias17,18. Por ello, las guías recomiendan el uso de escalas de actividad y calidad de vida en la evaluación clínica inicial del paciente, después de instaurar el tratamiento, tras cambiar la medicación y en pacientes mal controlados1.
Para evaluar la actividad de la UCE, se recomienda el Urticaria Activity Score 7 (UAS7)1,19, que permite medir la actividad de la urticaria en los 7 días anteriores20. Las versiones españolas del UAS y UAS7 han sido validadas como herramienta de diagnóstico y seguimiento del paciente con UCE en el estudio EVALUAS21.
Para valorar la actividad del angioedema se utiliza el Angioedema Activity Score22 y para cuantificar mejor el control de la enfermedad en todos los tipos de UC, es decir, espontánea o inducible, se utiliza el Urticaria Control Test22,23.
Como herramientas indispensables para monitorizar la actividad y el control de la UCE, el 90% de los expertos considera indispensable la UAS7, el 50% consideraría la Angioedema Activity Score y el 40% considera la Urticaria Control Test (anexo, tabla 1).
La cumplimentación del UAS7 la realiza el propio paciente. Este UAS7 se correlaciona bien con el Dermatology Life Quality Index (DLQI) empleado para valorar la calidad de vida en dermatología24,25.
Sobre el objetivo del tratamiento y control de la enfermedad, la recomendación de la guía es obtener el completo control de sus signos y síntomas, considerando siempre la seguridad y la calidad de vida de cada paciente1.
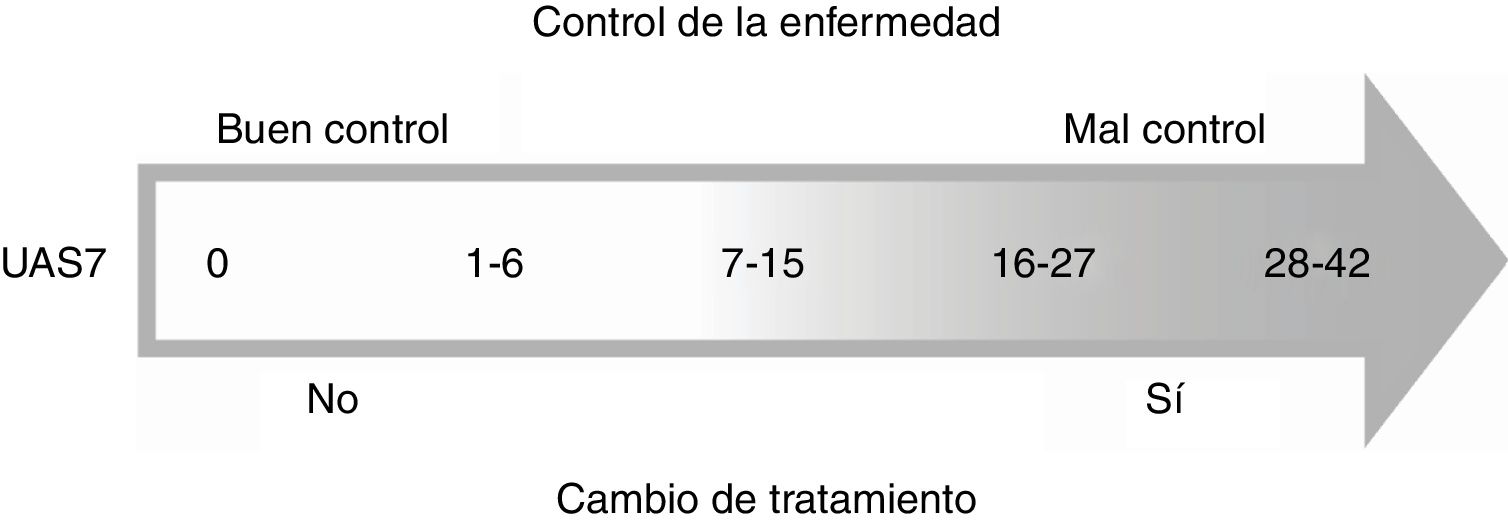
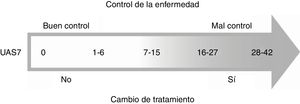
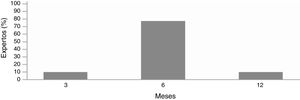
El comité de expertos consensuó que un resultado del UAS7<7 se considera un buen control de la enfermedad, mientras que un UAS7>7 se considera mal control y, por consiguiente, se debe cambiar el tratamiento (fig. 1).
Siguiendo las recomendaciones de las guías, la valoración completa del paciente con UCE requiere evaluar el impacto de la enfermedad en la calidad de vida1,20. Hasta la fecha, el único cuestionario desarrollado específicamente para medir la calidad de vida de los pacientes con UC es el Chronic Urticaria Quality of Life Questionnaire (CU-Q2oL) (fig. 2).
Respecto a la evaluación de la calidad de vida del paciente, el 30% de los expertos considera indispensable la DLQI. El 60% de los expertos consideraría la escala CU-Q2oL en casos puntuales y el 60% no consideraría en ningún caso la escala Angioedema Quality of Life Questionnaire.
El 80% de los expertos no considera indispensable evaluar la actividad, el impacto ni el control de la enfermedad en cada visita.
Asociación con otros tipos de urticariaDiferentes estudios han demostrado la asociación de UC con algún tipo de urticaria inducible, lo que refleja la importancia de los factores desencadenantes de cara al manejo de la enfermedad, puesto que parece haber una peor respuesta al tratamiento en pacientes con UCE que asocien angioedema o urticaria física o inducible26,27.
Los expertos consensúan que el 45% de los pacientes con UCE se asocia con UC inducible, y que es muy común la urticaria retardada por presión. También se indica que hay muchos pacientes con UCE que luego presentan urticaria inducible (brotes de colinérgicas, solares…, etc.). Las urticarias inducibles más frecuentes en las consultas son el dermografismo, la urticaria solar y las colinérgicas en pacientes con dermatitis atópicas.
Según datos publicados, aproximadamente un 40% de los afectados de UC también presentan angioedema26,28.
TratamientoEl tratamiento de la UCE consiste en evitar los factores desencadenantes, en el caso de que se hayan identificado, y en administrar fármacos de control sintomático1. Para el tratamiento sintomático de los pacientes con UCE, las guías recomiendan como primera línea el empleo de antihistamínicos H1 de segunda generación1,20. Sin embargo, dado que, aproximadamente, el 50% de los pacientes se mantienen sintomáticos a pesar del uso de antihistamínicos22, se recomienda como tratamiento de segunda línea el aumento de la dosis, incluso hasta alcanzar 4 veces la dosis autorizada1.
Como tratamiento de tercera línea se recomienda añadir a los antihistamínicos omalizumab y, como cuarta línea de tratamiento, ciclosporina A. Por otro lado, en caso de exacerbación, las guías recomiendan el empleo de corticosteroides orales, limitando su uso a ciclos cortos no superiores a 10 días1.
Al preguntar a los expertos sobre el grado de acuerdo o desacuerdo con el algoritmo de tratamiento de las guías europeas de 2018 para la UC, sobre una escala del 1 al 10 donde 1 corresponde a totalmente desacuerdo y 10 a totalmente de acuerdo, el 50% de los expertos contestó que está totalmente de acuerdo con el algoritmo de tratamiento de las guías europeas para la urticaria (puntuación de 9 sobre 10), el 40% dio una puntuación de 8 sobre 10 y el 10% restante de 7 sobre 10 (anexo, tabla 2).
AntihistamínicosEl uso de los antihistamínicos H1 de 1.ª generación no es recomendable en UC por su baja selectividad, porque penetra la barrera hematoencefálica, así como por su elevado número de efectos adversos29-32.
La totalidad de los expertos (100%) considera los antihistamínicos de 2.ª generación como 1.ª línea de tratamiento en pauta continua. Como 2.ª línea de tratamiento, se consideran los antihistamínicos de 2.ª generación, a dosis duplicadas o cuadruplicadas.
Los expertos basan su decisión en las recomendaciones de las guías y en los diferentes estudios publicados que demuestran la eficacia y seguridad de cuadruplicar la dosis de antihistamínicos H133-36. Los resultados de un estudio español muestran que el 74% de los pacientes responden a antihistamínicos H1 siguiendo las indicaciones de la guía. En este mismo estudio ven que la presencia de angioedema, los anticuerpos antitiroideos y la prueba del suero autógeno son factores que se asocian significativamente a la falta de respuesta a los antihistamínicos37.
El 100% de los expertos coincide en que cambian el antihistamínico H1 ante la no respuesta y en que acortan el periodo de subida de dosis, ya que creen que el algoritmo de la guía es demasiado lento. En un caso ideal, el 70% de los expertos esperaría de 0 a 4 semanas para cambiar la 1.ª línea y el 60% esperaría de 0 a 4 para cambiar la 2.ª línea (anexo, tablas 3 y 4).
OmalizumabLa eficacia y seguridad de omalizumab en el tratamiento del paciente con UCE ha sido constatada en los estudios pivotales fase III, ASTERIA I38, ASTERIA II39 y GLACIAL40,41, en los que se utilizaron como variables de eficacia, entre otras, la puntuación de UAS7 y DLQI.
Omalizumab también ha demostrado eficacia y seguridad en estudios observacionales realizados en vida real en pacientes con UCE42-46. Entre estos estudios se encuentra un análisis retrospectivo y descriptivo que incluyó a 110 pacientes con UCE tratados con omalizumab en 9 centros españoles47. El 81,8% de los pacientes tuvo una respuesta completa o significativa y solo un 7,2% no respondió al tratamiento. Además, el 60% de estos pacientes se mantuvieron asintomáticos tratados únicamente con omalizumab, y no se reportó ningún evento adverso grave. Los autores concluyeron que omalizumab es igualmente eficaz con independencia de los diferentes subtipos de urticaria y que puede ser el fármaco de elección para pacientes refractarios a antihistamínicos47.
Además, los resultados recientes del estudio XTEND-CIU48 de tratamiento durante más de 6 meses evidencian que el tratamiento continuado con omalizumab previene la aparición de recidivas, mejora la calidad de vida en los pacientes con UCE y disminuye el número de episodios de angioedema asociados a la enfermedad. Los autores concluyen que omalizumab es un fármaco eficaz y seguro utilizado a largo plazo.
Basándose en la evidencia publicada y las recomendaciones de la última actualización de la guía clínica europea de UC1, todos los expertos (100%) están de acuerdo con la guía en que el tratamiento de elección de 3.ª línea es con omalizumab a dosis de 300mg/4 semanas por la mayor eficacia, la seguridad demostrada y por tener la indicación.
Según el 80% de los expertos, un paciente es no respondedor a omalizumab si después de 6 meses con 300mg/4 semanas no tiene control de la enfermedad. El 20% restante considera no respondedor si no hay respuesta a los 6 meses tras escalado de dosis 300-450-600mg/4 semanas.
En caso de interrupción del tratamiento con omalizumab, el 90% de los expertos considera que es mejor bajar la dosis 150mg/4 semanas.
En relación con el retratamiento, el estudio de fase IIIb OPTIMA (N***CT 02161562) concluye que casi 2/3 de los pacientes tratados con omalizumab 300mg durante 6 meses están bien controlados49,50. Tras interrumpir el tratamiento, los datos demostraron que casi el 90% de los pacientes con UCE bien controlados previamente recuperaban el control efectivo de los síntomas a las 12 semanas de volver a ser tratados con omalizumab.
Los resultados del estudio de Metz et al.51 muestran una respuesta rápida y completa al reiniciar el tratamiento con omalizumab y retirar los antihistamínicos, sin acontecimientos adversos relevantes.
El 90% de los expertos considera que sí se puede retratar a los pacientes con omalizumab. El 100% de los expertos reintroduce el tratamiento a la misma dosis de inicio.
CiclosporinaLas últimas guías posicionan la ciclosporina como 4.ª línea de tratamiento en pacientes no respondedores a omalizumab1. Se debe tener en cuenta que la ciclosporina no tiene indicación en ficha técnica para el tratamiento de la UCE: las indicaciones en dermatología son psoriasis y dermatitis atópica52. Se utiliza en UCE con base en los resultados de ensayos clínicos controlados versus placebo y en estudios en combinación con antihistamínicos53-55. Es importante resaltar sus extensos efectos secundarios y su uso con seguridad en un periodo de 2 años. Está absolutamente contraindicada en hipertensión arterial no controlada, deterioro de función renal y en embarazadas.
La mayor parte de los expertos utilizaría ciclosporina a dosis de 2,5-5mg/kg como tratamiento de la UCE en caso de fracaso de tratamiento con omalizumab. Como controles rutinarios, los expertos eligen todas las opciones: hemograma, bioquímica, función renal y función hepática.
CorticoidesSegún las guías, se recomienda la prescripción de corticoides a ciclos cortos y en pautas descendentes en el tratamiento de exacerbaciones severas de la UC, especialmente cuando se acompaña de angioedema, por el riesgo de dificultad respiratoria secundaria1,56,57.
Para urticaria aguda y exacerbaciones agudas de UCE, un curso corto de corticosteroides orales puede ser de ayuda para reducir la duración o la actividad de la enfermedad58,59.
Los expertos consensúan que utilizarían los corticoides en brotes o en reagudizaciones, los mantendrían ciclos cortos de 10 días y aplicarían alguna pauta de retirada antes del inicio de otra línea de tratamiento.
ConclusionesEn la actualidad los profesionales sanitarios que atienden a los pacientes con UC tienen a su disposición guías de práctica clínica que proporcionan definiciones, criterios diagnósticos y pautas de tratamiento y seguimiento. El presente documento muestra un alto grado de concordancia entre las recomendaciones formuladas en dichas guías y la práctica clínica del sistema de salud de Andalucía.
El manejo multidisciplinar del paciente con urticaria siguiendo las recomendaciones permitirá optimizar y mejorar la actividad asistencial, aumentar la calidad de vida y reducir los costes socioeconómicos asociados al manejo subóptimo de esta entidad.
Conflicto de interesesTodos los autores del presente manuscrito refieren haber recibido honorarios como consultores por Novartis Ph.