Los pacientes diagnosticados de tuberculosis que reciben tratamiento antituberculoso pueden presentar un empeoramiento inesperado de su enfermedad, conocido como respuesta paradójica. Presentamos el caso de un varón de 59 años, con diagnóstico de lupus vulgar, que presentó un intenso empeoramiento paradójico de sus lesiones cutáneas tras iniciar tratamiento antituberculoso. Este fenómeno fue autolimitado, presentando mejoría progresiva con muy buena evolución final. La respuesta paradójica es un fenómeno conocido en pacientes infectados por el VIH tras iniciar tratamiento antirretroviral, y que también puede aparecer en pacientes no infectados por el VIH con tuberculosis que comienzan tratamiento antituberculoso. En la revisión de la literatura que se ha realizado los casos descritos con afectación tuberculosa cutánea y respuesta paradójica se refieren a tuberculosis miliar, siendo el que describimos el primero en lupus vulgar. El aumento de casos de tuberculosis en nuestro medio podría dar lugar a un aumento de la frecuencia de estas situaciones de empeoramiento paradójico.
Patients receiving treatment for tuberculosis may experience an unexpected deterioration of their disease; this is known as a paradoxical reaction. We present the case of a 59-year-old man with lupus vulgaris who experienced a paradoxical deterioration of cutaneous lesions after starting antituberculosis therapy. The reaction was self-limiting; the lesions gradually improved, and the final outcome was very good. Paradoxical reactions are well-known in patients with human immunodeficiency virus (HIV) infection who start antiretroviral therapy, but they can also occur in non–HIV-infected patients with tuberculosis who start antituberculosis therapy. In the literature reviewed, paradoxical reactions involving skin lesions were described in patients with miliary tuberculosis. The case we report is the first of a paradoxical reaction in lupus vulgaris. The increasing frequency of tuberculosis in Spain could lead to a rise in the number of paradoxical reactions.
El lupus vulgar (LV) es la forma más frecuente de tuberculosis cutánea (TBC) en Europa1,2. Su localización más frecuente es la cabeza y el cuello2, aparece en pacientes con un alto grado de sensibilidad a la tuberculina2 y tiende a presentar una evolución crónica pudiendo llegar a ser muy destructivo. Para el diagnóstico de infección tuberculosa se utilizan métodos como el Mantoux y/o el quantiferón TB gold, mientras que para el diagnóstico de la enfermedad tuberculosa cutánea se pueden usar métodos como el estudio histopatológico, cultivo e identificación del ADN mediante la reacción en cadena de la polimerasa (PCR)1,3. El LV supone una forma paucibacilar de TBC, por lo que técnicas de tinción como el Ziehl-Neelsen pueden resultar negativas, sin que este resultado descarte el diagnóstico de tuberculosis1,3. Lo mismo ocurre con el cultivo en medios para micobacterias de muestras cutáneas en el LV, que solo es positivo en el 6% de los casos1, y con la sensibilidad de la PCR, que oscila ente el 50 y el 74%, según diversos estudios1,3,4, pudiendo explicarse los resultados negativos por ser muestras paucibacilares1 y con una distribución no homogénea de los bacilos3. Según se ha descrito en la literatura los factores que podrían estar implicados en la negatividad del test quantiferón TB gold serían la presencia de comorbilidades o inmunosupresión de base, una realización errónea de la prueba, así como la localización extrapulmonar de la tuberculosis5. Sin embargo, a pesar de obtener resultados negativos en estos métodos, en los casos de sospecha de TBC el alto índice de presunción clínica, unido a lesiones histopatológicas compatibles en la biopsia cutánea, y una respuesta clínica satisfactoria al tratamiento antituberculoso se ha considerado también criterio diagnóstico3. Para el tratamiento del LV se aconsejan las mismas pautas utilizadas para la tuberculosis pulmonar o de otras localizaciones. La respuesta paradójica (RP) de diferentes enfermedades tras iniciar un correcto tratamiento ha sido ampliamente descrita en pacientes infectados por el VIH, pero es menos conocida en pacientes no infectados por el VIH con infección tuberculosa, y en lo referente a la afectación cutánea por empeoramiento paradójico, los casos publicados aluden sobre todo a la tuberculosis miliar6–8. Describimos el caso de un paciente diagnosticado de LV que presentó un empeoramiento paradójico tras recibir tratamiento antituberculoso, y realizamos una revisión de este fenómeno.
Caso clínicoVarón de 59 años que presentaba desde 2008 lesiones faciales que fueron valoradas en otro centro con diagnóstico de linfoma T de células grandes CD30+. Por este diagnóstico había seguido tratamiento con metotrexato a dosis variables, entre 5 y 20mg/semana, durante 4 años sin mejoría, por lo que finalmente fue derivado a nuestro centro en el año 2012 para valoración de tratamiento con radioterapia. Previamente se había realizado estudio de extensión con TAC cérvico-torácico-abdominopélvica en 2 ocasiones (2008 y 2011), con resultado normal.
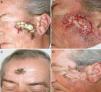
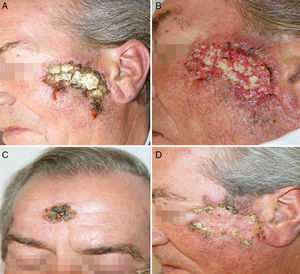
En el momento de la valoración en nuestra consulta el paciente presentaba una extensa placa de aspecto cicatricial central, deprimida y con borde sobreelevado, de 6,5cm de diámetro mayor, en la región cigomática izquierda (fig. 1). Además presentaba 3 lesiones cicatriciales residuales en el área centrofrontal y en la sien derecha. No mostraba otras lesiones en el resto del tegumento ni adenopatías en las principales cadenas.
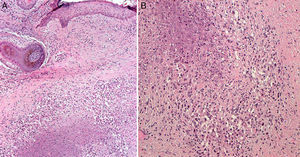
Se realizaron en ese momento 2 biopsias de la lesión situada en la zona cigomática. En el estudio anatomopatológico no se observaron imágenes sugestivas de linfoma, pero sí una dermatitis granulomatosa necrosante de tipo tuberculoide (fig. 2). Se ampliaron los estudios histoquímicos, con tinciones de PAS y metenamina, siendo negativas para hongos, y con la técnica de Zhiel-Neelsen, donde no se vieron bacilos ácido alcohol resistentes. Ante los hallazgos clínicos e histológicos se realizaron pruebas complementarias incluyendo cultivo y PCR para Mycobacterium tuberculosis de tejido que resultaron negativos. La prueba de Mantoux fue positiva, con una lectura a las 72h de 15mm. La determinación de quantiferón TB gold test fue negativa. Con estos resultados se realizó un diagnóstico clínico histológico de LV, considerando el resultado del quantiferón como un falso negativo. No hubo oportunidad de analizar las biopsias realizadas en el otro centro, con las que se había realizado años atrás el diagnóstico de linfoma T. Se suspendió el tratamiento con metotrexato y se inició medicación antituberculosa con isoniazida, pirazinamida y rifampicina a las mismas dosis que las propuestas para tuberculosis pulmonar.
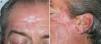
A las 2 semanas de comenzar el tratamiento antituberculoso el paciente presentó un empeoramiento franco de sus lesiones, con una intensa reacción inflamatoria, formación de costras y supuración, tanto en la lesión principal situada en el arco cigomático como en las otras que presentaban previamente un aspecto residual, localizadas en la zona centro frontal y en la sien derecha (fig. 3). Su estado general era bueno, sin fiebre ni otra sintomatología añadida, aparte del empeoramiento de sus lesiones cutáneas.
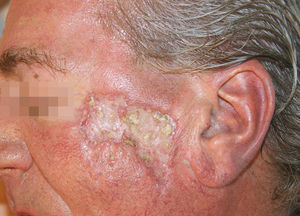
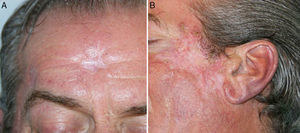
Se mantuvo la medicación a las mismas dosis, sin añadir nuevos fármacos, pero al mes del inicio del tratamiento antituberculoso se detectó en una analítica de control una hepatotoxicidad con elevación de las transaminasas mayor de 5 veces su valor normal, por lo que se suspendió la medicación en espera de la corrección de las alteraciones analíticas. Tras la normalización de los valores de transaminasas un mes después de la suspensión, se reintrodujo paulatinamente el tratamiento antituberculoso, siguiendo la pauta de isoniazida, etambutol y rifampicina durante 2 meses, y posteriormente 7 meses de isoniazida y rifampicina. Ante la reintroducción de tratamiento antituberculoso se observó de nuevo un empeoramiento de las lesiones, con mayor inflamación y formación de costras. En las siguientes analíticas de control el paciente mantuvo cifras correctas de transaminasas, sin nueva hepatotoxicidad, por lo que continuó con el tratamiento antituberculoso a las mismas dosis. Se realizaron curas de las lesiones inflamatorias costrosas, con mejoría progresiva, presentando finalmente muy buena evolución respecto a las lesiones iniciales, sin haber utilizado en ningún momento tratamientos como corticoides u otros dirigidos a su empeoramiento clínico (fig. 4).
DiscusiónLa RP es una consecuencia clínica adversa de la restauración de la respuesta inmunológica antígeno específica (RIAE) inducida por el tratamiento. Esta RP ha recibido múltiples nombres, como reacción o empeoramiento paradójico, síndrome inflamatorio de reconstitución inmune (SIRI) o síndrome de reconstitución inmunológica (SRI), refiriéndose todos ellos al mismo fenómeno. Dentro de la RP/SIRI podemos distinguir 2 formas, el SIRI paradójico, que se refiere a un empeoramiento o recaída de una enfermedad ya tratada o que se encuentra bajo tratamiento, y el SIRI de desenmascaramiento, en el que se produce una presentación acelerada de una enfermedad que se encontraba latente o subclínica9–11. La RP/SIRI es muy conocida en pacientes infectados por el VIH al comenzar tratamiento antirretroviral; sin embargo, este fenómeno no es específico de esta circunstancia, sino que se ha descrito en gran variedad de situaciones, desde pacientes inmunodeprimidos no infectados por el VIH sometidos a trasplantes de órganos sólidos ó médula ósea, o tratamientos quimioterápicos antitumorales, hasta pacientes inmunocompetentes10. Además, debemos destacar que la RP/SIRI acontece tanto para procesos infecciosos como no infecciosos10. Dentro de los procesos infecciosos, además de M. tuberculosis, la RP/SIRI se ha asociado con otras micobaterias atípicas, así como otros microorganismos que pueden ser bacterias, virus, hongos, parásitos y protozoos10. Especialmente graves son los casos de RP/SIRI asociados a Cryptococcus neoformans, presentándose como meningitis o enfermedad diseminada, o la RP/SIRI asociada al virus JC causando la leucoencefalopatía multifocal progresiva (LMP)10,11.
Cabe destacar la RP/SIRI en casos de leprorreacciones tipo i tras iniciar tratamiento antirretroviral en pacientes con coinfección por VIH-M. leprae10,12. Se cree que este tipo de reacción corresponde a casos de SIRI de desenmascaramiento de una infección por M. leprae que se encontraba latente en pacientes infectados por el VIH10.
En lo que se refiere a procesos no infecciosos la RP/SIRI se puede asociar a enfermedades autoinmunes, endocrinas o neoplásicas10,11. Entre estos cabe destacar los casos de RP/SIRI asociada al sarcoma de Kaposi, en el que se han descrito formas poco comunes y fatales asociadas a tratamiento antirretroviral9,10, casos de RP/SIRI sarcoidea, que se ha descrito con aparición más tardía, generalmente varios meses tras iniciar tratamiento antirretroviral, en comparación con otras enfermedades granulomatosas, como las micobacterias, de aparición más precoz9–11, o casos de RP/SIRI asociada a enfermedad de Graves Basedow9–11.
El desarrollo de una RP/SIRI en pacientes con diagnóstico de tuberculosis no infectados por VIH que reciben un adecuado tratamiento antituberculoso no es rara, ya que diversos estudios describen una frecuencia que varía entre 6-30% de los pacientes que reciben terapia antituberculosa6,8,13. La RP/SIRI afecta por igual a ambos sexos, habiéndose descrito desde niños a ancianos14. Su diagnóstico solo puede realizarse tras excluirse otros motivos que justifiquen esta sintomatología, como una sobreinfección añadida, terapia antituberculosa incorrecta, mal cumplimiento en la toma de la medicación, efectos secundarios de esta, absorción inadecuada del fármaco o desarrollo de resistencia a los tuberculostáticos6,8 (tabla 1). Este empeoramiento paradójico de tuberculosis en pacientes no infectados por el VIH es más frecuente en el sistema nervioso central, el aparato respiratorio y los ganglios linfáticos6,8,15,16. La afectación por esta respuesta del hueso, los tendones, el pericardio y la región ileocecal son otras de las localizaciones descritas, aunque con mucha menor frecuencia6,8. En el caso de la RP/SIRI con afectación cutánea la mayoría de los casos se refieren al desarrollo de abscesos subcutáneos en tuberculosis miliar7,8. La mayoría de las veces el deterioro clínico paradójico tras el inicio de la medicación antituberculosa es un fenómeno autolimitado, que no precisa cambios o suspensión del tratamiento antituberculoso8. En algunos casos que han presentado una RP/SIRI intensa, especialmente en tuberculomas intracraneales, se han añadido corticoides orales, con el supuesto de que estos podrían ayudar a suprimir la respuesta inmunológica que se cree que es la causante de este efecto; sin embargo aún no está claro el beneficio real de este tratamiento16, ya que en algunos casos se han descrito rápidas mejorías tras iniciar terapia corticoidea, pero en otros el deterioro clínico ha continuado a pesar de añadir este tratamiento17. En la mayoría de las series su uso parece seguro6 y beneficioso en el curso de este fenómeno, sin embargo son necesarios trabajos prospectivos que avalen su manejo8. Algunas publicaciones indican situaciones concretas en las que sería correcto añadir prednisolona a dosis de 1 a 2mg/kg/día durante no más de 6 semanas, como por ejemplo en casos de poliserositis tuberculosa, RP/SIRI sarcoidea, RP/SIRI autoinmunitaria, LMP por virus JC, o formas graves de RP/SIRI con independencia de su etiología, entre otros10.
Criterios de exclusión para diagnóstico de respuesta paradójica
| Terapia antituberculosa incorrecta |
| Mal cumplimiento de la pauta terapéutica |
| Absorción defectuosa de los fármacos |
| Resistencias a los fármacos utilizados |
| Sobreinfección u otro cuadro sobreañadido que justifique la sintomatología |
| Efectos secundarios de la terapia antituberculosa |
Los mecanismos de las reacciones paradójicas no se conocen bien, pero parecen ser inmunomediados por una respuesta inmunológica anormal a las proteínas liberadas por los bacilos tuberculosos destruidos8, un descenso de la inmunosupresión o un fenómeno local inducido por linfocitos altamente reactivos estimulados por micobacterias en disolución13,16. En nuestro paciente creemos que estos mecanismos, así como la reconstitución inmune secundaria a la suspensión del metotrexato, podrían ser la explicación para la RP/SIRI que presentó.
Como conclusión, presentamos un caso de LV que sufrió una RP/SIRI a la terapia antituberculosa, con un buen resultado final. En la literatura no hemos encontrado presentaciones similares, lo que probablemente se deba a que son situaciones infradiagnosticadas o poco publicadas. Como en la mayoría de los casos que padecen esta RP/SIRI, no fue necesario suspender ni modificar el tratamiento por el empeoramiento de sus lesiones cutáneas, aunque la detección de hepatotoxicidad obligó a la suspensión temporal del tratamiento, siendo el resultado final, tras la reintroducción de los fármacos, muy satisfactorio.
Creemos que esta reacción inmunológica paradójica temprana (2 semanas) pudo estar influenciada por la suspensión del metotrexato unida al hecho de que prácticamente al mismo tiempo se añadió el tratamiento antituberculoso.
Debido a que nuestro medio está viviendo un aumento de infección tuberculosa por diversos factores, como la epidemia del sida, el aumento de uso de los fármacos inmunosupresores, la inmigración de personas procedentes del tercer mundo y el incremento de cepas de M. tuberculosis resistentes a los tuberculostáticos de primera línea1,2,8, podrían aumentar también los casos de TBC, por lo que esta RP/SIRI tras el inicio del tratamiento podría verse con más frecuencia en la práctica clínica habitual y deberíamos estar familiarizados con ella.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.