En la actualidad existe una amplia variedad de tratamientos para el cáncer cutáneo no melanoma, como son 5-fluoracilo, mebutato de ingenol, imiquimod, diclofenaco, terapia fotodinámica, metotrexato, cetuximab, vismodegib, radioterapia, todos ellos con altas tasas de respuesta clínica e histológica. Sin embargo, algunos tumores no responden al tratamiento, debido a la aparición de resistencias, tanto primarias como adquiridas. El estudio de los procesos de resistencia es un campo extenso de investigación que conlleva a ampliar los conocimientos de la naturaleza de cada tumor, las características biológicas que lo hacen resistente y el diseño de nuevas terapias dirigidas contra los mismos. En este segundo trabajo se revisan las resistencias descritas a otros tratamientos no quirúrgicos frente al cáncer cutáneo no melanoma, diferentes a los tratamientos tópicos, como son diferentes anticuerpos monoclonales frente a CBC y CEC, la quimioterapia intralesional, la terapia fotodinámica y la radioterapia.
A wide range of treatments is now available for nonmelanoma skin cancer, including 5-fluorouracil, ingenol mebutate, imiquimod, diclofenac, photodynamic therapy, methotrexate, cetuximab, vismodegib, and radiotherapy. All are associated with high clinical and histologic response rates. However, some tumors do not respond due to resistance, which may be primary or acquired. Study of the resistance processes is a broad area of research that aims to increase our understanding of the nature of each tumor and the biologic features that make it resistant, as well as to facilitate the design of new therapies directed against these tumors. In this second article, having covered the topical treatments of nonmelanoma skin cancer, we review resistance to other nonsurgical treatments, such as monoclonal antibodies against basal and squamous cell carcinomas, intralesional chemotherapy, photodynamic therapy, and radiotherapy.
El cáncer de piel es la forma más frecuente de tumor maligno en la población caucásica. Entre ellos los tipos más comunes son: el carcinoma basocelular (CBC), el carcinoma espinocelular (CEC) y a distancia en cuanto a su frecuencia el melanoma. Según los estudios estadísticos, la incidencia de estos 3 tipos de tumores ha ido en aumento en todo el mundo en los 20 últimos años, sin embargo se ha mantenido estable su tasa de mortalidad. Se han reportado tasas de 2,53 casos/1.000 habitantes/año, en el caso del CBC1, en un estudio más reciente se ha observado que la tasa de incidencia del cáncer cutáneo no melanoma (CCNM) está infraestimada, con tasas de incidencia en CBC de 113/100.000 personas/año y en el caso del CEC de 38/100.000 personas/año2.
Hoy en día la cirugía es el tratamiento más utilizado, y en la mayoría de los casos curativa. Sin embargo, en un 15,7% de los CCNM los márgenes son positivos3, y en el caso de escisiones quirúrgicas completas las tasas de recurrencia son del 4,2%, alcanzando porcentajes más bajos con márgenes amplios, dando lugar a grandes defectos quirúrgicos4.
En el CCNM, como ya hemos comentado en la primera parte de esta revisión, disponemos además de la cirugía de un amplio abanico de opciones terapéuticas que ha crecido en los últimos años a expensas de los tratamientos tópicos y, recientemente, de aquellos dirigidos frente a las diferentes dianas terapéuticas como son vismodegib o cetuximab, sin olvidarnos de las que previamente disponíamos como la terapia fotodinámica (TFD), la radioterapia o incluso los quimioterápicos intralesionales. Una de las principales causas de fracaso de los tratamientos disponibles en oncología es la resistencia a los diferentes tratamientos disponibles. El estudio de las diferencias clínicas, histológicas y biológicas del CCNM en su respuesta a los diferentes tratamientos nos ayuda a conocer mejor su mecanismo de acción, así como a aumentar su eficacia y eficiencia permitiendo la selección de los pacientes con mayores probabilidades de respuesta a la misma.
A continuación se exponen los principales mecanismos implicados en la resistencia a estos fármacos. En la tabla 1 se resumen los descritos en TFD, vismodegib y cetuximab.
Resumen de las tasas de eficacia y los mecanismos de resistencia descritos en terapia fotodinámica, vismodegib y cetuximab
| Eficacia | Variables relacionadas con la resistencia | |
|---|---|---|
| Terapia fotodinámica | Respuesta completa en CBC (a los 3 meses: 91% y a los 5 años: 76%)10. Recurrencia a los 24 meses: 15%13 Respuesta completa en EB (a los 3 meses: 86% al 93% y a los 24 meses: 68% al 71%)10. Recurrencia a los 12 meses: 5%14 Respuesta completa en QA (a los 3 meses: 69-91%)12. Recurrencia a los 12 meses: 25%15 | Grosor del tumor (>2mm)20 Variantes histológicas (CBC pigmentados, morfeiforme y la infiltrante, patrón infiltrativo)15,22,23 Ulceración23 Hiperqueratosis24 Localizaciones (cara y cuero cabelludo) en el CBC29 Mutaciones en p5337,38. Sobreexpresión de ciclina D138,39. Variaciones de la vía Wnt/B-catenina38,39. Mutaciones en el gen PTCH138,39. Modificaciones en la expresión de Pgp40–44 Activación de la vía MAPK y Nrf245,46 La autofagia y la reducción de los mecanismos efectores inmunes48 Cambios en las proteínas de adhesión celular y en el citoesqueleto49 Efecto citoprotector del óxido nítrico inducido por la TFD50,51 Bajas dosis de ROS con estimulación de las células tumorales59 |
| Vismodegib | Respuestas parciales hasta en el 30,3% de CBC metastásicos, duración media de la respuesta de7,6 meses73 CBC localmente avanzados 20,6% de respuestas completas y 22,2% de respuestas parciales, con duración media de la respuesta de 7,6 meses73 | Mutaciones en Ptch175 Principalmente mutaciones en Smo Cambios en el número de copias en Sufu y Gli279 Mutaciones en ciclina D1 (CCND1)76,80 Regulación positiva compensatoria del IGF-1R/PI3K80,81 |
| Cetuximab | Respuestas completas en un 5% Respuestas parciales 22,2% Control de la enfermedad en un 69% con una mediana de la supervivencia libre de progresión de 4,1 meses101 | Falta de mutaciones en RAS101 La actividad Src y su translocación nuclear dependiente de EGFR106 Inestabilidad de PTEN, la hiperactivación de Akt107 Aumento de expresión de ligandos de EGFR106,108 Regulación positiva de EGFR, HER 2 y HER 3109–112 |
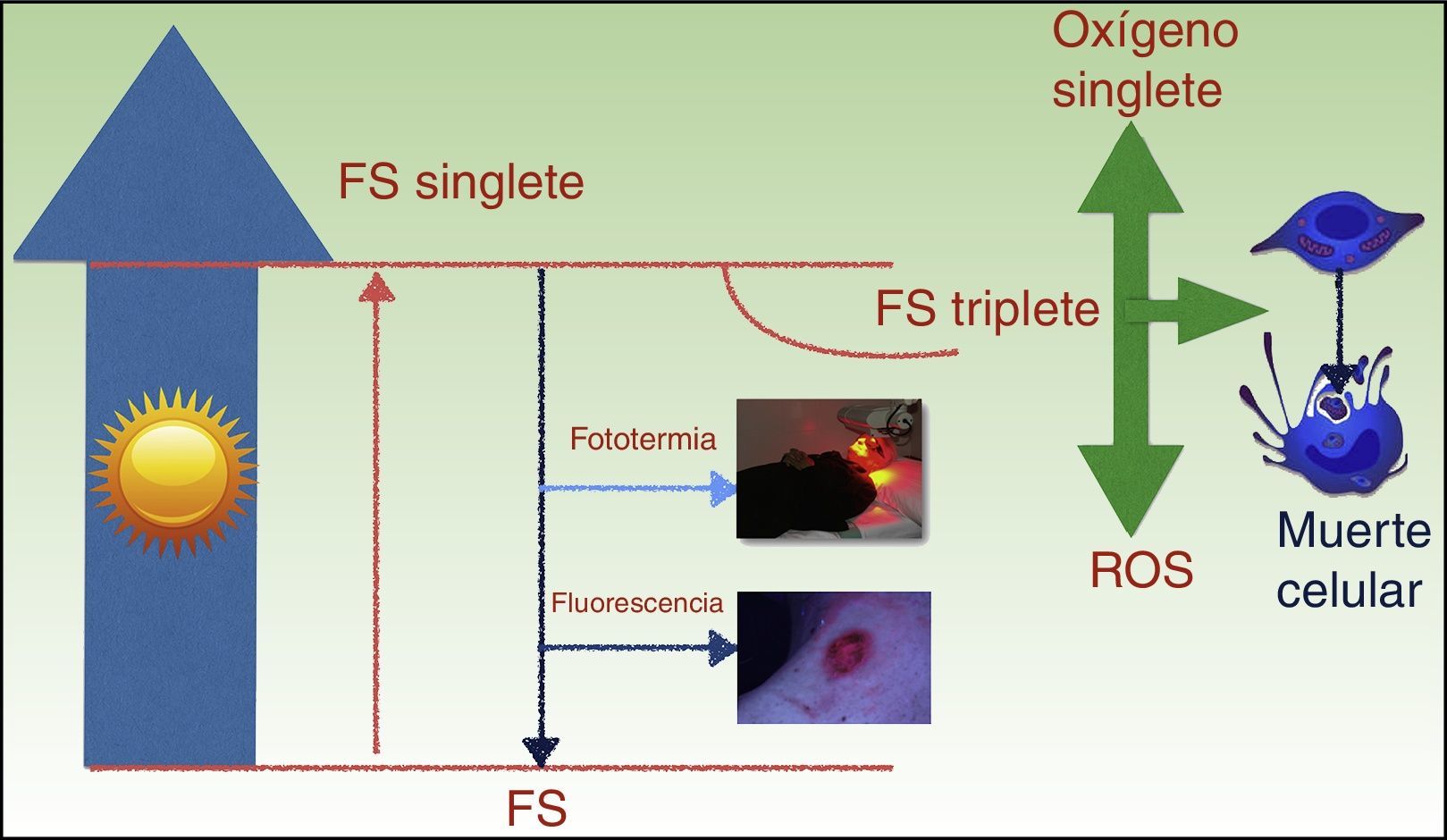
La TFD se fundamenta en las propiedades fotosensibilizantes de algunos compuestos que se activan con la luz y que, en presencia de oxígeno molecular (O2), generan especies reactivas de oxígeno (reactive oxygen species [ROS]) responsables de la muerte celular (fig. 1). En ella participan 3 componentes básicos: un compuesto fotosensibilizador (FS), luz y O25,6.
Mecanismo de acción de la TFD; la absorción de luz por un fotosensibilizador (FS) promueve un electrón a un orbital de mayor energía (FS-singlete) y a continuación este cambia la orientación de su momento angular de espín (FS-triplete). Su mayor vida del estado electrónico triplete favorece la formación de radicales libres y/u oxígeno singlete que dañan estructuras claves de la célula y finalmente causan su muerte.
Las propiedades antitumorales de la TFD derivan de los efectos citotóxicos directos sobre las células tumorales, e indirectos debido a su acción sobre el estroma del tumor. Además, tras el tratamiento se produce inflamación y respuesta inmune contra el tumor, fundamental para lograr el control tumoral a largo plazo5,7,8.
Los principales compuestos aprobados en oncología dermatológica en Europa son el ácido 5-aminolevulínico (ALA —Ameluz®—) y su derivado metilado (MAL —Metvix®—). Ambos son precursores del FS endógeno protoporfirina ix (PpIX), metabolito de la ruta hemo. Esta ruta está sujeta a un control feedback negativo, de manera que si se administra ALA o MAL exógenamente se acumula PpIX en las células tumorales. El MAL está aprobado en España para el tratamiento de QA, EB y para los CBC superficiales y nodulares menores de 2mm de profundidad, mientras que el ALA solo lo está para las QA5,9.
Entre las ventajas de la TFD destacan las altas tasas de respuesta completa, a los 3 meses del 91% y a los 5 años del 76% en el CBC, y a los 3 meses del 86% al 93% y a los 24 meses del 68% al 71% para la EB10. En el caso de las QA una única sesión de TFD con ALA (Levulan® y Kerastick®) obtiene tasas de curación del 76% y 72% al mes y al segundo mes del tratamiento respectivamente, aumentando al 86% cuando se administran 2 sesiones11. En el caso de la TFD con MAL (Metvix®) las tasas de respuesta por lesión a los 3 meses oscilan entre el 69% y el 91%12. Además, la TFD con MAL presenta bajas tasas de recurrencia, un 15% de los CBC recidivan a los 24 meses13, mientras que en el caso de la EB y las QA un 5% y un 25% recidivan a los 12 meses respectivamente14,15.
Otras ventajas son la posibilidad de combinar con otras terapias16, repetir el tratamiento cuando fuera necesario y todo ello con un excelente resultado cosmético y una gran satisfacción por parte del paciente17. Sin embargo, como limitaciones están el dolor durante la iluminación, la capacidad de penetración tanto del fotosensibilizante como de la luz y la posibilidad de aparición de resistencia, encontrando ocasionalmente tumores refractarios al tratamiento18,19.
Existen factores clínicos asociados a la resistencia a la TFD, como el grosor del tumor que ha sido el factor limitante más estudiado, especialmente en el tratamiento del carcinoma basocelular. McKay et al.20 observaron que un tumor mayor de 0,4mm de grosor tenía más posibilidades de recidivar. Las guías terapéuticas recomiendan no usar TFD en CBC nodulares de más de 2mm de grosor21.
Respecto a las variantes histológicas de los CBC, los pigmentados son más difíciles de tratar, ya que la melanina absorbe la luz, dejando la parte más profunda del tumor sin la suficiente luz para realizar la reacción fotodinámica, pudiendo dar lugar a tumores resistentes22. La variante histológica morfeiforme y la infiltrante, debido al aumento del colágeno y a los cordones de células que infiltran el tejido conectivo, lo hace más resistente a la penetración del fotosensibilizante, por eso la TFD no tiene indicación en este tipo de tumores15. Otros factores que influyen son la ulceración, comprobándose que puede ser un predictor negativo de la respuesta, al igual que el patrón infiltrativo23 y la hiperqueratosis24.
Según algunos autores el tamaño tumoral gigante o superior a 4cm en el caso del CBC puede ser un predictor de mala respuesta a la TFD25,26. Sin embargo, existen más estudios que apoyan la hipótesis de que el diámetro tumoral no afecta a la respuesta27–30. En el caso de la EB, Calzavara-Pinton et al.31 comprobaron que el diámetro de la lesión no es un predictor de la respuesta final, sin embargo se asocia a recaída.
Localizaciones como la cara o el cuero cabelludo tienen tasas más bajas de respuesta completa en el CBC que el tronco/cuello (a los 24 meses 54% vs. 88%)29. Y dentro de la cara, en la zona H las tasas de respuesta completa son más desfavorables, independientemente del tamaño tumoral29. Sin embargo, respecto a las queratosis actínicas, en estudios comparativos entre TFD vs. crioterapia las situadas en las extremidades parecen ser más resistentes a MAL-TFD que las ubicadas en la cara o en el cuero cabelludo32,33.
Pero no solo los factores clínicos pueden limitar la eficacia; se sabe que las células tumorales no siempre responden al estrés oxidativo generado por el tratamiento fotodinámico. Estas células serían las responsables de las recidivas que podrían progresar a situaciones más agresivas. De forma general, el proceso de resistencia puede deberse a factores tanto intrínsecos a las células tumorales como extrínsecos, en los que el ambiente tumoral desempeña un papel relevante en la respuesta a la TFD al proporcionar gradientes de factores de señalización, oxígeno y metabolitos34,35.
La resistencia a nivel intrínseco puede ser debida a un complejo conjunto de factores, incluyendo los relacionados con la expresión de genes implicados en la propia génesis del CCNM y los derivados del proceso fotodinámico36. En este sentido, las mutaciones en el ADN ocasionadas por la luz UV en los genes supresores de tumores, como p53, son frecuentes, habiéndose descrito como eventos tempranos en la carcinogénesis cutánea en un 50% de CBC y QA, y en un 90% de CCE37,38. También se ha descrito sobreexpresión de ciclina D1 en casi la mitad de QA, modificaciones de la vía Wnt/B-catenina (implicada en CCE) y mutaciones en el gen PTCH1 (que codifica para el receptor de proteínas Hedgehog [Hh]) en CBC, lo que podría afectar a la respuesta a la TFD38,39.
La concentración intracelular del fármaco es un mecanismo a destacar, y viene regulada por transportadores, como la glucoproteína-P (Pgp), que se encarga de expulsar el fármaco al medio. Existen estudios en líneas celulares de morfología epitelial: MA104 (población clonal proveniente de riñón de mono verde africano —Cercopithecus aethiops—), MDCK 60 y en células de leucemia mieloide crónica K562, resistentes a TFD obtenidas mediante múltiples ciclos de tratamiento, en las que existe una sobreexpresión de Pgp, mientras que en otros estudios no se ha encontrado dicha sobreexpresión40–44.
El estrés oxidativo ocasionado por la TFD activa cascadas de señalización implicadas en supervivencia, proliferación e inhibición de la apoptosis, mediadas por la proteína quinasa B (PKB/Akt), el factor nuclear k (NF-kB), la proteína quinasa activada por mitógenos (MAPK), la fosfatidil inositol-3 quinasa (PI3K) y la ciclooxigenasa 2 (COX-2), además de genes implicados en la ruta de respuesta antioxidante, como el factor relacionado con el factor nuclear eritroide 2 (Nrf2). La COX-2, que participa en la síntesis de prostaglandinas (PGE) y procesos inflamatorios45,46 está sobreexpresada en CCNM y se considera un marcador precoz de daño actínico. Las vías MAPK pueden ser activadas por el tratamiento fotodinámico y tener un papel relevante en el proceso de resistencia a TFD36.
Asimismo, tras la TFD se activa la ruta relacionada con Nrf2, el regulador principal de respuesta celular a procesos oxidativos. Nrf2 activa la transcripción de genes que tienen un elemento ARE en sus promotores, como la glutatión transferasa (GSH), la NADP (H) quinona oxidorreductasa 1 (NQO1), la hemooxigenasa 1 y la superóxido dismutasa, entre otras. Todas ellas tendrían un papel fundamental neutralizando las ROS y promoviendo la detoxificación, lo que podría favorecer la resistencia a TFD47.
También existen diversos estudios que relacionan la autofagia mediante la reducción de los mecanismos efectores inmunes48, así como proteínas de adhesión celular y del citoesqueleto en la resistencia a TFD49.
Además, está bien establecido en una gran variedad de tumores que el óxido nítrico media la supervivencia celular, el crecimiento, así como la migración y la invasión. La TFD resulta en la inducción de óxido nítrico tanto en el propio tumor como en el micro-entorno. El efecto citoprotector del óxido nítrico inducido por la TFD es el resultado de bajos niveles que activan el NF-kB/Snail YY1, favoreciendo la supervivencia/anti-apoptosis e inhibiendo la Raf kinase inhibitory protein, supresor de supervivencia/pro-apoptosis y metástasis50,51.
No hay muchas publicaciones que analicen los mecanismos por los que se produce la mala respuesta a TFD, y menos aún en CCNM, pero en los últimos años esta línea de investigación ha generado un interés creciente. Diferentes estudios ponen de manifiesto la resistencia a la TFD a nivel preclínico en modelos celulares y animales40–43,52–54. De la misma manera se han descrito resistencia a TFD en pacientes19,55,56. Nuestro grupo ha descrito resistencia a TFD con MAL en cultivos de queratinocitos murinos (Pam-212) con activación de la ruta PI3K/Akt57. Asimismo, se han aislado y caracterizado células de carcinoma escamoso humano de piel SCC13 resistentes a TFD con activación de la vía de PI3K/Akt58 y MAPK/ERK que parecen estar relacionados con el incremento de la agresividad tumoral tras la TFD en pacientes afectados de CCE invasivo19.
Finalmente, se ha descrito un incremento de la proliferación en cultivos celulares mediado por ROS con bajas dosis de TFD con MAL59. Ello podría apoyar el hecho de que en algún área tumoral que reciba una dosis fotodinámica insuficiente para destruir las células tumorales, las bajas dosis de ROS pudieran estimular la proliferación de las mismas.
Punto clave: entre los diversos mecanismos que se han descrito asociados a resistencias a TFD se encuentran parámetros clínicos como el espesor, el tamaño, la localización, el tipo histológico y parámetros moleculares como son: la sobreexpresión de Pgp; la alteración en la vía MAPK; las resistencias tumorales secundarias a Nrf2 y la activación de la transcripción de genes que tienen un elemento ARE en sus promotores; la autofagia y la reducción de los mecanismos efectores inmunes; y el efecto citoprotector del óxido nítrico inducido por la TFD que activan el NF-kB/Snail YY1 e inhiben la Raf kinase inhibitory protein favoreciendo la superviviencia tumoral.
Resistencia a metotrexatoEl metotrexato (MTX) intralesional se ha mostrado efectivo en el tratamiento adyuvante a la cirugía del queratoacantoma60,61 y también del CCE62.
El MTX es un análogo del ácido fólico que se une a la dihidrofolato reductasa, provocando la inhibición de la síntesis de ADN y la posterior muerte celular. En muchas ocasiones los queratoacantomas, dado su rápido crecimiento, se convierten en grandes tumores que, al tratarlos quirúrgicamente, pueden ocasionar defectos funcionales y cosméticos importantes. Annest et al. trataron con MTX —una media de 2,1 inyecciones durante un promedio de 18 días— una serie de 38 pacientes con queratoacantomas, obteniendo unas tasas de curación del 92%63.
La velocidad de crecimiento del queratoacantoma parece determinar su sensibilidad o resistencia al MTX. Así, la sensibilidad es alta al comienzo de la aparición del queratoacantoma, mientras que en estadios finales, en los que el crecimiento es más lento, no es de gran utilidad64.
Actualmente, aunque no existe un protocolo estandarizado de tratamiento con MTX, la concentración del compuesto (generalmente entre 12,5 a 25mg/ml) y/o la frecuencia de las inyecciones (desde una hasta 4 veces semanalmente) parecen estar en relación con la respuesta tumoral65.
Punto clave: la velocidad de crecimiento del queratoacantoma parece influir en su respuesta, encontrándose una mayor tasa de resistencia en aquellos de crecimiento lento.
Resistencia a vismodegibVismodegib (GDC-0449) es una molécula de administración oral que inhibe selectivamente la vía de señalización Hh. Consituye el primer fármaco disponible para el tratamiento del CBC localmente avanzado y metastásico66,67.
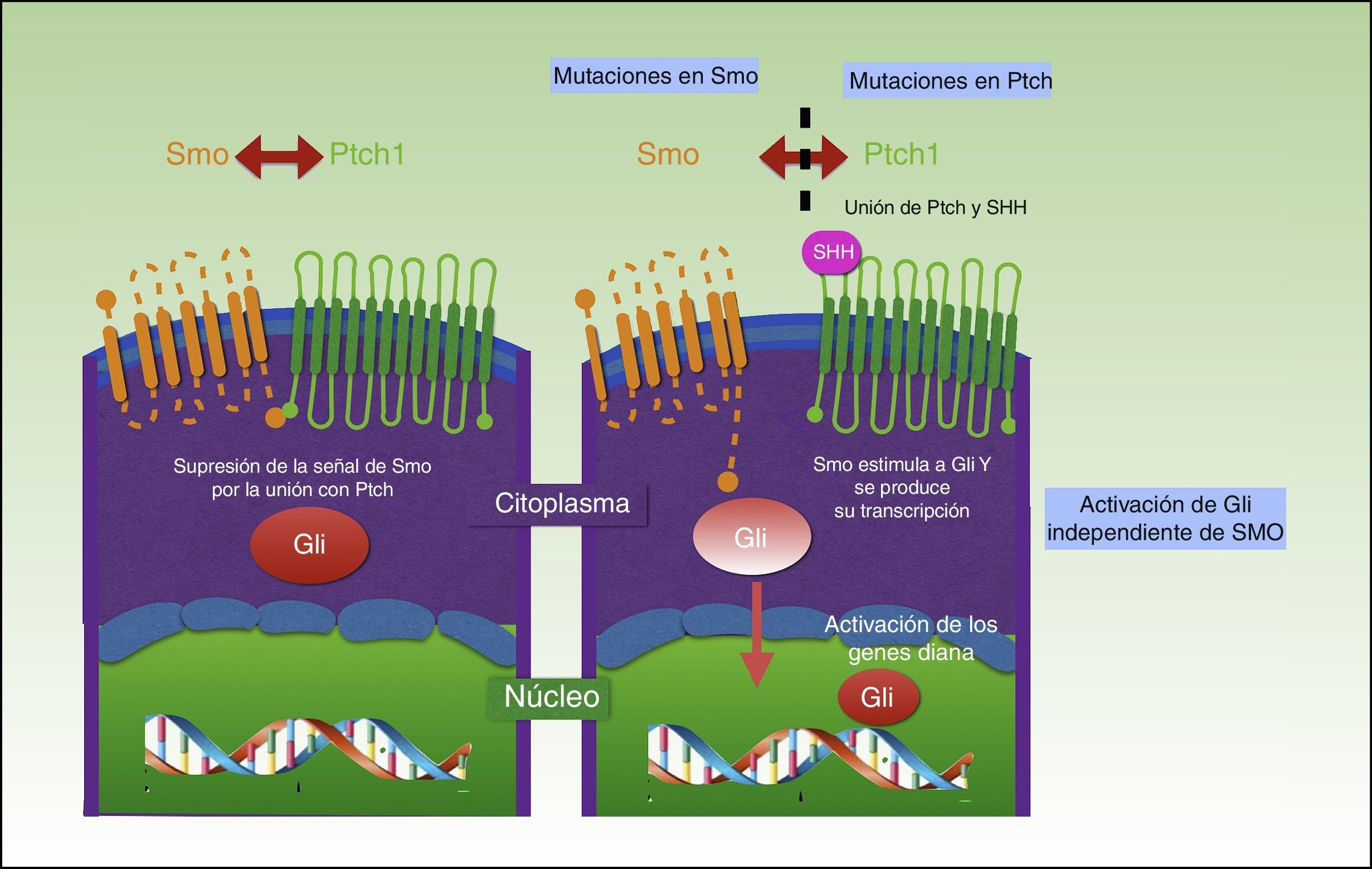
Se han descrito 3 moléculas de señalización de Hh en vertebrados que son Indian Hh ([Ihh] expresado en intestino y condrocitos), Desert Hh ([Dhh] expresado en las células de Sertoli) y Sonic Hh (Shh), relacionado con muchos procesos y mejor conocido. La vía de señalización Hh está compuesta por 3 elementos fundamentales: ligandos Hh, el receptor inhibitorio Patched (Ptch) y el receptor de señal Smoothened (Smo)68.
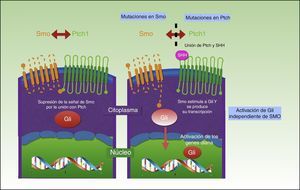
La proteína Ptch es el receptor de Shh y regula negativamente esta vía. El regulador positivo de la vía es la proteína Smo, que se encuentra permanentemente activada en ausencia de Ptch. A su vez, Smo activa los factores de transcripción Gli, que penetran en el núcleo activando la transcripción de genes implicados en el crecimiento celular, los cuales, a su vez, mediante feedback negativo, controlan a Ptch y a Gli. El resultado es una activación de la vía con proliferación, apoptosis y diferenciación epidérmica (fig. 2). Cuando los factores Gli están proteolizados actúan como inhibidores de la transcripción; su proteólisis depende de la unión a microtúbulos y a las proteínas denominadas supresor of fused (Sufu) que se unen a Gli impidiendo la activación de los genes diana de la vía Hh69–71.
En los CBC esporádicos podemos encontrar mutaciones en esta vía provocadas por la radiación UV. En un 80% por la inactivación de Ptch1, en un 10% por la ganancia de función en Smo y solo en un 1% por mutaciones en Sufu68.
Vismodegib se une e inactiva específicamente a Smo, impidiendo la activación de Gli, lo que frena la proliferación y el crecimiento tumoral. Von Hoff et al.72, en un ensayo clínico en fase i, observaron una tasa de respuesta en pacientes con CBC localmente avanzado y metastásico del 60% y 50%, respectivamente. Se ha comprobado en ensayos en fase ii que con una dosis diaria de vismodegib 150mg se obtuvieron respuestas parciales hasta en el 30,3% de CBC metastásicos, y en CBC localmente avanzados 20,6% de respuestas completas y 22,2% de parciales73.
Sin embargo, desde su aprobación se han ido notificando casos de resistencia. El primer caso se publicó en un paciente con un meduloblastoma debido a una mutación en Ptch1 (PTCH1-W844C), y en otros genes implicados en la vía Hh, provocando una rápida progresión de la enfermedad. Posteriormente se han ido publicando casos de mutaciones aisladas principalmente de manera heterozigota en Smo74,76.
Por otro lado, Brinkhuizen et al.77 investigaron la respuesta a Vismodegib en función de diferentes mutaciones que no estuviesen presentes en el tumor primario, es decir, que fueran resistencias adquiridas. Así, observaron que la mutación en SMO —c.842G[T (p.Trp281Leu) en el exón 4 y c.961G[A(p.Val321Met) en el exón 5— no estaba presente en el tumor inicial y sí en el tumor resistente.
Pricl et al.78 realizaron un estudio sobre resistencia primaria y adquirida a vismodegib describiendo 2 casos. El primero fue un caso con CBC metastásico que tras 2 meses de tratamiento con vismodegib 150mg/día se confirmó mediante un TAC la progresión de la enfermedad (resistencia primaria). El segundo paciente era un CBC localmente avanzado de gran tamaño (12cm), ulcerado, localizado en la región supraescapular y que debido a su irresecabilidad se decidió iniciar el tratamiento con 150mg/día de vismodegib. Aunque se obtuvo una respuesta clínica completa a los 5 meses, se produjo una recidiva tumoral 6 meses más tarde (resistencia adquirida). En el primer caso se descubrió una nueva mutación SMO G497W, y en el segundo existía en SMO una mutación D473Y solo en las biopsias postratamiento. La primera mutación SMO G497W da lugar a un reordenamiento conformacional de la proteína que resulta en una obstrucción parcial del sitio de entrada del fármaco, mientras que la mutación SMO D473Y induce un efecto directo en la geometría del sitio de unión que conduce a una interrupción total de la formación de enlaces de hidrógeno. Por lo tanto, ambas mutaciones pueden representar mecanismos diferentes.
Recientemente, Sharpe et al.79, realizando una secuenciación del exoma, comprobaron una heterogeneidad intratumoral, sin observar mutaciones en las biopsias pretratamiento, siendo por tanto todas ellas adquiridas y conduciendo a una hiperactivación de la vía Hh. Estas mutaciones tienen lugar en Smo afectando a 2 zonas, las que estaban en el sitio de unión al fármaco frente a las que aparecían de manera distal, pudiendo existir mecanismos de resistencia cruzada. En menor proporción se detectaron cambios en el número de copias en Sufu y Gli2.
Además se han observado otros mecanismos de resistencia como mutaciones en el gen diana Hh ciclina D1 (CCND1)76,80, y una regulación positiva compensatoria del IGF-1R/PI3K, como una posible vía en el desarrollo de resistencia a los antagonistas de Smo. Este mecanismo se ha observado en tumores resistentes LDE-22580,81.
Actualmente, los esfuerzos se centran en investigar nuevas dianas terapéuticas y desarrollar inhibidores de segunda generación que conserven actividad en presencia de mutaciones. Entre las diferentes estrategias se encuentra la inhibición de la vía Hh a través de itraconazol o con el óxido de arsénico, ambos antagonistas de la vía de señalización Hh con un mecanismo de acción diferente a vismodegib82,83.
Un enfoque alternativo podría consistir en bloquear otras vías que interactúen con la señalización de la vía Hh en el CBC y que conducen a una estimulación independiente de Gli1 e independiente de SMO, como EGFR84, la proteína quinasa C atípica ι/λ85, la proteína quinasa A86 y las vías RAS/MAPK y la de PI3K70,81,87.
A pesar de la buena respuesta inicial, los pacientes tratados con antagonistas de Smo han desarrollado con el tiempo resistencia debido a mecanismos de compensación que se van generando. Además, los antagonistas de Smo no son eficaces en tumores donde la hiperactivación de Hh se debe a mutaciones de componentes de la ruta distal de Smo, o en caso de la vía de activación no canónica, por la que se activan los factores de transcripción de Gli independiente de Smo. Por todas estas razones existe una intensa investigación en inhibidores de Hh, que actúan de manera distal a Smo88, como GANT61, que bloquea la función Gli89, y en una nueva clase de fármacos que se dirigen al bromodominio adicional C-terminal (BET), y las proteínas bromodominio (BRD2-4, BRDT) que reconocen residuos de lisina acetilados, como son los residuos de lisina del extremo N-terminal de las histonas, dando lugar a una asociación proteína-histona, y consecuentemente un reordenamiento de la cromatina. BRD4 regula la transcripción Gli actuando en los promotores de Gli1 y Gli2, eludiendo todos los mecanismos de resistencia de inhibidores de SMO que se han reportado hasta la fecha y que incluyen mutaciones de Smo o Sufu o amplificaciones en Gli290,91.
Punto clave: los casos de resistencia a vismodegib se deben a mutaciones somáticas en Ptch, pero sobre todo en Smo, así como a mutaciones distales a este receptor transmebrana, como la activación de Gli independiente de Smo o la regulación positiva compensatoria del IGF-1R/PI3K.
Resistencia a anticuerpos frente al receptor del factor de crecimiento epidérmico (cetuximab)En los últimos años la aprobación de cetuximab, un anticuerpo monoclonal que inhibe la actividad del receptor del factor de crecimiento epidérmico (EGFR), ha abierto otra posible vía para el tratamiento sistémico de pacientes con CCE irresecables o metastásicos. EGFR pertenece a la familia erbB de receptores, que consta de 4 miembros: erbB1 (EGFR), erbB2 (neu), erbB3 y erbB492.
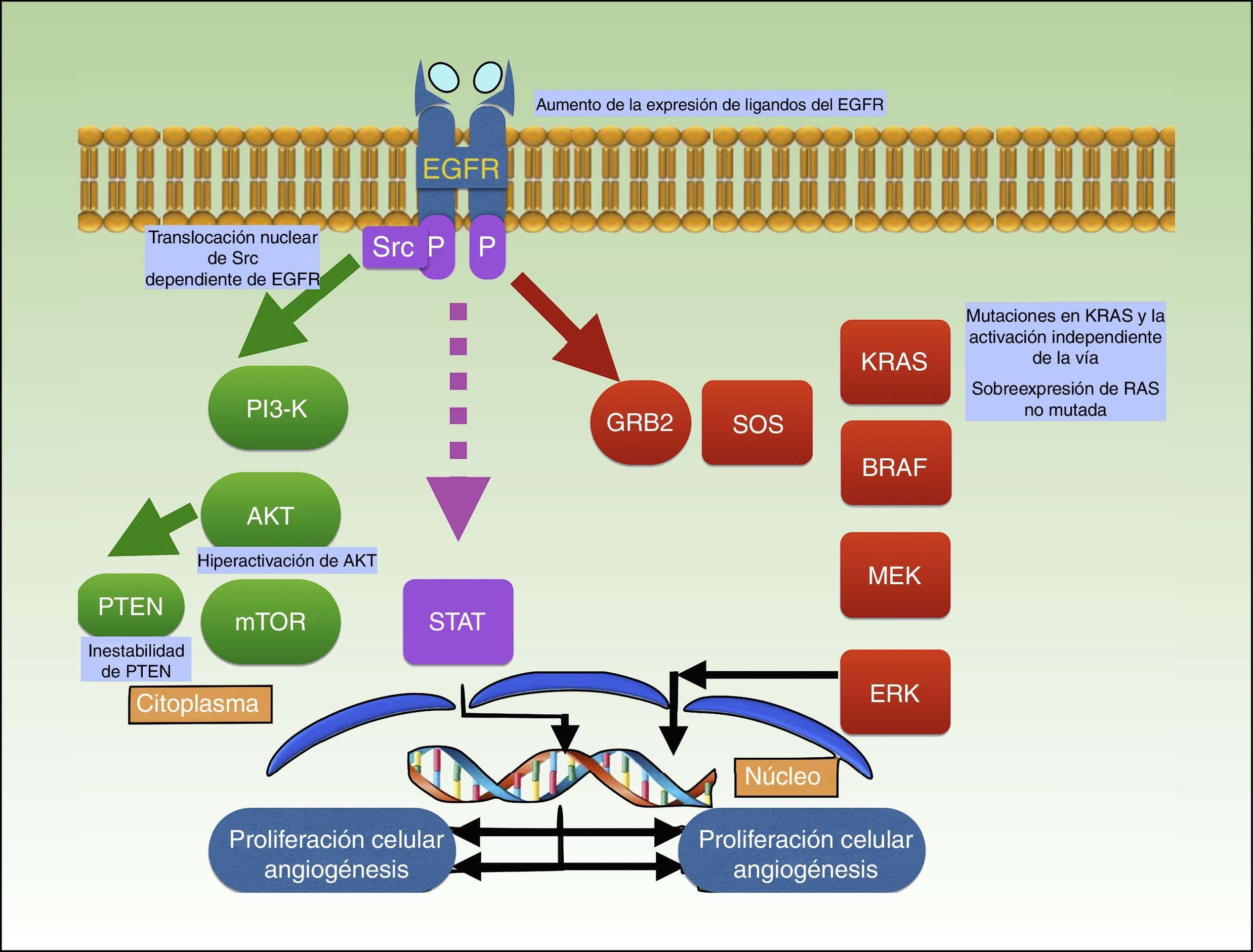
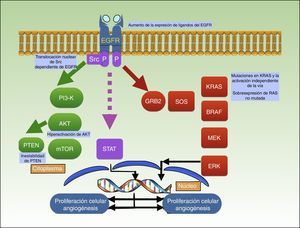
La unión de un ligando al dominio extracelular del receptor induce la activación de varias vías de señalización intracelulares, incluyendo PI3K/Akt, la señal de transducción y activación de la transcripción (STAT) y la vía Ras-MAPK, todas ellas involucradas en el crecimiento celular, la proliferación y/o la supervivencia (fig. 3)92–94.
Mecanismo de acción de cetuximab, que bloquea EGFR, con lo que impide la activación de varias vías de señalización intracelulares, incluyendo PI3K/Akt, la señal de transducción y activación de la transcripción (STAT) y la vía Ras-MAPK; se representan en el gráfico las diferentes mutaciones descritas hasta la actualidad que actúan como factores de resistencia a cetuximab en CEC.
El importante papel del EGFR en proliferación, supervivencia y progresión de las células tumorales humanas ha hecho que se desarrollen dianas terapéuticas, lo que supone un avance importante en la oncología95–99.
En cuanto al papel del EGFR en el CCNM, su expresión en los CCE se ha correlacionado con peor pronóstico100. Su bloqueo con cetuximab ha mostrado ser útil en CCE de cabeza y cuello y, aunque con menor número de publicaciones, ha demostrado su actividad en CCE cutáneo localmente avanzado, irresecable o metastásico. Un ensayo clínico de fase ii que incluyó 36 pacientes demostró 8 respuestas parciales, 2 respuestas completas y una tasa de control de la enfermedad del 69% a las 6 semanas, con una mediana de la supervivencia libre de progresión de 4,1 meses. Como criterio de inclusión era necesario la sobreexpresión de EGFR, y los resultados revelaron que sus niveles de expresión en el tumor estaban asociados con la eficacia. Además, se estudiaron otras mutaciones, concluyendo que la falta de mutaciones en RAS hace que los tumores sean más sensibles al tratamiento con cetuximab101.
En cáncer de colon y CCE de cabeza y cuello se han descrito diferentes mecanismos moleculares que podrían estar involucrados en el proceso de resistencia, como las mutaciones en K-RAS y la activación constitutiva de EGFR y su vía distal102–105.
Li et al.106 describieron que la resistencia adquirida a cetuximab se asociaba con la actividad Src y su translocación nuclear dependiente de EGFR. Otros mecanismos que se han encontrado en casos de resistencia han sido: la inestabilidad de PTEN, la hiperactivación de Akt107, el aumento de expresión de ligandos de EGFR106,108 y la regulación positiva de EGFR, HER 2 y HER 3109–112.
Punto clave: determinadas mutaciones en K-RAS, la activación constitutiva de EGFR, la sobreexpresión de la proteína RAS no mutada, la translocación nuclear Src dependiente de EGFR, la inestabilidad de PTEN, la hiperactivación de Akt, el aumento de expresión de ligandos de EGFR y la regulación positiva de EGFR, HER 2 Y HER 3 son mecanismos que se han detectado en casos de resistencia a cetuximab.
Resistencia a radioterapiaLa radioterapia consiste en el uso de radiaciones ionizantes para combatir un tumor. La radiación ionizante puede causar daño directo a las células o mediante la producción de ROS, siendo el ADN la principal diana celular. Hay 2 tipos principales: los fotones (rayos X y rayos gamma), que son los más usados, y la radiación de partículas (electrones o protones, entre otras). En los primeros los efectos de la radiación son a través de la producción de radicales libres, mientras que en los segundos cobra más importancia el daño directo al ADN. Tras la exposición a la radiación se puede inducir la detención del ciclo celular y reparar el daño o inducir la apoptosis, o en algunos casos promover la división celular y la producción de resistencia113,114.
La radioterapia es efectiva como primer tratamiento en CBC y CCE, con tasas de curación, a los 5 años, en torno al 90%. También lo es en carcinomas de piel que han recurrido a una primera cirugía. Así, cuando otras modalidades terapéuticas fallan o no pueden usarse, la radioterapia ha sido durante décadas una opción terapéutica para el CCNM. Sin embargo, la radiación ionizante tiene efectos secundarios bien conocidos, y por lo tanto la cantidad aplicada es limitada y pueden aparecer recidivas115,116.
En el tratamiento del CBC la radioterapia proporciona tasas altas de curación a los 5 años de más del 90% en la mayoría de los estudios, así como muy pocas complicaciones. La radioterapia también puede usarse en casos de recurrencia, invasión perineural y márgenes positivos tras cirugía en CCE. Es beneficiosa en determinadas regiones como el párpado inferior, el labio, la punta de la nariz y el pabellón auricular, con una eficacia entre el 70% y el 95%, y porcentajes de recurrencia en torno a un 3-11%, aunque según el grado de diferenciación histológica y la localización del tumor este porcentaje aumenta116–120.
Se ha comprobado que tanto la inhibición de EGFR como de STAT3, que desempeña un papel importante en la transmisión de las señales de crecimiento que se inician en el nivel de EGFR, mejoran los efectos de los tratamientos convencionales, como es la radioterapia en los CEC. Con lo que la activación constitutiva de ambos puede dar lugar a tumores menos radiosensibles y más resistentes a la misma121.
Punto clave: la activación de EGFR y de STAT3 afecta a la radiosensibilidad de las células del CEC.
Resistencia a quimioterapiaSe han utilizado varios agentes quimioterápicos en el tratamiento del CBC avanzado e irresecable y en el CEC. En el caso del CEC el cisplatino se ha utilizado solo o combinado con resultados variables. Las combinaciones se han hecho principalmente con bleomicina, doxorrubicina y 5-FU, e incluso una combinación de quimiorradiación con 5-FU. Sin embargo, no existen ensayos aleatorizados sobre su uso, y la mayoría de los datos sobre su eficacia se basan en pequeñas series de casos. En el caso del CBC parece que cisplatino, solo o en combinación, y otro régimen como vincristina, bleomicina y prednisolona son los más eficaces. Sin embargo, la quimioterapia tradicional no ha podido demostrar respuestas a largo plazo, excepto en unos pocos casos aislados, por lo que principalmente se usa como tratamiento paliativo122.
ConclusionesExiste una amplia variedad de resistencias a los tratamientos no quirúrgicos en el CCNM que varían desde el propio transporte del fármaco al interior de la célula, como la Pgp en la TFD, mutaciones en los genes diana como en SMO por vismodegib, alteraciones en la vías moleculares como MAPK en TFD y en los inhibidores del EGFR o incluso en las características de la propia célula desde sus moléculas de adhesión, el citoesqueleto, el tamaño y la evolución tumoral. Todas estas resistencias primarias y adquiridas nos ayudan a ampliar los conocimientos biológicos de cada tumor e investigar nuevas dianas u otras alternativas terapéuticas para afrontar las recidivas y la falta de respuesta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.