Los corticosteroides son el tratamiento sistémico de elección en los pacientes con pénfigo vulgar (PV). Su administración crónica produce efectos secundarios. La administración de ciclofosfamida (CF) intravenosa puede mejorar las manifestaciones clínicas del PV.
Material y métodoEstudiamos prospectivamente 8 pacientes diagnosticados de PV. Seis de los pacientes presentaban PV cutáneo-mucoso (PVCM) y 2 casos PV mucoso (PVM). El tratamiento consistió en 10 ciclos quincenales de CF en dosis de 10-15mg/kg, manteniendo la dosis inicial de corticosteroides y de inmunosupresor. Se evaluó la eficacia clínica y la evolución del título de anticuerpos anti-sustancia intercelular epidérmica (SIE) (inmunofluorescencia indirecta) y específicamente anti-desmogleína (Dsg) 1 y 3 (ELISA).
ResultadosTodos los pacientes con PV presentaron una excelente respuesta al tratamiento. Cinco de los 8 pacientes presentaron una remisión completa de las lesiones de PV después de los 10 ciclos de CF. En los otros 3 pacientes las lesiones cutáneas desparecieron unas semanas después del último ciclo de CF. En todos los pacientes se redujo de forma importante la dosis de inmunosupresores. Además, en todos los casos se observó una mejoría en la respuesta inmunológica después del tratamiento con CF, con disminución en el título de anticuerpos frente a las Dsg 1 y 3, así como del título de anticuerpos circulantes frente a la SIE. Tras un seguimiento medio de 15,1 meses (1-25 meses) ningún paciente ha presentado nuevas lesiones de PV. A su vez, no se han observado efectos secundarios por la CF.
ConclusionesLa administración de pulsos quincenales de CF intravenosa puede ser una opción terapéutica útil en pacientes con PV grave. Este esquema terapéutico permite disminuir la dosis de corticosteroides con una menor dosis acumulada de CF que en la administración oral diaria. Además, nuestros resultados muestran que este esquema terapéutico se acompaña de una remisión clínica e inmunológica en la mayoría de los pacientes.
Corticosteroids are the systemic treatment of choice in patients with pemphigus vulgaris, but chronic administration is associated with side effects. Intravenous treatment with cyclophosphamide can improve the clinical signs of pemphigus vulgaris.
Material and methodsWe prospectively studied 8 patients diagnosed with pemphigus vulgaris. Six of these had mucocutaneous pemphigus vulgaris and 2 had mucosal pemphigus vulgaris. Treatment consisted of 10 cycles of cyclophosphamide at a dose of 10-15mg/kg separated by 15 days, while maintaining the initial corticosteroid and immunosuppressant dose. Clinical efficacy was assessed and the anti-epidermal intercellular substance (EIS) and anti-desmoglein (DSG) 3 and 1 antibody titers were monitored (by indirect immunofluorescence and enzyme-linked immunosorbent assay, respectively).
ResultsAll patients with pemphigus vulgaris responded excellently to treatment. Five of the 8 patients achieved complete remission of pemphigus lesions after 10 cycles of cyclophosphamide. In the other 3 patients, the skin lesions disappeared a few weeks after the last cycle of cyclophosphamide. A substantial reduction in immunosuppressant dose was possible in all patients. Furthermore, an improved immunologic response was observed in all cases after cyclophosphamide treatment, with decreased anti-DSG1 and anti-DSG3 antibody titers and well as decreased circulating anti-EIS antibody titers. During the mean 15.1 month follow-up (range, 1-25 months), no new lesions appeared and no side effects of cyclophosphamide therapy were reported.
ConclusionsFortnightly cycles of intravenous cyclophosphamide may be a useful therapeutic option in patients with severe pemphigus vulgaris. A reduction of corticosteroid dose was possible with this therapeutic approach and the cumulative cyclophosphamide dose was lower than with daily oral administration. Our findings also show that the therapeutic approach induces clinical and immunologic remission in most patients.
El pénfigo vulgar (PV) es una enfermedad ampollosa autoinmune mediada por autoanticuerpos tipo inmunoglobulina G (IgG) dirigidos frente a las desmogleínas (Dsg) de los desmosomas de los queratinocitos de piel y mucosas1. Se reconocen dos formas clínicas: PV cutáneomucoso (PVCM) y PV mucoso (PVM). La mortalidad de esta enfermedad era elevada hasta la introducción de los corticosteroides como tratamiento de elección, estimándose actualmente en el 5–15 %2. En muchos de estos casos la causa de la muerte se debe a los efectos secundarios resultantes de la administración prolongada de corticosteroides y no propiamente al PV3-5.
Son muchos los fármacos que pueden ser utilizados de forma eficaz en el PV, permitiendo además reducir la dosis acumulada de corticosteroides sistémicos. Entre ellos destacan los fármacos antiinflamatorios, los fármacos inmunomoduladores o fármacos inmunosupresores, tales como la azatioprina, micofenolato mofetilo, ciclosporina o ciclofosfamida (CF). Con la combinación de corticosteroides y fármacos inmunosupresores se ha conseguido disminuir la morbilidad y la mortalidad en el PV5,6.
El objetivo principal en el tratamiento del PV es conseguir una eficacia clínica alta con una morbilidad terapéutica baja. En la literatura existen varios trabajos que muestran la eficacia clínica de la administración de ciclos intravenosos de CF7-11. Mediante esta vía de administración la morbilidad disminuye en comparación con la administración de CF diaria por vía oral, manteniéndose la eficacia terapéutica12,13. Siguiendo las indicaciones establecidas para la administración de CF por vía intravenosa10,11, llevamos a cabo este trabajo en 8 pacientes con PV grave, en los que añadimos este agente alquilante en ciclos cada quince días, asociados al tratamiento previo con prednisona y azatioprina o micofenolato mofetilo por vía oral. El objetivo principal del presente estudio fue evaluar la eficacia clínica e inmunológica en los pacientes, y conocer cómo la administración quincenal de CF intravenosa podría favorecer la disminución de corticosteroides e inmunosupresores.
Pacientes y métodosEste estudio prospectivo incluye 8 pacientes diagnosticados de PV grave durante el período comprendido entre 2002 y 2007. Todos los pacientes fueron atendidos en el Departamento de Dermatología de la Clínica Universitaria de Navarra. El diagnóstico de PV se basó en los hallazgos de la biopsia cutánea de las lesiones activas, de los estudios de inmunofluorescencia directa de la piel perilesional, así como en la detección de anticuerpos circulantes frente a las Dsg 1 y 3 mediante técnica de ELISA (MBL Naka-Ku, Nagoya, 460–002, Japan), y de anticuerpos frente a la sustancia intercelular epidérmica (SIE) mediante inmunofluorescencia indirecta (Movaco-Grifols, Spain). La información clínica y epidemiológica de cada paciente está incluida en la tabla 1. De los 8 pacientes, 6 presentaban PVCM y 2 PVM.
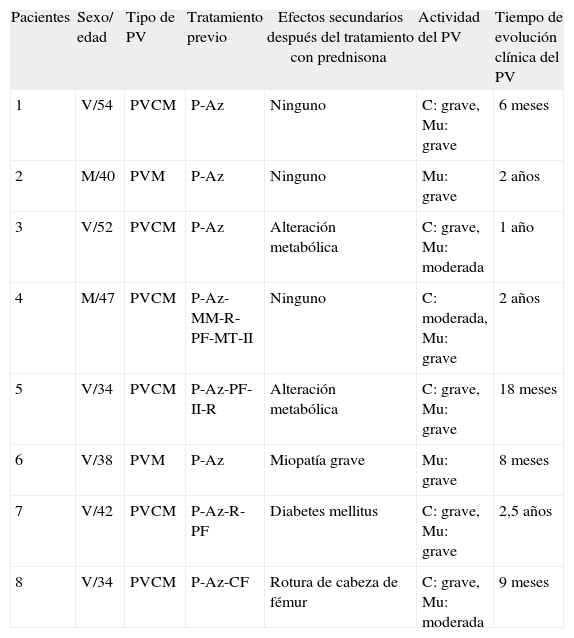
Información clínica de los pacientes con pénfigo vulgar antes del tratamiento con ciclos quincenales de ciclofosfamida
| Pacientes | Sexo/ edad | Tipo de PV | Tratamiento previo | Efectos secundarios después del tratamiento con prednisona | Actividad del PV | Tiempo de evolución clínica del PV |
| 1 | V/54 | PVCM | P-Az | Ninguno | C: grave, Mu: grave | 6 meses |
| 2 | M/40 | PVM | P-Az | Ninguno | Mu: grave | 2 años |
| 3 | V/52 | PVCM | P-Az | Alteración metabólica | C: grave, Mu: moderada | 1 año |
| 4 | M/47 | PVCM | P-Az-MM-R-PF-MT-II | Ninguno | C: moderada, Mu: grave | 2 años |
| 5 | V/34 | PVCM | P-Az-PF-II-R | Alteración metabólica | C: grave, Mu: grave | 18 meses |
| 6 | V/38 | PVM | P-Az | Miopatía grave | Mu: grave | 8 meses |
| 7 | V/42 | PVCM | P-Az-R-PF | Diabetes mellitus | C: grave, Mu: grave | 2,5 años |
| 8 | V/34 | PVCM | P-Az-CF | Rotura de cabeza de fémur | C: grave, Mu: moderada | 9 meses |
Actividad cutánea de la enfermedad: leve, menos de 20 ampollas; moderada, 20–40 ampollas; grave, más de 40 ampollas; sin lesiones. Actividad de la enfermedad en las mucosas: leve, 1–5 erosiones pequeñas; moderada, 5–10 erosiones; grave, más de 10 erosiones o erosiones grandes. Tomada de Fleischli ME et al11. Az: azatioprina; C: cutáneo; CF: ciclofosfamida; II: inmunoglobulinas intravenosas; MM: micofenolato mofetilo; MT: metotrexato; Mu: mucosa; P: prednisona; PF: plasmaféresis; PVCM: pénfigo vulgar cutáneo-mucoso; PVM: pénfigo vulgar mucoso; R: rituximab; V: varón.
Los pacientes incluidos en el protocolo fueron aquellos con PV grave o moderado según la escala propuesta por Fleischli et al11, cuando presentaban brotes de lesiones nuevas o lesiones antiguas que no curaban a pesar de recibir tratamiento adecuado, y aquellos pacientes que presentaron efectos secundarios por la administración de dosis elevada de prednisona necesaria para controlar las lesiones de PV. Los fármacos inmunosupresores que habían recibido previamente los pacientes fueron anticuerpo anti-CD20, plasmaféresis, metotrexato, Ig intravenosa y CF oral (tabla 1).
Inicialmente, los ciclos intravenosos de CF se administraron mensualmente, tal y como se ha descrito en la literatura8. No obstante, en el primer paciente que tratamos pudimos apreciar que con este intervalo aparecían rebrotes de lesiones activas antes de realizar la siguiente infusión. Por este motivo decidimos pautar los ciclos de CF cada quince días. Este primer paciente recibió 10 ciclos. A partir de entonces, todos los pacientes incluidos en este protocolo recibieron el mismo número de ciclos con la misma periodicidad.
Establecimos los siguientes criterios para excluir a los pacientes de este protocolo: embarazo o mujeres lactantes; administración de fármacos citotóxicos un mes antes; evidencia de infección grave; historia de neoplasias; consumo importante de alcohol o de sustancias tóxicas; úlcera péptica activa; historia de disfunción hepática (transaminasa glutámico pirúvica [GPT] > 70 UI/l) o insuficiencia renal (creatinina sérica > 1,5mg/dl); leucocitos < 2.000/μl; o insuficiencia cardíaca (New York Heart Association [NYHA] clase III o IV). Los efectos secundarios potenciales debidos a la CF, tales como supresión de médula ósea, inmunosupresión, disfunción hepática o cistitis hemorrágica, se evaluaron periódicamente tanto clínica como analíticamente. Todos los pacientes fueron informados acerca de los riesgos y beneficios del tratamiento con CF y en todos los casos se obtuvo el consentimiento informado.
Los pacientes incluidos fueron tratados de forma ambulatoria en el Hospital de Día de nuestro centro. En cada caso se administraron 10–15mg/kg de CF por vía intravenosa, diluida en 500ml de suero salino, durante 90 minutos. Las sesiones de CF se administraron cada dos semanas. Los pacientes recibieron una hidratación adecuada con 500ml de suero salino dos horas antes de recibir la CF. Se realizó profilaxis antiemética mediante la administración de dos dosis de ondansetrón (8mg) cada 8 horas, seguido de granisetrón (1mg) cada 12 horas durante tres días. La primera dosis de ondansetrón se pautó 1 hora antes de administrar la CF. Este tratamiento se complementó con omeprazol para prevenir las alteraciones gastroduodenales secundarias a la CF. La administración de CF fue suspendida si la cifra de neutrófilos disminuía por debajo de 1.500/μl antes de cada sesión. El protocolo inicial fue de 10 sesiones de CF, aunque en cada paciente el número final de ciclos dependió de la respuesta clínica e inmunológica.
Además de los ciclos de CF, los pacientes recibieron dosis altas de prednisona (0,9-1mg/kg/día), azatioprina (1,5-2mg/kg/día) o micofenolato mofetilo (2–3g/día) (tabla 1). La dosis de prednisona fue bajándose 5–15mg/ día mensualmente desde el inicio de los ciclos de CF en función de la respuesta clínica y el título de anticuerpos circulantes frente a las Dsg 1 y 3. Cuando los pacientes alcanzaron la dosis de 10mg/día de prednisona, la dosis de inmunosupresores (azatioprina o micofenolato mofetilo) fue disminuyéndose lentamente. Este tratamiento se complementó con alendronato (70mg semanales). En varios pacientes aparecieron efectos secundarios debidos a la administración de corticosteroides sistémicos (tabla 1).
ResultadosTodos los pacientes incluidos en este estudio mostraron una respuesta clínica e inmunológica excelente (según los criterios publicados en la literatura11), después de la administración de los 10 ciclos de CF cada 15 días. Globalmente, las lesiones curaron de forma completa en una media de 5,1 meses (rango entre 3 y 7 meses) (tabla 2). La respuesta clínica a la CF en los pacientes se observó en una de estas dos fases: o en una fase inicial, en la que algunos pacientes presentaron una resolución completa de las lesiones durante los ciclos de CF, o en una fase retardada, en la que los pacientes continuaron mejorando a pesar de suspender los ciclos de CF y de ir disminuyendo progresivamente la dosis de prednisona y de inmunosupresores.
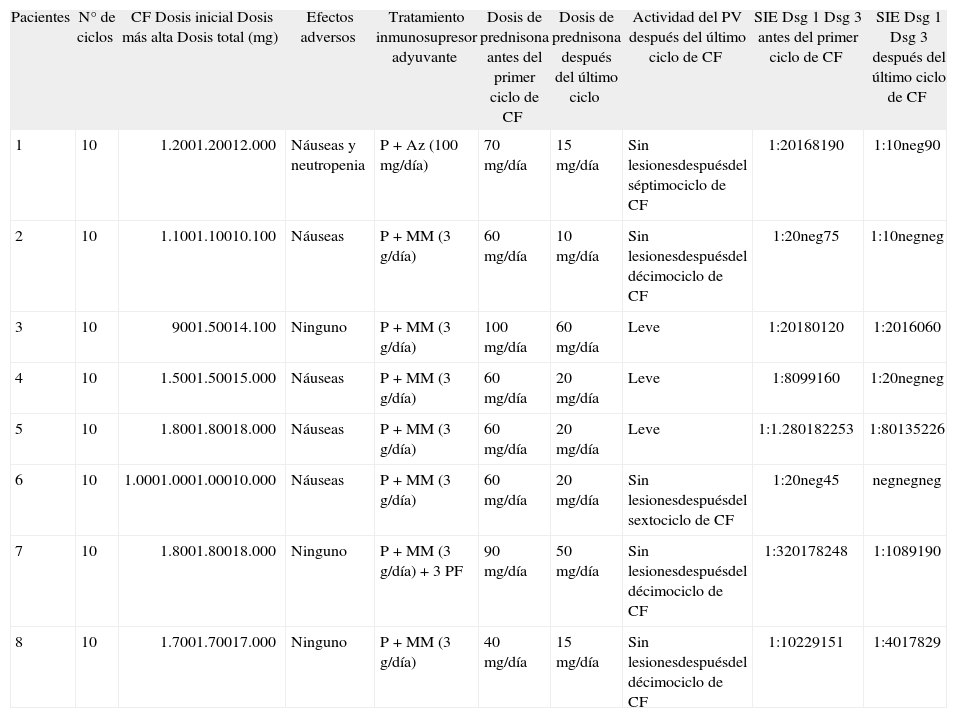
Respuesta al tratamiento con bolos quincenales de ciclofosfamida
| Pacientes | N° de ciclos | CF Dosis inicial Dosis más alta Dosis total (mg) | Efectos adversos | Tratamiento inmunosupresor adyuvante | Dosis de prednisona antes del primer ciclo de CF | Dosis de prednisona después del último ciclo | Actividad del PV después del último ciclo de CF | SIE Dsg 1 Dsg 3 antes del primer ciclo de CF | SIE Dsg 1 Dsg 3 después del último ciclo de CF |
| 1 | 10 | 1.2001.20012.000 | Náuseas y neutropenia | P + Az (100mg/día) | 70mg/día | 15mg/día | Sin lesionesdespuésdel séptimociclo de CF | 1:20168190 | 1:10neg90 |
| 2 | 10 | 1.1001.10010.100 | Náuseas | P + MM (3g/día) | 60mg/día | 10mg/día | Sin lesionesdespuésdel décimociclo de CF | 1:20neg75 | 1:10negneg |
| 3 | 10 | 9001.50014.100 | Ninguno | P + MM (3g/día) | 100mg/día | 60mg/día | Leve | 1:20180120 | 1:2016060 |
| 4 | 10 | 1.5001.50015.000 | Náuseas | P + MM (3g/día) | 60mg/día | 20mg/día | Leve | 1:8099160 | 1:20negneg |
| 5 | 10 | 1.8001.80018.000 | Náuseas | P + MM (3g/día) | 60mg/día | 20mg/día | Leve | 1:1.280182253 | 1:80135226 |
| 6 | 10 | 1.0001.0001.00010.000 | Náuseas | P + MM (3g/día) | 60mg/día | 20mg/día | Sin lesionesdespuésdel sextociclo de CF | 1:20neg45 | negnegneg |
| 7 | 10 | 1.8001.80018.000 | Ninguno | P + MM (3g/día) + 3 PF | 90mg/día | 50mg/día | Sin lesionesdespuésdel décimociclo de CF | 1:320178248 | 1:1089190 |
| 8 | 10 | 1.7001.70017.000 | Ninguno | P + MM (3g/día) | 40mg/día | 15mg/día | Sin lesionesdespuésdel décimociclo de CF | 1:10229151 | 1:4017829 |
Respuesta al tratamiento con ciclofosfamida: excelente, indica pacientes con enfermedad grave o moderada en los que desaparecen las lesiones cutáneas; buena, enfermedad grave que mejora a moderada o leve; mínima, enfermedad moderada que mejora a enfermedad leve; y sin cambios, no aparecen cambios o la enfermedad empeora. Respuesta clínica completa: indica ausencia de lesiones cutáneas o mucosas activas del pénfigo vulgar (negativo). Actividad cutánea de la enfermedad: leve, menos de 20 ampollas; moderada, 20–40 ampollas; grave, más de 40 ampollas; no lesiones. Actividad de la enfermedad en las mucosas: leve, 1–5 erosiones pequeñas; moderada, 5–10 erosiones; grave, más de 10 erosiones o erosiones grandes. Tomada de Fleischli ME et al11. Az: azatioprina; CF: ciclofosfamida; Dsg: desmogleína; MM: micofenolato mofetilo; neg: negativo; P: prednisona; PF: plasmaféresis; SIE: título de anticuerpos anti-sustancia intercelular epidérmica mediante inmunofluorescencia indirecta.
En 5 pacientes (62,5 %) observamos una respuesta completa al terminar el décimo ciclo de CF, con curación total de las lesiones de PV en una media de 4,4 meses (rango entre 3 y 5 meses) (pacientes 1, 2, 6, 7 y 8) (tabla 2). Solamente en 3 casos encontramos algunas lesiones activas al terminar los 10 ciclos (pacientes 3, 4 y 5). Además, en todos los pacientes la dosis de prednisona pudo reducirse en más del 50 % en ese momento (tabla 2). Es interesante observar que en todos los casos se detectó una disminución importante en el título de anticuerpos anti-Dsg 1 y 3, así como del título de los anticuerpos anti-SIE. En un paciente (paciente 6) no encontramos datos de respuesta inmunológica del PV, y en dos casos (pacientes 2 y 4) no se encontraron anticuerpos circulantes frente a las Dsg 1 y 3, a pesar de que los anticuerpos circulantes anti-SIE eran ligeramente positivos (tabla 2). Durante el tiempo de seguimiento registrado, ningún paciente ha presentado lesiones activas de PV, ni en la piel ni en las mucosas. Por tanto, la respuesta clínica puede ser considerada excelente (tabla 3).
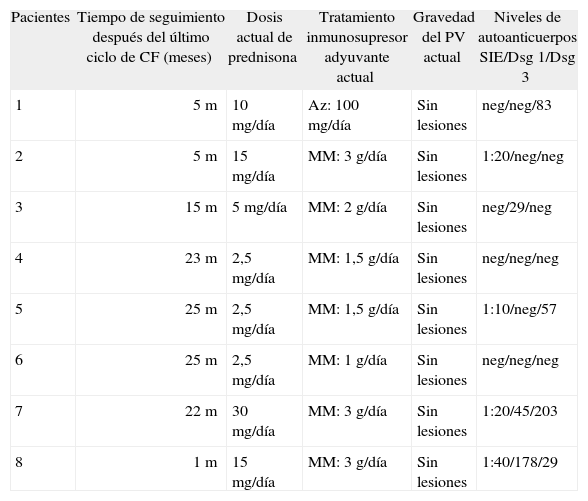
Respuesta clínica prolongada a la administración de pulsos quincenales de ciclofosfamida
| Pacientes | Tiempo de seguimiento después del último ciclo de CF (meses) | Dosis actual de prednisona | Tratamiento inmunosupresor adyuvante actual | Gravedad del PV actual | Niveles de autoanticuerpos SIE/Dsg 1/Dsg 3 |
| 1 | 5m | 10mg/día | Az: 100mg/día | Sin lesiones | neg/neg/83 |
| 2 | 5m | 15mg/día | MM: 3g/día | Sin lesiones | 1:20/neg/neg |
| 3 | 15m | 5mg/día | MM: 2g/día | Sin lesiones | neg/29/neg |
| 4 | 23m | 2,5mg/día | MM: 1,5g/día | Sin lesiones | neg/neg/neg |
| 5 | 25m | 2,5mg/día | MM: 1,5g/día | Sin lesiones | 1:10/neg/57 |
| 6 | 25m | 2,5mg/día | MM: 1g/día | Sin lesiones | neg/neg/neg |
| 7 | 22m | 30mg/día | MM: 3g/día | Sin lesiones | 1:20/45/203 |
| 8 | 1m | 15mg/día | MM: 3g/día | Sin lesiones | 1:40/178/29 |
Az: azatioprina; CF: ciclofosfamida; Dsg: desmogleína; m: meses; MM: micofenolato mofetilo; neg: negativo; PV: pénfigo vulgar; SIE: título de anticuerpos circulantes anti-sustancia intercelular epidérmica, mediante inmunofluorescencia indirecta.
Los pacientes 3, 4 y 5 presentaron una resolución completa de las lesiones de PV en una media de 6,5 meses desde el inicio de los ciclos de CF, y en una media de 1,5 meses desde que completaron los 10 ciclos de CF. Fue interesante la observación de una mejoría clínica progresiva en cada uno de los pacientes a pesar de completar y parar los ciclos de CF, y de disminuir progresivamente la dosis de prednisona, hasta alcanzar la dosis de 10mg/día. El tratamiento inmunosupresor adyuvante fue también reduciéndose de forma progresiva (tabla 2). Encontramos también una disminución progresiva en el título de anticuerpos circulantes (tabla 2). El título de anticuerpos anti-SIE fue ligeramente positivo sólo en 4 pacientes (pacientes 2, 5, 7 y 8). La determinación de anticuerpos anti-Dsg 1 y 3 mediante ELISA fue negativa en 3 pacientes (pacientes 2, 4 y 6); en 3 casos solamente uno de los dos autoanticuerpos fue positivo (pacientes 1, 3 y 5); mientras que en 2 pacientes (pacientes 7 y 8) ambos autoanticuerpos fueron positivos, a pesar de que ninguno de los dos presentaba lesiones activas después de 1 y 22 meses del último ciclo de CF. El paciente 5 recientemente ha presentado de nuevo un ligero aumento en el título de anticuerpos frente a las Dsg 1 y 3, pero no se han encontrado lesiones activas de PV. Estos pacientes deberán ser evaluados periódicamente por el riesgo de presentar nuevamente una elevación del título de anticuerpos circulantes asociado con lesiones activas de PV. Es interesante resaltar que la dosis inicial del tratamiento inmunosupresor se pudo reducir en 4 pacientes (pacientes 3, 4, 5 y 6) (tabla 3).
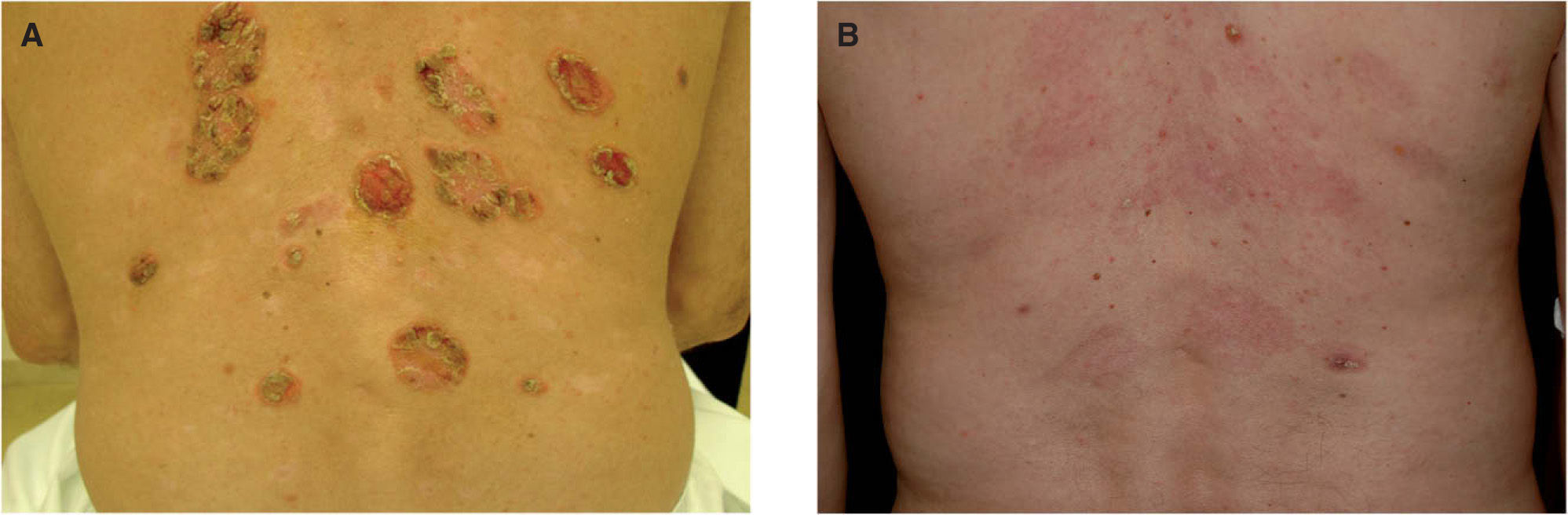
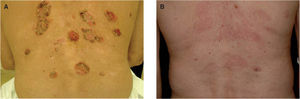
En las figuras 1A y 1B se muestran los resultados obtenidos con alguno de los pacientes.
Efectos secundariosNo hemos observado efectos secundarios relevantes en los 8 pacientes durante el tratamiento quincenal con ciclos de CF. Cinco pacientes presentaron náuseas a pesar del tratamiento antiemético, que cedieron unos días después de cada ciclo. En un paciente se detectó una neutropenia transitoria (800/μl), que precisó la administración de factor estimulante de colonias, recuperando así la cifra de neutrófilos y no presentando nuevamente esta alteración en los ciclos posteriores (tabla 2). No se han observado hasta la fecha otros efectos secundarios debidos a la CF después de suspender este tratamiento. No hemos observado otros efectos secundarios derivados de la administración de azatioprina o micofenolato mofetilo. A su vez, no hemos encontrado infecciones secundarias derivadas de la inmunosupresión.
DiscusiónLa administración sistémica de corticosteroides es la forma de tratamiento más eficaz en las primeras fases del PV. Este tratamiento se suele complementar con la administración de fármacos inmunosupresores ahorradores de corticosteroides, como son la azatioprina y el micofenolato mofetilo4. La administración de CF ha demostrado ser eficaz también en los pacientes con PV. Su administración en dosis bajas por vía oral ha sido asociada con una mayor incidencia de efectos secundarios3,4,12-14 comparada con la administración en ciclos intravenosos de forma periódica15-19. Esta observación ha llevado a establecer varios esquemas terapéuticos con el fin de minimizar la toxicidad y la dosis acumulada del fármaco, y conseguir una mayor eficacia clínica en los pacientes con PV. Entre los esquemas propuestos destaca la administración de CF asociada a corticosteroides en ciclos mensuales12 o semanales20, la administración de CF mensualmente junto con dosis bajas de CF por vía oral8,11, la administración de ciclos de CF junto con ciclos de dexametasona7,9,21, la asociación de plasmaféresis con bolos de CF22,23, el tratamiento conjunto de CF y vincristina24 o las dosis ablativas de CF25,26. Solamente en algún paciente aislado se han administrado bolos de CF asociados a azatioprina y prednisona11.
En nuestro estudio, la respuesta clínica en los 8 pacientes con PV después de los pulsos quincenales de CF fue considerada excelente, consiguiendo una desaparición de las lesiones en una media de 5,1 meses. El 62,5 % de los pacientes no presentó lesiones cutáneas o mucosas activas en el momento de recibir el décimo ciclo de CF. El 37,5 % restante presentó una respuesta clínica completa después del décimo ciclo, en un período de tiempo medio de 6,5 meses, y en una media de 1,5 meses después de terminar el décimo ciclo de CF. En otros estudios en los que se ha empleado la CF en ciclos intravenosos mensuales11, el 66 % de los pacientes con PV presentó una respuesta clínica excelente, y el 22 % de ellos tuvo solamente una respuesta clínica mínima. El control de la enfermedad se observó en ese estudio entre los 2–5 meses en todos los casos que tuvieron una respuesta clínica al fármaco. Bhat et al10 encontraron, en su serie de pacientes con PV tratados con CF intravenosa mensualmente, una curación de las lesiones cutáneas de PV en una media de 2,1 meses, y de 3,6 meses en las lesiones de las mucosas. No obstante, los autores incluyeron en su estudio solamente a pacientes con menos del 10 % de la superficie corporal afectada. Pasricha et al7 observaron una curación completa de las lesiones de PV en el 32 % de sus pacientes tratados con una combinación de dexametasona y CF en pulsos junto con CF en dosis bajas por vía oral, pudiendo así suspender todo tipo de tratamiento. Este mismo grupo, unos años después, ha observado que el 72 % de sus pacientes con PV entra en remisión completa dentro del primer año de iniciar el esquema terapéutico propuesto por ellos, mientras que el 48,5 % lo hacen dentro de los 6 meses, y el 23,5 % entre los 7–12 meses27.
En la literatura se recomienda la utilización de CF en ciclos mensuales. Este hecho se basa en la observación de que tras su administración por vía intravenosa produce un descenso progresivo en la cifra de leucocitos, que comienza en el segundo o tercer día y es máximo a los 10–12 días8,28. Es en ese momento donde la producción de autoanticuerpos se ve más afectada, produciéndose un incremento en su producción nuevamente 1 ó 2 semanas más tarde, siendo en ese punto donde la nueva administración de CF podría tener más efecto. A pesar de estos datos, nuestra experiencia inicial nos hizo ver que los pacientes presentaban un brote importante al cumplirse las 4 semanas desde el último ciclo de CF, justo antes del siguiente ciclo. Este hecho, y los hallazgos en pacientes con linfomas tratados con CF en los que se obtenía una mejor respuesta clínica cuando la «densidad» o «concentración» de este fármaco era mayor en el tiempo, nos llevó a evaluar la respuesta clínica en pacientes con PV administrando la CF quincenalmente en lugar de mensualmente. Una pauta similar a la nuestra ha sido propuesta también por Pasricha et al7, al proponer ciclos de CF cada 2–3 semanas en pacientes con PV grave, con el fin de inducir una remisión clínica más precoz y un tiempo de duración de la fase activa de la enfermedad más corto. Por tanto, los ciclos de CF cada dos semanas deberían estar indicados solamente en aquellos pacientes en quienes podamos encontrar una actividad clínica importante del PV.
No hemos observado rebrotes de lesiones de PV en nuestros pacientes hasta este momento. Además, los niveles de anticuerpos anti-SIE y de anti-Dsg 1 y 3 han mostrado un importante y progresivo descenso durante el tratamiento con CF que ha continuado una vez se han completado y suspendido los ciclos de CF. El paciente 5 presentó nuevamente una ligera elevación de los anticuerpos anti-Dsg 1 y 3 dos años después de permanecer estos anticuerpos negativos. No obstante, este incremento no se ha acompañado hasta el momento de nuevas lesiones cutáneas o mucosas de PV. A pesar de ello, este paciente debe ser evaluado más frecuentemente por el riesgo de presentar un nuevo rebrote de la enfermedad. Además, 3 pacientes (pacientes 1, 7 y 8) estaban asintomáticos unos pocos meses después de suspender los ciclos de CF, a pesar de continuar todavía con anticuerpos anti-Dsg 1 y 3 positivos. En los demás pacientes no hemos observado tampoco nuevos rebrotes de la enfermedad. Por el contrario, Fleischli et al11, después de tratar a sus pacientes con ciclos mensuales de CF, encontraron rebrotes en casi el 50 % de los casos, y en el estudio de Bhat et al10 esta cifra fue del 34,6 % entre las 3 semanas y los 8 meses desde el último ciclo de CF mensual. Pandya y Sontheimer8 encontraron también resultados similares a estos trabajos. Por tanto, nuestros resultados muestran que, en pacientes con PV grave, la administración de CF en ciclos quincenales sin suprimir los inmunosupresores ahorradores de esteroides puede eliminar los clones patógenos de linfocitos B de una forma más eficaz que cuando se administran mensualmente. Algunos pacientes pueden mantener anticuerpos circulantes frente a las Dsg 1 o 3, aunque quizá tengan un papel patógeno muy bajo o ausente para producir lesiones activas de PV.
Los efectos secundarios relacionados con la CF fueron escasos o casi nulos en nuestros pacientes. Se han descrito hallazgos similares en pacientes tratados con ciclos mensuales de CF7,10,11. No obstante, no podemos descartar la posibilidad de complicaciones tardías y, por tanto, estos pacientes deben seguir siendo evaluados periódicamente.
En la mayoría de los pacientes, la dosis de prednisona pudo ser reducida en un 50 % respecto de la dosis inicial o incluso más. A su vez, la dosis de los fármacos inmunosupresores ha podido disminuirse en un porcentaje importante de pacientes. En la actualidad, solamente el paciente 7 presenta una dosis moderada de prednisona. Por tanto, la administración quincenal de CF también permite disminuir la dosis de inmunosupresores en un plazo de tiempo corto, consiguiendo así disminuir de forma importante el riesgo de efectos secundarios sin perder eficacia clínica.
El tratamiento de CF en ciclos intravenosos quincenales podría estar indicado en los pacientes con PV grave que no responden al tratamiento inmunosupresor convencional, cuando los pacientes empiezan a presentar efectos secundarios por la medicación, principalmente por los corticosteroides, o cuando presentan brotes de lesiones aun con dosis elevadas de corticosteroides. Sin embargo, son necesarios más estudios controlados para poder determinar el papel real de este fármaco en el manejo del PV y su seguridad a largo plazo. Por otra parte, deberían establecerse unas pautas de actuación claras y saber cuándo debemos emplear fármacos alquilantes como la CF intravenosa, u otros fármacos como los anticuerpos anti-CD2029-31 asociados a otros inmunosupresores en pacientes con PV grave.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.