En los últimos años, estamos asistiendo a una revolución en el tratamiento de las enfermedades inflamatorias, entre ellas la psoriasis, por la aparición de nuevos fármacos, muchos de ellos desarrollados por biotecnología (los inhibidores del factor de necrosis tumoral alfa [anti-TNF] y los inhibidores de las interleucinas 12 y 23). Pero no todos los pacientes responden favorablemente a la terapia biológica, bien por presentar una respuesta insuficiente desde el principio (lo que se denomina fallo primario), porque responden inicialmente pero luego pierden eficacia (fallo secundario), o bien por acontecimientos adversos.
Cuando un paciente no responde a un fármaco biológico, tenemos diferentes opciones: aumentar la dosis del mismo biológico o acortar el intervalo, combinar ese biológico con otro tratamiento de los denominados clásicos, cambiar a otro biológico de la misma familia (en el caso de anti-TNF) o cambiar a otro biológico con un mecanismo de acción diferente. Hoy en día no hay evidencia científica suficiente para saber cuál es la alternativa más adecuada y se adopta una u otra de forma empírica.
Las causas de fracaso a un tratamiento biológico no son del todo conocidas. Una puede ser la existencia de un mecanismo alternativo y distinto del que bloquea el fármaco biológico empleado, circunstancia que cabe esperar más frecuente en el fracaso primario y otra la aparición de anticuerpos dirigidos frente a ese biológico que neutralizan su acción o aceleran su aclaramiento, es lo que se denomina inmunogenicidad, que presumiblemente tendrá mayor peso en el fracaso secundario1. Cualquier proteína externa, incluyendo los fármacos biológicos, puede inducir una respuesta específica del sistema inmunitario que conduce a la formación de anticuerpos (denominados en este caso anticuerpos antifármaco, en inglés anti-drugantibodies [ADA]). La determinación de ADA es un punto importante en la evaluación de la seguridad de un fármaco biológico; es obligada en los ensayos clínicos y hay recomendaciones al respecto tanto de la European Medicines Agency como de la Food and Drug Administration. Sin embargo, su estudio en la práctica clínica está poco extendido y resulta algo polémico. En un número reciente de Actas Dermo-sifiliográficas, hay un excelente artículo al respecto en la sección de «Controversias en Dermatología»2, donde se aborda ampliamente el tema.
La producción de ADA depende de una serie de factores. Algunos de ellos dependen de la naturaleza del agente biológico (tamaño y estructura de la proteína, tipo de proteína: humana o no, presencia de conjugados o fragmentos, formulación y condiciones de almacenamiento); otros, de la administración del tratamiento (vía, dosis, duración del tratamiento y posología), debiendo considerarse también el perfil de los propios pacientes (genética, edad, exposición previa, medicación concomitante, enfermedad a tratar).
Hay una serie de problemas técnicos a la hora de determinar la inmunogenicidad, ya que no es fácil medir anticuerpos frente a anticuerpos3. Hay distintas técnicas con distintas sensibilidades y especificidades que ofrecen resultados dispares4,5. No hay un método estandarizado para estudiar la inmunogenicidad, como tampoco hay valores estandarizados respecto a los niveles de fármaco óptimos en psoriasis o ADA y la mayoría de las técnicas no permiten distinguir entre ADA neutralizantes y ADA no neutralizantes. Además, la inmunogenicidad es un proceso dinámico, en desarrollo y que cambia con el tiempo. De este modo, hay positividades transitorias, sobre todo en los primeros meses que no se traducen en un verdadero bloqueo de la actividad del fármaco y son teóricamente modulables mediante cambios en la dosis o la asociación de fármacos inmomoduladores. Por este motivo, es importante hacer más de una determinación y hacer una correlación de los resultados con la clínica del paciente. Hoy en día, el método que más se usa es el Enzyme-linkedimmunosorbentassays (ELISA), porque es el más sencillo, un ELISA de captura para medir la concentración del fármaco biológico y ELISA puente para medir los ADA. Pero el ELISA tiene una serie de limitaciones: no permite detectar IgG 4, no se pueden detectar ADA en presencia de fármaco, puede dar reacciones cruzadas con el factor reumatoide y/o el complemento activado. La interpretación del nivel de ADA debe relacionarse siempre con la dosis del fármaco y el momento en el que se ha administrado3. En la actualidad, solo disponemos de kits comerciales para la determinación de anticuerpos antiinfliximab, adalimumab y etanercept.
En la práctica, lo que nos interesa saber es si la presencia de ADA tiene relevancia clínica. La primera y más importante consecuencia de la aparición del ADA es la alteración de la farmacocinética del biológico, ya que los ADA se unen al fármaco biológico y pueden neutralizar su acción y/o formar inmunocomplejos que aumentan el aclaramiento del fármaco de la circulación, lo que se traduce en una pérdida de eficacia6-8 y una menor supervivencia del tratamiento biológico9,10.
Por otro lado, los pacientes con ADA tienen mayor riesgo de acontecimientos adversos8: reacciones infusionales en el caso de infliximab11, reacciones locales en el sitio de inyección en el caso de golimumab12 y acontecimientos tromboembólicos en pacientes con artritis reumatoide con ADA tratados con adalimumab13.
Hay trabajos en Reumatología y Gastroenterología que han demostrado que el desarrollo de ADA se puede prevenir o modular mediante tratamiento concomitante con inmunosupresores, principalmente metotrexato, aunque faltan trabajos en psoriasis4,5.
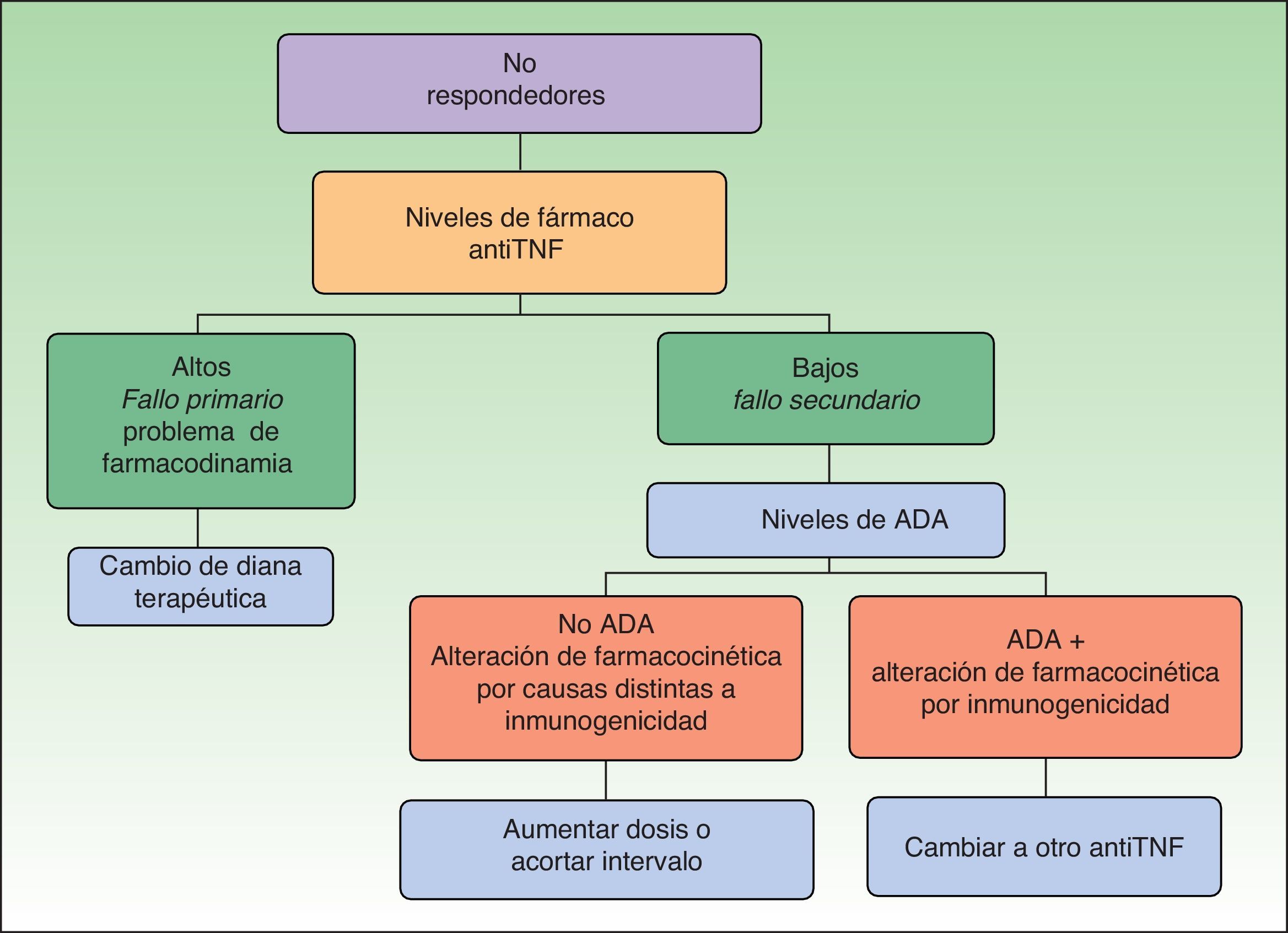
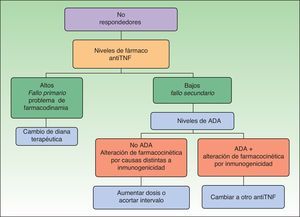
También la inmunogenicidad puede ser muy útil a la hora de decidir cuál es el tratamiento más adecuado en pacientes con fallo a un primer anti-TNF. El estudio de la inmunogenicidad nos permite elaborar algoritmos de decisión basados en los niveles de fármaco, niveles de anticuerpos antifármaco y respuesta clínica4,14,15. Estos algoritmos se desarrollan en el artículo sobre este tema publicado recientemente en esta revista2. Nosotros hemos incluido el algoritmo para pacientes no respondedores (fig. 1) porque es el que nos resulta más útil en la clínica y, además, ya ha sido validado por otros autores16. Introducimos en el algoritmo el concepto de fallo primario y secundario según los niveles de fármaco y explicamos las distintas situaciones. Desde un punto de vista clínico, la falta o la pérdida de respuesta se denomina fallo primario o secundario, según en el momento en el que aparece. En los fallos primarios, se recomienda cambio a otro biológico con distinto mecanismo de acción y en los fallos secundarios, en principio, intensificación del mismo tratamiento, aunque se ha visto que hasta un 10% de los pacientes desarrollan ADA frente a anti-TNF en las primeras 4 semanas de tratamiento y hay pacientes que tras perder respuesta no la recuperan al intensificar la terapia biológica. Si nos basamos en una medida objetiva como el nivel del fármaco, se define fallo primario cuando el paciente no responde clínicamente a pesar de tener niveles adecuados del fármaco en sangre y fallo secundario cuando la no respuesta se debe a unos niveles disminuidos o ausentes del fármaco en suero (con o sin ADA), independientemente del tiempo en el que se presenta la falta de eficacia terapéutica17. Según el algoritmo, en pacientes no respondedores, si el nivel de fármaco es alto (fallo primario), se propone cambiar a otro fármaco con distinto mecanismo de acción (no anti-TNF), ya que estos pacientes no se beneficiarían de un incremento de la dosis del anti-TNF ni del cambio a otro fármaco con similar mecanismo de acción. Por el contrario, si el nivel de fármaco es bajo (fallo secundario), entonces se determinarían los ADA. Si no hay ADA, el origen de la falta de respuesta es un problema de farmacocinética pero de causa distinta a la inmunogenicidad, por ejemplo dosis inadecuadas para el peso del paciente, por lo que se recomienda aumentar la dosis del biológico. Sin embargo, si los niveles de ADA son altos, en este caso la alteración de la farmacocinética es debida a la inmunogenicidad, que presumiblemente sería la causante de la disminución de los niveles del fármaco y se debería cambiar a otro biológico, preferiblemente otro anti-TNF, porque parece que los pacientes que desarrollan anticuerpos anti-TNF serían aquellos en los que esta vía sería la más importante, aunque esta afirmación en la actualidad permanece en el terreno de la especulación14. Lo que sí se ha comprobado es que los pacientes que fracasan a un anti-TNF con ADA+tiene mejor respuesta clínica a un segundo anti-TNF que aquellos pacientes que no responden y no desarrollan ADA18. La aplicación de esta estrategia en pacientes con enfermedad inflamatoria intestinal tratados con infliximab ha permitido ahorrar un promedio entre el 30 y el 50% del coste del tratamiento por paciente comparada con la intensificación del biológico, sin comprometer la respuesta clínica19.
Los estudios de inmunogenicidad también tienen su interés, aunque quizá sea menor, en pacientes respondedores. En este grupo, resulta más difícil de estandarizar cuándo se deben realizar los estudios de inmunogenicidad en función de los distintos tratamientos y es más complicado interpretar los resultados. También se determina primero el nivel de fármaco para, si es alto, ensayar reducir la dosis y hacer un seguimiento estrecho de la respuesta clínica. El problema es que se desconoce la ventana terapéutica (el rango de niveles séricos óptimos de cada fármaco) en psoriasis que sirvan como referencia. Además, estas estrategias de desintensificación del biológico (disminuyendo dosis o aumentando el intervalo) las estamos haciendo ya en la práctica clínica, guiándonos por la actividad de la enfermedad cutánea, por lo que el estudio de inmunogenicidad parece menos necesario. Si el nivel de fármaco es bajo, se determina el título de anticuerpos. Si es alto, hay autores que recomiendan suspender el tratamiento por el riesgo de efectos adversos. Nosotros también creemos que sería mejor suspenderlo porque en estos casos el fármaco está siendo bloqueado por los ADA y si el paciente sigue bien quizá se deba a que la enfermedad no tiene actividad.
En resumen, creemos que la inmunogenicidad es una herramienta útil para tomar decisiones en pacientes tratados con biológicos (sobre todo no respondedores, «switchers» o pacientes con reacciones infusionales). Todavía faltan estudios en psoriasis que determinen la relación entre la respuesta clínica y los niveles séricos óptimos de cada fármaco para una determinada respuesta, así como la repercusión de la aparición de anticuerpos antifármaco en dicha respuesta clínica. En todo caso, la monitorización de la inmunogenicidad en los tratamientos biológicos debe considerarse como una herramienta adicional que nos permitirá desarrollar esquemas terapéuticos personalizados, haciendo estos tratamientos más rentables desde el punto de vista económico.
Sin embargo, hasta ahora, el estudio de la inmunogenicidad se centra en la experiencia de otras especialidades, en concreto Reumatología y Gastroenterología, y los datos específicos en Dermatología son muy escasos. Es primordial, por tanto, que nuestro interés se traduzca en la producción de datos propios como herramienta fundamental para el manejo de estos tratamientos en el paciente dermatológico.