En situaciones clínicas difíciles de psoriasis moderada y grave la información sobre las estrategias terapéuticas más adecuadas es insuficiente.
Material y métodosSe plantearon 5 escenarios: psoriasis pediátrica, infecciones en pacientes tratados con biológicos, localizaciones difíciles, supervivencia de las terapias biológicas e impacto en la calidad de vida, identificando aquellas cuestiones en las que la evidencia era controvertida o insuficiente. Tras la discusión con un grupo de dermatólogos expertos en el manejo de la psoriasis moderada-grave, se llevó a cabo un cuestionario que fue implementado según la metodología Delphi.
ResultadosSe alcanzó el consenso en 66 de los 93 ítems finales planteados (70,9%) (49 en el acuerdo, 17 en el desacuerdo). Se acordó la conveniencia de incorporar la evaluación del índice de masa corporal, las comorbilidades metabólicas y la medición de la calidad de vida en el seguimiento de la psoriasis infantil. En este grupo de edad, el metotrexato y el etanercept se consideraron las mejores opciones de tratamiento sistémico y biológico, respectivamente. Aunque la evidencia científica se interpretó como heterogénea y de difícil extrapolación, se consensuó que la individualización y la flexibilidad en las dosis, el tratamiento continuo y las combinaciones terapéuticas incrementaban la supervivencia del fármaco. Se acordó la conveniencia de incorporar el índice de calidad de vida en dermatología como marcador de eficacia terapéutica y en la toma de decisiones en la práctica clínica.
ConclusionesLa opinión estructurada de los expertos contribuye en la toma de decisiones en aquellos aspectos en los que la información disponible es incompleta o contradictoria.
There is insufficient information on how best to treat moderate to severe psoriasis in difficult clinical circumstances.
Material and methodsWe considered 5 areas where there is conflicting or insufficient evidence: pediatric psoriasis, risk of infection in patients being treated with biologics, psoriasis in difficult locations, biologic drug survival, and impact of disease on quality of life. Following discussion of the issues by an expert panel of dermatologists specialized in the management of psoriasis, participants answered a questionnaire survey according to the Delphi method.
ResultsConsensus was reached on 66 (70.9%) of the 93 items analyzed; the experts agreed with 49 statements and disagreed with 17. It was agreed that body mass index, metabolic comorbidities, and quality of life should be monitored in children with psoriasis. The experts also agreed that the most appropriate systemic treatment for this age group was methotrexate, while the most appropriate biologic treatment was etanercept. Although it was recognized that the available evidence was inconsistent and difficult to extrapolate, the panel agreed that biologic drug survival could be increased by flexible, individualized dosing regimens, continuous treatment, and combination therapies. Finally, consensus was reached on using the Dermatology Quality of Life Index to assess treatment effectiveness and aid decision-making in clinical practice.
ConclusionsThe structured opinion of experts guides decision-making regarding aspects of clinical practice for which there is incomplete or conflicting information.
El abordaje terapéutico de la psoriasis ha experimentado un importante salto cualitativo en los últimos años con la incorporación de información científica de gran calidad. Sin embargo, la evidencia disponible, que es firme y consistente en los escenarios evaluados en los ensayos clínicos pivotales, resulta incompleta en situaciones complejas o especiales descartadas en estos trabajos. En estas situaciones, el manejo terapéutico dista de las indicaciones reflejadas en la ficha técnica del producto y de las recomendaciones basadas en los estudios de referencia. Desde esta perspectiva, los artículos fundamentados en la práctica clínica real aportan información que permite una aproximación menos estructurada pero que facilita conclusiones prácticas y estratégicas. A modo de ejemplo, los estudios del registro prospectivo BIOADADERM, fundamentado en la práctica habitual, han puesto de manifiesto que el uso de biológicos se incrementa con el tiempo de seguimiento de los pacientes1 y que las estrategias de reducción o escalada de dosis son frecuentes en la práctica clínica2. También en estos escenarios resultan de interés las recomendaciones de consenso basadas en la opinión de expertos y elaboradas siguiendo una metodología válida y rigurosa, facilitando a los clínicos información de notable valor específico que difícilmente será obtenida por otras vías. En este contexto deben situarse diferentes estudios que han utilizado la metodología Delphi para abordar las pautas de actuación en casos difíciles de psoriasis, así como en diferentes aspectos de la enfermedad3-10.
En un estudio previo y siguiendo la técnica Delphi, un panel de expertos consensuó propuestas en 5 situaciones clínicas especiales11. El objetivo de este estudio fue extender este proyecto a 5 escenarios complejos adicionales en los que el tratamiento no está bien definido o no existen protocolos de actuación basados en evidencias firmes.
Material y métodosComité científicoEl comité científico estaba integrado por 5 dermatólogos clínicos con amplia experiencia en el tratamiento de la psoriasis moderada-grave con la supervisión de un coordinador nacional. Cada uno de ellos planteó diversos escenarios clínicos en los que, en su opinión, existían cuestiones controvertidas y de interés clínico en las que sería de interés desarrollar recomendaciones. Tras una reunión conjunta de discusión y análisis, se seleccionaron los 5 escenarios siguientes: psoriasis pediátrica de moderada a grave; riesgo de infecciones en pacientes tratados con biológicos; localizaciones especiales; supervivencia de las terapias biológicas en psoriasis, y evaluación del impacto de la psoriasis en la calidad de vida de los pacientes.
Revisión bibliográficaLos propios miembros del comité científico, con el soporte de un metodólogo externo independiente, efectuaron una revisión sistemática y exhaustiva del periodo 2009-2014 de las siguientes bases de datos: MEDLINE, Embase, The Cohrane Library, U.S. National Guidelines Clearinghouse, Tripdatabase y las Guías de Práctica Clínica del Sistema Nacional de Salud. No se estableció un límite temporal para los ensayos clínicos que abordaran un tema de interés. La revisión tuvo como objetivo la implementación, para cada tema, de un listado de preguntas que, en opinión de los miembros del comité, y después de reuniones de consenso, reflejaban en mejor medida los aspectos de mayor interés en la práctica clínica para cada uno de los ámbitos y que no estaban cubiertos con la información disponible en la literatura.
La búsqueda bibliográfica se realizó en diciembre de 2014 y se seleccionaron el español y el inglés como idioma de publicación. Los niveles de evidencia y los grados de recomendación de las diferentes publicaciones fueron evaluados según las guías desarrolladas por The Scottish Intercollegiate Guidelines Network (SING)12.
Desarrollo del cuestionario y aplicación del método DelphiTras la evaluación critica de la evidencia disponible, el comité científico elaboró un cuestionario inicial destinado a complementar la evidencia científica con la opinión estructurada y consensuada de los expertos en psoriasis, invitando para ello a 25 dermatólogos del ámbito nacional con experiencia en psoriasis para participar en la evaluación del mismo. Estos 25 especialistas en dermatología, provenientes de distintas comunidades autónomas, asistieron a una reunión presencial en la que cada miembro del comité científico presentó uno de los escenarios seleccionados, con tiempo suficiente para la discusión de dichos escenarios, así como para la ampliación de detalles referentes a las características del estudio. Con la intención de subrayar el ámbito clínico del estudio, los distintos escenarios y las cuestiones planteadas en ellos se desarrollaron a partir de casos clínicos problema.
A partir del cuestionario inicial, la revisión de la literatura y las cuestiones surgidas en la reunión presencial se elaboró un cuestionario, con preguntas redactadas de forma asertiva, destinado a estructurar la opinión de los expertos en aspectos controvertidos de cada uno de los temas presentados. El cuestionario final constaba de 93 ítems, distribuidos en los 5 escenarios clínicos.
El cuestionario en formato electrónico se envió, de forma individualizada y diferida tras la reunión presencial, a los miembros del comité de expertos, quienes debían señalar su grado de acuerdo con cada uno de los ítems en una escala del a 1 al 9 (1=pleno desacuerdo, 9=pleno acuerdo). En cada una de las cuestiones había un espacio en blanco para que el experto incluyera los comentarios que considerara oportunos. Se usó el método Delphi modificado siguiendo las recomendaciones de la RAND/UCLA13. Tras el análisis de los resultados, cada participante realizaba una nueva votación con un nuevo cuestionario donde solo se incluían las preguntas que no habían sido consensuadas en la primera ronda. En esta segunda ronda, cada ítem tenía que ser puntuado de nuevo de acuerdo con el criterio previo o bien se podía modificar según las respuestas de los otros expertos.
AnálisisSe consideraba consensuado un ítem en el acuerdo si la mediana entraba en la región 7-9; consensuado en el desacuerdo si la mediana estaba incluida en la región 1-3, y no consensuado si la mediana quedaba en la región 4-6. Como criterio adicional para considerar un ítem como consensuado se debían cumplir otros 2 criterios: a)el número de panelistas que votaba fuera de la región 1-3 o 7-9 debía ser menor de 1/3 del total, y b)el intervalo intercuartílico (ICC) de la mediana de las respuestas tenía que ser ≤4.
En el anexo 1 (material adicional) se describen los detalles de la metodología Delphi.
ResultadosEl cuestionario evaluado contenía un total de 93 ítems. En la primera ronda de evaluación se consensuaron 51 de las 93 cuestiones planteadas (54,8%), con 40 en el acuerdo y 11 en el desacuerdo. En total, tras las dos rondas de evaluación se alcanzó un consenso en 66 de los 93 ítems planteados (un 70,9%): 49 en el acuerdo y 17 en el desacuerdo (tablas 1-5).
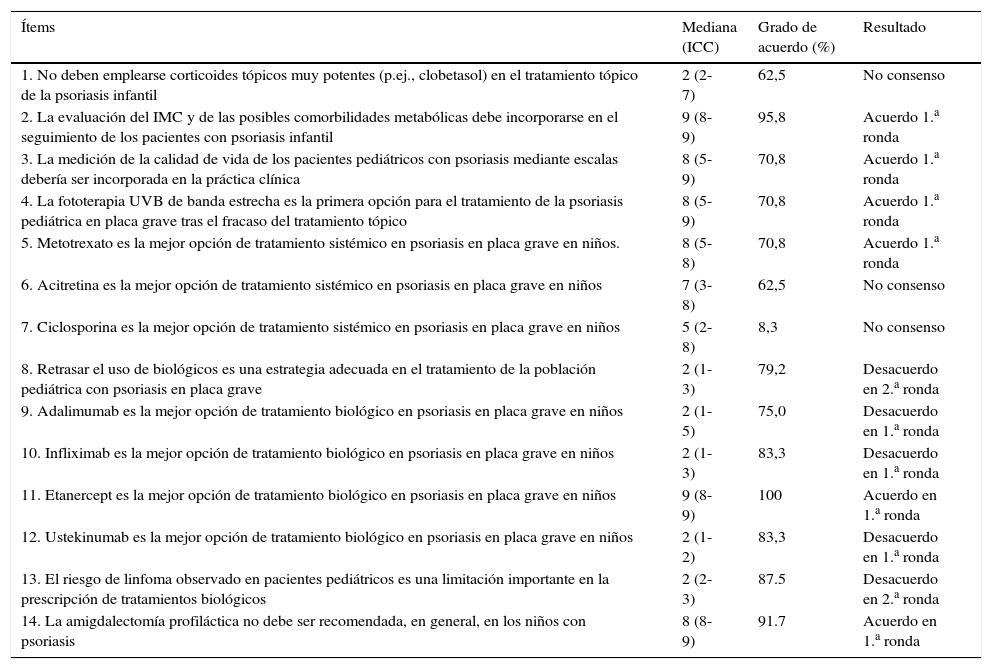
Resultados escenario 1. Psoriasis pediátrica de moderada a grave. Controversias en la terapiaa
| Ítems | Mediana (ICC) | Grado de acuerdo (%) | Resultado |
|---|---|---|---|
| 1. No deben emplearse corticoides tópicos muy potentes (p.ej., clobetasol) en el tratamiento tópico de la psoriasis infantil | 2 (2-7) | 62,5 | No consenso |
| 2. La evaluación del IMC y de las posibles comorbilidades metabólicas debe incorporarse en el seguimiento de los pacientes con psoriasis infantil | 9 (8-9) | 95,8 | Acuerdo 1.a ronda |
| 3. La medición de la calidad de vida de los pacientes pediátricos con psoriasis mediante escalas debería ser incorporada en la práctica clínica | 8 (5-9) | 70,8 | Acuerdo 1.a ronda |
| 4. La fototerapia UVB de banda estrecha es la primera opción para el tratamiento de la psoriasis pediátrica en placa grave tras el fracaso del tratamiento tópico | 8 (5-9) | 70,8 | Acuerdo 1.a ronda |
| 5. Metotrexato es la mejor opción de tratamiento sistémico en psoriasis en placa grave en niños. | 8 (5-8) | 70,8 | Acuerdo 1.a ronda |
| 6. Acitretina es la mejor opción de tratamiento sistémico en psoriasis en placa grave en niños | 7 (3-8) | 62,5 | No consenso |
| 7. Ciclosporina es la mejor opción de tratamiento sistémico en psoriasis en placa grave en niños | 5 (2-8) | 8,3 | No consenso |
| 8. Retrasar el uso de biológicos es una estrategia adecuada en el tratamiento de la población pediátrica con psoriasis en placa grave | 2 (1-3) | 79,2 | Desacuerdo en 2.a ronda |
| 9. Adalimumab es la mejor opción de tratamiento biológico en psoriasis en placa grave en niños | 2 (1-5) | 75,0 | Desacuerdo en 1.a ronda |
| 10. Infliximab es la mejor opción de tratamiento biológico en psoriasis en placa grave en niños | 2 (1-3) | 83,3 | Desacuerdo en 1.a ronda |
| 11. Etanercept es la mejor opción de tratamiento biológico en psoriasis en placa grave en niños | 9 (8-9) | 100 | Acuerdo en 1.a ronda |
| 12. Ustekinumab es la mejor opción de tratamiento biológico en psoriasis en placa grave en niños | 2 (1-2) | 83,3 | Desacuerdo en 1.a ronda |
| 13. El riesgo de linfoma observado en pacientes pediátricos es una limitación importante en la prescripción de tratamientos biológicos | 2 (2-3) | 87.5 | Desacuerdo en 2.a ronda |
| 14. La amigdalectomía profiláctica no debe ser recomendada, en general, en los niños con psoriasis | 8 (8-9) | 91.7 | Acuerdo en 1.a ronda |
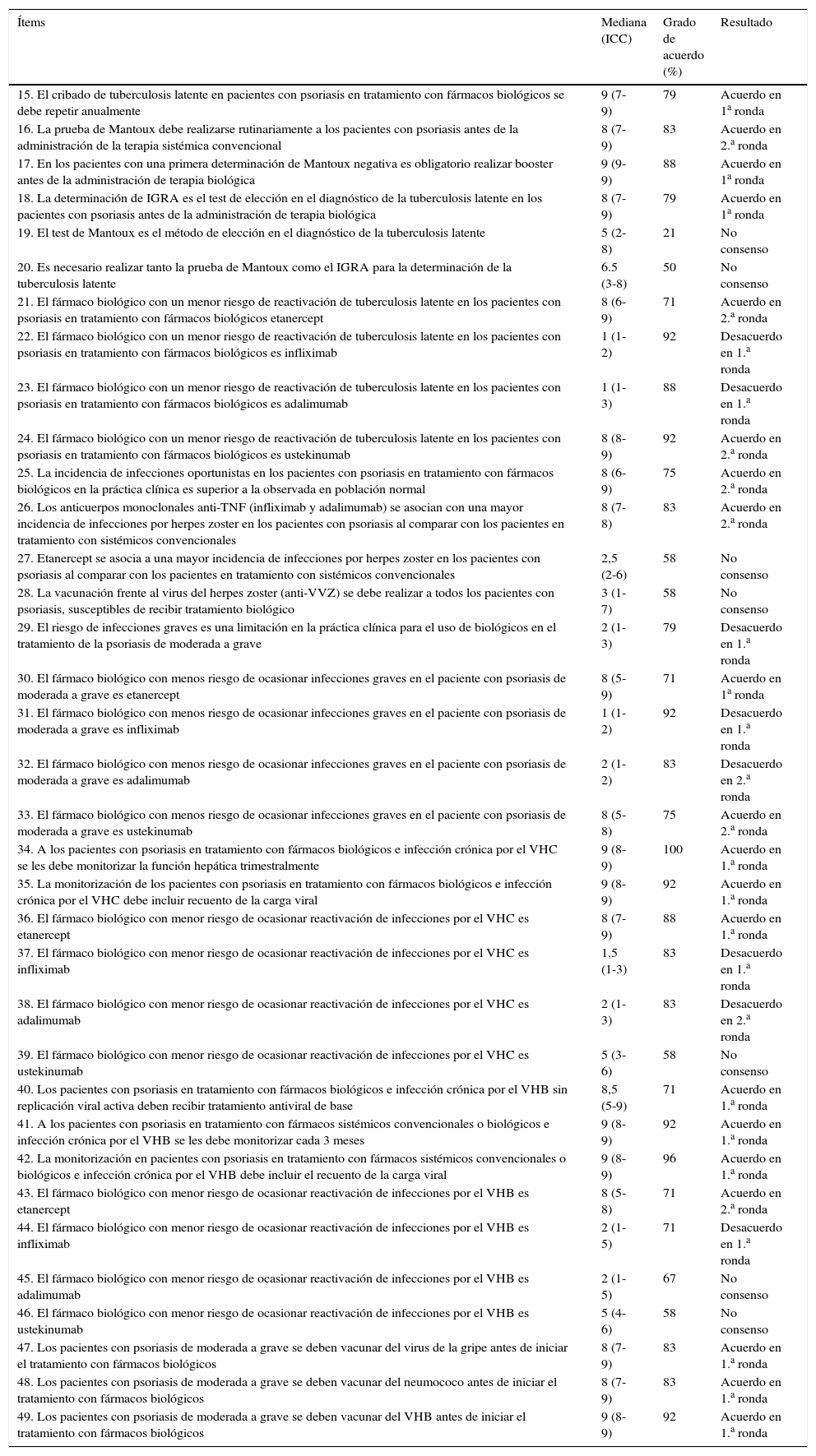
Resultados escenario 2. Riesgo de infecciones en pacientes con psoriasis tratados con biológicos
| Ítems | Mediana (ICC) | Grado de acuerdo (%) | Resultado |
|---|---|---|---|
| 15. El cribado de tuberculosis latente en pacientes con psoriasis en tratamiento con fármacos biológicos se debe repetir anualmente | 9 (7-9) | 79 | Acuerdo en 1a ronda |
| 16. La prueba de Mantoux debe realizarse rutinariamente a los pacientes con psoriasis antes de la administración de la terapia sistémica convencional | 8 (7-9) | 83 | Acuerdo en 2.a ronda |
| 17. En los pacientes con una primera determinación de Mantoux negativa es obligatorio realizar booster antes de la administración de terapia biológica | 9 (9-9) | 88 | Acuerdo en 1a ronda |
| 18. La determinación de IGRA es el test de elección en el diagnóstico de la tuberculosis latente en los pacientes con psoriasis antes de la administración de terapia biológica | 8 (7-9) | 79 | Acuerdo en 1a ronda |
| 19. El test de Mantoux es el método de elección en el diagnóstico de la tuberculosis latente | 5 (2-8) | 21 | No consenso |
| 20. Es necesario realizar tanto la prueba de Mantoux como el IGRA para la determinación de la tuberculosis latente | 6.5 (3-8) | 50 | No consenso |
| 21. El fármaco biológico con un menor riesgo de reactivación de tuberculosis latente en los pacientes con psoriasis en tratamiento con fármacos biológicos etanercept | 8 (6-9) | 71 | Acuerdo en 2.a ronda |
| 22. El fármaco biológico con un menor riesgo de reactivación de tuberculosis latente en los pacientes con psoriasis en tratamiento con fármacos biológicos es infliximab | 1 (1-2) | 92 | Desacuerdo en 1.a ronda |
| 23. El fármaco biológico con un menor riesgo de reactivación de tuberculosis latente en los pacientes con psoriasis en tratamiento con fármacos biológicos es adalimumab | 1 (1-3) | 88 | Desacuerdo en 1.a ronda |
| 24. El fármaco biológico con un menor riesgo de reactivación de tuberculosis latente en los pacientes con psoriasis en tratamiento con fármacos biológicos es ustekinumab | 8 (8-9) | 92 | Acuerdo en 2.a ronda |
| 25. La incidencia de infecciones oportunistas en los pacientes con psoriasis en tratamiento con fármacos biológicos en la práctica clínica es superior a la observada en población normal | 8 (6-9) | 75 | Acuerdo en 2.a ronda |
| 26. Los anticuerpos monoclonales anti-TNF (infliximab y adalimumab) se asocian con una mayor incidencia de infecciones por herpes zoster en los pacientes con psoriasis al comparar con los pacientes en tratamiento con sistémicos convencionales | 8 (7-8) | 83 | Acuerdo en 2.a ronda |
| 27. Etanercept se asocia a una mayor incidencia de infecciones por herpes zoster en los pacientes con psoriasis al comparar con los pacientes en tratamiento con sistémicos convencionales | 2,5 (2-6) | 58 | No consenso |
| 28. La vacunación frente al virus del herpes zoster (anti-VVZ) se debe realizar a todos los pacientes con psoriasis, susceptibles de recibir tratamiento biológico | 3 (1-7) | 58 | No consenso |
| 29. El riesgo de infecciones graves es una limitación en la práctica clínica para el uso de biológicos en el tratamiento de la psoriasis de moderada a grave | 2 (1-3) | 79 | Desacuerdo en 1.a ronda |
| 30. El fármaco biológico con menos riesgo de ocasionar infecciones graves en el paciente con psoriasis de moderada a grave es etanercept | 8 (5-9) | 71 | Acuerdo en 1a ronda |
| 31. El fármaco biológico con menos riesgo de ocasionar infecciones graves en el paciente con psoriasis de moderada a grave es infliximab | 1 (1-2) | 92 | Desacuerdo en 1.a ronda |
| 32. El fármaco biológico con menos riesgo de ocasionar infecciones graves en el paciente con psoriasis de moderada a grave es adalimumab | 2 (1-2) | 83 | Desacuerdo en 2.a ronda |
| 33. El fármaco biológico con menos riesgo de ocasionar infecciones graves en el paciente con psoriasis de moderada a grave es ustekinumab | 8 (5-8) | 75 | Acuerdo en 2.a ronda |
| 34. A los pacientes con psoriasis en tratamiento con fármacos biológicos e infección crónica por el VHC se les debe monitorizar la función hepática trimestralmente | 9 (8-9) | 100 | Acuerdo en 1.a ronda |
| 35. La monitorización de los pacientes con psoriasis en tratamiento con fármacos biológicos e infección crónica por el VHC debe incluir recuento de la carga viral | 9 (8-9) | 92 | Acuerdo en 1.a ronda |
| 36. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHC es etanercept | 8 (7-9) | 88 | Acuerdo en 1.a ronda |
| 37. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHC es infliximab | 1,5 (1-3) | 83 | Desacuerdo en 1.a ronda |
| 38. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHC es adalimumab | 2 (1-3) | 83 | Desacuerdo en 2.a ronda |
| 39. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHC es ustekinumab | 5 (3-6) | 58 | No consenso |
| 40. Los pacientes con psoriasis en tratamiento con fármacos biológicos e infección crónica por el VHB sin replicación viral activa deben recibir tratamiento antiviral de base | 8,5 (5-9) | 71 | Acuerdo en 1.a ronda |
| 41. A los pacientes con psoriasis en tratamiento con fármacos sistémicos convencionales o biológicos e infección crónica por el VHB se les debe monitorizar cada 3 meses | 9 (8-9) | 92 | Acuerdo en 1.a ronda |
| 42. La monitorización en pacientes con psoriasis en tratamiento con fármacos sistémicos convencionales o biológicos e infección crónica por el VHB debe incluir el recuento de la carga viral | 9 (8-9) | 96 | Acuerdo en 1.a ronda |
| 43. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHB es etanercept | 8 (5-8) | 71 | Acuerdo en 2.a ronda |
| 44. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHB es infliximab | 2 (1-5) | 71 | Desacuerdo en 1.a ronda |
| 45. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHB es adalimumab | 2 (1-5) | 67 | No consenso |
| 46. El fármaco biológico con menor riesgo de ocasionar reactivación de infecciones por el VHB es ustekinumab | 5 (4-6) | 58 | No consenso |
| 47. Los pacientes con psoriasis de moderada a grave se deben vacunar del virus de la gripe antes de iniciar el tratamiento con fármacos biológicos | 8 (7-9) | 83 | Acuerdo en 1.a ronda |
| 48. Los pacientes con psoriasis de moderada a grave se deben vacunar del neumococo antes de iniciar el tratamiento con fármacos biológicos | 8 (7-9) | 83 | Acuerdo en 1.a ronda |
| 49. Los pacientes con psoriasis de moderada a grave se deben vacunar del VHB antes de iniciar el tratamiento con fármacos biológicos | 9 (8-9) | 92 | Acuerdo en 1.a ronda |
IIC: intervalo intercuartílico.
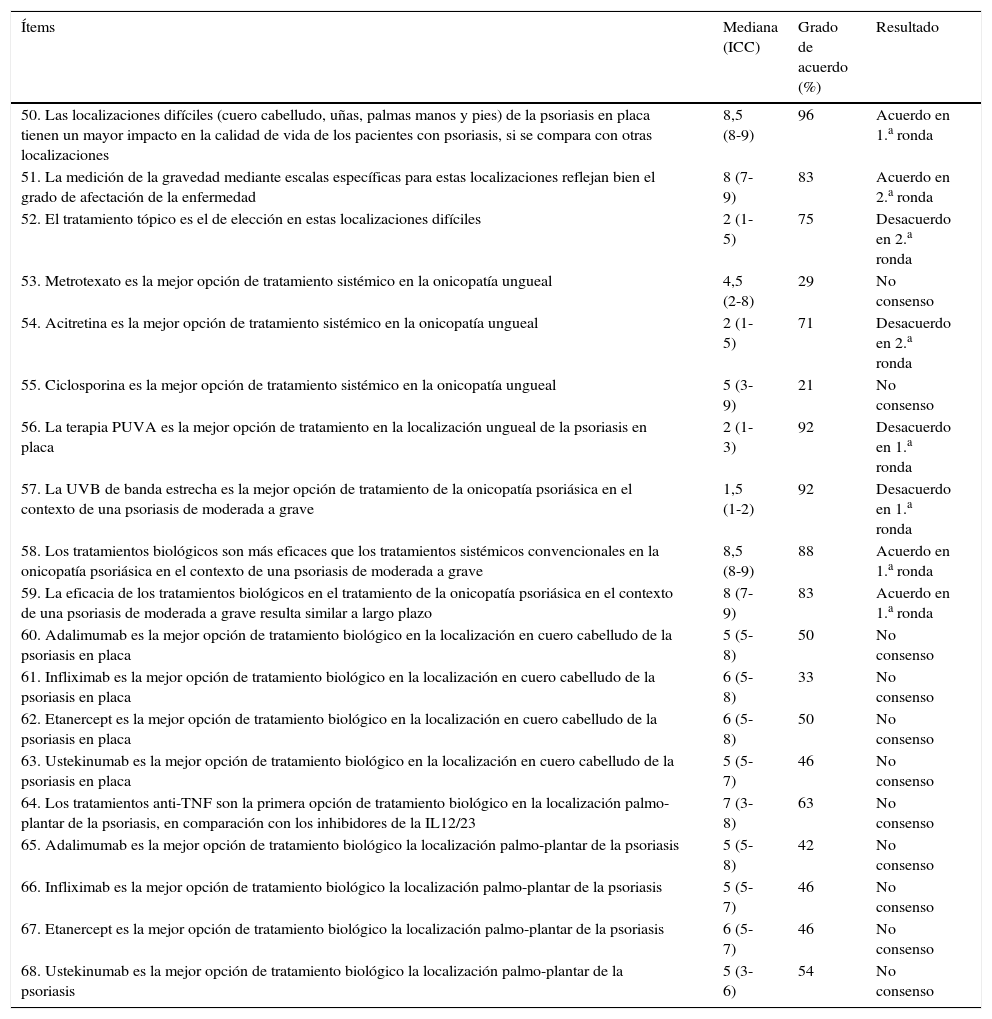
Resultados escenario 3. Localizaciones difíciles de la psoriasis: controversias, impacto y tratamiento
| Ítems | Mediana (ICC) | Grado de acuerdo (%) | Resultado |
|---|---|---|---|
| 50. Las localizaciones difíciles (cuero cabelludo, uñas, palmas manos y pies) de la psoriasis en placa tienen un mayor impacto en la calidad de vida de los pacientes con psoriasis, si se compara con otras localizaciones | 8,5 (8-9) | 96 | Acuerdo en 1.a ronda |
| 51. La medición de la gravedad mediante escalas específicas para estas localizaciones reflejan bien el grado de afectación de la enfermedad | 8 (7-9) | 83 | Acuerdo en 2.a ronda |
| 52. El tratamiento tópico es el de elección en estas localizaciones difíciles | 2 (1-5) | 75 | Desacuerdo en 2.a ronda |
| 53. Metrotexato es la mejor opción de tratamiento sistémico en la onicopatía ungueal | 4,5 (2-8) | 29 | No consenso |
| 54. Acitretina es la mejor opción de tratamiento sistémico en la onicopatía ungueal | 2 (1-5) | 71 | Desacuerdo en 2.a ronda |
| 55. Ciclosporina es la mejor opción de tratamiento sistémico en la onicopatía ungueal | 5 (3-9) | 21 | No consenso |
| 56. La terapia PUVA es la mejor opción de tratamiento en la localización ungueal de la psoriasis en placa | 2 (1-3) | 92 | Desacuerdo en 1.a ronda |
| 57. La UVB de banda estrecha es la mejor opción de tratamiento de la onicopatía psoriásica en el contexto de una psoriasis de moderada a grave | 1,5 (1-2) | 92 | Desacuerdo en 1.a ronda |
| 58. Los tratamientos biológicos son más eficaces que los tratamientos sistémicos convencionales en la onicopatía psoriásica en el contexto de una psoriasis de moderada a grave | 8,5 (8-9) | 88 | Acuerdo en 1.a ronda |
| 59. La eficacia de los tratamientos biológicos en el tratamiento de la onicopatía psoriásica en el contexto de una psoriasis de moderada a grave resulta similar a largo plazo | 8 (7-9) | 83 | Acuerdo en 1.a ronda |
| 60. Adalimumab es la mejor opción de tratamiento biológico en la localización en cuero cabelludo de la psoriasis en placa | 5 (5-8) | 50 | No consenso |
| 61. Infliximab es la mejor opción de tratamiento biológico en la localización en cuero cabelludo de la psoriasis en placa | 6 (5-8) | 33 | No consenso |
| 62. Etanercept es la mejor opción de tratamiento biológico en la localización en cuero cabelludo de la psoriasis en placa | 6 (5-8) | 50 | No consenso |
| 63. Ustekinumab es la mejor opción de tratamiento biológico en la localización en cuero cabelludo de la psoriasis en placa | 5 (5-7) | 46 | No consenso |
| 64. Los tratamientos anti-TNF son la primera opción de tratamiento biológico en la localización palmo-plantar de la psoriasis, en comparación con los inhibidores de la IL12/23 | 7 (3-8) | 63 | No consenso |
| 65. Adalimumab es la mejor opción de tratamiento biológico la localización palmo-plantar de la psoriasis | 5 (5-8) | 42 | No consenso |
| 66. Infliximab es la mejor opción de tratamiento biológico la localización palmo-plantar de la psoriasis | 5 (5-7) | 46 | No consenso |
| 67. Etanercept es la mejor opción de tratamiento biológico la localización palmo-plantar de la psoriasis | 6 (5-7) | 46 | No consenso |
| 68. Ustekinumab es la mejor opción de tratamiento biológico la localización palmo-plantar de la psoriasis | 5 (3-6) | 54 | No consenso |
IIC: intervalo intercuartílico.
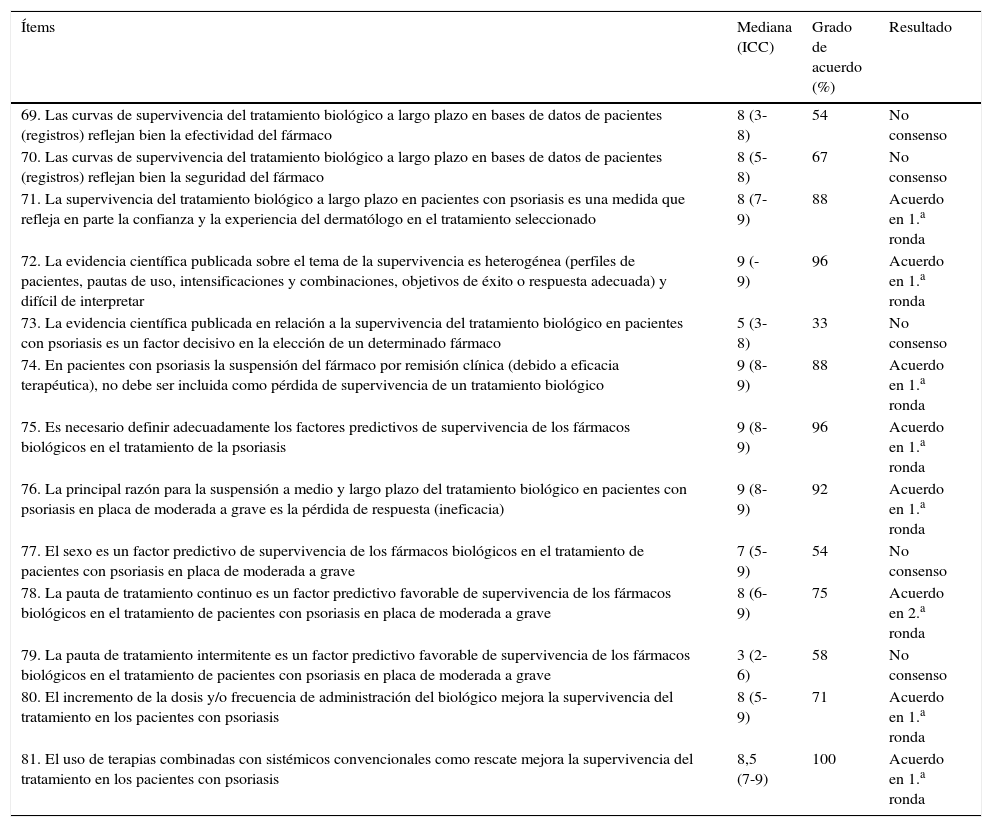
Resultados escenario 4. Supervivencia de las terapias biológicas en la psoriasis
| Ítems | Mediana (ICC) | Grado de acuerdo (%) | Resultado |
|---|---|---|---|
| 69. Las curvas de supervivencia del tratamiento biológico a largo plazo en bases de datos de pacientes (registros) reflejan bien la efectividad del fármaco | 8 (3-8) | 54 | No consenso |
| 70. Las curvas de supervivencia del tratamiento biológico a largo plazo en bases de datos de pacientes (registros) reflejan bien la seguridad del fármaco | 8 (5-8) | 67 | No consenso |
| 71. La supervivencia del tratamiento biológico a largo plazo en pacientes con psoriasis es una medida que refleja en parte la confianza y la experiencia del dermatólogo en el tratamiento seleccionado | 8 (7-9) | 88 | Acuerdo en 1.a ronda |
| 72. La evidencia científica publicada sobre el tema de la supervivencia es heterogénea (perfiles de pacientes, pautas de uso, intensificaciones y combinaciones, objetivos de éxito o respuesta adecuada) y difícil de interpretar | 9 (-9) | 96 | Acuerdo en 1.a ronda |
| 73. La evidencia científica publicada en relación a la supervivencia del tratamiento biológico en pacientes con psoriasis es un factor decisivo en la elección de un determinado fármaco | 5 (3-8) | 33 | No consenso |
| 74. En pacientes con psoriasis la suspensión del fármaco por remisión clínica (debido a eficacia terapéutica), no debe ser incluida como pérdida de supervivencia de un tratamiento biológico | 9 (8-9) | 88 | Acuerdo en 1.a ronda |
| 75. Es necesario definir adecuadamente los factores predictivos de supervivencia de los fármacos biológicos en el tratamiento de la psoriasis | 9 (8-9) | 96 | Acuerdo en 1.a ronda |
| 76. La principal razón para la suspensión a medio y largo plazo del tratamiento biológico en pacientes con psoriasis en placa de moderada a grave es la pérdida de respuesta (ineficacia) | 9 (8-9) | 92 | Acuerdo en 1.a ronda |
| 77. El sexo es un factor predictivo de supervivencia de los fármacos biológicos en el tratamiento de pacientes con psoriasis en placa de moderada a grave | 7 (5-9) | 54 | No consenso |
| 78. La pauta de tratamiento continuo es un factor predictivo favorable de supervivencia de los fármacos biológicos en el tratamiento de pacientes con psoriasis en placa de moderada a grave | 8 (6-9) | 75 | Acuerdo en 2.a ronda |
| 79. La pauta de tratamiento intermitente es un factor predictivo favorable de supervivencia de los fármacos biológicos en el tratamiento de pacientes con psoriasis en placa de moderada a grave | 3 (2-6) | 58 | No consenso |
| 80. El incremento de la dosis y/o frecuencia de administración del biológico mejora la supervivencia del tratamiento en los pacientes con psoriasis | 8 (5-9) | 71 | Acuerdo en 1.a ronda |
| 81. El uso de terapias combinadas con sistémicos convencionales como rescate mejora la supervivencia del tratamiento en los pacientes con psoriasis | 8,5 (7-9) | 100 | Acuerdo en 1.a ronda |
IIC: intervalo intercuartílico.
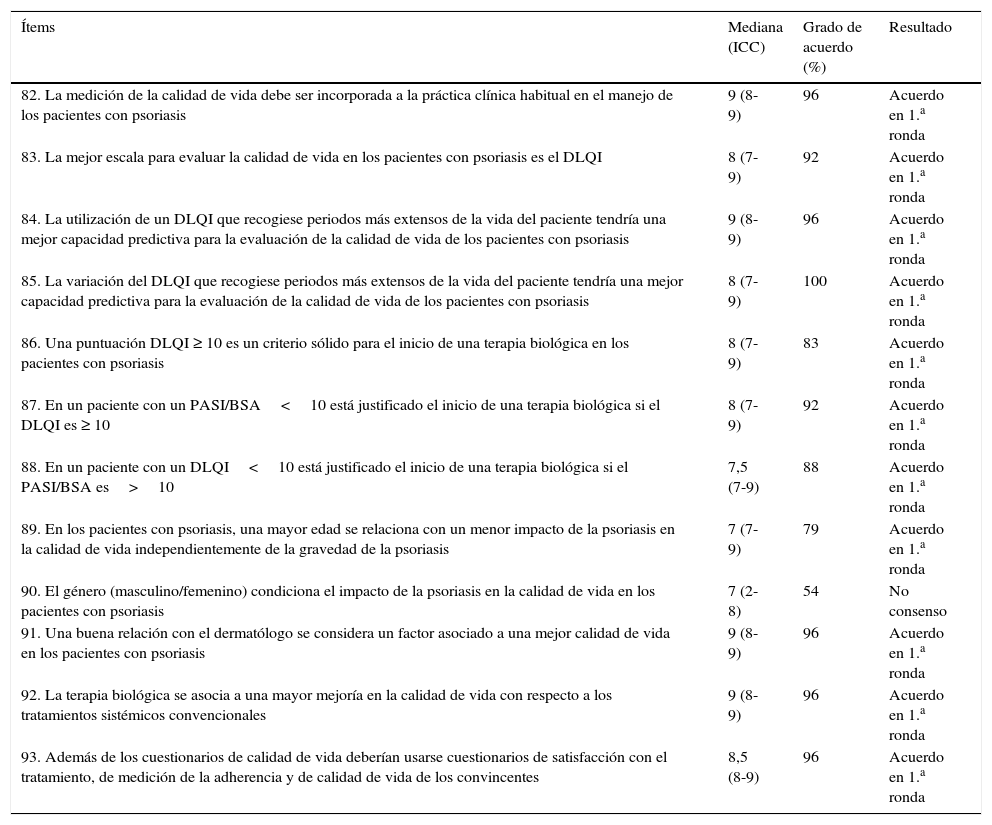
Resultados escenario 5. Evaluación del impacto de la psoriasis en la calidad de vida de los pacientes
| Ítems | Mediana (ICC) | Grado de acuerdo (%) | Resultado |
|---|---|---|---|
| 82. La medición de la calidad de vida debe ser incorporada a la práctica clínica habitual en el manejo de los pacientes con psoriasis | 9 (8-9) | 96 | Acuerdo en 1.a ronda |
| 83. La mejor escala para evaluar la calidad de vida en los pacientes con psoriasis es el DLQI | 8 (7-9) | 92 | Acuerdo en 1.a ronda |
| 84. La utilización de un DLQI que recogiese periodos más extensos de la vida del paciente tendría una mejor capacidad predictiva para la evaluación de la calidad de vida de los pacientes con psoriasis | 9 (8-9) | 96 | Acuerdo en 1.a ronda |
| 85. La variación del DLQI que recogiese periodos más extensos de la vida del paciente tendría una mejor capacidad predictiva para la evaluación de la calidad de vida de los pacientes con psoriasis | 8 (7-9) | 100 | Acuerdo en 1.a ronda |
| 86. Una puntuación DLQI ≥ 10 es un criterio sólido para el inicio de una terapia biológica en los pacientes con psoriasis | 8 (7-9) | 83 | Acuerdo en 1.a ronda |
| 87. En un paciente con un PASI/BSA<10 está justificado el inicio de una terapia biológica si el DLQI es ≥ 10 | 8 (7-9) | 92 | Acuerdo en 1.a ronda |
| 88. En un paciente con un DLQI<10 está justificado el inicio de una terapia biológica si el PASI/BSA es>10 | 7,5 (7-9) | 88 | Acuerdo en 1.a ronda |
| 89. En los pacientes con psoriasis, una mayor edad se relaciona con un menor impacto de la psoriasis en la calidad de vida independientemente de la gravedad de la psoriasis | 7 (7-9) | 79 | Acuerdo en 1.a ronda |
| 90. El género (masculino/femenino) condiciona el impacto de la psoriasis en la calidad de vida en los pacientes con psoriasis | 7 (2-8) | 54 | No consenso |
| 91. Una buena relación con el dermatólogo se considera un factor asociado a una mejor calidad de vida en los pacientes con psoriasis | 9 (8-9) | 96 | Acuerdo en 1.a ronda |
| 92. La terapia biológica se asocia a una mayor mejoría en la calidad de vida con respecto a los tratamientos sistémicos convencionales | 9 (8-9) | 96 | Acuerdo en 1.a ronda |
| 93. Además de los cuestionarios de calidad de vida deberían usarse cuestionarios de satisfacción con el tratamiento, de medición de la adherencia y de calidad de vida de los convincentes | 8,5 (8-9) | 96 | Acuerdo en 1.a ronda |
IIC: intervalo intercuartílico.
Varón de 12 años con historia de psoriasis desde los 4 años. Presenta lesiones de forma continua con exacerbaciones ocasionales coincidiendo con episodios de faringoamigdalitis pultácea. Apenas sale de casa los fines de semana, ni quiere hacer deporte, para no mostrar las lesiones cutáneas. Acude por uno de estos episodios con un PASI de 12,6 y BSA de 14.
La psoriasis en la edad pediátrica frecuentemente se acompaña, al igual que ocurre en el adulto, de comorbilidades tales como obesidad y enfermedades cardiovasculares. En un estudio de 33.981 pacientes con el diagnóstico de psoriasis recogidos en una base de datos de 1,3 millones de personas no seleccionadas de una organización alemana de seguro de enfermedad obligatorio y que cubría todas las regiones, la tasa global de comorbilidades en pacientes menores de 20años de edad era el doble que en sujetos sin psoriasis. En este estudio, la psoriasis juvenil se asociaba con un aumento de las tasas de hiperlipidemia, obesidad, hipertensión, diabetes mellitus, artritis reumatoide y enfermedad de Crohn14. Por otra parte, en un estudio multicéntrico transversal de 409 niños con psoriasis, un 37,9% de los casos tenían un exceso de adiposidad (índice de masa corporal [IMC] ≥percentil 85) en comparación con un 20,5% de los controles, así como un aumento de la adiposidad central (circunferencia de la cintura ≥percentil 90) (9,3% de los controles frente a 21,2% en niños con psoriasis grave), determinando un aumento del riesgo de síndrome metabólico15. Otros estudios también han demostrado un incremento del riesgo cardiovascular en la psoriasis pediátrica16,17. Por ello, los pacientes y sus padres deben ser informados de la asociación entre la psoriasis y el riesgo cardiovascular, advirtiendo de la importancia de fomentar un estilo de vida saludable.
Aunque la evidencia acerca de la relación entre la psoriasis pediátrica, la morbilidad psiquiátrica y el impacto en la calidad de vida es limitada, se ha descrito que los niños con psoriasis tienen más riesgo de desarrollar depresión y ansiedad que los niños sanos18,19. La psoriasis también influye negativamente en la calidad de vida de los pacientes y de sus padres. Los síntomas articulares y el prurito afectan especialmente a la calidad de vida20,21. En un estudio de calidad de vida en pacientes pediátricos se observó una peor calidad de vida en comparación con niños sanos, con un impacto negativo similar al demostrado en niños con enfermedades consideradas graves tales como la artritis, las enfermedades psiquiátricas, el asma y la diabetes22.
No existen guías estandarizadas para el tratamiento de la psoriasis en niños y adolescentes. Los corticosteroides tópicos generalmente constituyen la primera línea de tratamiento local23. En una encuesta en la que participaron un panel de expertos europeos formado por dermatólogos y médicos con especial interés en las enfermedades inflamatorias pediátricas, los corticoides y los análogos de la vitaminaD fueron las primeras opciones de tratamiento tópico, seguidas de los inhibidores de la calcineurina24. De acuerdo con los resultados de una revisión sistemática, los análogos de la vitaminaD se recomiendan especialmente por su eficacia y su buena tolerancia25.
En formas más extensas, refractarias a la terapia tópica, la fototerapia —en particular la terapia UVB de banda estrecha (311-313nm)— se ha considerado la estrategia terapéutica más eficaz y segura en la infancia, de forma independiente al tipo de piel24.
Respecto a los tratamientos sistémicos convencionales, en el caso de la acitretina no hay ensayos clínicos aleatorizados que demuestren su eficacia en niños, aunque se han empleado con éxito y con un perfil de seguridad aceptable en formas de psoriasis en placa grave, psoriasis pustulosa (palmoplantar o generalizada) y en psoriasis eritrodérmica26. De acuerdo con una revisión sistemática de estudios sobre tratamiento de psoriasis infantil desde 1980 hasta 2008, metotrexato fue el tratamiento sistémico de elección para niños con psoriasis en placa moderada a grave25. En el caso de la ciclosporina existe evidencia para su uso en el tratamiento de psoriasis recalcitrante en placa y psoriasis pustulosa juvenil, aunque la indicación de psoriasis no aparece entre las aprobadas para este fármaco en la edad pediátrica27. Su combinación con fototerapia está contraindicada a largo plazo por la posibilidad de incrementar el riesgo de carcinogénesis cutánea24.
Por último, teniendo en cuenta la relación entre amigdalitis estreptocócica y psoriasis, se ha propuesto la amigdalectomía en casos de psoriasis grave recurrente infantil. De acuerdo con una revisión sistemática reciente, esta opción terapéutica podría ser considerada como una alternativa en casos de psoriasis recalcitrante asociada con episodios de amigdalitis28. Sin embargo, los datos de esta revisión se basan en 20 artículos publicados durante los últimos 53años en la que se incluyeron 410 pacientes, con un 71% de mejoría tras la intervención, pero 15 de estas publicaciones eran casos clínicos o series sin grupo control28.
No existen guías específicas para el uso de los inhibidores del factor de necrosis tumoral alfa (TNF-α) (infliximab, adalimumab, etanercept) en la infancia. La Food and Drug Administration (FDA) publicó una serie de advertencias respecto al uso de estos fármacos en pediatría por el potencial de carcinogénesis, fundamentada en la comunicación de 48 casos de diferentes tumores malignos (especialmente linfoma) en niños tratados con estos fármacos29. Sin embargo, existen numerosos factores de confusión condicionados por el riesgo de malignidad asociado con enfermedades subyacentes y al uso concomitante de fármacos inmunosupresores. De hecho, en el momento actual, y con la experiencia clínica acumulada, no se ha establecido una relación causal entre el uso de inhibidores TNF-α y el desarrollo de una neoplasia en niños.
Etanercept está aprobado por la Agencia Europea de Medicamentos (EMA) para el tratamiento de la psoriasis en placa crónica grave en niños a partir de 6años y adolescentes que no son controlados adecuadamente o son intolerantes a otras terapias sistémicas o fototerapia30. Es el agente biológico con mayor cantidad de información disponible, procedente de ensayos clínicos aleatorizados en la población infantil y adolescente31, y el único con estudios de extensión32. Otros estudios observacionales también han demostrado que etanercept es eficaz en el tratamiento pediátrico de psoriasis eritrodérmica y pustulosa33,34. Por otra parte, el 70% de los participantes en un consenso del grupo de expertos europeos consideraron etanercept como primera línea de tratamiento para la psoriasis en placa crónica juvenil debido a su eficacia, tolerabilidad y buen perfil de seguridad24. Dos estudios sobre artritis idiopática juvenil, uno de ellos con un seguimiento de 8años, mostraron un perfil de seguridad para etanercept semejante al de pacientes con psoriasis pediátrica35,36.
Recientemente (25 de febrero de 2015), la EMA ha autorizado una nueva indicación de adalimumab para el tratamiento de la psoriasis crónica en placas en niños y adolescentes a partir de los 4años de edad, teniendo como referencia los resultados de eficacia y seguridad obtenidos en un estudio multicéntrico, aleatorizado y controlado (estudio MO4-717A) que evaluaba 2 dosis de adalimumab (0,4 y 0,8mg/kg por vía subcutánea hasta un máximo de 20 o 40mg) frente a metotrexato (0,1mg/kg aumentando a 0,4mg/kg por vía oral hasta un máximo de 25mg/semana) (los resultados de este aún no están publicados; se pueden consultar en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Assessment_Report_-_Variation/human/000481/WC500186769.pdf).
El estudio CADMUS es un estudio faseiii, aleatorizado y controlado con placebo en el que se evaluaron la eficacia y la seguridad de ustekinumab a 2 dosis (mitad de dosis y dosis estándar) con respecto a placebo en un grupo de 110 pacientes de entre 12 y 18años en el tratamiento de la psoriasis moderada y grave durante un año37. En la semana 12 el 78,4% de pacientes a mitad de dosis y el 80,6% a dosis estándar alcanzaron el Psoriasis Area and Severity Index (PASI)-75, y el 54,1 y el 61,1% el PASI-90, respectivamente. La respuesta se mantuvo en la mayoría de pacientes hasta la evaluación de las 52 semanas, aunque fue mejor en los pacientes tratados con la dosis estándar. El tratamiento fue en general bien tolerado, con un perfil de seguridad similar al atribuido al fármaco en la edad adulta37.
Resultados del consensoEn este escenario (tabla 1) hubo acuerdo en 6 ítems, desacuerdo en 5 y no se alcanzó el consenso en 3. Entre los acuerdos, cabe destacar la incorporación del índice de masa corporal (IMC) y posibles comorbilidades metabólicas en el seguimiento de la psoriasis infantil, así como la conveniencia de la medición de la calidad de vida mediante escalas. Respecto al tratamiento, el panel de expertos estuvo de acuerdo en que la fototerapia UVB de banda estrecha es la primera opción tras el fracaso del tratamiento tópico, y que metotrexato y etanercept son las mejores opciones de tratamiento sistémico y tratamiento biológico, respectivamente, en la psoriasis en placa grave. No hubo consenso en el uso de corticoides tópicos potentes, acitretina o ciclosporina. Asimismo, los panelistas no recomendaron la amigdalectomía profiláctica y también estuvieron en desacuerdo respecto a que el riesgo de linfoma era una limitación importante en la prescripción de tratamientos biológicos.
Escenario 2. Riesgo de infecciones en pacientes con psoriasis tratados con biológicosPaciente varón de 52 años, con psoriasis de larga evolución en tratamiento con etanercept desde hace 4 años. En una visita de seguimiento se detecta positividad para el test de Mantoux con negatividad del de IGRA.
Es conocido que la administración de fármacos biológicos, en particular fármacos anti-TNF, conlleva el riesgo de reactivación de tuberculosis pulmonar latente. Por ello los pacientes en tratamiento con estos fármacos deben ser monitorizados para la detección de tuberculosis antes, durante y después del tratamiento. En un metaanálisis en red de los efectos adversos de la terapia biológica, el riesgo de reactivación de tuberculosis fue significativamente mayor que en los controles (odds ratio: 4,68; intervalo de confianza del 95%: 1,18-18,60)38. Según los datos de una revisión sistemática de ensayos clínicos controlados, el riesgo de reactivación de tuberculosis aún es mayor cuando los fármacos biológicos se usan en combinación con fármacos inmunosupresores en comparación con la monoterapia39. De hecho, tras la implementación de guías de recomendación de la Sociedad Española de Reumatología en marzo de 2002 que recogían actuaciones dirigidas a la prevención de la infección por tuberculosis en pacientes que iban a recibir tratamiento con anti-TNF-α, el riesgo relativo de los pacientes en tratamiento con anti-TNF-α con respecto a la población normal descendió de 19 a 740. Con respecto a los métodos de diagnóstico, la discusión acerca de cuál debe ser el test prioritario en el diagnóstico de infección latente tuberculosa es uno de los aspectos más controvertidos en la gestión del riesgo infeccioso en pacientes bajo terapia biológica. En países endémicos y con alta tasa de vacunación el método interferon γ release assay (IGRA) parece el más adecuado para detectar tuberculosis latente41. En el consenso TBNET42 sobre el riesgo de tuberculosis relacionado con el uso de terapias anti-TNF-α se establece que la correlación Mantoux-IGRA se incrementa en países con baja prevalencia de tuberculosis y baja vacunación. En un análisis conjunto de 2.282 pacientes con enfermedades reumáticas sometidos a cribado por infección tuberculosa latente antes de tratamiento con biológicos, los test de IGRA demostraron una especificidad superior (y posiblemente sensibilidad) en comparación con la prueba de la tuberculina43. Sin embargo, no está suficientemente aclarado el valor predictivo positivo o negativo del QuantiFERON® en pacientes inmunodeprimidos o en pacientes con historia de tuberculosis y valores persistentes positivos o negativos de QuantiFERON®. Tampoco hay datos concluyentes ni recomendaciones respecto a la frecuencia con la que deben reiterarse los test de Mantoux y/o IGRA en el seguimiento en los pacientes con psoriasis44.
El uso de fármacos biológicos en pacientes con psoriasis se ha asociado a un aumento del riesgo de infección por herpes zóster45,46. Según los datos obtenidos del registro alemán RABBIT, la población tratada con adalimumab e infliximab tiene un riesgo 1,82 veces superior de padecer infección por herpes zoster con respecto a los controles, mientras que el riesgo para etanercept fue de 1,36, inferior al riesgo global de cualquier anti-TNF-α (1,63)47. En una revisión de ensayos clínicos aleatorizados y estudios de cohortes se recomendó la vacunación antes del inicio de la terapia con biológicos, especialmente en el caso de infliximab46. Esta actitud se ha propuesto también en pacientes en tratamientos combinados con biológicos y metotrexato, especialmente en presencia de factores de riesgo adicionales48.
Respecto al riesgo de infecciones graves y oportunistas en pacientes con psoriasis y tratamiento biológico, un reciente análisis longitudinal de una cohorte de 11.466 pacientes con psoriasis (registro PSOLAR)49 demostró una incidencia acumulada de infecciones graves de 0,83 por 100 pacientes-año para ustekinumab, 1,47 para etanercept, 1,97 para adalimumab y 2,49 para infliximab, siendo la neumonía y la celulitis las infecciones más frecuentes. En un estudio de seguimiento a 5 años (OBSERVE-5) auspiciado por la FDA en pacientes con psoriasis tratados con etanercept, la tasa de incidencia acumulada de infecciones graves fue del 6,5%50.
El empleo de adalimumab, infliximab y etanercept se ha asociado con casos de reactivación de la hepatitisB, así como de reactivación de hepatitisC para etanercept51. Antes de iniciar el tratamiento con fármacos anti-TNF-α resulta preciso disponer de una valoración del estado de la función hepática en aquellos pacientes con hepatitis C. Si se decide iniciar el tratamiento, se ha propuesto una monitorización periódica de la función hepática52. En un estudio retrospectivo multicéntrico que analizaba la eficacia y la seguridad de ustekinumab en pacientes con psoriasis y hepatitisC o B se concluyó que la terapia biológica fue efectiva y segura en la mayoría de los pacientes a pesar de que, aun bajo esta perspectiva, el uso del fármaco debería limitarse a aquellos casos con una tasa de riesgo-beneficio justificado53,54.
Una de las actuaciones que en mejor medida puede permitir prevenir el desarrollo de infecciones graves en pacientes con terapia biológica es una adecuada vacunación. De hecho, se recomienda remitir al paciente a la unidad de medicina preventiva o unidad especializada de enfermedades infecciosas en cuanto se decida iniciar el tratamiento sistémico, con vistas a poder implementar aquellos déficits en el calendario de vacunación de forma previa a iniciar tratamientos con efecto inmunosupresor. En su conjunto, el calendario de vacunación de pacientes con terapias sistémicas inmunosupresoras y biológicas es similar al recomendado en la población adulta. Sin embargo, existe cierto consenso en que las vacunaciones recomendadas en todos los casos son las de la gripe y Streptococcus pneumoniae, y las opcionales, en función del perfil del paciente, incluyen la de Haemophilus influenzae de tipoB, Neisseria meningitidis, virus de la hepatitisB y difteria y tétanos55,56. De forma ideal, la vacunación debe realizarse de forma previa a iniciar la terapia inmunosupresora. Sin embargo, si aquella se lleva a cabo finalmente durante el tratamiento biológico, aunque puede condicionar niveles de inmunización menores a los habituales, en general son suficientes para garantizar una inmunización adecuada. Debe recordarse la contraindicación de la vacunación con agentes vivos durante la terapia biológica y los fármacos sistémicos inmunosupresores.
Sin embargo, las tasas de vacunación entre los pacientes con enfermedades autoinmunitarias inflamatorias, incluyendo la psoriasis, siguen siendo bajas. Se recomienda a los dermatólogos que aconsejen a sus pacientes acerca de la actualización de las vacunas de acuerdo con el calendario de vacunaciones vigente, como medida para prevenir la infección y aumentar la seguridad de las terapias inmunomoduladoras57.
Resultados del consensoTal como se describe en la tabla 2, de los 35 ítems que componían esta sección del cuestionario, se alcanzó el acuerdo en 20 (57,1%), no hubo consenso en 7 y los expertos estuvieron en desacuerdo en los 8 restantes. Cabe destacar el acuerdo en la importancia de efectuar una prueba de Mantoux antes de la administración no solo de la terapia biológica sino también de la terapia sistémica convencional con efectos inmunosupresores y determinar el efecto booster en pacientes con un primer test de Mantoux negativo, así como elegir una técnica IGRA para el diagnóstico de tuberculosis latente antes de la primera administración de fármacos biológicos. También hubo acuerdo en considerar etanercept como el fármaco biológico con un menor riesgo de reactivación de tuberculosis latente y de asociación a infecciones graves y de reactivación de infecciones por el virus de la hepatitisC y de la hepatitisB. Por otra parte, el panel de expertos mostraba un grado de acuerdo elevado en la necesidad de monitorizar la función hepática y la carga viral en los pacientes VHC y VHB positivos en tratamiento con fármacos biológicos o sistémicos convencionales. Antes de iniciar el tratamiento con fármacos biológicos, los expertos consideraron adecuado vacunar del virus de la gripe, del neumococo y del VHB.
Escenario 3. Localizaciones difíciles de la psoriasis: controversias, impacto y tratamientoMujer de 36 años. Presenta psoriasis limitada (BSA 5), pero con marcada afectación del cuero cabelludo y de las uñas, con onicopatía psoriásica en la mayoría de ellas. El impacto en la calidad de vida es elevado (DLQI 15).
El término «psoriasis en localizaciones difíciles» se ha empleado para hacer referencia a la psoriasis localizada en las uñas, el cuero cabelludo, las palmas y las plantas. Estas áreas suelen caracterizarse por asociarse a un importante impacto físico, emocional y funcional, y donde la mayoría de los tratamientos tópicos resultan incómodos o ineficaces58-60. La evidencia derivada de ensayos clínicos controlados que evalúen comparativamente la eficacia y la seguridad de los tratamientos sistémicos, fototerapia y tratamiento con biológicos en estas localizaciones es escasa.
En el caso de la psoriasis ungueal, una revisión sistemática elaborada por el grupo Cochrane61, en la que se incluían 18 ensayos clínicos controlados con un total de 1.266 pacientes publicados entre 1946 y 1982, ya señalaba que la heterogeneidad de los estudios impedía presentar resultados concluyentes. Aunque los tratamientos sistémicos han mostrado beneficio, sus efectos adversos potencialmente graves limitan su uso, de modo que no parecen una opción realista en la psoriasis ungueal, a menos que se indiquen por la existencia concomitante de psoriasis cutánea o artritis psoriásica, psoriasis ungueal grave, refractaria a otros tratamientos, o que determine un impacto notable en la calidad de vida del paciente. La evidencia de los tratamientos tópicos es poco concluyente y de baja calidad metodológica61. En un análisis post hoc del ensayo clínico BELIEVE se presentaba un subanálisis del tratamiento con adalimumab en 733 pacientes con psoriasis ungueal y/o del cuero cabelludo. En todas las variables (PASI-75, escala analógica visual, Dermatology Life Quality Index [DLQI]) el efecto de adalimumab fue mejor en la psoriasis del cuero cabelludo que en la ungueal62. Recientemente, la Fundación Nacional de Psoriasis de Estados Unidos ha elaborado unas recomendaciones para el tratamiento de la psoriasis ungueal tras haber revisado las publicaciones sobre el tema incluidas en la base de datos PubMed desde 1947 a 2014, sin restricciones referentes al idioma de publicación de los artículos63. Se señala la conveniencia de que los pacientes sean evaluados para descartar la presencia de una onicomicosis que complicaría el tratamiento. En pacientes con enfermedad limitada a las uñas, los corticoides tópicos de alta potencia con o sin análogos de la vitaminaD sería la opción inicial, seguida de tratamiento con fármacos biológicos (adalimumab, etanercept, ustekinumab) o sistémicos (metotrexato, acitretina) en el caso de fracaso del tratamiento tópico. Para pacientes con psoriasis ungueal y psoriasis cutánea y/o afectación articular, adalimumab, etanercept, ustekinumab, metotrexato, acitretina e infliximab serían recomendables de acuerdo con las características individuales de la enfermedad y criterio del especialista63. Por otra parte, en un estudio retrospectivo sobre la eficacia de infliximab, adalimumab, etanercept, ustekinumab en psoriasis ungueal, las diferencias en la mejoría del NAPSI a las 12, 24 y 36 semanas no fueron significativas entre los grupos de tratamiento64.
Con respecto a la psoriasis en el cuero cabelludo, una revisión sistemática de los tratamientos tópicos utilizados en 26 ensayos clínicos aleatorizados y controlados con 8.020 participantes puso en evidencia que los corticoides tópicos potentes resultaban más eficaces que los análogos de la vitaminaD en esta localización, aunque no hay datos sobre seguridad en el tratamiento a largo plazo65. Los resultados de un metaanálisis en red también coinciden en la indicación de los corticoides tópicos potentes asociados o no con análogos de la vitaminaD (calcipotriol/betametasona)66,67. Las recomendaciones basadas en consensos de expertos sugieren reservar la fototerapia y el tratamiento con biológicos para pacientes con enfermedad grave y recalcitrante68, así como para aquellos en los que la afectación del cuero cabelludo se acompañe de psoriasis generalizada69.
Aunque hay datos de eficacia de infliximab, adalimumab y etanercept en localizaciones difíciles, incluyendo las palmas y las plantas, no se han publicado ensayos prospectivos comparativos que justifiquen la priorización de un determinado biológico. En un estudio de 15 pacientes con psoriasis palmoplantar pustulosa (PPP) asignados a tratamiento con etanercept 50mg 2 veces a la semana durante 3 meses o placebo (tras los 3 meses todos los pacientes fueron tratados con etanercept durante 3 meses más), se observó una reducción estadísticamente significativa (p=0,038) de la mediana del Palmo-Plantar Pustulosis Area of Severity Index (PPPASI) desde el inicio a las 24 semanas de tratamiento solo en el grupo de etanercept70. En un análisis post hoc del estudio REACH de 72 pacientes con psoriasis crónica palmoplantar asignados a tratamiento con adalimumab o placebo durante 16 semanas, se observó que el grupo de pacientes tratados con adalimumab que alcanzó el objetivo de respuesta NAPSI-50, también obtuvo grados de aclaramiento en el Physician's Global Assessment (PGA) de manos y pies. La eficacia de adalimumab no se vio afectada por la edad, el género, el peso, la puntuación PASI, la duración de la enfermedad, el historial de artritis psoriásica, el tratamiento sistémico previo, el historial de fumador o la enfermedad de las uñas71.
Según las directrices del Grupo Español de Psoriasis basadas en la evidencia72, el tratamiento con fármacos biológicos en pacientes con psoriasis en áreas de difícil tratamiento está indicado cuando la psoriasis cumpla alguna de las siguientes condiciones: a)no controlable con tratamiento tópico o sistémico convencional; b)formas extensas (NAPSI>10); c)empeoramiento rápido; d)percepción de gravedad subjetiva (DLQI>10), y e)artropatía psoriásica asociada. En su conjunto, aunque existe una notable heterogeneidad en las medidas de evaluación empleadas, solo cerca de 1 de cada 3 pacientes tratados alcanzará una remisión completa o casi completa (p.ej.. PGA 0/1) en los distintos estudios realizados con terapia biológica en esta localización.
Resultados del consensoEste escenario (tabla 3) de 19 ítems fue el que registró el menor consenso (11 ítems). Hubo acuerdo en que las localizaciones difíciles (cuero cabelludo, uñas, palmoplantar) de la psoriasis en placa tienen un mayor impacto en la calidad de vida en comparación con otras localizaciones. Se consideró que la medición de la gravedad mediantes escalas específicas para estas localizaciones reflejaba adecuadamente el grado de afectación de la enfermedad, y también se asumió una mayor eficacia de los tratamientos biológicos en la onicopatía psoriásica frente a los tratamientos sistémicos convencionales. En la psoriasis del cuero cabelludo y palmoplantar no hubo consenso en cuál era la mejor opción de tratamiento biológico.
Escenario 4. Supervivencia de las terapias biológicas en la psoriasisVarón de 47 años con IMC de 32kg/m2. Presenta una psoriasis de larga evolución por la que ha realizado tratamientos previos con metotrexato, ciclosporina y fototerapia. Inició terapia biológica con adalimumab, que inicialmente mejoró el cuadro clínico, con pérdida de respuesta después de un año. Tras este periodo inició tratamiento con infliximab, con respuesta que nunca fue completa y que se mantuvo 18 meses, con recaída posterior a pesar del tratamiento combinado con metotrexato y el acortamiento de dosis. Se evalúan las posibilidades disponibles y las perspectivas de alcanzar una respuesta mantenida en el tiempo
Se define como supervivencia el tiempo en el que un determinado fármaco se mantiene como una opción adecuada para un paciente concreto. Medir la supervivencia de los fármacos biológicos en la psoriasis plantea dificultades por la heterogeneidad y limitaciones de los estudios. La supervivencia del fármaco es el reflejo de una combinación de eficacia, seguridad y conveniencia. Los datos de seguridad referidos a los agentes biológicos indican que, al menos durante los primeros meses de tratamiento, presentan un perfil favorable e incluso superior al de los tratamientos sistémicos convencionales. En un metaanálisis de 24 ensayos clínicos aleatorizados y controlados, con un total de 9.384 pacientes, cuya variable primaria fue la proporción de pacientes con PASI-75, infliximab fue el fármaco más eficaz (diferencia de riesgo [DR] 77%) seguido de adalimumab (DR 44%) y etanercept (DR 30%)73. Recientemente, en un estudio observacional que investigaba la eficacia clínica y la supervivencia de los fármacos a los 12 meses de tratamiento, la tasa de supervivencia de ustekinumab fue del 96,7%, de adalimumab del 79,7% y de infliximab del 73,3%74. En otro estudio que determinaba las diferencias en la supervivencia de los fármacos biológicos según una base de datos de pacientes con psoriasis recogidos en un centro médico en Amsterdam, la supervivencia a 1 y 4 años para los pacientes naïve era similar (etanercept 85 y 64%; adalimumab 77 y 77%; infliximab 75 y 75%), siendo inferior en los no naïve (etanercept 86 y 42%; adalimumab 84 y 56%; infliximab 68 y 43%; ustekinumab 84 y 57%)75. En el registro prospectivo DERMBIO76, que incluye todos los pacientes con psoriasis tratados con biológicos en centros académicos de Dinamarca (1.867 tratamientos en 1.277 pacientes durante 10 años), la supervivencia media fue de 47 meses, con un porcentaje del 67% de interrupción del tratamiento atribuida a la falta de eficacia (9,7% por efectos adversos). La media estimada de supervivencia fue de 59 meses para adalimumab, 44 para infliximab y 30 para etanercept. La supervivencia fue superior en varones que en mujeres y en pacientes no tratados previamente con biológicos76.
En el registro prospectivo BioCAPTURE se analizaban los tratamientos biológicos iniciados a partir de enero de 2010 cuando todos los agentes biológicos estaban disponibles77. Un episodio se consideraba continuo si se había suspendido por un periodo de tiempo ≤90días (son frecuentes suspensiones por cirugías, vacaciones, infecciones, etc.). El periodo de observación fue de un año, en el que se describe la supervivencia de los tratamientos y también el porcentaje de pacientes que mostraron ‘happy’ drug survival definido como DLQI≤5 y en tratamiento continuado. La supervivencia de ustekinumab fue más alta en comparación con etanercept. También mostró una tendencia a conseguir una mejor supervivencia cuando se comparaba con adalimumab. Hubo un aumento a lo largo del tratamiento del porcentaje de pacientes que se evaluaron como ‘happy’: 27, 64, 69, 72 y 79% en la visita basal y 3, 6, 9 y 12 meses, respectivamente. La inefectividad y los acontecimientos adversos, o ambos, fueron las principales razones de suspensión del tratamiento. Los expertos, con un grado de acuerdo del 92%, llegaron al consenso en la primera ronda respecto al papel de la ineficacia (pérdida de respuesta) como la principal causa de suspensión del tratamiento.
En un estudio de la eficacia y la seguridad a largo plazo de etanercept y adalimumab en 85 pacientes ≥65años con psoriasis y artritis psoriásica seguidos durante 3años se constató una mayor supervivencia de etanercept (74,5%) frente a adalimumab (60,7%) y la mayoría de suspensiones del tratamiento por ineficacia78. En el estudio OSCARI se estudiaron las tasas de supervivencia de etanercept, infliximab y adalimumab en pacientes naïve con psoriasis en la práctica clínica habitual, siendo del 80,7% para etanercept, el 61,9% para infliximab y el 58,8% para adalimumab tras un periodo de observación de hasta 6años79. Asimismo, la mayoría suspendió el tratamiento por ineficacia (etanercept 14,4%, infliximab 27,9%, adalimumab 27,2%) y unos pocos por seguridad (etanercept 2,8%, infliximab 8,8%, adalimumab 4,4%)79. En el estudio OSCARII, un estudio en faseiv que analiza la tasa de supervivencia a largo plazo de etanercept en pacientes con psoriasis en la práctica clínica habitual, de un total de 367 pacientes, se analizaron 152 con psoriasis en placa80. Estos pacientes fueron tratados con etanercept en tratamiento intermitente (110 pacientes, 72,4%) o continuo (42 pacientes, 27,6%).
La duración del tratamiento en pacientes con tratamiento intermitente fue de 1.706 días y para tratamiento continuo, de 1.249 días80.
Hay que señalar que la pérdida de adherencia al tratamiento es uno de los principales factores que incrementa el coste de la terapia. En este sentido, la pérdida de validez de un fármaco condiciona a menudo la introducción de otro agente biológico con una nueva pauta de inducción que resulta más costosa que la atribuida al mantenimiento81. Entre los factores predictores de supervivencia de los fármacos biológicos en los distintos trabajos se han señalado, además de las propiedades inherentes a cada uno de ellos, el incremento de dosis, la frecuencia de administración, el uso de terapias combinadas, la producción de anticuerpos anti-fármaco, una mayor tasa de catabolismo y, en último término, las decisiones clínicas que prevalecen en el cambio de un fármaco a otro.
Resultado del consensoDe los 13 ítems que componían este escenario, hubo acuerdo en 8 (tabla 4). Los expertos coincidían en que la evidencia científica publicada sobre el tema es heterogénea y de difícil interpretación y que es necesario definir adecuadamente los factores predictores de supervivencia de los fármacos biológicos. Asimismo, se consensuó que el incremento de la dosis y/o la frecuencia de administración del biológico mejora la supervivencia del tratamiento, y que la suspensión del fármaco por remisión clínica debida a la eficacia terapéutica no debe ser incluida como pérdida de supervivencia. La pauta de tratamiento continuo se consideró por el panel como un factor predictor favorable de supervivencia. Por otra parte, el uso de terapias combinadas con tratamientos sistémicos convencionales como rescate también fue considerado como una acción que mejoraba la supervivencia del tratamiento en los pacientes con psoriasis.
Escenario 5. Evaluación del impacto de la psoriasis en la calidad de vida de los pacientesMujer de 22 años. Presenta una psoriasis en placas con PASI de 5 y BSA de 3, con lesiones muy infiltradas y eritematosas y referidas como muy pruriginosas en diversas localizaciones. A pesar de que la extensión de la enfermedad es moderada, el DLQI es elevado, superior a 10, en visitas sucesivas.
El desafío terapéutico en los pacientes con psoriasis es no solo conseguir una remisión a largo plazo de los signos y síntomas de la enfermedad, sino también mejorar la calidad de vida de los pacientes. La relevancia del impacto de la psoriasis en las diferentes dimensiones de la calidad de vida implica la necesidad de añadir cuestionarios validados en la evaluación del paciente, aunque en la vida real el empleo sistemático de estas herramientas no está bien establecido.
En un consenso de expertos basado en la evidencia derivada de la revisión de 154 artículos seleccionados entre 10.642 referencias bibliográficas publicadas entre 1980 y 2009, 44 dermatólogos elaboraron 10 recomendaciones para la práctica clínica, entre las que se incluían el uso del DLQI, el SF-36 y el Skindex-29, así como del DLQI antes de iniciar un tratamiento sistémico y durante el seguimiento de los pacientes82. En este trabajo se ponía de manifiesto que los cuestionarios son incompletos y poco útiles para valorar otros aspectos, como el estado de ánimo, el estrés, el impacto sobre el sueño o sobre el entorno familiar, la aceptación/satisfacción con tratamiento actual o el grado de fatiga. Un estudio reciente muestra que la escala DLQI sobre la vida completa (LT DLQI) que mide calidad de vida crónica predice mejor la calidad de vida que la escala DLQI de la última semana o del último año83.
Todos los tratamientos biológicos (etanercept, infliximab, adalimumab, ustekinumab) han demostrado su eficacia en el objetivo de mejorar la calidad de vida de los pacientes con psoriasis a través de distintos índices o escalas de calidad de vida.
El prurito es un síntoma relevante en la psoriasis que tiene un gran impacto en la calidad de vida. En el ensayo aleatorizado PRISTINE84 se evaluaron 2 pautas de tratamiento de etanercept: 50mg subcutáneo una vez a la semana versus 50mg subcutáneo 2 veces a la semana. Las escalas de calidad de vida se correlacionaban con el nivel de prurito. De este modo, a mayor prurito, mayor impacto negativo en las escalas de calidad de vida. Tras 24 semanas de tratamiento, los niveles de prurito descendieron en ambos grupos de tratamiento, mejorando todas las escalas de calidad de vida. Respecto a la influencias de las pautas de tratamiento en la calidad de vida, el estudio aleatorizado CRYSTEL85 analizaba una pauta de terapia continua (etanercept 25mg subcutáneo 2 veces a la semana durante 54semanas) y una pauta de terapia intermitente (etanercept 50mg subcutáneo 2 veces a la semana durante ≤12semanas, tras discontinuación; si aparecía una recaída, se reiniciaba con etanercept 25mg subcutáneo 2 veces a la semana). La pauta continua se evaluó en 352 pacientes y la intermitente, en 359. A las 54 semanas, ambos grupos mejoran significativamente DLQI, EQ-5D, HADS-depresión, HADS-ansiedad y SF-36-vitalidad, con una mejoría significativa del DLQI y EQ-5D en el grupo de tratamiento continuo, pero de magnitud no relevante.
En un metaanálisis acerca de los efectos comparativos de las terapias biológicas en la calidad de vida en pacientes con psoriasis en placas, se concluyó que todos los fármacos mejoraban la calidad de vida (DLQI) en comparación con el placebo86. Asimismo, en una revisión sistemática reciente, las incomodidades e insatisfacciones generadas por la psoriasis (medidas con el cuestionario EuroQOL de 5 dimensiones) eran comparables a las generadas por otras enfermedades crónicas (enfermedades cardiovasculares, diabetes, insuficiencia renal avanzada, enfermedades hepáticas, cáncer y trastornos de la visión)87. En una encuesta de la National Psoriasis Foundation estadounidense, efectuada de 2003 a 2011, con 5.604 pacientes que respondieron a la misma, se comprobó cómo, entre los desempleados, un 92% mencionaban a la psoriasis como causa del paro. En la población activa un 49% de sujetos habían faltado al trabajo de forma regular a causa de la enfermedad. Los pacientes con psoriasis grave tenían 1,8 más posibilidades de no trabajar, tras ajustar por edad y sexo, que los pacientes con psoriasis leve88.
Finalmente, otros aspectos que afectan la calidad de vida de pacientes con psoriasis incluyen el grado de extensión de las lesiones en la piel, la visita por parte del paciente a numerosos médicos, la edad juvenil, sentir falta de apoyo por parte de los profesionales de la salud, sensación de desatención al no estar preparadas las instalaciones o no disponer de información sobre los efectos secundarios y las alternativas de tratamiento. Por otra parte, tanto la escala DLQI como el PASI influyen en la prescripción de los tratamientos biológicos, aunque el PASI parece que influye en mayor medida en la práctica clinica89.
Resultados del consensoEn este escenario de 12 aseveraciones, todas menos una (el género condiciona el impacto de la psoriasis en la calidad de vida) se aprobaron por acuerdo en la primera ronda Delphi (tabla 5), destacando la importancia de incorporar la medición de la calidad de vida en la práctica clínica habitual, utilizando preferentemente el DLQI. Una puntuación ≥10 en el DLQI se consideró un criterio sólido para iniciar terapia con biológicos. Otros acuerdos se referían a una superior mejoría en la calidad de vida con los biológicos respecto a los tratamientos sistémicos convencionales, a la influencia positiva de una buena relación entre dermatólogo y paciente, a la importancia de la variación del DLQI como marcador de eficacia de las terapias con biológicos o a la necesidad de incorporar cuestionarios de satisfacción con el tratamiento y la medición de la adherencia.
DiscusiónLa psoriasis en la edad infantil es un ámbito relativamente poco explorado. A ello ha contribuido probablemente una menor prevalencia a esta edad, la dificultad de llevar a cabo ensayos clínicos y la priorización de aspectos relacionados con la seguridad. Sin embargo, la progresión del conocimiento global sobre la enfermedad ha permitido extender a este grupo de edad los avances experimentados en las formas del adulto y la importancia de las comorbilidades y del impacto en la calidad de vida14,15. En este sentido, los expertos del panel reconocieron y recomendaron integrar la ponderación de las comorbilidades y la evaluación objetiva del impacto de la calidad de vida en la toma de decisiones. Desde el punto de vista terapéutico, las conclusiones de los expertos parecen incidir en la priorización de la seguridad, reflejada en la preferencia por la terapia UVB-BE como estrategia de elección en las formas graves. En el tratamiento sistémico convencional, metotrexato, un fármaco en el que los dermatólogos han demostrado una experiencia creciente en los últimos años, se priorizó sobre otras posibilidades. La eficacia y la seguridad descritas en los estudios con terapia biológica, a menudo no explorada en profundidad en el caso de otros tratamientos sistémicos, podría, en opinión del panel, permitir priorizar su elección sobre otras variantes de tratamiento sistémico en las formas más graves31-34. Etanercept se consideró la opción de elección en función de la experiencia acumulada en el momento del consenso. La ampliación, de forma reciente, de estudios hacia otros tratamientos biológicos tales como adalimumab (recientemente aprobado por la EMA para el tratamiento de psoriasis crónica en placas en niños y adolescentes a partir de los 4años de edad) o ustekinumab37 podría incrementar las posibilidades y el abanico terapéutico disponible.
El riesgo de infecciones, comunes u oportunistas, ha sido considerado como una de las limitaciones y peligros de la terapia biológica en distintas enfermedades inflamatorias desde el inicio de su empleo38. Sin embargo, la experiencia creciente en dermatología, que es distinta a la procedente de pacientes con otras enfermedades inflamatorias crónicas, parece indicar que este riesgo, en su conjunto, sería limitado en los pacientes con psoriasis con respecto al observado en otras enfermedades inflamatorias, tanto por el perfil del paciente como por la ausencia de terapia inmunosupresora adicional, y algo superior para infliximab y adalimumab que para etanercept y ustekinumab49. Estas conclusiones, procedentes en gran parte de estudios epidemiológicos y registros, parecen ser asumidas por los expertos del panel a la hora de posicionar las distintas alternativas con respecto al riesgo de reactivación de infecciones latentes, infecciones oportunistas o infecciones graves. Aunque la controversia acerca de la conveniencia de los test de IGRA frente al Mantoux en la evaluación de la tuberculosis latente podría estar resolviéndose con ventaja hacia el primero, la ausencia de evidencia firme se refleja también en la conveniencia, según los expertos, de mantener ambas como opciones adecuadas, e incluso complementarias43.
Las dificultades en el manejo terapéutico de las conocidas como localizaciones difíciles en psoriasis —cuero cabelludo, uñas, palmas y plantas—, así como la escasez de información estructurada y de elevada evidencia, se reflejaron en la falta de consenso acerca de las mejores opciones en cada caso58-60. De cualquier forma, sí hubo consenso en considerar que el tratamiento biológico resultaba una opción más efectiva en algunas de estas variantes, como la onicopatía psoriásica —sin priorizarse ninguna alternativa— y sobre el importante impacto de estas variantes en la calidad de vida del paciente.
Conforme se afianza la experiencia en el manejo de la terapia biológica para la psoriasis resulta más evidente que la supervivencia o la persistencia del fármaco es uno de los elementos relevantes en la toma de decisiones. No solo por el impacto que en la calidad de vida del paciente tiene la reaparición de la enfermedad cutánea controlada en los primeros meses del tratamiento, sino también desde el punto de vista de la seguridad y del coste adicional atribuible a nuevas pautas de inducción78. Sin embargo, el panel de expertos coincidió en considerar que aunque la información disponible es creciente, también es heterogénea y de difícil interpretación, ya que, por ejemplo, las pautas intermitentes o de suspensión, por motivos ajenos al curso del tratamiento —como por voluntad del paciente al alcanzar la remisión— o por causas intercurrentes, pueden atribuirse en los registros erróneamente a un fracaso terapéutico. En cualquier caso, la experiencia de los panelistas favoreció el empleo de pautas continuas, la flexibilidad e individualización posológica, frente a la rigidez de la ficha técnica, y la combinación como instrumentos para mejorar las perspectivas y la persistencia del efecto terapéutico. Estas circunstancias parecen reflejar que las posibilidades derivadas de la práctica clínica diaria, aunque difícilmente podrán ser estructuradas en forma de una evidencia firme, pueden resultar de gran utilidad en la optimización de los resultados terapéuticos.
La importancia de la incorporación de parámetros de calidad de vida a la evaluación del curso terapéutico en la psoriasis moderada-grave es creciente. Ello se debe no solo a que su mejora es un objetivo primario del tratamiento, sino también a la a menudo falta de correspondencia entre la evolución en los parámetros objetivos de la enfermedad y la percepción subjetiva del paciente —evidente, por ejemplo, en áreas visibles de escasa extensión— y a las diferencias observadas entre los objetivos prioritarios entre médico y paciente81. En este sentido, los panelistas mostraron una muy notable coherencia con la incorporación e incluso la priorización de los parámetros referidos a la calidad de vida en la toma de decisiones terapéuticas en la psoriasis moderada-grave. Sin embargo, estas opiniones contrastan con el limitado empleo de estos parámetros fuera de los ensayos clínicos y con las limitaciones de los cuestionarios disponibles en el objetivo de abarcar de forma completa y satisfactoria todos los aspectos relevantes en la vida de los pacientes80.
En definitiva, el presente artículo desarrolla algunos de los aspectos más relevantes y controvertidos en el momento actual en los que la información disponible es incompleta o incluso contradictoria, en donde la opinión estructurada de los expertos puede resultar de utilidad a los dermatólogos clínicos con experiencia y manejo de la psoriasis en la toma de decisiones en su actividad diaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derechos a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste consenso Dephi ha contado con la ayuda de Pfizer España, que financió la encuesta electrónica y las reuniones presenciales, así como las teleconferencias. Ningún empleado de Pfizer ha participado en ninguna de las discusiones del panel de expertos ni en la redacción del texto.
Conflicto de interesesJ.M. Carrascosa ha recibido honorarios como consultor o por participación en conferencias por parte de Abbvie, Janssen, MSD, Pfizer-Wyeth, Amgen y Lilly.
M. Ribera ha recibido pagos por conferencias, consultoría e investigación por parte de Abbvie, Gebro, Leo-Pharma, MSD, Novartis, Pfizer y Janssen.
M. Galán ha participado en estudios y dado conferencias para Pfizer, Janssen, Abbvie, MSD, Novartis, Leo-Pharma y Gebro-Pharma.
A. Pérez Ferriols ha recibido honorarios relacionados con la investigación, por el asesoramiento como experto, por la participación en ensayos clínicos y/o por impartir conferencias por parte de Abbvie, Almirall, Avéne, Biogen, Cantabria, Ferrer, Isdin Johnson & Johnson, Leo-Pharma, MSD, Novartis, Pfizer y Viñas.
I. Yanguas ha recibido honorarios en concepto de consultoría por parte de Abbvie, Janssen, Pfizer y Schering-Plough.
R. de Lucas no ha declarado conflicto de intereses.
Los autores agradecen especialmente la participación de los dermatólogos en la metodología Delphi, sin la cual este estudio no se hubiera podido llevar a cabo, así como el soporte editorial de Nature Publishing Group Iberoamérica y la labor de redacción de la Dra. Marta Pulido en la redacción del manuscrito.