Los corticoides son fármacos ampliamente utilizados en la práctica clínica, especialmente de forma tópica en dermatología. Estas sustancias pueden actuar como alérgenos y producir tanto reacciones de hipersensibilidad inmediata como retardada. La alergia en forma de dermatitis de contacto es la reacción más frecuente, y debe estudiarse mediante pruebas epicutáneas en unidades especializadas. Actualmente la batería estándar española tiene buenos marcadores para su detección, pero no ideales. Por ello, es rentable aplicar una batería específica de corticoides si dichos marcadores son positivos, así como los corticoides propios aportados por los pacientes. En cuanto a las reacciones de hipersensibilidad inmediata, son mucho menos habituales, pero potencialmente más graves. Debido a que estos fármacos son necesarios en múltiples enfermedades, es importante confirmar la sensibilización a estas sustancias, y orientar el uso de corticoides alternativos. En el presente artículo pretendemos revisar los principales conceptos respecto a estos 2 tipos de reacciones de hipersensibilidad en la alergia a corticoides, así como su abordaje en la práctica clínica.
Corticosteroids are widely used drugs in the clinical practice, especially by topic application in dermatology. These substances may act as allergens and produce immediate and delayed hypersensitivity reactions. Allergic contact dermatitis is the most frequent presentation of corticosteroid allergy and it should be studied by patch testing in specific units. The corticosteroids included in the Spanish standard battery are good markers but not ideal. Therefore, if those makers are positive, it is useful to apply a specific battery of corticosteroids and the drugs provided by patients. Immediate reactions are relatively rare but potentially severe, and it is important to confirm the sensitization profile and to guide the use of alternative corticosteroids, because they are often necessary in several diseases. In this article we review the main concepts regarding these two types of hypersensitivity reactions in corticosteroid allergy, as well as their approach in the clinical practice.
Los corticoides son fármacos ampliamente utilizados en la práctica clínica de dermatología, especialmente de forma tópica. En 1952 Sulzberger y Witten sintetizaron un compuesto tópicamente activo denominado sustancia F, que fue conocido posteriormente como hidrocortisona o cortisol1. Desde su introducción han demostrado gran eficacia como fármacos antiinflamatorios y antimoduladores, sin embargo, también pueden comportarse paradójicamente como alérgenos, dando lugar a reacciones de hipersensibilidad. Este efecto se describió por primera vez en los años 502–5, y posteriormente se han recogido muchos más casos. Dentro de las reacciones de hipersensibilidad las de tipo iv o retardadas, que cursan con clínica de dermatitis alérgica de contacto (DAC), se dan con mucha mayor frecuencia que las de tipo i o inmediatas, las cuales son menos conocidas6.
Los corticoides presentan una estructura química similar entre sí, por lo que no es infrecuente que se produzcan reacciones cruzadas entre ellos. Esto dificulta el estudio de la sensibilización a estas sustancias, y por ello, varios autores han intentado clasificarlos en diferentes grupos. Actualmente disponemos de una clasificación para la DAC que divide a los corticoides en 3 grupos y a los pacientes en 2 de forma que podemos abordarlos de manera más práctica. Sin embargo, todavía no se dispone de una clasificación ideal y es frecuente seguir encontrando discordancias en la práctica clínica diaria. Además, esta clasificación tampoco permite organizar las reacciones cruzadas que ocurren en la hipersensibilidad inmediata a corticoides.
A pesar de que en el año 2005 los corticoides fueron nombrados los alérgenos de contacto del año7, la alergia a estas sustancias sigue sin conocerse bien, y supone un reto en la práctica clínica. La forma de presentación y los test diagnósticos son difíciles de interpretar en muchas ocasiones, y presentan unas peculiaridades que merece la pena conocer. Es importante determinar bien el fármaco implicado ante la sospecha de una reacción alérgica a estas sustancias, así como los fármacos que pueden utilizarse como alternativa, ya que los corticoides pueden llegar a ser casi imprescindibles para el control o tratamiento de determinadas enfermedades.
El presente artículo revisa los principales conceptos respecto a estos 2 tipos de reacciones de hipersensibilidad en la alergia a corticoides, así como su abordaje en la práctica clínica.
Tipo de alergiasLos corticoides pueden dar lugar a reacciones de hipersensibilidad tipo i (mediadas por IgE) que ocurren tras escasos minutos de la exposición a estas sustancias, y reacciones de hipersensibilidad tipo iv (mediadas por linfocitos T) que ocurren pasadas horas o días tras la exposición a estos medicamentos. En estas últimas se han estudiado las características de las células T y se ha observado en las biopsias cutáneas un infiltrado inflamatorio de células T CD3+ con un perfil de citocinas predominantemente Th28. En la tabla 1 quedan reflejadas las características principales de estas 2 entidades.
Alergia a corticoides: reacciones de hipersensibilidad inmediata y retardada
| Tipo de reacción | Inmediata | Retardada |
|---|---|---|
| Frecuencia | Excepcional | DAC: frecuentes Reacciones generalizadas: raro |
| Principal vía de sensibilización | Intravenosa | Tópica/piel (también aerotransportada) |
| Factores predisponentes | Asma Pacientes trasplantados | Enfermedades dermatológicas crónicas Automedicación con corticoides |
| Presentación clínica | Minutos tras la exposición a corticoides Urticaria, angioedema, anafilaxia | Horas o días tras la exposición a corticoides No respuesta o empeoramiento de la clínica tras tratamiento con corticoides DAC (efecto «donut») Erupción generalizada |
| Procedimientos diagnósticos | In vivo: Prick test o IDR (lectura temprana) In vitro: IgE específica, test de activación de basófilos | In vivo: Pruebas epicutáneas o IDR (lectura tardía) In vitro: Test de transformación de linfocitos |
| Moléculas implicadas más frecuentes | Metilprednisolona e hidrocortisona | Hidrocortisona, metilprednisolona, budesonida (moléculas sin C-16 metilación o halogenización) |
| Reacciones cruzadas y clasificación | Mecanismo no claro Reacciones cruzadas frecuentes entre metilprednisolona e hidrocortisona | Grupo 1, 2 y 3 Perfil 1: pacientes alérgicos a un grupo de corticoides Perfil 2: pacientes alérgicos a la molécula del corticoide |
| Manejo terapéutico | Evaluación individualizada del perfil de sensibilidad/tolerancia Betametasona y dexametasona tolerada en muchos casos | Perfil 1: Utilización de corticoides de los grupos a los cuales no está sensibilizado Perfil 2: evaluación individualizada del perfil de sensibilidad/tolerancia |
DAC: dermatitis alérgica de contacto; IDR: intradermorreacción.
La frecuencia de DAC a corticoides en la literatura es variable y oscila desde un 0,2% a un 5%9. En España se estima que la prevalencia de sensibilización a los corticoides es del 1,1% en los pacientes estudiados mediante pruebas epicutáneas10. Estas tasas son menores a las descritas en Europa (2,6%)11 y en Estados Unidos (4,6%)12. En las series españolas la budesonida es el principal alérgeno13,14, mientras que en Estados Unidos el más frecuente es el tixocortol15. En Europa la budesonida, el tixocortol y el 17-butirato de hidrocortisona parecen tener tasas de sensibilización similares16.
Las variaciones encontradas en la prevalencia de la DAC a corticoides por reacciones de hipersensibilidad retardada pueden deberse a múltiples factores, como son la frecuencia de uso de corticoides en cada país, los hábitos de prescripción, el conocimiento de la alergia a corticoides y las pruebas utilizadas para el diagnóstico17. En este sentido, en Europa utilizamos concentraciones más bajas de corticoides para las pruebas epicutáneas que en Estados Unidos.
La hipersensibilidad retardada a corticoides afecta con mayor frecuencia a mujeres. Los pacientes más predispuestos a desarrollar una DAC a corticoides son aquellos con enfermedades dermatológicas crónicas (eccemas crónicos, dermatitis atópica, dermatitis de estasis, úlceras crónicas), debido principalmente a la alteración de la barrera cutánea y al ambiente proinflamatorio que presentan. La automedicación con corticoides sin supervisión de un facultativo es otro factor predisponente. Además, algunos autores han postulado que puede existir una predisposición genética18.
EtiopatogeniaVías de sensibilización/fuentes de exposiciónLa vía más común de sensibilización a corticoides es la aplicación cutánea directa, aunque también se ha descrito tras contacto indirecto por un mecanismo aerotransportado, por ejemplo en familiares de pacientes que utilizan aerosoles con budesonida19,20. Otras rutas de sensibilización que se han registrado, aunque menos frecuentes, son a través de la mucosa conjuntival, la mucosa nasal, el tracto respiratorio y el tracto gastrointestinal21–23.
Reacciones cruzadas y clasificaciónEl anillo básico de los esteroides es el ciclopentanoperhidrofenantreno. Su modificación mediante procesos de halogenación y/o esterificación permite mejorar sus propiedades terapéuticas, consiguiendo una mejor penetración en la piel, aumentando su efectividad y su potencia. Sin embargo, por esta similitud química son frecuentes las reacciones cruzadas, las cuales son difíciles de interpretar. Con el fin de encuadrar mejor la sensibilización a estas sustancias varios autores han tratado de clasificarlas en grupos.
Clásicamente los corticoides fueron clasificados en 1989 por Coopman et al.24 en 4 grupos: A, B, C y D en función de su estructura y patrones de reacción cruzada. En el año 2000 Matura et al. dividieron este último en 2 subgrupos: D1 y D225. Posteriormente se observó que con el uso de la clasificación las reacciones cruzadas no siempre eran las predecibles ni las esperadas, por lo que fue modificada. En 2009 Baeck et al. estudiaron los modelos moleculares de los corticoides y las pruebas epicutáneas de 315 pacientes sensibilizados a corticoides9, y en 2011 propusieron una nueva clasificación más simplificada que divide los corticoides en 3 grupos basados en las reacciones cruzadas según su estructura molecular26,27(tabla 2).
Clasificación de corticoides según Baeck et al
| Grupo 1 | Grupo 2 | Grupo 3 |
|---|---|---|
| Moléculas no metiladas ni halogenadas | Moléculas halogenadas con estructura cis-ketal o diol en C16/C17 | Moléculas halogenadas y metiladas en C16 |
| Corresponden a budesonida+grupo A+grupo D2 de la clasificación de Coopman et al.24 | Corresponden al grupo B de la clasificación de Coopman et al.24 | Corresponden a grupo C+grupo D1 de la clasificación de Coopman et al.24 |
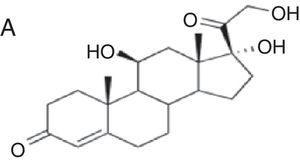
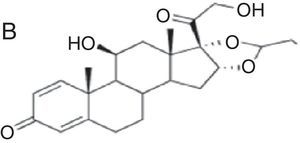
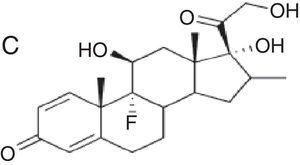
| Budesonida Cloprednol Acetato de cortisona Acetato de diclorisona Dipluprednato Acetato de fludrocortisona Fluorometolona Acetato de fluprednisolona Hidrocortisona Hidrocortisona aceponato Acetato de hidrocortisona 17-butirato de hidrocortisona 21-butirato de hidrocortisona Hidrocortisona hemisuccinato Acetato de isofluprednona Mazipredona Medrisona Acetato de metilprednisolona Aceponato de metilprednisolona Metilprednisolonahemisuccinato Prednicarbato Prednisolona Caproato de prednisolona Pivalato de prednisolona Prednisolona sodio metasulfobenzoato Succinato de prednisolona Prednisona Pivalato de tixocortol | Triamcinolona Amcinonida Desonidaa Flucoronida Flumoxonida Flunisolida Acetonido de fluocinolona Fluocinonida Halcinonidaa Acetónido de triamcinolona Benetónido de triamcinolona Diacetato de triamcinolona Hexacetónido de triamcinolona | Dipropionato de alclometasona Dipropionato de beclometasona Betametasona 17-valerato de betametasona Dipropionato de betametasona Betametasona sodio fosfato Propionato de clobetasol Clobetasona butirato Desoximetasona Dexametasona Acetato de dexametasona Dexametasona sodio fosfato Valerato de diflucortolona Diacetato de diflorasona Pivalato de flumetasona Fluocortinabutilo Fluocortolona Caprilato de fluocortolona Pivalato de fluocortolona Acetato de fluocortolona Acetato de fluprednidene Halometasona Meprednisona Propionato de fluticasona Furoato de mometasona |
Se ha visto que los corticoides del grupo 1 son los que producen reacciones alérgicas con más frecuencia, mientras que los del grupo 3 son los de menor poder sensibilizante y los que menos reacciones cruzadas producen28. Esto parece deberse a que los metabolitos producidos por el proceso de degradación son factores determinantes en estas reacciones cruzadas. Se ha observado in vitro la formación de productos de degradación (corticoide-glioxal) en la cadena lateral C17 que producen alteraciones en C21. Este complejo que puede unirse con la mayoría de aminoácidos se une de manera irreversible con grupos guanidínicos de la arginina de proteínas séricas, convirtiéndose en un antígeno29. De este modo, los corticoides más alergénicos son aquellos cuyos productos de degradación se unen más fácilmente a la arginina30,31, como por ejemplo la budesonida. La halogenación de la molécula parece disminuir esta capacidad de unión a la arginina, lo cual explicaría quizás por qué los corticoides halogenados del tipo betametasona son menos alergénicos.
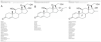
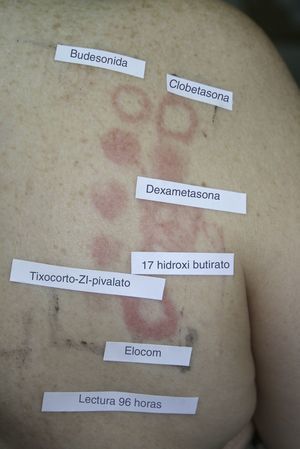
Además de esta nueva clasificación en 3 grupos, los autores proponen dividir a los a pacientes en 2 perfiles según la sensibilización a uno o a varios grupos, de forma que el perfil 1 de pacientes solamente reaccionaría contra un único grupo, y el perfil 2, en el cual los pacientes reaccionan frente a todo el espectro del corticoide, reconociendo el esqueleto de estas sustancias (fig. 1). Estos últimos pacientes son los que parecen tener un riesgo mayor de padecer reacciones cutáneas generalizadas tras la administración de corticoides por vía sistémica.
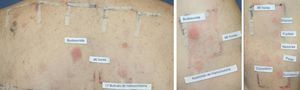
Ejemplo de paciente del perfil 2 reaccionando contra todo el espectro de corticoides. Se trata de un paciente con diagnóstico de psoriasis invertida sensibilizado a los 3 grupos de corticoides. Lectura a las 96h: con la batería estándar modificada se detectó positividad para la budesonida++, y la 17-butirato-hidrocortisona+ (grupo 1). Con la batería de corticoides se detectó positividad a acetónido de triamcinolona+(grupo 2). Con los corticoides propios además se consiguió detectar alergia al grupo 3, siendo positivas las siguientes cremas comerciales: Diproderm®+, Elocom®+, Fucibet®+, Nasonex®+, Peitel®+, Suniderma®+.
La forma más frecuente de presentación de las reacciones de hipersensibilidad retardada a corticoides es en forma de eczema crónico. Muchas veces es difícil reconocerla porque la clínica es larvada y la cronología atípica, por lo que la información proporcionada por el paciente es fundamental. Debemos sospechar la posibilidad de una DAC a corticoides cuando la localización del eczema coincide con el lugar de aplicación de los mismos, o ante dermatosis crónicas que no mejoren tras la aplicación de estas sustancias32. Otros datos a tener en cuenta son la presencia de una reacción más intensa en los bordes de la lesión que en el centro del área tratada debido al efecto antiinflamatorio, o la presencia de signos secundarios al uso prolongado de corticoides como atrofia, rosácea o dermatitis perioral por el retraso en el diagnóstico de esta entidad. Sin embargo, su presentación como eczema de manos es menos frecuente que en el resto de población estudiada con pruebas epicutáneas9.También debemos tenerla presente en profesiones como trabajadores del medio hospitalario y empleados de la industria farmacéutica, aunque existen pocos casos ocupacionales recogidos en la literatura33 (tabla 3).
Criterios de sospecha de dermatitis alérgica de contacto a corticoides
| Dermatitis eccematosa crónica persistente |
| Erupción más intensa en los bordes de la lesión |
| Falta de mejoría clínica a pesar de tratamiento adecuado con corticoides |
| Empeoramiento de la dermatosis tras tratamiento con corticoides |
| Exposición ocupacional a corticoides (trabajadores del medio hospitalario y empleados de la industria farmacéutica) |
En pacientes sensibilizados el uso de colirios con corticoides puede dar lugar a edema y/o eczema periocular, conjuntivitis, sensación de picor, escozor y/o lagrimeo21. El uso de corticoides inhalados puede producir erupciones eczematosas periorificiales (peribucal, perinasal…), con posible extensión a mucosas provocando cuadros de congestión nasal, rinitis, estomatitis e incluso broncoespasmo22,34.
Además se ha descrito en pacientes sensibilizados por vía tópica la aparición de erupciones generalizadas tras la administración de corticoides vía oral, inhalada, parenteral, o transmucosa35–38. Estas reacciones retardadas sistémicas se pueden presentar en forma de erupciones maculopapulares o eccematosas, o incluso con ampollas y púrpura. Otras erupciones documentadas en pacientes con alergia a varios corticoides han sido tras la administración de hormonas esteroideas39–41.
Otras formas de presentación descritas de forma aislada son: el angioedema/urticaria de aparición retardada42, el eritema fijo medicamentoso43, el eritema multiforme44,45 y la pustulosis exantemática aguda generalizada46.
DiagnósticoPara el diagnóstico de estas reacciones los métodos más empleados son los test in vivo, como las pruebas epicutáneas o la lectura tardía de la intradermorreacción (IDR). Las pruebas epicutáneas son de elección, mientras que la lectura tardía de IDR no se realiza de rutina por el riesgo de atrofia cutánea que conlleva47. El test in vitro para la hipersensibilidad retardada a corticoides incluye el test de transformación de linfocitos, que está más restringido a centros específicos48–51.
A la hora de realizar la lectura e interpretación de las pruebas epicutáneas con corticoides debemos conocer una serie de particularidades. En la lectura temprana los corticoides pueden producir una reacción tipo «donut o efecto borde», que consiste en la aparición de reacción solo en los bordes del parche y no en la zona media del mismo, probablemente por el efecto antiinflamatorio en la zona central, donde la concentración es mayor (fig. 2). Otra reacción que se ha descrito es el blanqueamiento de la piel en la zona de aplicación del parche a las 48h debido a un efecto de vasoconstricción. Por otra parte, debemos dar importancia a los eritemas tardíos, dado que los corticoides pueden suprimir o retrasar una respuesta positiva por el efecto antiinflamatorio e inmunomodulador52. En función de esto, la normativa actual del International Contact Dermatitis Research Group (ICDRG), incluye realizar una tercera lectura transcurridos 7 días desde la colocación de los parches, para evitar posibles falsos negativos.
Ejemplo de reacción tipo «donut o efecto borde» en una lectura con parches de corticoides a las 96h. Esta reacción consiste en la aparición de reacción en los bordes del parche y no en la zona media del mismo, probablemente debido a un predominio del efecto antiinflamatorio en la zona media del parche, donde la concentración es mayor.
Para el estudio con pruebas epicutáneas, contamos con marcadores como la budesonida, el tixocortol-pivalato y el 17-butirato-hidrocortisona, los 2 primeros incluidos en series estándar europea y española47, y la tercera incluida en el TRUE test o la batería estándar del Grupo Americano de Dermatitis de Contacto.
En nuestro país la batería estándar del Grupo Español para la Investigación de la Dermatitis de Contacto y Alergia Cutánea (GEIDAC) aplica la budesonida a la concentración de 0,01% en vaselina y el tixocortol-21-pivalato al 0,1% en vaselina. Aunque la vaselina es un buen vehículo para el estudio de los corticoides, algunos autores han postulado que el mejor método para detectar la hipersensibilidad retardada a corticoides es mediante la utilización de los principios activos diluidos en etanol53. Estos 2 marcadores identifican a la mayoría de los pacientes, sin embargo al pertenecer ambos al grupo 1 de la clasificación, los pacientes alérgicos a los grupos 2 y/o 3 pueden pasar desapercibidos. Por ello es importante estudiar a los pacientes con baterías específicas y productos propios. También podría resultar de utilidad añadir algún corticoide de los grupos 2 y/o 3 a la batería estándar, al menos temporalmente, para conocer mejor la prevalencia de sensibilidad a estos grupos.
En aquellos pacientes que presenten una positividad para algún marcador de la alergia a corticoides de la batería estándar, y en aquellos que tengamos una alta sospecha clínica de alergia a corticoides pero no hayamos obtenido positividad a los marcadores de alergia a corticoides, deberíamos ampliar el estudio con la aplicación de una serie específica de corticoides y con los productos propios del paciente54. Un ejemplo de batería específica de corticoides sería la suministrada por Chemotechnique Diagnostics AB (Malmo, Suecia), que incluye además de los corticoides de nuestra batería estándar: el acetónido de triamcinolona (1,0% vaselina), la dexametasona-21-fosfato (1,0% vaselina), el clobetasol-17-propionato (1,0% vaselina), la betametasona-17-valerato (1,0% vaselina) y la alclometasona-17-21-dipropionato (1,0% vaselina).
En nuestra experiencia, en muchas ocasiones encontramos pacientes con positividad a algún marcador que no presenta positividad al testarlo con corticoides del mismo grupo o con productos propios que contienen corticoides del mismo grupo. Si obtenemos alguna positividad a algún producto propio del paciente debemos descartar que no se trate de una alergia a alguno de los excipientes del mismo, pues muchas veces se manifiesta de la misma forma que la DAC a corticoides. Ejemplos de excipientes alergénicos empleados en las fórmulas de corticoides son el clorocresol55, el alcohol bencílico, la hidrocloruroetilendiamina, el palmitato de isopropilo, los parabenos, el polisorbato 60, el propilenglicol, el alcohol estearílico, el dioctilsulfosuccinato de sodio, el metabisulfito de sodio y el 1,2,-hexanetriol17,56–59.
La existencia de cosensibilización o sensibilización a múltiples alérgenos en los pacientes alérgicos a corticoides es bien conocida60. En la serie de 315 pacientes de Baeck et al. se encontraron reacciones positivas a otros alérgenos hasta en un 84% de los casos, y los más frecuentes fueron los metales y las fragancias9. Otros alérgenos que clásicamente han sido implicados en la cosensibilización con los corticoides son el sulfato de neomicina y el dihidrocloruro de etilendiamina (fig. 3), y han sido atribuidos a la presencia de estos en una misma crema farmacéutica.
Manejo terapéuticoEl manejo terapéutico de los pacientes alérgicos a corticoides continúa siendo complicado. La clasificación reciente de Baeck et al.26,27ha permitido reclasificar los corticoides según su estructura química, y a los pacientes según su perfil de alergia a un solo grupo o a varios. Sin embargo, no es ideal, ya que en algunos pacientes durante el seguimiento no se observan reacciones tras la utilización de corticoides tópicos del grupo al cual están sensibilizados. Tampoco parece ser útil para recomendar la utilización de corticoides inhalados o por vía sistémica, ya que no se conoce bien el patrón de reacción cruzada tras la administración por estas vías.
Aunque todavía existen dudas a la hora de recomendar la utilización de unos u otros, resulta prudente recomendar a los pacientes del perfil 1 que eviten todos los corticoides tópicos del grupo al cual están sensibilizados según la clasificación actual, la cual es orientativa. Para aconsejar la utilización de uno u otro será conveniente parchearlo o hacer una prueba de uso con el producto previamente, y comprobar así que el paciente no está sensibilizado. La opción que se puede plantear a aquellos pacientes del perfil 2 es recomendar la utilización de otras medidas, como los inhibidores de la calcineurina, reservando solo los corticoides para situaciones de urgencia cuando no hay otra alternativa terapéutica.
Reacciones de hipersensibilidad inmediataEpidemiologíaLas reacciones de hipersensibilidad inmediata a corticoides son relativamente raras, pero es importante conocerlas, ya que suponen un mayor riesgo y un problema terapéutico para todas las especialidades médicas. Se estima que la prevalencia es del 0,1-0,3%61,62.
EtiopatogeniaVías de sensibilización/fuentes de exposiciónLa vía más común de sensibilización a corticoides en estas reacciones de hipersensibilidad inmediata es la intravenosa, aunque también se han descrito otras rutas de sensibilización como la oral, la intramuscular, la intraarticular y la subcutánea. Parece que se ha encontrado una mayor incidencia de estas vías en sujetos asmáticos63 y en pacientes tratados habitualmente con corticoides, como por ejemplo trasplantados. Sin embargo, en estos casos es difícil de determinar si este incremento de incidencia es debido a una mayor susceptibilidad o a la gran exposición a corticoides.
Reacciones cruzadas y clasificaciónLas moléculas más implicadas en este tipo de reacciones son la hidrocortisona y la metilprednisolona. Aunque sí que se han visto reacciones cruzadas entre ellas, no disponemos de suficientes datos para demostrar patrones de reacción cruzada y clasificaciones, como ocurre con las reacciones de hipersensibilidad retardada. De hecho, se han registrado casos de alergia a hidrocortisona/metilprednisolona que posteriormente han tolerado por vía sistémica otros corticoides del grupo 1, como la prednisona, además de corticoides de otros grupos como la betametasona y dexametasona63–65.
Por otra parte, algunos autores han registrado casos de hipersensibilidad debidos no a los corticoides en sí, sino a los succinatos que se añaden a estos fármacos para hacerlos más solubles en las administraciones intravenosas66–68.
ClínicaSe han descrito diferentes cuadros clínicos de hipersensibilidad inmediata secundarios a la administración de corticoides, como son el angioedema, la urticaria69-71 o la anafilaxia61. Aunque es poco frecuente, también existe la posibilidad de urticaria de contacto por estas sustancias.
DiagnósticoPara el diagnóstico de estas reacciones pueden realizarse pruebas in vivo, que incluyen principalmente el prick test y la lectura tempana de intradermorreacción (IDR), así como los test de provocación en caso de que las pruebas hayan sido negativas, siempre valorando el riesgo/beneficio que se puede obtener. Las pruebas in vitro incluyen la IgE específica69,70 y el test de activación de basófilos72.
A la hora de interpretar las pruebas es importante descartar que la reacción alérgica sea debida a los conservantes o aditivos de los medicamentos, como por ejemplo la carboximetilcelulosa o el macrogol73,74.
Manejo terapéuticoEl uso de corticoides sistémicos generalmente es una herramienta necesaria en el tratamiento de múltiples enfermedades. La demostración de que en la alergia inmediata a un determinado corticoide no necesariamente implique reacción a otros, hace que esté indicado realizar un estudio por alergología, con el fin de confirmar la sensibilización/tolerancia del paciente. Es importante, como en cualquier estudio de fármacos, la realización de una historia clínica detallada con el fin de conocer la causa por la cual el corticoide ha sido indicado, el tipo y cinética de la reacción, así como los posibles factores concomitantes, teniendo también en cuenta los excipientes que contiene el preparado. La mayoría de autores utilizan las pruebas cutáneas y las pruebas de exposición controlada con el fin de demostrar la implicación del fármaco. Además se deben efectuar pruebas de exposición controlada con otros corticoides que no contengan succinatos y de grupo distinto al que se ha producido la reacción, con el objetivo de poder ofrecer al paciente un tratamiento alternativo. En casos de urgencia se recomienda usar la betametasona y el deflazacort en pacientes con alergia a otros corticoides63.
ConclusionesLa alergia a corticoides es una entidad que cada vez se da con más frecuencia, sobre todo en forma de DAC. La prevalencia de esta entidad oscila desde un 0,2% a un 5%, y el alérgeno más frecuente varía según el país. En España el alérgeno más frecuente es la budesonida seguido del tixocortol, con tasas de prevalencia del 0,95% y del 0,63% respectivamente75.
Actualmente esta reacción sigue suponiendo una importante restricción para el paciente y un reto terapéutico para el dermatólogo en la práctica clínica. La forma de presentación de la alergia a corticoides y los test diagnósticos son difíciles de interpretar en muchas ocasiones, por ello es importante conocer bien esta entidad.
La reciente clasificación de Baeck et al.26,27ha permitido reclasificar los corticoides según su estructura química, y a los pacientes según su alergia a corticoides de un solo grupo o de varios, mejorando el tratamiento y las recomendaciones sobre los corticoides que va a poder utilizar.
Los marcadores de los que disponemos en la batería estándar española para detectar la alergia a corticoides pertenecen al grupo 1, y por tanto podríamos no identificar a pacientes alérgicos a los grupos 2 y/o 3. El estudio mediante la serie específica de corticoides y las cremas comerciales propias del paciente pueden ser de gran utilidad para conocer el perfil de sensibilidad de cada paciente.
No obstante, en ocasiones sigue existiendo discordancia entre los resultados encontrados en las pruebas epicutáneas y la tolerancia de estos pacientes a los distintos preparados comerciales. Para poder ofrecer un tratamiento alternativo es aconsejable realizar pruebas de exposición con otros corticoides de un grupo distinto al que está sensibilizado, o aconsejar la utilización de otras medidas como los inhibidores de la calcineurina.
Las reacciones de hipersensibilidad inmediata, aunque son más raras, pueden ser potencialmente graves. Se trata de un problema para todas las especialidades médicas, ya que son unos fármacos muchas veces casi imprescindibles, y por ello está indicado realizar un estudio alergológico con el fin de confirmar la sensibilización. Es muy importante, como en cualquier estudio de fármacos, la realización de una historia clínica detallada con el fin de conocer la causa por la que el corticoide ha sido indicado, y tener en cuenta no solo el principio activo, sino también los excipientes que contiene el preparado. Una vez que se conoce el responsable del cuadro, se debe orientar al paciente hacia el uso de corticoides alternativos. En casos de urgencia se recomienda usar la betametasona y el deflazacort.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.