El hígado graso no alcohólico es la principal causa de enfermedad hepática en nuestro medio. Los pacientes con psoriasis presentan mayor prevalencia y gravedad y peor pronóstico de esta hepatopatía. El vínculo patogénico entre ambas es el estado de inflamación crónica y la resistencia periférica a la insulina, habitual en las comorbilidades asociadas a la psoriasis. Por este motivo, en la evaluación de los pacientes con psoriasis, en particular si existen componentes del síndrome metabólico y se requiere tratamiento sistémico, se recomienda descartar esta posibilidad. La coexistencia de psoriasis e hígado graso no alcohólico, con probable sinergia entre ambos, condiciona las medidas generales que deben recomendarse en estos pacientes y también la estrategia terapéutica, por la potencial hepatotoxicidad de algunos de ellos. En este sentido, algunos de los fármacos convencionales habituales como acitretino, metotrexato o ciclosporina presentan potenciales efectos hepatotóxicos cuya repercusión en cada paciente debe evaluarse de forma individualizada. Los fármacos anti-TNF podrían tener efectos beneficiosos fundamentados en el buen control del proceso inflamatorio y de una mejoría de la resistencia periférica a la insulina. Sin embargo, se han descrito casos de hepatotoxicidad en algunos pacientes. No existe evidencia de efectos beneficiosos o perjudiciales de los fármacos anti p40 o anti IL-17.
Nonalcoholic fatty liver disease (NAFLD) is the most prevalent liver condition in the West. The prevalence and severity of NAFLD is higher and the prognosis worse in patients with psoriasis. The pathogenic link between psoriasis and NAFLD is chronic inflammation and peripheral insulin resistance, a common finding in diseases associated with psoriasis. NAFLD should therefore be ruled out during the initial evaluation of patients with psoriasis, in particular if they show signs of metabolic syndrome and require systemic treatment. Concomitant psoriasis and NAFLD and the likelihood of synergy between them place limitations on general recommendations and treatment for these patients given the potential for liver toxicity. As hepatotoxic risk is associated with some of the conventional drugs used in this setting (e.g., acitretin, methotrexate, and ciclosporin), patients prescribed these treatments should be monitored as appropriate. Anti-tumor necrosis factor agents hold the promise of potential benefits based on their effects on the inflammatory process and improving peripheral insulin resistance. However, cases of liver toxicity have also been reported in relation to these biologics. No evidence has emerged to suggest that anti-p40 or anti-interleukin 17 agents provide benefits or have adverse effects.
El hígado graso no alcohólico (HGNA) es la enfermedad por depósito de grasa en el hígado en ausencia de un consumo significativo de alcohol, uso de medicación esteatogénica (esteroides, metotrexato, tamoxifeno, amiodarona) o determinadas enfermedades hereditarias (enfermedad de Wilson, abetalipoproteinemia, enfermedad de Wolman, enfermedad por depósito de ésteres de colesterol)1. Excluidas estas causas, prácticamente todos los pacientes tienen un nexo epidemiológico común asociado a factores de riesgo metabólico, como obesidad, diabetes mellitus tipo 2, hipertensión arterial o dislipidemia. El mecanismo fisiopatológico compartido entre hígado graso y síndrome metabólico es la resistencia insulínica2.
Histológicamente se distinguen 2 formas: la esteatosis, en la que existe un depósito de grasa sin daño hepatocitario y la esteatohepatitis, en la que, además, existe daño hepatocitario con inflamación y, eventualmente, fibrosis. En general, la mortalidad de los pacientes con hígado graso está aumentada respecto a población control ajustada sin hígado graso, de forma independiente a la variante histológica (esteatosis o esteatohepatitis), siendo la primera causa de muerte la cardiovascular3. Por su carácter inflamatorio, la esteatohepatitis tiene un potencial evolutivo hepático, de manera que un 15-25% de los pacientes habrá evolucionado a cirrosis en un plazo de 10 años. Una vez desarrollada la cirrosis, las complicaciones derivadas de ella (insuficiencia hepática, varices esofágicas, hepatocarcinoma) llevarán al 25% de los pacientes a la muerte en un plazo de 5 años4. Por qué en unos pacientes el depósito de grasa provoca inflamación y fibrosis y en otros no es desconocido, aunque probablemente intervienen factores genéticos y medioambientales5.
La trascendencia de la enfermedad reside en que, actualmente, es la primera causa de hepatopatía en Occidente. Aproximadamente un 20% de la población adulta general padece hígado graso no alcohólico y, de ellos, ≈20% presenta la forma agresiva o esteatohepatitis6. En personas con síndrome metabólico la prevalencia de HGNA es mucho más elevada, de forma que la padece el 38% de las personas con sobrepeso (índice de masa corporal [IMC] 25-30), el 46% de los obesos (IMC 30-40), el 65% de los pacientes con obesidad grave (IMC 40-45) y hasta un 90% de los pacientes con obesidad mórbida (IMC>45, de ellos, un 5% con cirrosis). En diabéticos la prevalencia de HGNA es del 69%, y de un 50% en los pacientes con hipertrigliceridemia7. Como manifestación de esta gravedad, la esteatohepatitis no alcohólica es, actualmente, la segunda causa de trasplante hepático en Estados Unidos y se espera que pase a ser la primera en los próximos años8.
Pese a estas cifras la enfermedad está claramente infradiagnosticada debido a que, salvo en las formas ya muy avanzadas, carece de síntomas o signos que permitan sospecharla, y también porque, desde el punto de vista analítico, se caracteriza por una alteración leve e inespecífica de la bioquímica hepática, que incluso puede mantenerse dentro de los límites de la normalidad en un 15-39% de los pacientes9,10.
El diagnóstico de enfermedad por hígado graso se basa en la demostración de la existencia de esteatosis en la biopsia hepática o en pruebas de imagen y en la exclusión de otras causas generales de enfermedad hepática, consumo de alcohol o de desencadenantes específicos de esteatosis1. Teniendo en cuenta que el listado de motivos de enfermedad hepática está bien establecido11, y que las causas alternativas de esteatosis son muy infrecuentes y, en principio, relativamente fáciles de identificar, la acción diagnóstica fundamental es la demostración de esteatosis. La biopsia hepática es la prueba de elección, pero se trata de una exploración invasiva, asociada a morbimortalidad, y no exenta de costes12. Además, es evidente que no es posible ni razonable biopsiar al 20% de la población. Por ello, existe un creciente interés en conseguir un diagnóstico no invasivo de la enfermedad. El diagnóstico más habitual de hígado graso es mediante técnicas de imagen como ecografía, TAC y RMN, que logran alta sensibilidad y especificidad (de entre el 60-94%, respectivamente13,14). Por su inocuidad y accesibilidad, la ecografía es la prueba de elección habitual1. No obstante, ni la bioquímica hepática ni las pruebas de imagen permiten distinguir adecuadamente entre esteatosis y esteatohepatitis, ni establecer o descartar la existencia de fibrosis hepática. Por ello, se han desarrollado diversos índices serológicos, siendo el más aceptado el Nonalcoholic Fatty Liver Disease Fibrosis Score. En este índice15, a través del cálculo mediante una fórmula (http://nafldscore.com) basada en variables fácilmente accesibles (índice de masa corporal, edad, plaquetas, albúmina, GOT y GPT [tabla 1]) se obtiene elevada sensibilidad y especificidad en el objetivo de excluir (90% y 60%, respectivamente) o detectar (67% y 97%, respectivamente) la existencia de fibrosis avanzada, según determinados puntos de corte en la puntuación obtenida, con un AUROC de 0,85. La gravedad del daño hepático a través de elastometría podría potencialmente también valorarse de forma indirecta mediante medición de la rigidez hepática. Su utilidad en el hígado graso sería, principalmente, la de identificar pacientes con bajo riesgo de fibrosis avanzada o cirrosis debido a su menor precisión en los estadios de daño más avanzados16.
Cálculo de la puntuación del hígado graso no alcohólico (non-alcoholic fatty liver disease fibrosis score)15
| HGNA fibrosis score=–1,675+0,037×edad (años)+0,094×IMC (kg/m2)+1,13×intolerancia glucosa/diabetes (sí=1, no=0)+0,99×AST/ALT ratio – 0,013×plaquetas (×109/l) – 0,66×albúmina (g/dl) |
| Cálculo en: http://nafldscore.com |
| <–1,455: predictor de bajo riesgo de fibrosis avanzada |
| >0,676: predictor de fibrosis avanzada |
| Indeterminado entre –1.455 y 0,676 |
ALT: alanino aminotransferasa; AST: aspartartato aminotransferasa; IMC: índice de masa corporal; NAFLD fibrosis score: puntuación de fibrosis del hígado graso no alcohólico.
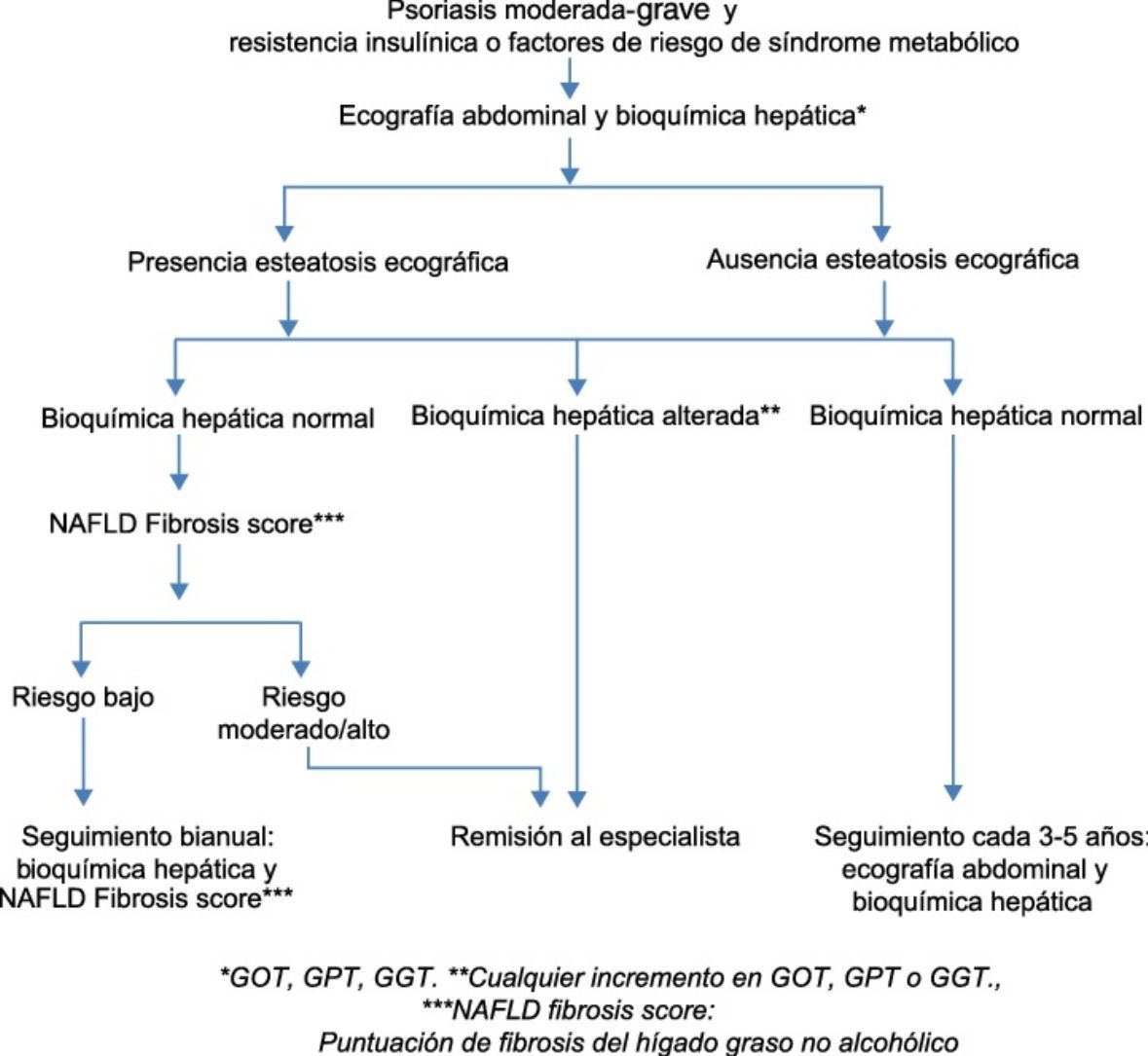
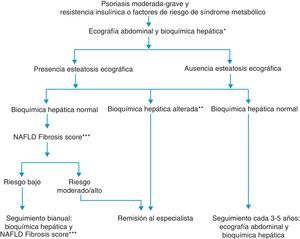
Recientemente, la Asociación Europea para el Estudio del Hígado, conjuntamente con la Asociación Europea para el Estudio de la Diabetes y la Asociación Europea para el Estudio de la Obesidad, ha propuesto una nueva guía clínica para el manejo de los pacientes con HGNA17. En ella recomiendan el despistaje de hígado graso mediante ecografía abdominal y bioquímica hepática a todos los pacientes con resistencia insulínica o factores de riesgo de síndrome metabólico. Se considera valorable cualquier alteración en el perfil de las transaminasas, GOT, GPT y/o GGT, independientemente de su cuantía. Dicho despistaje se aplicaría de acuerdo al algoritmo desarrollado en la figura 117.
Hígado graso no alcohólico (HGNA) en pacientes con psoriasis17.
*GOT, GPT, GGT.
**Cualquier incremento en GOT, GPT o GGT.
***NAFLD fibrosis score: puntuación de fibrosis del hígado graso no alcohólico.
En el momento actual no existe un tratamiento específico del hígado graso. La pérdida de peso superior a un 7-10% y el ejercicio permiten una mejoría histológica18, pero son difíciles de lograr y, sobre todo, de mantener en el largo plazo. Debe evitarse el consumo de alcohol, de grasas saturadas y de bebidas edulcoradas con fructosa19. Por el contrario, el consumo de café puede ser recomendable20. Se han intentado múltiples fármacos (metformina, pioglitazona, ácido eicosapentanoico, estatinas, vitamina E), pero ninguno de ellos presenta unas evidencias que permitan recomendar su empleo de manera firme1,6,21–24.
Hígado graso no alcohólico y psoriasisHace aproximadamente una década se empezaron a publicar los primeros estudios observacionales en los que se documentaba la relación entre hígado graso y psoriasis25,26, la cual fue confirmada en otros posteriores (tabla 2)27,28. Gisondi et al. encontraron una frecuencia de HGNA —diagnosticada por ecografía—mayor en los pacientes con psoriasis que en los controles (47% vs 28%) en una serie de 130 pacientes consecutivos con psoriasis y 260 controles sanos ajustados por edad, sexo e IMC. Además de mayor probabilidad de padecer síndrome metabólico y concentraciones de PCR y mayor gravedad, los pacientes con psoriasis e HGNA tuvieron mayor IL-6 y menores niveles de adiponectina con respecto a aquellos con psoriasis sin HGNA. Abedini et al. describieron HGNA en el 65,6% de pacientes psoriásicos vs. 35% de controles sanos28. Van der Voort et al. encontraron HGNA en el 46,2% de pacientes con psoriasis frente al 33,3% en los controles en una serie de 2.292 individuos mayores de 55 años en un estudio poblacional que formaba parte del estudio Rotterdam27. Estos datos podrían tener que ver con la relación entre psoriasis y síndrome metabólico, ya que estos últimos son factores patogénicos del HGNA29. Miele et al., en una cohorte en la que los autores comparaban pacientes con psoriasis y con o sin HGNA, encontraron además relación entre esta última variable y la artropatía psoriásica26. La relación entre las formas más graves de psoriasis y HGNA también ha sido reportada por otros autores30. Roberts et al. encontraron además esteatohepatitis en el 22% de los pacientes con psoriasis y HGNA que fueron biopsiados. En comparación con los pacientes con NHGA sin esteatohepatitis, aquellos fueron con mayor frecuencia obesos, con mayores niveles de insulina y también mayores niveles de transaminasas30. Estos mismos autores describieron diferencias notables en el riesgo de HGNA en función del origen étnico. De este modo, los pacientes de origen hispánico fueron los que tuvieron mayor probabilidad de ser diagnosticados de HGNA (83%) seguido de los caucásicos (39%) y afroamericanos (33%)27.
Principales resultados de los estudios sobre prevalencia y características epidemiológicas del HGNA y psoriasis
| Autores | Población | N (ps) | N (sin Ps) | Resultados | Población |
|---|---|---|---|---|---|
| Roberts et al.30 | Pacientes con psoriasis o PsA | 103 | – | Prevalencia de HGNA del 47%. Esteatohepatitis en el 22% de aquellos con HGNA | Caucásicos/hispánicos Afroamericanos/asiáticos |
| Gisondi et al.25 | Pacientes de dermatología de un hospital Controles: personal del hospital | 130 | 260 | Frecuencia de HGNA mayor en pacientes psoriásicos que en controles (47% vs. 28%; p<0,0001). Los pacientes con psoriasis y HGNA (n=61) tuvieron con mayor frecuencia síndrome metabólico y PCR y mayor gravedad de la psoriasis (PASI) (14,2±12.6 vs. 9,6±7,4; p<0,01) que aquellos con psoriasis sin HGNA (n=69) | No descrito Caucásicos (¿) |
| Miele et al.26 | Pacientes con psoriasis comparados con pacientes con HGNA sin psoriasis | 142 | 125 | 59,2% fueron diagnosticados de HGNA. Los pacientes con psoriasis e HGNA tuvieron con mayor frecuencia más síndrome metabólico, obesidad, dislipidemia, ratio AST/ALT incrementado y artritis psoriásica. Los pacientes con psoriasis tuvieron HGNA más grave que aquellos sin psoriasis | No descrito Caucásicos (¿) |
| Abedini et al.28 | HGNA en psoriasis vs controles sanos | 123 | 123 | Prevalencia de HGNA mayor en psoriasis (65,6% vs. 35%, p<0,01, OR=3,53) Grado medio de HGNA mayor en psoriasis (grado 2 vs. grade 1, p<0,01). Mayor frecuencia de hipertensión (16,5%), alteraciones en la función hepática (16,4%) y síndrome metabólico (46,6%) | No descrito Caucásicos (¿?) |
| Van der Voort et al.27 | Prevalencia de HGNA en pacientes con psoriasis vs sin psoriasis>55 años | 118 | 2.174 | Prevalencia de HGNA del 46,2% vs 33% en pacientes sin psoriasis, independiente de consumo de alcohol, ALT, o síndrome metabólico la psoriasis siguió siendo un factor predictivo | Caucásicos 95% |
ALT: alanino aminotransferasa; AST: aspartartato aminotransferasa; HGNA: hígado graso no alcohólico; PCR: proteina C reactiva; PsA: artritis psoriásica.
El dermatólogo debe tener un alto índice de sospecha del HGNA, porque en la mayor parte de los casos va a cursar de forma asintomática. En primer lugar deberá conocer su elevada prevalencia en los pacientes con psoriasis. Por otro lado, deberá identificar sus factores de riesgo, relacionados con los componentes del síndrome metabólico: DM, obesidad, dislipidemia y HTA. Las alteraciones bioquímicas pueden ser poco evidentes, en forma de elevación, normalmente discreta —por debajo de 2-3 veces los valores normales— y con un cociente ALT/AST>1, y ocasionalmente con elevación leve de la fosfatasa alcalina (FA) y de la gammaglutamil transpeptidasa (GGT)31. Hay que tener en cuenta que en aproximadamente un 15-30% o más de los pacientes con HGNA la bioquímica hepática va a ser normal10, aun cuando hasta el 35% de estos últimos presentará fibrosis hepática avanzada o cirrosis. De este modo, en presencia de componentes del síndrome metabólico, factor de riesgo más prevalente del HGNA, estaría indicada también una prueba de imagen complementaria —ecografía— para descartar esta posibilidad, incluso en el caso de normalidad de la bioquímica hepática17. Tal y como se comentaba previamente, la aplicación del algoritmo recomendado por sociedades especializadas se refleja en la figura 1. En pacientes psoriásicos sin elementos del síndrome metabólico no está determinada la conveniencia de realizar estudios de imagen en ausencia de alteraciones en la bioquímica hepática en el momento actual.
Una vez confirmada la existencia de HGNA, el dermatólogo colaborará con las medidas generales recomendadas en cuanto a los hábitos alimentarios y generales y al ajuste de las dosis de fármacos en el caso de incremento de las transaminasas.
La ausencia de daño hepático en una primera valoración no excluye su aparición a lo largo de los años. Por ello, estos pacientes requerirían nueva valoración si presentan signos bioquímicos de daño hepático o desarrollan síndrome metabólico17.
Patogénesis del hígado graso no alcohólico en psoriasisAunque no es el objetivo de este trabajo profundizar sobre la patogénesis del HGNA, sí que vale la pena conocer que en su origen y desarrollo se ha propuesto la llamada multiple-hit hypotesis32. En un primer paso se produciría un cúmulo anómalo de triglicéridos en los hepatocitos, fenómeno en el que desempeña un papel de gran relevancia la resistencia insulínica. En una segunda fase este hígado esteatósico aparece susceptible a la lesión inducida por diversas adipocinas y al estrés oxidativo en el retículo endoplásmico, la disfunción mitocondrial y la apoptosis hepática, que favorecería la transición desde la esteatosis simple a la esteatohepatitis. En esta evolución, además de la resistencia insulínica —que está implicada en los 2 pasos del HGNA, así como en la inducción y activación de citocinas profibróticas— pueden contribuir citocinas proinflamatorias procedentes de procesos inflamatorios crónicos, como la psoriasis33. En este contexto, la relación patogénica entre el hígado graso y la psoriasis es compleja y probablemente multifactorial, aunque presumiblemente relacionada con la existencia de un estado subyacente de inflamación crónica persistente.
Es probable que la relación entre HGNA y psoriasis se fundamente en parte en que algunas comorbilidades frecuentes en la psoriasis sean también causa de HGNA. De entre ellas debe destacarse la obesidad. Existe una indudable relación epidemiológica entre la obesidad y la psoriasis, en particular en las formas graves, probablemente bidireccional, de forma que la obesidad favorece la psoriasis y su gravedad y viceversa34. También la prevalencia de HGNA es claramente superior en pacientes obesos, en particular en el caso de la obesidad central, con un exceso de tejido adiposo visceral, más activo desde un punto de vista metabólico que el subcutáneo35. La obesidad se relaciona con un riesgo de desarrollo de resistencia insulínica que, como se indicaba anteriormente, representa un factor patogénico fundamental en el HGNA36. El exceso de depósito graso condiciona un disbalance entre las citocinas pro y antiinflamatorias que favorecería la progresión de la hepatopatía. El incremento de adipocitocinas procedentes de los adipocitos pueden condicionar una acción proinflamatoria —TNF-alfa, IL-6, leptina, visfatin, resistina— tanto en la piel psoriásica —condicionando la proliferación queratocitaria, la angiogénesis, la respuesta Th1 o la expresión de moléculas de adhesión— como en el HGNA, contribuyendo a la resistencia a la insulina o a la fibrogénesis hepática. Por el contrario, disminuye la presencia de adipocitocinas protectoras frente a la inflamación, tales como la adiponectina, que promueve citocinas antiinflamatorias en la piel y favorece la sensibilidad a la insulina37.
Resulta muy interesante la implicación de la IL-17 tanto en la psoriasis como en el HGNA. Los linfocitos T del tejido adiposo sintetizan IL-17, con capacidad para regular la adipogénesis y el metabolismo de la glucosa. En el HGNA, tanto las células Th17 como la IL-17 podrían favorecer la evolución desde la esteatosis simple hacia la esteatohepatitis38.
Implicaciones terapéuticas con la terapia sistémica convencionalLa elevada prevalencia de HGNA en pacientes con psoriasis condiciona las perspectivas terapéuticas en una dermatosis que deberá ser tratada durante décadas.
En el ámbito de las enfermedades inflamatorias crónicas, es conocido que la incidencia de toxicidad hepática por metotrexato es superior en la psoriasis39 a la observada en otros procesos crónicos. A modo de ejemplo, en un reciente estudio retrospectivo, el 58% de 710 pacientes con psoriasis tratada con metotrexato presentaban elevación de las transaminasas40, circunstancia que, a la luz de los nuevos conocimientos, podría tener que ver en la relación conocida en la actualidad entre HGNA y psoriasis. Teniendo en cuenta la elevada prevalencia de hígado graso y de esteatohepatitis en los pacientes con psoriasis, debería valorarse descartar la existencia de esteatosis significativa de forma previa a iniciar el tratamiento, al menos en aquellos pacientes con elementos del síndrome metabólico. En este sentido, además de la ecografía, se ha propuesto la utilidad de fibrotest® o de la elastografía hepática (fibroScan®) para identificar el riesgo de fibrosis hepática subyacente41.
La toxicidad hepática de MTX presenta hallazgos histológicos —y por lo tanto, quizás mecanismos patogénicos— distintos a los asociados al HGNA. Sin embargo, los factores de riesgo que favorecen y agravan la hepatoxicidad por MTX y el HGNA,tales como la obesidad, la diabetes o la hiperlipidemia son comunes y frecuentes en pacientes con psoriasis grave42.
La hepatotoxicidad se encuentra entre los efectos secundarios potenciales de ciclosporina A, tanto de forma directa como a través de un deterioro del perfil lipídico43. Acitretina también puede incrementar los triglicéridos y se ha asociado a un incremento de las transaminasas en uno de cada 4 pacientes, aunque no se han detectado daños histológicos después de su uso intermitente de forma prolongada44.
Biológicos en pacientes con psoriasis e hígado grasoAl igual que en otras enfermedades inflamatorias crónicas, TNF-alfa desempeña un papel central en el proceso inflamatorio del HGNA45. De hecho, se estudia su uso como herramienta diagnóstica y pronóstica en el hígado graso46. Teniendo como punto de partida este papel patogénico, incluso se ha evaluado el uso de medicamentos antiTNF-alfa, tales como infliximab o adalimumab en el HGNA47,48, considerando que el empleo de fármacos anti-TNF ha permitido mejorar los parámetros bioquímicos hepáticos y metabólicos en series de pacientes tratados en diversas enfermedades inflamatorias49,50.
El perfil de seguridad de los fármacos biológicos en cuanto a la interacción con el HGNA es, en su conjunto, mejor al de la terapia convencional discutida con anterioridad. A modo de ejemplo, adalimumab fue utilizado durante una media de 5 años en 32 pacientes con enfermedad hepática y psoriasis, no observándose ningún caso de progresión de la hepatopatía ni de hepatotoxicidad51.
La terapia biológica podría ejercer efectos regulatorios sobre algunas adipocitoquinas. De este modo, Shibata et al. demostraron un incremento en los niveles de adiponectina e IL-6 durante el tratamiento con infliximab52. Por otro lado, se ha comprobado cómo adalimumab y etanercept podrían ejercer un efecto inhibidor de las adipocitoquinas proinflamatorias53.
Existen estudios contradictorios acerca del impacto de los fármacos anti-TNF sobre el perfil lipídico, factor de riesgo relevante en el HGNA. De este modo, mientras que en algunos trabajos no se ha demostrado un impacto significativo, en otros estudios se observó un incremento de los niveles de triglicéridos y un descenso del colesterol HDL en pacientes con artropatía psoriásica tratados con infliximab54 o, por el contrario, una modulación favorable del HDL-C, Apo A1 y Apo B, de la reducción en la peroxidación lipídica y en las propiedades antioxidantes y antiinflamatorias de HDL en el caso de etanercept55.
Marra et al. demostraron una mejoría en la sensibilidad a la insulina en pacientes tratados con etanercept por psoriasis, circunstancia que, potencialmente, podría ejercer un impacto favorable en el curso y pronóstico del HGNA56.
Sin embargo, debe tenerse en cuenta que, de forma infrecuente, los fármacos anti-TNF pueden inducir hepatitis autoinmunes o farmacológicas57. Sin embargo, este riesgo es muy bajo, habiéndose reportado hasta el momento tan solo 20 casos de hepatitis autoinmune, la mayoría leves y asociados a infliximab y con rápida respuesta al tratamiento esteroideo41. Por otro lado, el empleo de fármacos antiTNF se ha asociado a un incremento de peso en pacientes con psoriasis, en general limitado, pero apreciable en el uso a largo plazo en algunos pacientes, que podría agravar la obesidad frecuente en pacientes con psoriasis grave y HGNA58.
En un estudio sobre una serie de 44 pacientes tratados durante un tiempo medio de 46,7 meses con ustekinumab se detectó elevación de transaminasas en 6 pacientes, de los cuales 5 presentaban toxicidad hepática asociada a otros fármacos, 3 tuvieron hígado graso y 3 estaban recibiendo fármacos hepatotóxicos de forma concomitante con ustekinumab. Los autores concluyeron que la hepatotoxicidad asociada a ustekinumab era leve e infrecuente59. La toxicidad hepática no se describe como un efecto secundario detectado en ensayos clínicos de secukinumab60.
ConclusionesEl HGNA es la principal causa de enfermedad hepática en nuestro medio (tabla 3). Los pacientes con psoriasis presentan una mayor prevalencia y gravedad y peor pronóstico de esta hepatopatía, y su evaluación debe ser una rutina dentro de su atención dermatológica. El vínculo patogénico entre ambas es el estado de inflamación crónica y la resistencia periférica a la insulina, habitual en las comorbilidades asociadas a la psoriasis. El dermatólogo debe conocer la elevada prevalencia de HGNA en los pacientes con psoriasis y también la mayor posibilidad de esteatohepatitis, en particular en aquellos con formas graves de la enfermedad y en presencia de elementos del síndrome metabólico. Los pacientes con psoriasis y resistencia insulínica o factores de riesgo de síndrome metabólico deben realizarse una evaluación específica de hígado graso mediante ecografía abdominal y bioquímica hepática. La coexistencia de psoriasis y HGNA, con probable sinergia entre ambos, condiciona las medidas generales que deben recomendarse en estos pacientes y también la estrategia terapéutica, por la potencial hepatotoxicidad de algunos de los fármacos empleados o, por el contrario, por la posibilidad de que el buen control de la inflamación y de los factores patogénicos asociados al HGNA favorezcan un mejor pronóstico en otros.
- -
La incidencia de HGNA en psoriasis es 1,5 a 3 veces mayor que en la población no psoriásica, lo que supone, en la práctica, que puede encontrarse en alrededor de la mitad de estos pacientes. También se encuentra incrementado el porcentaje de pacientes con esteatohepatitis.
- -
El pronóstico en el HGNA viene condicionado por la presencia y gravedad de la esteatohepatitis y la fibrosis hepática.
- -
En aquellos pacientes con resistencia insulínica o elementos de síndrome metabólico y psoriasis moderada-grave se recomienda la práctica de una ecografía abdominal, incluso en ausencia de alteraciones de la bioquímica hepática.
- -
Los pacientes con HGNA deberán ser remitidos al hepatólogo para control y seguimiento.
- -
La presencia de hígado graso condiciona la elección terapéutica y hace conveniente monitorizar de forma individualizada el uso de fármacos con potencial hepatotóxico.
- -
Los fármacos biológicos anti-TNF podrían aportar beneficios teóricos en pacientes con HGNA de forma secundaria al mejor control del proceso inflamatorio y de la resistencia periférica a la insulina. No existe evidencia de interacción de ustekinumab y secukinumab en la evolución del HGNA.
Factores de riesgo de síndrome metabólico
| Factores de riesgo de síndrome metabólico |
|---|
| Circunferencia de la cintura≥94cm (♂),≥80cm (♀) |
| Tensión arterial≥130/85mmHg o en tratamiento por hipertensión |
| Glucemia en ayunas≥100mg/dl o en tratamiento por diabetes mellitus tipo 2 |
| Trigliceridemia≥150mg/dl |
| HDL colesterol<40mg/dl (♂) o<50mg/dl (♀) |
Fuente: EASL-EASD-EASO17.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesAbbvie ha facilitado reuniones para los integrantes del grupo, pero ninguno de sus empleados ha participado en el desarrollo y elaboración del material científico, las discusiones o el texto escrito.
JM Carrascosa ha participado en asesorías y/o ponencias invitadas y/o ensayos clínicos para Laboratorios Abbvie, Janssen, Lilly, Pfizer, Novartis, Pfizer y Celgene.