El término pseudolinfoma cutáneo designa proliferaciones linfoides cutáneas benignas de naturaleza reactiva que simulan linfomas cutáneos. Se trata de un término puramente descriptivo que engloba diferentes entidades reactivas, con diversa etiología, patogénesis, presentación clínica, histología y comportamiento. En el presente artículo revisaremos los distintos tipos de pseudolinfoma cutáneo. Como veremos, para llegar al correcto diagnóstico de los mismos será preciso en cada caso la integración de los datos clínicos con los histopatológicos, inmunofenotípicos y moleculares. Incluso entonces, en ocasiones solo la evolución confirmará el diagnóstico, por lo que el seguimiento será esencial.
The term cutaneous pseudolymphoma refers to benign reactive lymphoid proliferations in the skin that simulate cutaneous lymphomas. It is a purely descriptive term that encompasses various reactive conditions with a varied etiology, pathogenesis, clinical presentation, histology, and behavior. We present a review of the different types of cutaneous pseudolymphoma. To reach a correct diagnosis, it is necessary to contrast clinical, histologic, immunophenotypic, and molecular findings. Even with these data, in some cases only the clinical course will confirm the diagnosis, making follow-up essential.
Los pseudolinfomas cutáneos (PLC) son proliferaciones linfocíticas reactivas benignas que simulan linfomas cutáneos (LC) desde el punto de vista clínico y/o histopatológico1–6. El concepto fue introducido por primera vez por Kaposi en 1891 bajo la denominación sarcomatosis cutis. Posteriormente ha recibido diversos nombres, correspondiendo en su totalidad las descripciones iniciales a PLC de células B4,5,7,8.
Clásicamente se han dividido atendiendo a sus características histopatológicas e inmunofenotípicas en función del linfoma al que simulan, según el componente linfocitario principal, en PLC de células B (PLC-B) y de células T (PLC-T)9, aunque en muchas ocasiones esta diferenciación es artificial. Esta continúa siendo la clasificación más utilizada en la actualidad.
La lista de los pseudolinfomas cutáneos se ha visto en los últimos años incrementada debido a la incorporación de múltiples procesos reactivos con hallazgos histopatológicos similares a los de los verdaderos linfomas. Así mismo, resulta interesante señalar que varias entidades clasificadas en el pasado como pseudolinfomas cutáneos han pasado a ser reclasificados como linfomas de bajo grado, en función de los datos clínico-patológicos, los estudios de biología molecular y el seguimiento6.
No existen demasiados datos sobre su epidemiología, aunque parece que los PLC-B son más frecuentes que los tipo T, y afectan más al sexo femenino4,5,10. Se presentan generalmente en adultos, aunque pueden aparecer a cualquier edad. No se han descrito casos familiares3.
En la patogénesis de estos procesos algunos autores señalan la participación del tejido linfoide asociado a la piel (SALT), análogo cutáneo del tejido linfoide asociado a mucosas (MALT), y la proliferación del mismo tras la estimulación antigénica11. Esta teoría podría indicar la posibilidad de la progresión de los PLC a un verdadero LC como resultado de la estimulación antigénica permanente, de forma análoga a lo que sucede en la mucosa gástrica con la infección persistente por Helycobacter pylori12. Se han observado algunos casos de PLC con progresión a LC13–17. Sin embargo, la verdadera progresión desde un PLC correctamente diagnosticado hacia un LC es excepcional, si es que alguna vez se produce.
El diagnóstico de PLC precisará de la integración de los datos clínicos con los histopatológicos, atendiendo en este caso tanto a la arquitectura como a la composición de los infiltrados, en combinación con la inmunohistoquímica y los estudios de reordenamiento molecular6,18,19. Respecto a estos últimos conviene señalar que, en general, deberíamos esperar policlonalidad en los procesos pseudolinfomatosos. Sin embargo, en los LC verdaderos a veces no es posible demostrar la clonalidad de la lesión, y en algunos pseudolinfomas podemos encontrar poblaciones B y T monoclonales5,8,20–26. Por ello, aunque el estudio molecular es útil, sus resultados deben ser interpretados con cautela y en el contexto del resto de hallazgos.
A continuación describiremos los principales tipos de PLC (tabla 1).
Pseudolinfomas cutáneos
| Paniculitis lúpica |
| Pseudolinfomas en tatuajes |
| Pseudolinfomas en los sitios de vacunación |
| Linfocitoma cutis |
| Pseudolinfomas en lesiones de acrodermatitis crónica atrófica |
| Foliculitis pseudolinfomatosa |
| Reacción linfomatoide a fármacos |
| Morfea |
| APACHE |
| Pseudolinfoma polipoide angiomatoide rico en células T |
| Placa linfoplasmocitaria pretibial |
| Sífilis secundaria |
| Reacción persistente a picaduras |
| Reticuloide actínico |
| Liquen escleroso y atrófico |
| Liquen aureus |
| Pseudolinfoma solitario de células T |
| Queratosis liquenoide |
| Dermatitis de contacto linfomatoide |
| Proliferación linfoide atípica en pacientes positivos para el VIH |
| Pseudolinfomas CD30+ |
| Enfermedad por IgG4 |
| Dermatitis anular liquenoide |
| Eritema palpable migratorio arciforme |
| Otros pseudolinfomas cutáneos |
La afectación del tejido celular subcutáneo en los pacientes con lupus, proceso conocido como paniculitis lúpica (PL), puede clínica y sobre todo histológicamente plantear el diagnóstico diferencial con el linfoma de células T subcutáneo tipo paniculítico (PLTCL)6,27.
La PL se presenta como placas o nódulos subcutáneos en zonas raramente afectadas por otras paniculitis, como son la cara, los hombros y la parte proximal de los brazos. Los anticuerpos antinucleares y otros criterios diagnósticos de lupus eritematoso sistémico pueden estar ausentes.
La histología muestra una paniculitis predominantemente lobulillar con densos infiltrados linfoides en la dermis profunda y en la hipodermis, a veces con presencia de septos fibrosos ensanchados. El infiltrado es mixto, con abundantes linfocitos B, células plasmáticas y células dendríticas plasmocitoides agrupadas, a menudo formando centros germinales reactivos. La unión dermoepidérmica puede mostrar la dermatitis de interfase propia de la conectivopatía de base, lo que constituye una de las claves para realizar el diagnóstico diferencial. A diferencia del PLTCL, en la PL no encontraremos citofagocitosis ni los característicos anillos de linfocitos atípicos rodeando los adipocitos (rimming). El estudio de reordenamiento del gen del TCR (T-cell receptor) demuestra policlonalidad6,27.
Merece la pena señalar la existencia, aunque infrecuente, de casos de linfoma de células T de tipo paniculítico que muestran solapamiento en sus hallazgos histopatológicos con la paniculitis lúpica. En el estudio de Willemze et al. sobre 83 pacientes con este tipo de linfoma, observaron la presencia de abundantes células plasmáticas mezcladas con los linfocitos CD4+ en 4 sujetos que además padecían lupus eritematoso, lo que había conducido a un diagnóstico inicial erróneo de PL. En estos casos la presencia de atipia celular en combinación con la pérdida de marcadores pan-T y/o el reordenamiento clonal del gen del TCRγ resultaron clave para llegar a un correcto diagnóstico28.
Pseudolinfomas en tatuajesLos tatuajes pueden producir de forma poco frecuente reacciones pseudolinfomatosas frente al pigmento, con una latencia variable29,30. El color más frecuentemente implicado es el rojo30. Se presentan como nódulos subcutáneos11.
En el examen histológico se observa un denso infiltrado dérmico difuso con refuerzo perivascular y perianexial, constituido principalmente por linfocitos pequeños (más frecuentemente T, pero también pueden ser mixtos o B) y macrófagos, pudiendo observarse eosinófilos, plasmocitos, histiocitos y células gigantes multinucleadas. Pueden disponerse formando folículos linfoides con centros germinales o en patrones similares a la micosis fungoide (MF). La epidermis puede presentar espongiosis, exocitosis o degeneración vacuolar de la basal29,30. La presencia de macrófagos fagocitando el pigmento resulta clave en el diagnóstico.
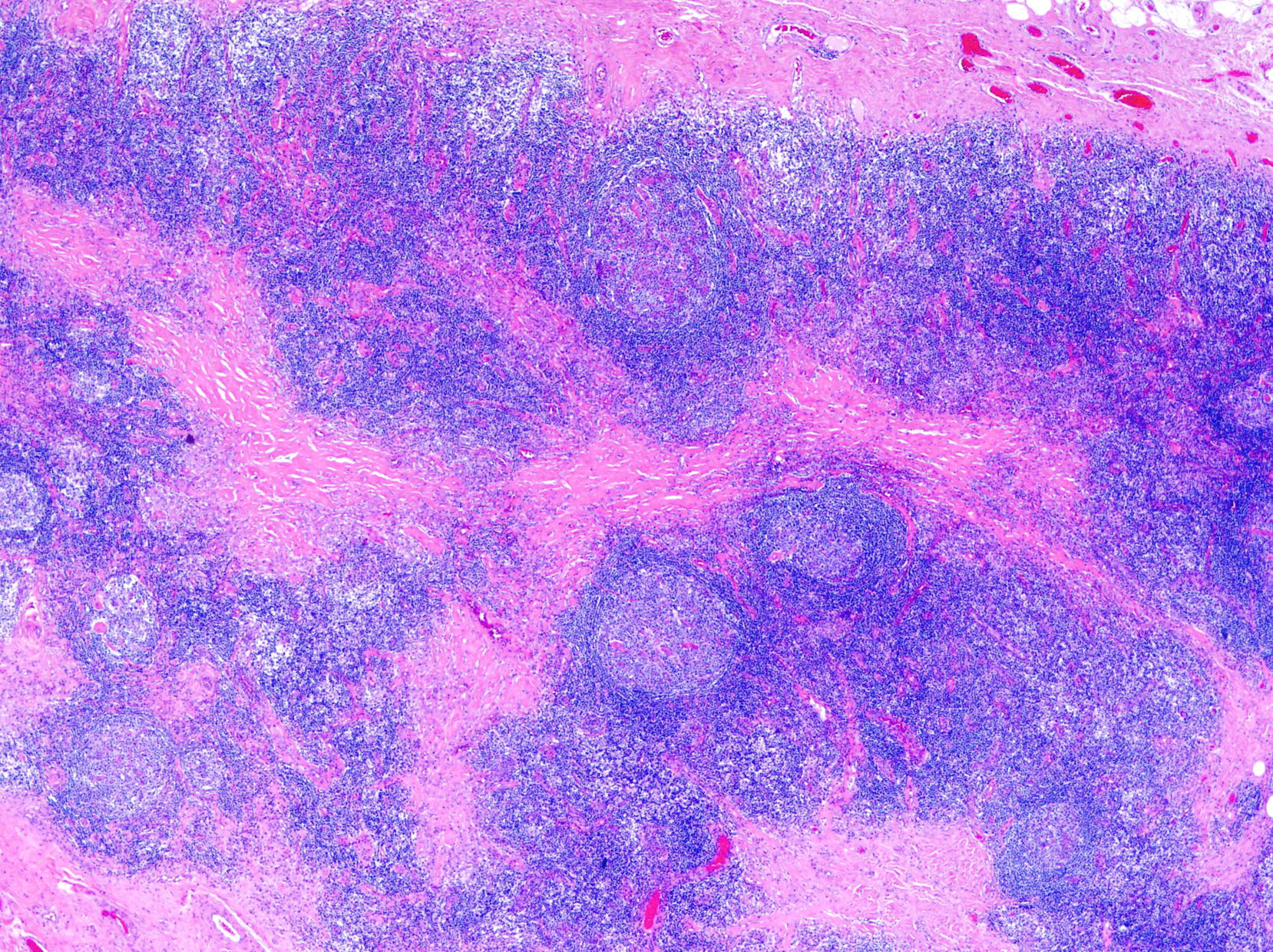
Pseudolinfomas en los sitios de vacunaciónEn ocasiones en los sitios de vacunación aparece una respuesta inflamatoria intensa que simula un LC, como resultado de una reacción de hipersensibilidad retardada ante los constituyentes de la vacuna. Este fenómeno se produce sobre todo en las vacunas que contienen aluminio, elemento que ayuda a retardar la absorción de los componentes, y prolonga el estímulo antigénico6,31. Se presentan como pápulas o nódulos eritematosos superficiales o profundos6,32.
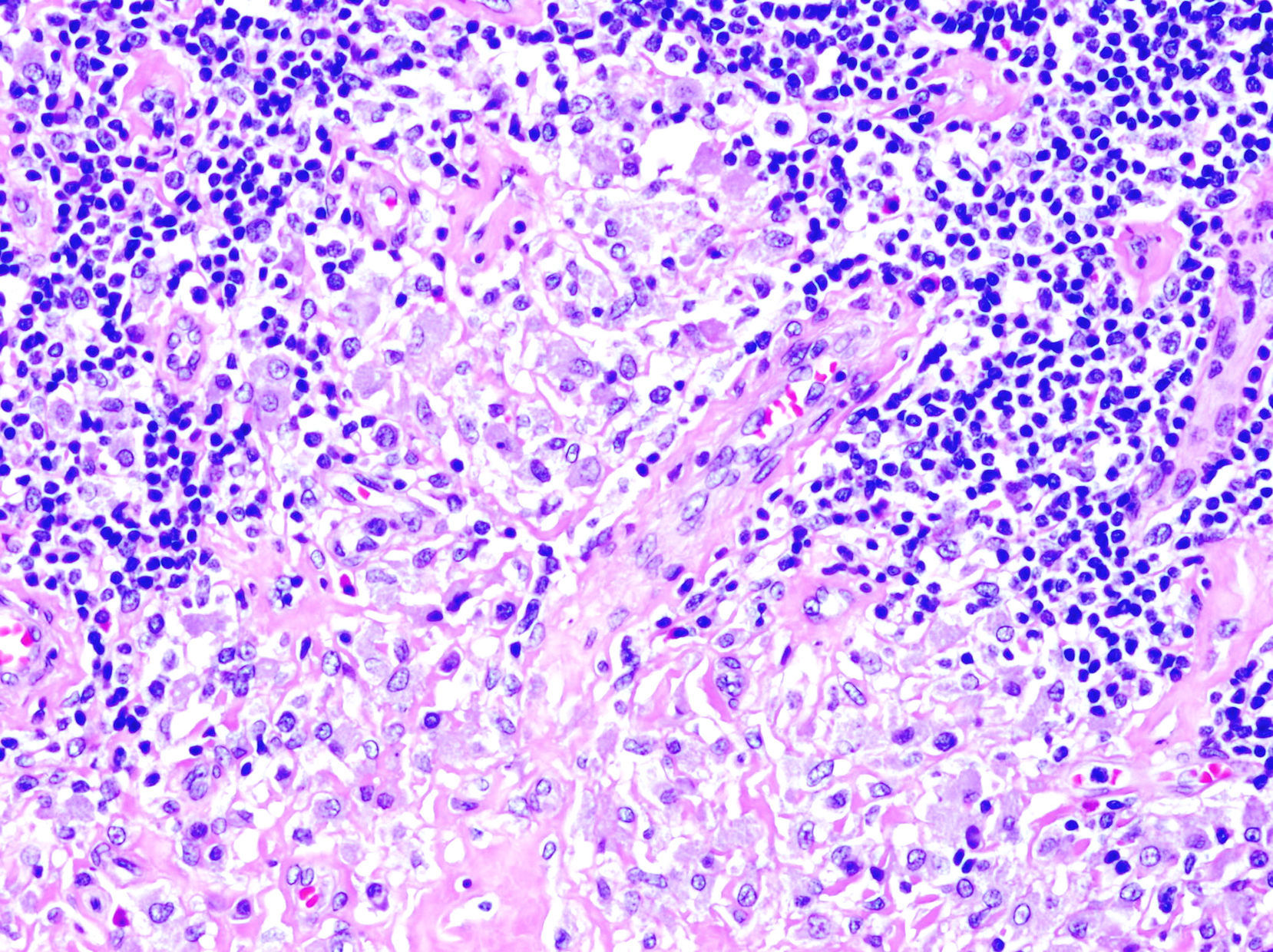
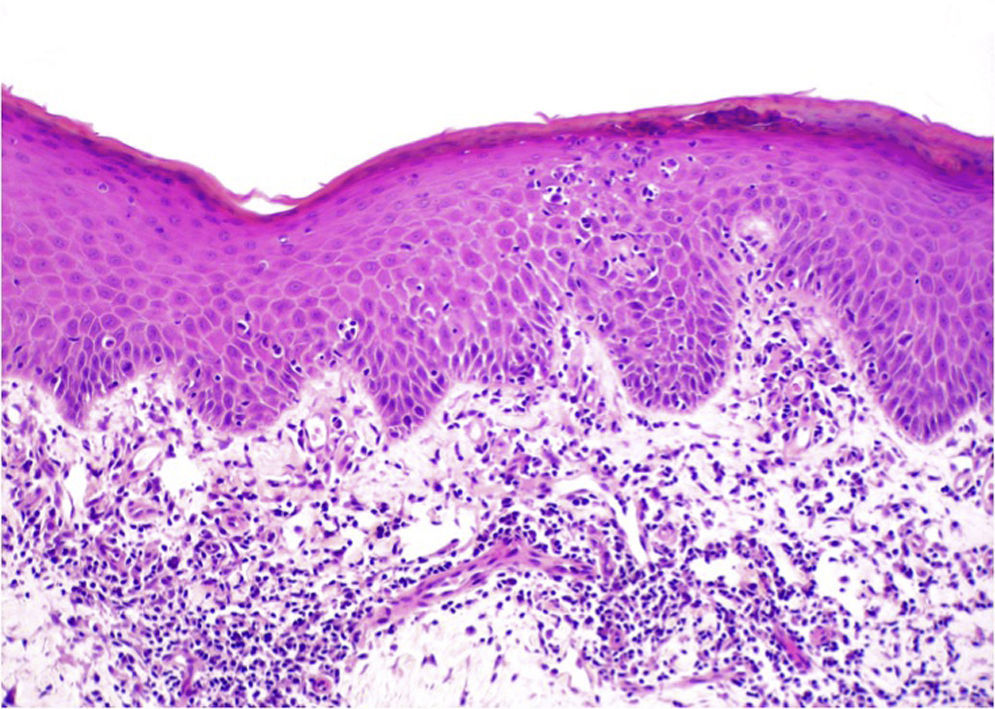
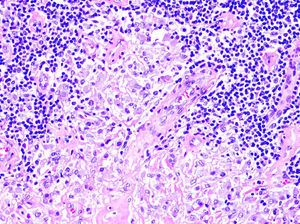
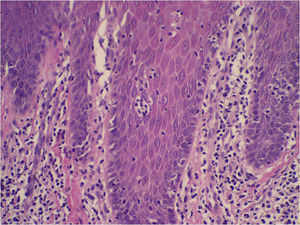
El patrón histológico puede ser liquenoide, similar a la MF, o nodular, simulando el linfoma del centro folicular (fig. 1), aunque a diferencia de aquel no observaremos células bcl6+ fuera de los centros germinales reactivos6,33. Ocasionalmente aparecen grupos de células CD30+33. Es característico que los histiocitos del infiltrado, solitarios o agrupados formando granulomas epitelioides, muestren abundante citoplasma granular y basófilo (fig. 2), que se corresponde con el depósito intracelular del aluminio de la vacuna, en los casos en los que este es el elemento implicado.
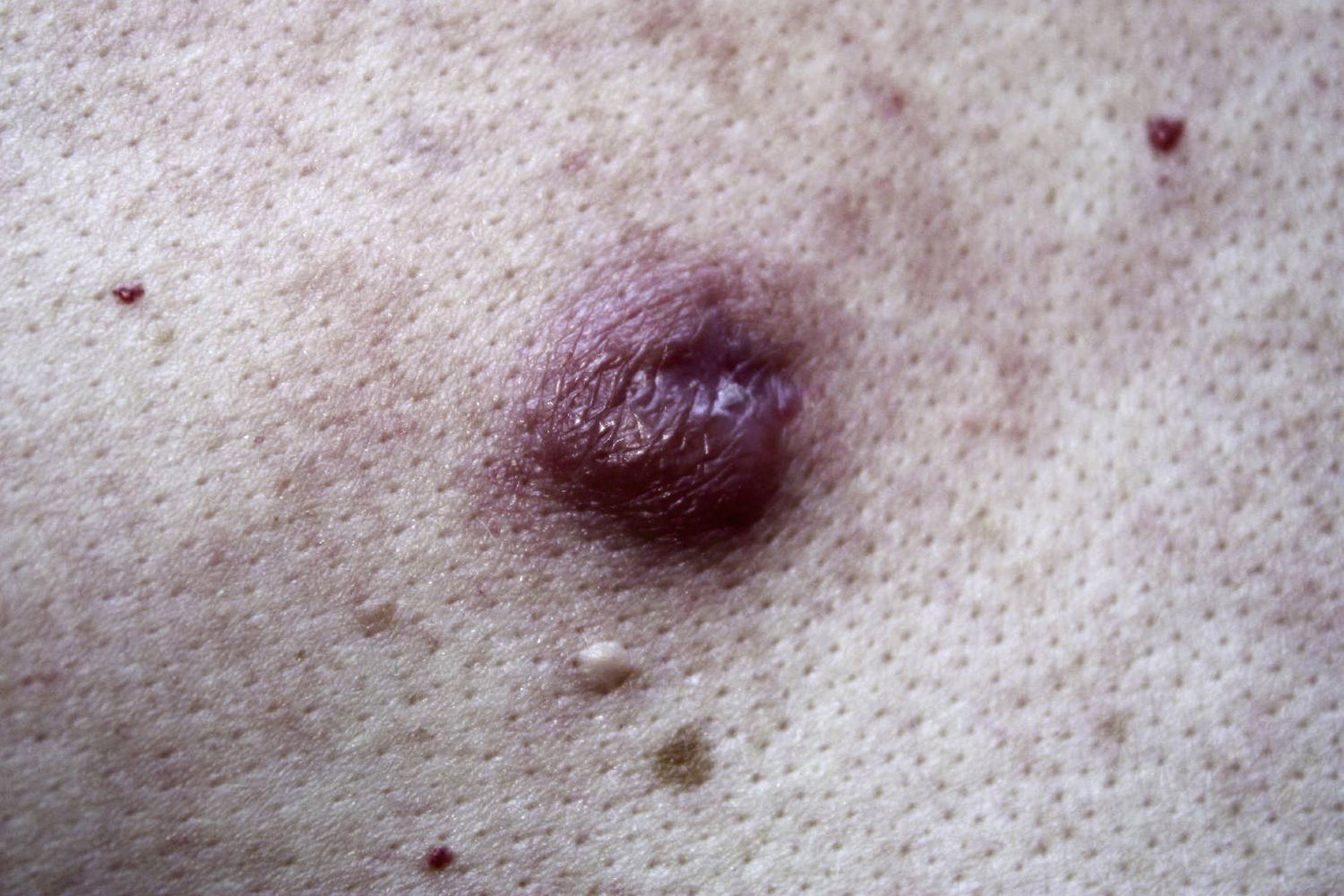
El linfocitoma cutis (LiC) fue descrito por primera vez por Spiegler en 1894. Es el prototipo de PLC-B y quizás la forma más frecuente. Representa una reacción inmunológica local exagerada frente a diversos estímulos, habiéndose descrito de forma más extensa su relación con picaduras de artrópodos6,32–37. Una de las asociaciones más clásicas es con la espiroqueta Borrelia burgdorferi tras la picadura de la garrapata Ixodes22,38.
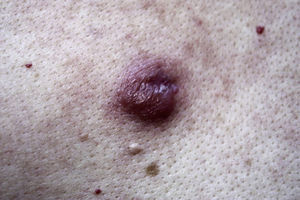
Se presenta como un nódulo solitario de coloración rojiza (fig. 3) o más raramente como placas o pápulas agrupadas. La localización más habitual es la cara y el cuello. La afectación del lóbulo de la oreja, los pezones o el escroto es muy característico del LiC asociado a B. burgdorferi6,38–40.
De forma menos frecuente se han descrito formas tipo miliaria, que cursan como múltiples micropápulas traslúcidas y monomorfas distribuidas de forma simétrica en la cabeza y el cuello, asintomáticas o levemente pruriginosas11,41,42.
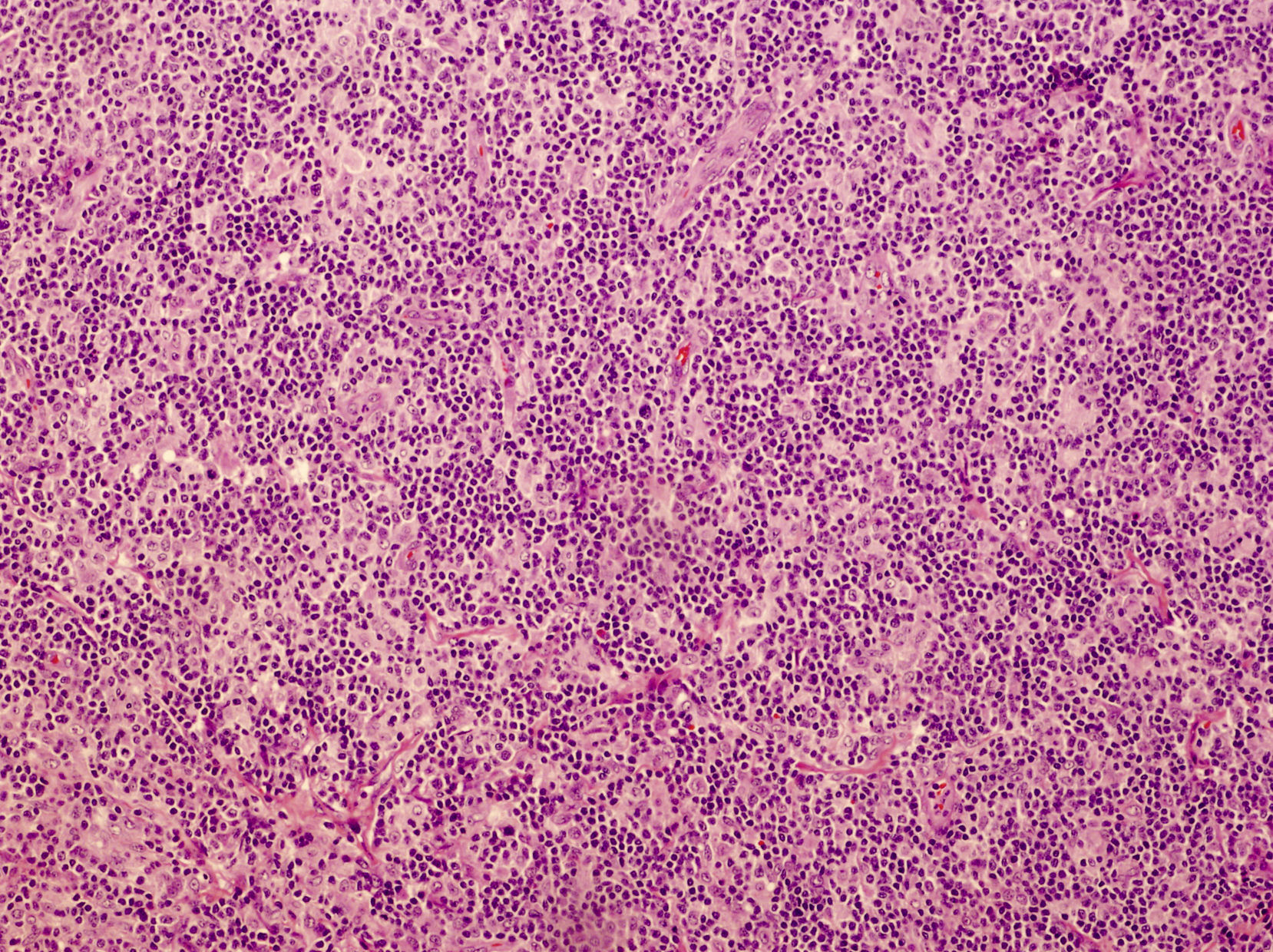
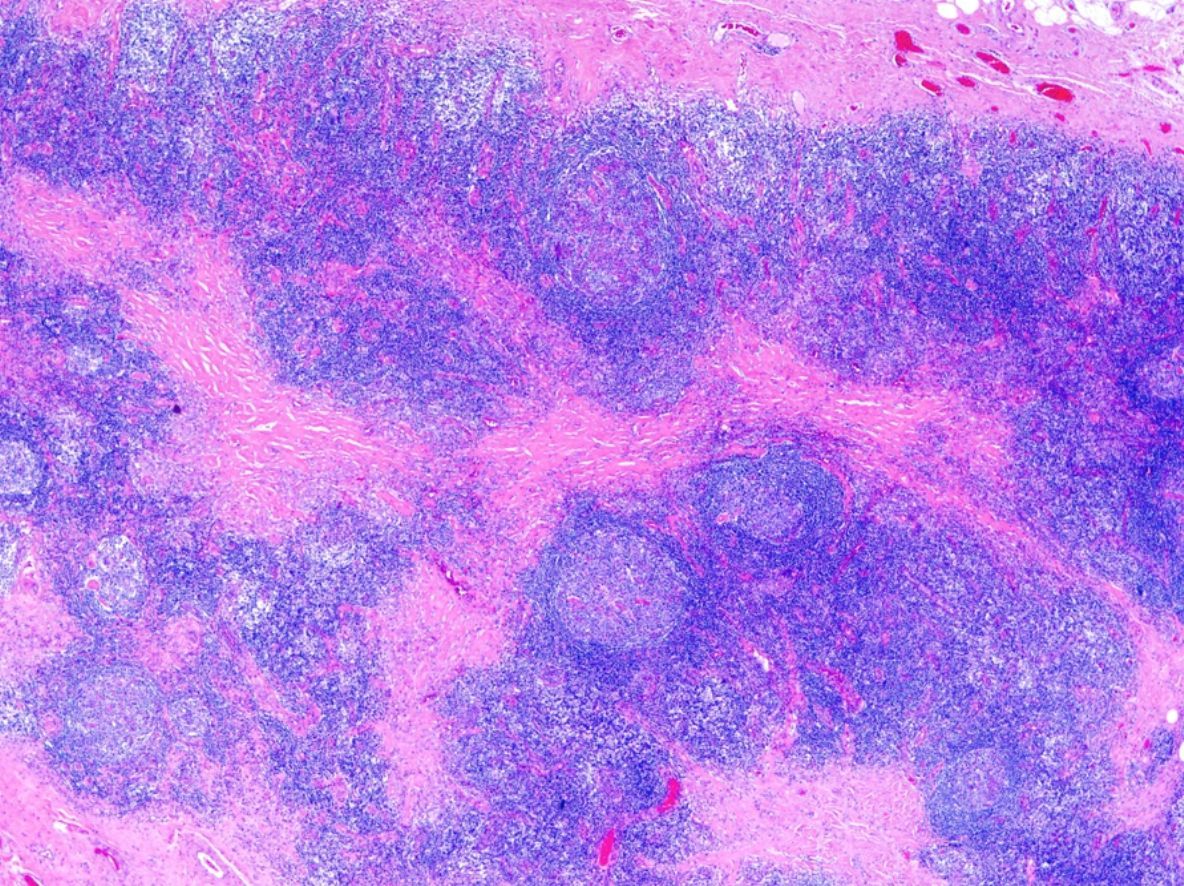
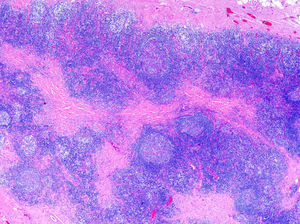
El examen histológico muestra un denso infiltrado linfoide dérmico denso, nodular, con formación de centros germinales que de forma característica no presentan zona del manto y pueden confluir. Aunque en los pseudolinfomas el infiltrado suele localizarse de forma más marcada en la dermis superficial (top heavy) a diferencia de los linfomas (bottom heavy), en los linfocitomas asociados a B. burgdorferi este suele distribuirse por la totalidad de la dermis y alcanzar la porción superficial del tejido celular subcutáneo6.
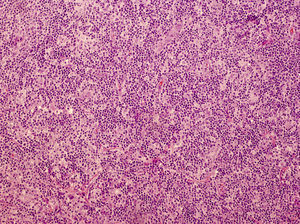
Respecto a su composición, se observan células plasmáticas, eosinófilas, abundantes linfocitos T reactivos y cuerpos macrofágicos tingibles (fig. 4). Esta heterogeneicidad es un dato más a considerar con relación al diagnóstico diferencial con los verdaderos linfomas, donde el infiltrado suele ser más homogéneo. El inmunofenotipo predominante es de célula B del centro germinal, con positividad para CD20, CD10 y bcl-6 y negatividad para bcl-2. El índice proliferativo de los centros germinales puede ser muy elevado, pero no se observa atipia celular y el crecimiento respeta las estructuras anexiales, a diferencia de los auténticos linfomas. El reordenamiento suele ser, aunque no siempre, policlonal. En los casos que cursan con varias lesiones, buscar clonalidad en más de una es muy útil para diferenciar pseudolinfoma de linfoma. La presencia de la misma clona en 2 lesiones distintas o en distintos momentos evolutivos orientaría hacia el diagnóstico de linfoma6,39,43.
Pseudolinfoma en las lesiones de acrodermatitis crónica atróficaSe han descrito casos de pseudolinfoma en las lesiones de acrodermatitis crónica atrófica, manifestación cutánea tardía de la infección por Borrelia. Las lesiones pueden mostrar histopatológicamente 2 patrones diferentes. Uno simula una micosis fungoide, mientras que el otro, menos frecuente, recuerda a los linfomas cutáneos de células B. El estudio de reordenamiento demuestra la policlonalidad del infiltrado44,45.
Foliculitis pseudolinfomatosaSe trata de una variante de PLC caracterizada por la presencia de folículos pilosos hiperplásicos junto con un infiltrado linfoide que puede simular un linfoma cutáneo. Cursa como una, o menos frecuentemente, varias lesiones cupuliformes o nodulares, localizadas en la cara, el cuero cabelludo o el tronco12,46.
Histológicamente, pueden simular un linfoma T pleomórfico de células pequeñas/medianas, un linfoma B del centro folicular, e incluso una MF foliculotropa. El denso infiltrado linfocitario se localiza de forma predominante en torno a los folículos pilosos, los cuales muestran cambios hiperplásicos y engrosamiento de su pared. En ocasiones son visibles agregados de histiocitos perifoliculares S100+ y CD1A+. Los estudios de reordenamiento demuestran la policlonalidad del infiltrado11,12,46–50.
Reacción linfomatoide a fármacosMúltiples fármacos pueden inducir infiltrados linfoides cutáneos que simulan linfomas clínica y/o histológicamente. Los más habitualmente implicados son los anticonvulsivantes y los antihipertensivos, pero se ha descrito también con otros (tabla 2).
Fármacos implicados en reacciones cutáneas pseudolinfomatosas
| Anticonvulsivantes | Fenitoína, carbamacepina, mefenitoína, trimetadona, fenobarbital, primidona, butobarbitol, metosuximida, fensuximida |
| Antipsicóticos | Clorpromazina, tioridazina, prometazina, metilfenidato |
| Antihipertensivos | |
| IECA | Captopril, enalapril, benazepril |
| Bloqueadores beta | Atenolol, labetalol |
| Bloqueadores de los canales de calcio | Verapamilo, diltiazem, benidipino |
| Diuréticos | Moduretic, hidroclorotiazida |
| Citotóxicos | Ciclosporina, metotrexato |
| Reumatológicos | Oro, salicilatos, fenacetina, D-penicilamina, alopurinol, AINE |
| Antibióticos | Penicilina, dapsona, nitrofurantoína, vancomicina |
| Antidepresivos | Fluoxetina, doxepina, depramina, amitriptilina, litio |
| Ansiolíticos | Benzodiazepinas (clonazepam, lorazepam) |
| Antihistamínicos | Difenhidramina |
| Antihistamínicos H2 | Cimetidina, ranitidina |
| Antiarrítmicos | Procainamida, mexiletina |
| Agentes tópicos | Mentol, eugenol |
| Hormonas sexuales | Estrógenos, progesterona |
| Hipolipidemiantes | Lovastatina |
| Fármacos biológicos | Adalimumab, infliximab, etanercept |
| Otros | Lornoxicam, ácido zoledrónico |
Clínicamente se presentan como pápulas generalizadas, placas o nódulos, e incluso eritrodermia, en ocasiones con acentuación en zonas fotoexpuestas6,36,61. Las lesiones se inician habitualmente durante las 2 a 8 primeras semanas tras la introducción del medicamento, aunque se han descrito comienzos más tardíos36,42,62. La clínica cutánea puede acompañarse de adenopatías, fiebre y menos frecuentemente hepatoesplenomegalia, artralgias y alteraciones analíticas diversas que incluyen elevación de enzimas hepáticas y eosinofilia, sobre todo en los casos producidos por anticonvulsivantes61,63. Ocasionalmente pueden detectarse células de Sézary circulantes36.
Histológicamente la reacción linfomatoide a fármacos se presenta como un infiltrado de linfocitos de predominio T en banda, con espongiosis y exocitosis en la epidermis, simulando una MF. Otras veces adopta un patrón de células B nodular o difuso, con formación de centros germinales y simula un linfoma del centro folicular o de la zona marginal. Se ha descrito la presencia de atipia celular, así como la aparición de abundantes células CD30+ en algunos casos, lo que puede dificultar el diagnóstico diferencial. Algunos datos orientativos de reacción linfomatoide a fármacos incluyen la presencia de queratinocitos necróticos, la extravasación de hematíes, la incontinencia de pigmento, el edema en la dermis, la ausencia de fibrosis en la dermis papilar, y la presencia de otras células inflamatorias en el infiltrado, así como un reordenamiento clonal negativo en el análisis molecular. La localización en zonas fotoexpuestas orientaría así mismo a una RLF42,43,61,64–68.
La RLF se resuelve cuando se retira el fármaco responsable en un tiempo variable y recurre cuando se reintroduce42,43. Muy rara vez se ha documentado el desarrollo de un verdadero LC69, en cuyo caso las lesiones cutáneas no regresarían tras la suspensión del medicamento.
MorfeaEn la fase inflamatoria de las conectivopatías, especialmente en la esclerodermia localizada, la afectación del colágeno a menudo no es muy evidente y se pueden observar infiltrados linfoides densos que simulan LC, sobre todo linfomas B de la zona marginal. Las células plasmáticas están casi siempre presentes y el estudio de reordenamiento del gen de las cadenas ligeras demuestra la policlonalidad del infiltrado6,70,71. La correlación clínico-patológica resulta fundamental.
Angioqueratoma acral pseudolinfomatoso/pseudolinfoma papular pequeñoEl angioqueratoma acral pseudolinfomatoso (AAP), originariamente descrito bajo el acrónimo APACHE (acral pseudolymphomatous angiokeratoma in children) es una entidad benigna y rara, de etiopatogenia desconocida, aunque para algunos autores se trata de una reacción de hipersensibilidad a picaduras4,6,72,73. Consiste en pápulas o nódulos rojo-violáceos agrupados asintomáticos, habitualmente en zonas acrales, siendo más frecuentes en niños y adolescentes11,36,72–75.
Histológicamente se observa un infiltrado linfoide B y T dérmico denso bien diferenciado de morfología nodular, que no suele afectar a los anejos, con presencia de células plasmáticas, eosinófilos y ocasionalmente histiocitos y células gigantes multinucleadas. Puede acompañarse de una proliferación de capilares. La epidermis normalmente está preservada, aunque se han descrito vacuolización de la basal, exocitosis y espongiosis6,72.
Pseudolinfoma polipoide angiomatoide rico en células TSe trata de lesiones cuyos hallazgos histopatológicos son similares a los observados en el AAP, pero que se presentan como lesiones polipoideas solitarias en zonas no acrales, con predilección por la cabeza y el tronco. Afecta típicamente a adultos jóvenes11,76,77. A diferencia del AAP, en el pseudolinfoma polipoide angiomatoide hay una predominancia de linfocitos T CD4+en el infiltrado y faltan los vasos prominentes de paredes gruesas que se observan en aquel. Ambas entidades deben distinguirse de la hiperplasia angioplasmacelular que histológicamente presenta un infiltrado mucho más rico en células plasmáticas76–78.
Placa linfoplasmocítica pretibial/tibial en niñosLa placa linfoplasmocitaria pretibial (PLP) es una entidad benigna, de curso crónico y etiología desconocida, probablemente reactiva. Cursa como pápulas o placas bien delimitadas, rojo-violáceas y asintomáticas, con preferencia por la parte anterior de la tibia en niños. Histológicamente es similar al AAP, aunque encontramos una presencia más marcada de células plasmáticas, junto con los linfocitos y los vasos prominentes. En la epidermis pueden aparecer vacuolización, exocitosis y cuerpos apoptóticos. El estudio de reordenamiento demuestra policlonalidad79–82.
Sífilis secundariaEn algunos casos las lesiones de sífilis secundaria, y más raramente de sífilis primaria y terciaria, pueden presentar al examen histopatológico un infiltrado celular linfoplasmocitario que simula los linfomas cutáneos de células B de la zona marginal. La presencia de una dermatitis de interfase/liquenoide o la inflamación granulomatosa coexitiendo con estos infiltrados son las claves para pensar en este diagnóstico. El reordenamiento demuestra policlonalidad, y las tinciones inmunohistoquímicas específicas para T. pallidum confirman la presencia de los microorganismos. El tratamiento antibiótico produce una rápida resolución de las lesiones. Mención aparte merecen algunos casos de sífilis maligna, que pueden presentar lesiones clínicamente indistinguibles de una papulosis linfomatoide e histológicamente difíciles de diferenciar, salvo por la abundancia de células plasmáticas y de nuevo la detección de la espiroqueta6,83,84.
Reacción persistente a picaduras de artrópodosEl paradigma de este cuadro es la escabiosis nodular, si bien otros artrópodos pueden inducirla. En su patogenia se ha propuesto una reacción de hipersensibilidad retardada a algún componente del ácaro, aunque rara vez se identifica en las lesiones. Clínicamente son pápulas rojizas o nódulos pruriginosos persistentes, a pesar de un tratamiento adecuado6,36.
En la histología la escabiosis nodular puede simular una MF, una papulosis linfomatoide, un linfoma de Hodgkin y, en algún caso, un linfoma cutáneo de células B. Lo más habitual es observar un infiltrado linfohistiocitario denso perivascular superficial y profundo de predominio T, en muchos casos con expresión de CD30+, junto con células plasmáticas, eosinófilos y vasos prominentes6,12,36,85,86.
Reticuloide actínicoEl reticuloide actínico es una fotodermatitis crónica que suele presentarse en personas de edad avanzada, con mayor frecuencia varones. Se caracteriza por una extrema fotosensibilidad a un amplio espectro de radiación UV6,36,43,87. Su patogenia permanece oscura, pero se ha propuesto que durante una reacción fotoalérgica un constituyente normal de la piel resultaría alterado y pasaría a ser antigénico88,89.
En las fases iniciales cursa como una dermatitis eczematosa muy pruriginosa con tendencia a la liquenificación localizada en zonas fotoexpuestas, que puede extenderse posteriormente a otras áreas36,88. Histológicamente se observa un infiltrado mixto perivascular superficial o profundo que puede incluir algunas células mononucleares atípicas. Puede simular una MF, al adoptar un patrón en banda con exocitosis de linfocitos, o ser más difuso y simular un linfoma T periférico. La relación CD4/CD8 está reducida con respecto a aquellas entidades36,43,88.
En la evolución pueden aparecer eritrodermia, adenopatías y ectropion, y en hasta un 10% células de Sézary en sangre periférica, dificultando el diagnóstico diferencial6,36,90–92. A diferencia de la MF y el SS, en el reticuloide actínico la sensibilidad a la luz UVB, UVA, e incluso a la luz visible es muy alta y puede producir la exacerbación del cuadro88.
El reticuloide actínico es un proceso crónico y no presenta tendencia a la remisión espontánea43,93. La fotoprotección resulta fundamental, unida a la evitación del contacto con los alérgenos asociados en el caso de haberse identificado6.
Liquen escleroso y atróficoA veces el liquen escleroso y atrófico genital, particularmente en su fase inicial, presenta características histopatológicas que plantean el diagnóstico diferencial con la MF. Las lesiones muestran un infiltrado linfoide denso dispuesto en banda en la dermis superficial y un marcado epidermotropismo6,94. Para mayor confusión, en bastantes casos el reordenamiento demuestra clonalidad95,96. En el líquen escleroso y atrófico no suele haber atipia celular en el infiltrado, los linfocitos intraepidérmicos suelen situarse en la parte baja de la epidermis, sin extensión pagetoide, y a menudo observaremos cambios de interfase94. La correlación clínico-patológica resulta fundamental.
Liquen aureusEl liquen aureus (LA) puede también simular los hallazgos histológicos de la MF y, en algunos casos, el análisis molecular puede revelar clonalidad6. De nuevo se requiere una buena correlación clínico-patológica.
Pseudolinfoma solitario de células TEs uno de los tipos de pseudolinfoma más controvertidos. Puede presentarse como lesiones superficiales en las mamas de mujeres adultas, con histología similar a la MF y ocasionalmente monoclonalidad, en una forma que se solapa con la queratosis liquenoide. En otros casos, aparece como lesiones nodulares solitarias con hallazgos histológicos similares a los del linfoma cutáneo pleomórfico de células T pequeñas/medianas y un comportamiento indolente. La exéresis resulta curativa6,97,98.
Queratosis liquenoideEs una neoplasia epitelial benigna, relacionada con las queratosis seborreicas y con los lentigos solares, que afecta a pacientes de edad avanzada. Cursa como pequeñas placas descamativas localizadas normalmente en el tronco. Histológicamente, los hallazgos pueden simular los de la MF, al observarse un infiltrado linfocitario denso en banda con cierto epidermotropismo y ocasionalmente monoclonalidad. La correlación clínico-patológica es básica6,99–101.
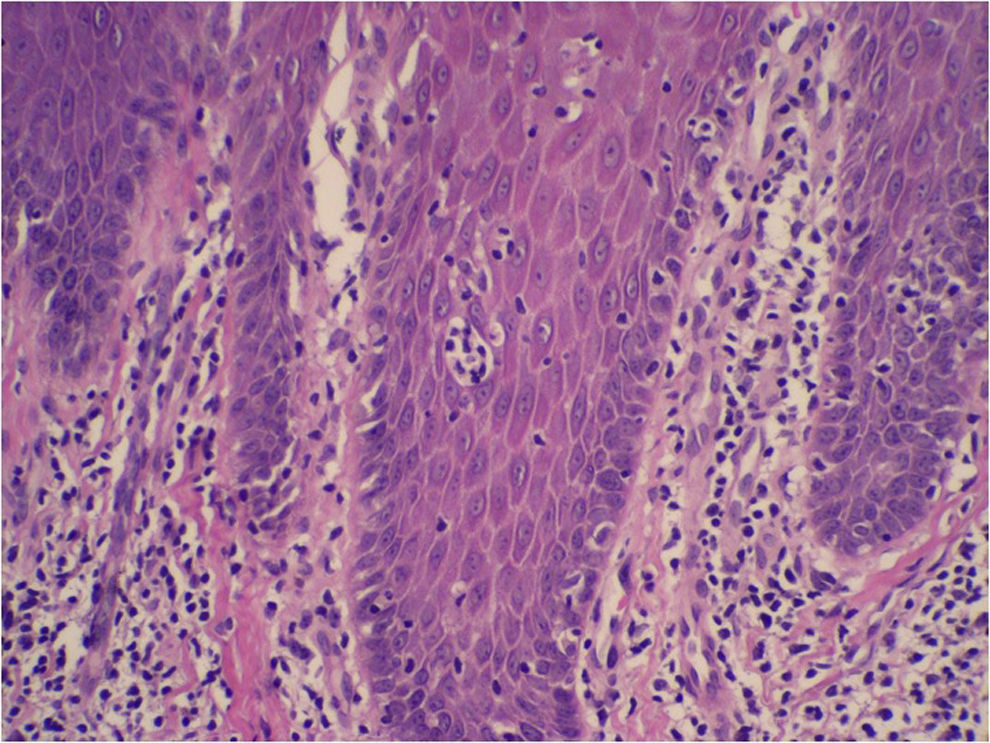
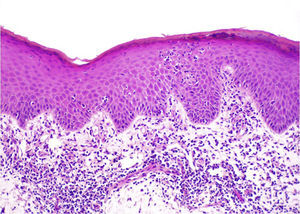
Dermatitis de contacto linfomatoideDescrita por vez primera por Orbaneja et al. en 1976102, esta forma de dermatitis de contacto simula los hallazgos clínicos e histopatológicos de la MF. Cursa como placas eritematosas pruriginosas de curso oscilante, más frecuentemente en varones de edades medias102–104. En la histología se observa un infiltrado en banda de linfocitos con predominio T y epidermotropismo (fig. 5). Sin embargo, en la epidermis pueden aparecer espongiosis o microvesiculación, la atipia es escasa y no se evidencian microabscesos de Pautrier, aunque se suelen observar pequeñas colecciones intraepidérmicas de queratinocitos entremezclados con células de Langerhans y algunos linfocitos que a menudo se confunden con aquellos (fig. 6). El análisis del reordenamiento del TCR suele demostrar generalmente policlonalidad43,94,103,104.
Dermatitis de contacto linfomatoide. En esta paciente sensibilizada a metilcloroisotiazolinona y a colofonia la histología mostraba un infilitrado linfocitario en banda, y en algunas zonas sin espongiosis la presencia de agrupaciones en la epidermis que recordaban a los microabscesos de Pautrier.
En la tabla 3 se especifican los alérgenos que han sido implicados en la dermatitis de contacto linfomatoide102,105–115. Las pruebas epicutáneas demuestran la sensibilización103 y el cuadro se resuelve tras la evitación de la exposición a los alérgenos causales6.
Alérgenos que han sido implicados en la dermatitis de contacto linfomatoide
| Fósforo |
| N-isopropil-N-fenil parafenilendiamina |
| Dihidrocloruro de etilendiamina |
| Naftenato de cobalto |
| Sulfato de níquel |
| Parafenilendiamina |
| Tiosulfato sódico de oro |
| Zinc |
| Dibutil éster del ácido escuárico |
| Metilcloroisotiazolinona/metilisotiazolinona |
Se trata de un proceso linfoproliferativo policlonal de aparente naturaleza reactiva, que clínica e histológicamente simula un linfoma T y se presenta en individuos con infección por el VIH, particularmente con inmunosupresión grave. Su patogenia es desconocida116.
Clínicamente cursa como una erupción pruriginosa generalizada, que asocia con frecuencia cambios pigmentarios (hipo o hiperpigmentación) y liquenificación. Se han descrito además linfadenopatías, esplenomegalia, eosinofilia y en ocasiones células de Sézary circulantes116–118.
Histológicamente las lesiones muestran hallazgos similares a los de la MF, pero con un predominio de linfocitos CD8+. Los estudios de clonalidad son negativos116,119–121.
Pseudolinfoma de células CD30+En los últimos años se ha descrito la presencia de linfocitos atípicos grandes CD30+ en numerosos procesos cutáneos reactivos (tabla 4). En estos pseudolinfomas los linfocitos CD30+ están dispersos por todo el infiltrado y no agrupados. El reordenamiento demuestra policlonalidad. Además, a menudo en la histología de estas lesiones encontramos datos del proceso específico subyacente6,122.
Procesos pseudolinfomatosos que pueden presentar proliferación de células CD30+
| Infecciosos | Virus Orf Molusco contagioso Verrugas víricas Herpes simple Herpes zóster Hongos Micobacterias Leishmaniasis Sífilis secundaria Infección por Stenotrophomonas matophilia Abscesos cutáneos Escabiosis |
| Farmacológicos | Carbamacepina Cefuroxima Quimioterápicos Gemcitabina Leuprolida Doxepina Antihipertensivos Atenolol Amlodipino Valsartán IECA Isoflavonas Sertralina Gabapentina |
| Otros | Picaduras de artrópodos Hidrosadenitis Acupuntura con oro Erupción de la recuperación linfocitaria Pitiriasis liquenoide y varioliforme Lesiones por coral marino rojo Dermatitis atópica Síndrome de Sweet Úlceras de estasis Rinofima Quistes rotos |
Es un proceso caracterizado por la infiltración de una gran variedad de órganos por un infiltrado linfoplasmocitario que incluye células plasmáticas IgG4+, junto con cambios escleróticos y elevación de los niveles séricos de IgG4 (por encima de 135mg/dl)128.
La afectación de la piel es poco frecuente, pero puede presentarse aislada y cursar sin elevación de los títulos séricos de IgG4. Clínicamente se presenta como placas o nódulos únicos o múltiples en la cabeza y/o en las extremidades de adultos de edades medias, con predominio masculino129–132.
En la histología se observa un infiltrado inflamatorio mixto en la dermis, y ocasionalmente en el tejido celular subcutáneo, inmerso en un estroma esclerótico11,128,130. Cuando la relación de células IgG4+/células IgG totales es superior a 40% es altamente sugestivo de esta entidad128.
Dermatitis anular liquenoideEsta entidad, de patogenia desconocida, fue inicialmente descrita en niños y comparte muchas características histológicas e inmunofenotípicas con la MF. Se presenta como placas asintomáticas eritematoparduzcas de morfología anular, únicas o múltiples, de bordes sobreelevados localizadas en el tronco.
Histológicamente se observa un infiltrado linfocitario en banda de predominio CD8+, degeneración vacuolar en la unión dermoepidérmica y queratinocitos necróticos en la punta de las crestas interpapilares. No hay epidermotropismo marcado, microabscesos de Pautrier ni fibrosis en la dermis papilar. Los estudios moleculares descartan la monoclonalidad133–135.
Eritema palpable migratorio arciformeSe trata de un proceso poco frecuente que cursa con placas anulares eritematosas localizadas predominantemente en el tronco, de extensión centrífuga, con tendencia a la desaparición en días a semanas. Histológicamente muestra un infiltrado linfocitario de predominio CD4+ perivascular y perianexial sin afectación epidérmica, sin células plasmáticas ni mucina intersticial. El estudio molecular demuestra reordenamiento policlonal en la mayoría de los casos136,137.
Otros pseudolinfomas cutáneosAdemás de los PLC, que hemos detallado a lo largo de este trabajo, existen otros procesos cutáneos que pueden simular clínica y/o histopatológicamente linfomas cutáneos.
Así, en la fase inflamatoria del vitíligo, en la que todavía no se aprecian manchas acrómicas, sino placas eritematosas y descamativas, se puede observar un infiltrado liquenoide denso en banda con exocitosis de linfocitos en la parte inferior de la epidermis que simula una MF. La mayoría de las células son linfocitos CD8+. El seguimiento resulta fundamental138.
Se han comunicado así mismo casos de pseudolinfomas en relación con la infección por herpes simple y herpes zoster, pudiendo imitar linfomas cutáneos T, B o procesos linfoproliferativos CD30+139.
En algunos casos de lupus eritematoso discoide crónico se ha descrito la presencia de células atípicas6. Del mismo modo, el infiltrado linfocitario de Jessner puede confundirse histopatológicamente con un LC de células B. La policlonalidad de los infiltrados, así como la presencia de agregados de monocitos plasmocitoides CD123+ son datos que facilitan el diagnóstico diferencial43,140.
Respecto a la pitiriasis liquenoide y varialiforme aguda (PLEVA), continúa debatiéndose sobre su auténtica naturaleza. La PLEVA generalmente tiene un comportamiento benigno, y probablemente es un proceso reactivo de causa infecciosa o inflamatoria141–143. Sin embargo, en algunos casos se ha documentado el reordenamiento monoclonal141, y al menos en la forma febril ulceronecrótica se ha considerado su relación con los linfomas cutáneos citotóxicos, con los que comparte hallazgos clínico-patológicos, si bien los infiltrados no son tan densos ni tan profundos como en estos últimos ni la morfología de las células tan atípica144. Es en esta variedad en la que el seguimiento debe ser más cuidadoso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer a los Dres. Jaime Guijarro, Jose Carlos Pascual, Javier Mataix, Juan Francisco Silvestre y María Niveiro su ayuda en la elaboración de este artículo, aportando sus casos y experiencia.