La psoriasis es una enfermedad mediada inmunológicamente, de causa desconocida, que característicamente presenta infiltración cutánea por polimorfonucleares neutrófilos y microabscesos de Munro. La interleucina (IL)-8 es una de las principales quemocinas atrayentes de los polimorfonucleares neutrófilos. Aunque la producción de IL-8 en psoriasis se ha atribuido principalmente al queratinocito, presentamos datos que apoyan la producción de esta por los linfocitos T antígeno de linfocito cutáneo (CLA)+.
Material y métodosse incluyeron 6 pacientes con psoriasis y 6 sanos. Mediante técnicas de separación inmunomagnética se aislaron los linfocitos T CLA+ y CLA–. Se cuantificó la producción de IL-8 e IFNγ de cada subpoblación celular a través de un ELISA. Finalmente, se analizó su expresión génica mediante reacción en cadena de la polimerasa a tiempo real.
ResultadosTanto los linfocitos T CLA+ como CLA–, de controles y pacientes con psoriasis, aumentaban significativamente la producción de IFNγ cuando eran activados, mientras que sólo los linfocitos T CLA+ activados, tanto de controles como de sujetos con psoriasis, producían IL-8. Se confirmó la expresión preferente de IL-8 e IFNγ en linfocitos T CLA+ respecto de CLA–.
DiscusiónEstudios previos han demostrado la producción de IL-8 por linfocitos T en dermatosis inflamatorias ricas en neutrófilos, tales como la pustulosis exantemática aguda generalizada, la enfermedad de Behçet y la psoriasis pustulosa. Nosotros hemos confirmado el papel del subgrupo de linfocitos T con tropismo cutáneo (CLA+) en la producción de IL-8 en la psoriasis no pustulosa.
Psoriasis is an immune-mediated disease typically associated with cutaneous neutrophilic infiltration and Munro microabscesses. Interleukin (IL)-8 is one of the main neutrophil-attracting chemokines. Although keratinocytes have traditionally been considered to be the principal source of IL-8 in psoriasis, we present data that suggest that cutaneous lymphocyte associated antigen (CLA)+ T lymphocytes synthesize this cytokine.
Material and methodsSix patients with psoriasis and 6 healthy controls were studied. Immunomagnetic separation was used to isolate CLA+ and CLA– T lymphocytes and IL-8 and interferon (IFN)-γ production was quantified for each cell subpopulation using enzyme–linked immunosorbent assay. Finally, gene expression of IL-8 was analyzed by reverse transcriptase-polymerase chain reaction.
ResultsCLA+ and CLA− T lymphocytes from patients with psoriasis and from controls showed a significantly increased production of IFN-γ when activated, whereas only activated CLA+ T lymphocytes (from patients and controls) synthesized IL-8. The higher level of expression of IL-8 and IFN-γ by CLA+ T lymphocytes in comparison to CLA– cells was confirmed.
DiscussionPrevious studies have confirmed IL-8 production by T lymphocytes in inflammatory skin diseases with neutrophil-rich infiltrates, such as acute generalized exanthematous pustulosis, Behçet disease, and pustular psoriasis. We have confirmed the role of the subset of T lymphocytes with skin tropism (CLA+) in IL-8 production in nonpustular psoriasis.
La psoriasis es una inflamación crónica de la piel con una importante base genética, y que se caracteriza por alteraciones en el crecimiento y diferenciación de los queratinocitos, junto con múltiples alteraciones bioquímicas, inmunológicas y vasculares1. Se considera que el desencadenamiento de la disregulación en la función de los queratinocitos se debe a la participación de elementos del sistema inmunitario tales como células T, células dendríticas y diferentes tipos de citocinas2. Los neutrófilos también están presentes en las lesiones psoriásicas; la infiltración cutánea por polimorfonucleares neutrófilos y los microabscesos de Munro son un hallazgo histológico característico de la psoriasis, confirmando el papel adyuvante de esta célula en la patogenia de la enfermedad. Se ha postulado que los neutrófilos intraepidérmicos podrían influir no sólo en el crecimiento y la diferenciación de los queratinocitos, sino que también promoverían la activación de los linfocitos T, induciéndoles la expresión en superficie de HLA–DR3. Desde el punto de vista clinicopatológico, la acumulación de neutrófilos en el estrato córneo se ha asociado a placas de psoriasis intensamente inflamatorias y recalcitrantes al tratamiento3.
Los neutrófilos son quemoatraídos por diferentes quimiocinas, que pueden actuar sinérgicamente. Entre ellas se encuentran la interleucina (IL)-8 (CXCL-8), C5a, MIP-1, MIP2, MIP-3, y GCP-24. En la psoriasis la IL-8 es producida por diferentes células residentes al ser estimuladas, siendo el queratinocito una de las principales. Sin embargo, la interacción de los linfocitos T con tropismo cutáneo con los neutrófilos está poco estudiada en la psoriasis. El antígeno cutaneous lymphocyte associated antigen (CLA, ‘antígeno de linfocito cutáneo’) distingue los linfocitos T memoria con tropismo cutáneo. Diferentes estudios apoyan el concepto de una la migración inicial hacia la piel de linfocitos T, que es previa al desencadenamiento de la lesión psoriásica5–8. Recientemente se ha estudiado el papel del los linfocitos T CLA+ circulantes en las fases agudas de la psoriasis, evidenciando una reducción en circulación de dichas células, que se correlaciona con la gravedad y que se explica por infiltración local de estos linfocitos T9,10.
En este estudio nos hemos interesado por la posible interacción entre los linfocitos T CLA+ y los neutrófilos en la psoriasis. Para ello hemos estudiado la probable producción de IL-8, un mediador con una potente capacidad de atracción de neutrófilos, por parte de linfocitos T memoria CLA+ circulantes de pacientes con psoriasis y sujetos sanos. Nuestros resultados indican que la activación de linfocitos T CLA+ conduce a una elevada producción de IL-8.
Material y métodosSe incluyeron 6 pacientes con psoriasis vulgar (excluyéndose explícitamente aquellos con eritrodermia, psoriasis pustulosa o con artritis asociada) y 6 sanos. Se les realizó una extracción sanguínea. Todos los pacientes y controles firmaron un consentimiento informado.
A los pacientes incluidos en el estudio se les había practicado previamente una biopsia confirmatoria. Se valoró la gravedad (Psoriasis Area Severity Index [PASI]), extensión (Body Surface Area [BSA]) y se revisaron las características clínicas, incluyendo los posibles factores desencadenantes (infección estreptocócica, estrés, etc.). Las muestras se obtuvieron tras un periodo de blanqueo mínimo de 6 semanas sin ningún tipo de tratamiento.
Purificación de linfocitos T CLA+ circulantes de sangre periférica y activaciónLas células T CLA+ (linfocitos con capacidad de infiltrar la piel) se purificaron a partir de linfocitos obtenidos de sangre periférica mediante una separación de Ficoll a partir de 60ml de sangre. Seguidamente se realizaron tres separaciones inmunomagnéticas consecutivas utilizando anticuerpos y anticuerpos conjugados a partículas magnéticas, según el protocolo descrito11. Las dos primeras separaciones eliminaron linfocitos CD14, CD19, CD16 y CD45RA, obteniéndose una suspensión celular de linfocitos T memoria CD45R0. La tercera separación permitió escindir las subpoblaciones de células memoria CLA+ y CLA– de dicha población de linfocitos T memoria.
Activación de los linfocitos T CLA+/CLA−Los linfocitos purificados se incubaron en RPMI 10% FCS y se activaron con anti-CD3 y anti-CD28, a razón de 500.000células/ml. Transcurridas 48h se obtuvieron los sobrenadantes de estos cultivos y se congelaron a −80°C hasta su posterior utilización para activar cultivos de queratinocitos. La IL-8 y el IFNγ se cuantificaron mediante un kit comercial de ELISA de R&D Sytems.
Análisis de la expresión génica de IL-8 mediante reacción en cadena de la polimerasa a tiempo realSe realizó la extracción de ARN de los linfocitos T CLA+ y CLA– de pacientes con psoriasis y controles sanos. Se utilizó el kit Gene Elute Mammalian (Sigma) y se procedió a la realización de cADN mediante kit High Capacity cDNA Reverse Transcription (Applied Biosystems) para el posterior análisis posreacción en cadena de la polimerasa a tiempo real (RT–PCR) mediante ABI7900HT (Applied Biosystems) y procesado de la información con el software de análisis SDS Ver. 1.0 (Applied Biosystems).
Los resultados se presentan normalizados para un house-keeping gene interno que es la GAPDH, según la fórmula 1,8−ΔCt * 10.000.
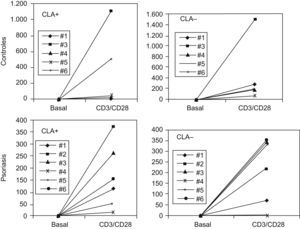
ResultadosProducción de IL-8 e IFNγ por los linfocitos T CLA+ y CLA– activadosEl estudio por ELISA de los sobrenadantes nos permitió estudiar la cantidad de proteína sintetizada de IFNγ, como control de la activación, e IL-8. Tanto los linfocitos T CLA+ como CLA– de controles sanos y de pacientes con psoriasis aumentaban significativamente la producción de IFNγ cuando eran activados mediante CD3/CD28, respecto los no activados (fig. 1), hecho que confirmaba la validez de la activación in vitro.
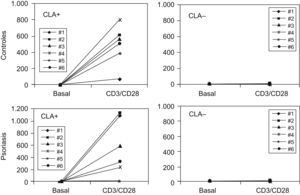
En cambio, cuando se estudió la producción de IL-8, únicamente se observó la presencia de esta citocina en los sobrenadantes de los linfocitos T CLA+ activados, tanto de controles sanos (media de 494pg/ml±254) como de psoriasis (media de 566.55pg/ml±464,414) (fig. 2).
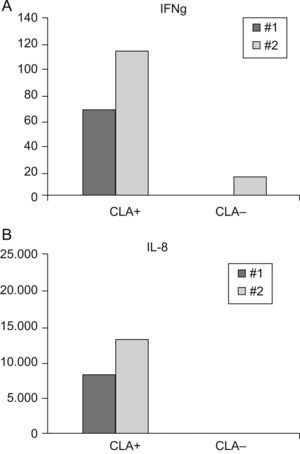
Reacción en cadena de la polimerasa a tiempo real de IL-8 e IFNγ en linfocitos T CLA+ y CLA–El estudio de expresión mediante RT-PCR de los linfocitos T CLA+ y CLA− de pacientes con psoriasis (n=2) mostró una expresión mayor del gen de IFNγ (96,51±26;) e IL-8 (29569,26±8584) en linfocitos T CLA+ respecto en linfocitos T CLA–(IFNγ 7,71±145; IL-8: 66,06±31,64) (fig. 3).
DiscusiónLos resultados de este estudio revelan por primera vez que los linfocitos T CLA+ circulantes, con capacidad de migrar a la piel, tanto de pacientes con psoriasis como de individuos sanos, producen niveles significativos de IL-8 al ser activados. El hecho de que la producción de IL-8 esté presente tanto en los linfocitos T CLA+ procedentes de pacientes con psoriasis como en los de sujetos sanos, apoya la relevancia de este mecanismo para la funcionalidad de la inflamación en la piel.
El reclutamiento de neutrófilos en las infecciones bacterianas y fúngicas es un proceso rápido e independiente de los linfocitos T. Los neutrófilos suelen ser una de las primeras células reclutadas en el sitio de la infección, a través de diferentes citocinas y quemocinas. En cambio, en las diferentes enfermedades inflamatorias ricas en neutrófilos, con posible formación de pústulas estériles, la fisiopatogenia es distinta. Tradicionalmente, el reclutamiento del neutrófilo se ha atribuido a la producción de IL-8/CXCL8 por el queratinocito. Sin embargo, recientemente, algunos autores han sugerido el papel adicional del linfocito T, la primera célula inflamatoria reclutada en la piel afecta12–14 en la síntesis de IL-8.
Es conocida la capacidad de producción de IL-8 por los linfocitos T en la enfermedad de Behçet y en la psoriasis pustulosa. Se ha demostrado por inmunohistoquímica que, aparte de los queratinocitos, las células T (CD4+⪢CD8+) infiltrantes expresan IL-8, así como CCR6 (a diferencia de la dermatitis atópica, en la que los linfocitos T no mostraban dicha positividad). Asimismo, se estudió la activación in vitro de clonas de linfocitos T aislados a partir de piel afecta de dichas enfermedades y se analizaron los sobrenadantes. Se objetivó que estas células secretaban IL-8, así como GM–CSF15. Hasta el momento no se ha estudiado el papel del linfocito T en el reclutamiento de neutrófilos en la psoriasis no pustulosa. Nuestros resultados confirman la producción de IL-8 por los linfocitos T en la psoriasis únicamente cuando son activados. Además, se observa una clara diferencia entre los linfocitos T CLA+ y los T CLA– en su capacidad de producir IL-8 tanto en psoriasis como en sujetos control, asociando la producción de IL-8 a la capacidad migratoria de linfocitos a la piel. De hecho, un estudio previo ya había apuntado una relación entre la migración de linfocitos T CLA+ a la piel y la IL-8 y su receptor CXCR2, lo cual indicaba una posible relación de la IL-8 con la fisiopatología de las células T con tropismo cutáneo16.
La pustulosis exantemática aguda generalizada (PEAG) es una de las enfermedades en que mejor se ha caracterizado el papel del linfocito T en la síntesis de IL-8. Se ha demostrado que no sólo el queratinocito, sino también el linfocito T específico de fármaco (tanto aislado de piel afecta de PEAG como de sangre periférica), es capaz de sintetizar IL-8 tras ser estimulado13,14,17. Schaerli et al han caracterizado este subgrupo de linfocitos T CXCL8+ en la PEAG. Observaron que los sobrenadantes de estos linfocitos activados eran intensamente quemoatrayentes para los neutrófilos, siendo la IL-8 el principal quimoatrayente y los receptores CXCR1 y CXCR2 los más probablemente implicados en el neutrófilo17. Además, se demostró que los neutrófilos tratados con medio condicionado a partir de linfocitos T CXCL8+ presentaban una mayor supervivencia, demostrándose por una tasa de apoptosis un 40% inferior. Dado que este subgrupo de linfocitos presentaba una elevada expresión del receptor del CCR6 se sugirió que dicho receptor de quimiocinas podía tener un papel importante en el reclutamiento de estas células en las fases iniciales de la inflamación cutánea. De hecho, y apoyando nuestros resultados, que indican un papel central de los linfocitos T productores de IL-8 en la migración a la piel, los linfocitos T CLA+ expresan niveles elevados de CCR6 en su supeficie18.
En conclusión, nuestros datos apoyan el concepto de que la producción de IL-8 por los linfocitos T CLA+ desempeña un papel importante en las dermatosis inflamatorias crónicas con infiltración neutrofílica estéril como la psoriasis. La migración temprana de linfocitos T CLA+ a la piel, con capacidad de producción de IL-8 y su posterior activación local generaría IL-8, que atraería los neutrófilos. Es posible que la combinación de IL-8 secretada por los linfocitos T, más otras citocinas/quemocinas derivadas de otras células residentes, como los queratinocitos, dé lugar al reclutamiento y a la supervivencia de los polimorfonucleares neutrófilos en la psoriasis no pustulosa.
FinanciaciónEstudio financiado con la Beca “Fundación Salud 2000”—Serono 2003–2006.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.