Sr. Director:
El linfoma plasmablástico (LP) constituye una variedad infrecuente de linfoma difuso de células B grandes, descrito inicialmente por Delecluse et al1 en 1997, y que suele localizarse en la cavidad oral en pacientes con infección por el virus de la inmunodeficiencia humana (VIH)2. De elevado grado de malignidad, se considera relacionado en su patogenia con el virus de Ebstein-Barr (VEB)3. Las células, de aspecto inmunoblástico, se caracterizan por perder antígenos de célula B madura como CD20, y adquirir marcadores de célula plasmática como CD38 o CD1384. El tratamiento incluye quimioterapia y terapia antirretroviral de alta eficacia, con escasas tasas de respuesta.
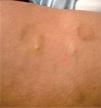
Se trata de una mujer de 43 años remitida a nuestra consulta para la valoración de lesiones nodulares dolorosas progresivas. En la exploración se objetivan nódulos subcutáneos de entre 1 y 3 cm en el tronco y los miembros inferiores (fig. 1) de consistencia firme, adheridos a planos profundos y con aspecto violáceo contusiforme de la piel suprayacente.
Como antecedentes destaca que la paciente es ex-usuaria de drogas por vía parenteral, y presenta infección por el VHB (antígeno de superficie positivo), VHC y VIH (estadio B3), por lo que se encuentra en tratamiento con metadona y antirretrovirales (tenofovir, lamivudina, ritonavir y atazanavir).
Se solicita analítica sanguínea, incluyendo hemograma, coagulación, bioquímica, serologías y marcadores tumorales, destacando niveles de CD4 de 377/μl, alteración del perfil hepático (AST 87 U/l, ALT 78 U/l, fosfatasa alcalina 177 U/l y GGT 89 ), elevación de la (β–2 microglobulina de 4.184,5 mg/l y confirmación serológica de infección por el VIH, virus de la hepatitis B (VHB), VHC, así como marcadores de infección pasada por VEB.
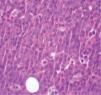
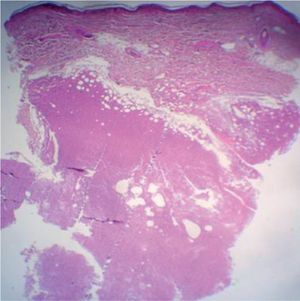
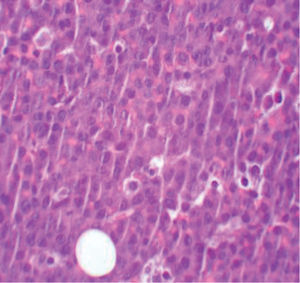
La biopsia revela la presencia de un infiltrado tumoral difuso hipodérmico, constituido por células linfoplasmocitoides con marcado pleomorfismo y numerosos macrófagos (figs. 2 y 3).
El estudio inmunohistoquímico muestra celularidad negativa para CD20, MUM-1, bcl6, CD3, TDT y HHV-8. Sin embargo, las células tumorales presentan positividad para marcadores de célula plasmática como el CD138, así como un elevado índice proliferativo y, mediante técnicas de hibridación in situ, se confirma la positividad para el marcador EBER del VEB. Se realiza así el diagnóstico de LP.
Se solicita un estudio de extensión incluyendo tomografía axial computarizada corporal total que confirma infiltración tumoral esplénica, ganglionar y renal. Se completa el estudio con un aspirado-biopsia de médula ósea que muestra plasmocitosis reactiva y normocelularidad de las tres series, descartándose infiltración tumoral. El linfoma se clasifica en estadio IV-A.
Se inicia quimioterapia con esquema CHOP y quimioterapia intratecal profiláctica. Sin embargo, la paciente fallece tras el primer ciclo por complicaciones del tratamiento.
El LP es, según la clasificación OMS-EORTC, un linfoma difuso de células B grandes con diferenciación terminal1,2. En 1997 Delecluse et al1 describieron una serie de 16 pacientes con LP oral. Quince de ellos eran varones, positivos para el VIH, y 11 homosexuales. Morfológicamente, el tumor presentaba características de linfoma difuso de células B grandes pero mostraba negatividad para el antígeno común leucocitario, así como para CD20. Por el contrario, destacaba la positividad para marcadores de células plasmáticas como CD38 o CD138, así como la detección en 9 de 15 pacientes de infección por el VEB mediante hibridación in situ con EBER.
Desde su reciente descripción inicial apenas se han publicado una cuarentena de casos, en su mayoría de localización oral en pacientes positivos para el VIH2, siendo los casos extraorales extremadamente infrecuentes4. Las localizaciones extraorales incluyen mucosa nasal, ganglios linfáticos, estómago, pulmón y piel, entre otras, y -aunque excepcionales- presentan las mismas características clínico-patológicas5–7. Recientemente, Tavora et al4 han revisado todos los casos de LP de localización extraoral publicados en la literatura inglesa.
Característicamente, el estudio anatomopatológico revela la proliferación de linfocitos B grandes, con morfología redonda u oval, citoplasma amplio y eosinófilo, y un núcleo excéntrico con nucléolo prominente. Suelen asociar macrófagos en «cielo estrellado» y presentan un elevado índice mitótico. Inmunohistoquímicamente se caracterizan por la positividad para marcadores de células plasmáticas como CD38 y CD138.
Además, se asocian en su patogenia al VEB (patrón de latencia tipo I), por lo que es frecuente hallar positividad para marcadores del virus como ARN-VEB, LMP o EBER3. Los estudios iniciales que implicaban también al HHV-8 en la patogenia del LP no han resultado concluyentes, considerándose en la actualidad una infección coincidente.
De elevado grado de malignidad, suelen presentar un pronóstico sombrío a pesar del tratamiento con quimioterapia, siendo el esquema CHOP el más empleado y con las mayores tasas de respuesta. Recientemente se ha comunicado un caso de remisión completa de un LP cutáneo en un paciente con infección por el VIH con quimioterapia tipo CHOP asociada con tratamiento antirretroviral de alta eficacia7,8.
Finalmente, estudios recientes apuntan que los linfomas de células B grandes en una fase terminal de diferenciación podrían estar constituidos por un número mayor de entidades de lo que inicialmente se había pensado, con diferentes características clinicopatológicas y fenotípicas incluyendo, entre otros, el LPB de tipo «mucosa oral», el LPB con diferenciación plasmacítica o aquellos secundarios a mieloma múltiple o plasmacitomas9.