El porocarcinoma ecrino (PCE) es la neoplasia maligna más frecuente de la glándula ecrina y se origina en la porción ductal de la misma1. Fue descrito por Pinkus y Mehregan en el año 19632. Es un tumor raro que representa entre el 0,005 y el 0,01% de todos los tumores cutáneos3. La mayoría surge de novo, aunque entre el 18 y el 50% de los casos publicados se desarrollan junto a un poroma ecrino previo4. Suele afectar a personas mayores de 50 años, sin un predominio de sexo5. Se localiza con una mayor frecuencia en las extremidades inferiores, en la cabeza y el cuello. Su presentación clínica es variada y simula otros tumores cutáneos. Se han postulado como factores predisponentes la exposición solar crónica, la exposición a agentes químicos o la inmunosupresión5. En cuanto al pronóstico, la tasa de recidiva local tras el tratamiento quirúrgico es de un 20%, la tasa de metástasis en ganglios linfáticos regionales es del 20% y la tasa de metástasis a distancia es de un 11%6.
Se realizó un estudio retrospectivo, descriptivo, de casos de PCE diagnosticados entre 2014 y 2018 en el Complejo Asistencial Universitario de León. Se revisaron las historias clínicas de los pacientes y las láminas de biopsia de cada caso, caracterizando la epidemiología, el curso clínico, los factores histológicos de mal pronóstico, la inmunohistoquímica y la evolución de estos pacientes. Se utilizó estadística descriptiva para el tratamiento de los datos.
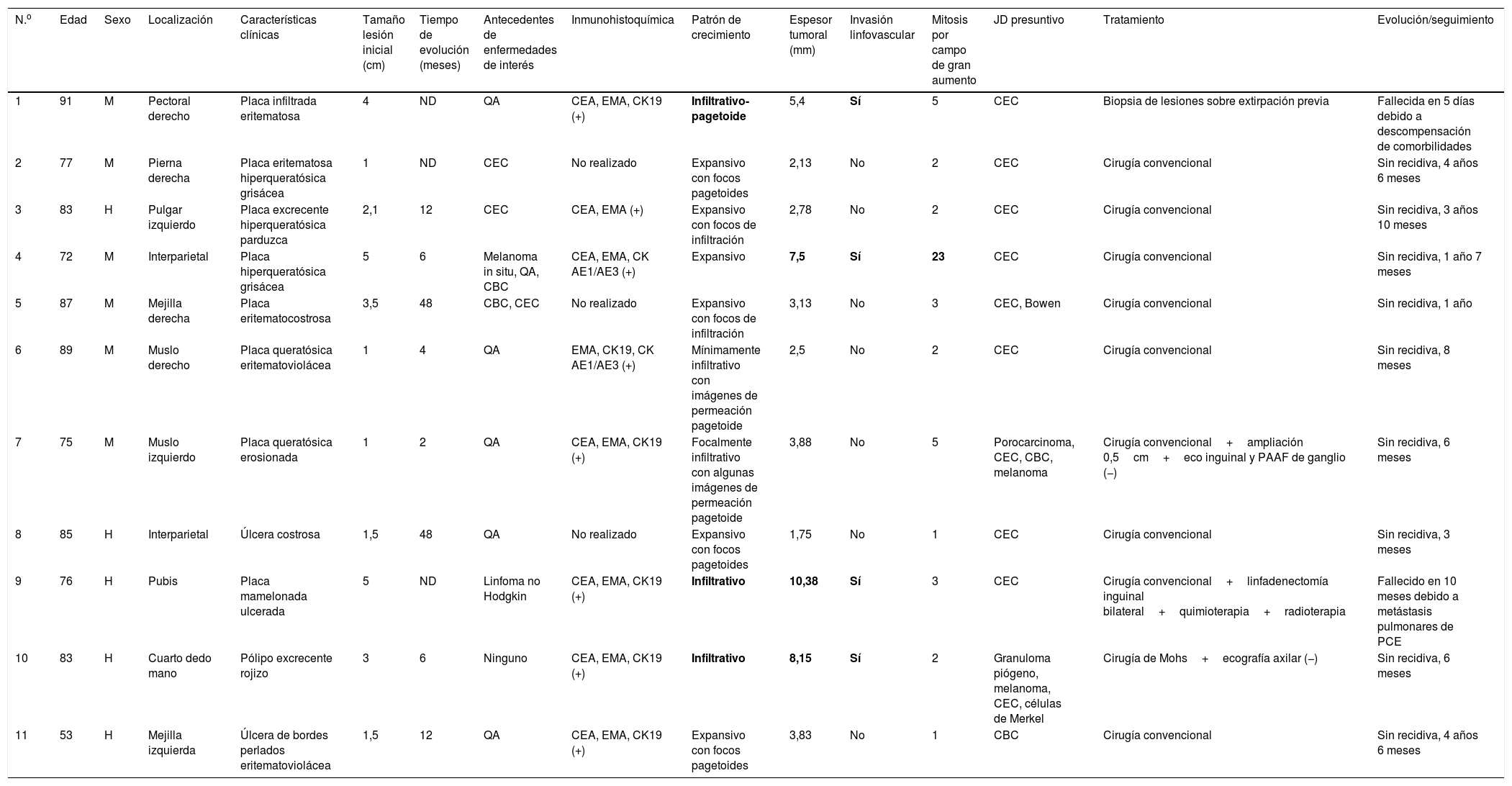
Se identificaron 11 casos de PCE, cuyas características clínico-histológicas se muestran en la tabla 1. La mediana de edad de presentación fue de 83 años, con un rango de 53 a 91 años; 5 de los pacientes eran hombres y 6 mujeres.
Características clínicas, histológicas, tratamiento y evolución de los pacientes con un porocarcinoma ecrino
| N.o | Edad | Sexo | Localización | Características clínicas | Tamaño lesión inicial (cm) | Tiempo de evolución (meses) | Antecedentes de enfermedades de interés | Inmunohistoquímica | Patrón de crecimiento | Espesor tumoral (mm) | Invasión linfovascular | Mitosis por campo de gran aumento | JD presuntivo | Tratamiento | Evolución/seguimiento |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 91 | M | Pectoral derecho | Placa infiltrada eritematosa | 4 | ND | QA | CEA, EMA, CK19 (+) | Infiltrativo-pagetoide | 5,4 | Sí | 5 | CEC | Biopsia de lesiones sobre extirpación previa | Fallecida en 5 días debido a descompensación de comorbilidades |
| 2 | 77 | M | Pierna derecha | Placa eritematosa hiperqueratósica grisácea | 1 | ND | CEC | No realizado | Expansivo con focos pagetoides | 2,13 | No | 2 | CEC | Cirugía convencional | Sin recidiva, 4 años 6 meses |
| 3 | 83 | H | Pulgar izquierdo | Placa excrecente hiperqueratósica parduzca | 2,1 | 12 | CEC | CEA, EMA (+) | Expansivo con focos de infiltración | 2,78 | No | 2 | CEC | Cirugía convencional | Sin recidiva, 3 años 10 meses |
| 4 | 72 | M | Interparietal | Placa hiperqueratósica grisácea | 5 | 6 | Melanoma in situ, QA, CBC | CEA, EMA, CK AE1/AE3 (+) | Expansivo | 7,5 | Sí | 23 | CEC | Cirugía convencional | Sin recidiva, 1 año 7 meses |
| 5 | 87 | M | Mejilla derecha | Placa eritematocostrosa | 3,5 | 48 | CBC, CEC | No realizado | Expansivo con focos de infiltración | 3,13 | No | 3 | CEC, Bowen | Cirugía convencional | Sin recidiva, 1 año |
| 6 | 89 | M | Muslo derecho | Placa queratósica eritematoviolácea | 1 | 4 | QA | EMA, CK19, CK AE1/AE3 (+) | Mínimamente infiltrativo con imágenes de permeación pagetoide | 2,5 | No | 2 | CEC | Cirugía convencional | Sin recidiva, 8 meses |
| 7 | 75 | M | Muslo izquierdo | Placa queratósica erosionada | 1 | 2 | QA | CEA, EMA, CK19 (+) | Focalmente infiltrativo con algunas imágenes de permeación pagetoide | 3,88 | No | 5 | Porocarcinoma, CEC, CBC, melanoma | Cirugía convencional+ampliación 0,5cm+eco inguinal y PAAF de ganglio (−) | Sin recidiva, 6 meses |
| 8 | 85 | H | Interparietal | Úlcera costrosa | 1,5 | 48 | QA | No realizado | Expansivo con focos pagetoides | 1,75 | No | 1 | CEC | Cirugía convencional | Sin recidiva, 3 meses |
| 9 | 76 | H | Pubis | Placa mamelonada ulcerada | 5 | ND | Linfoma no Hodgkin | CEA, EMA, CK19 (+) | Infiltrativo | 10,38 | Sí | 3 | CEC | Cirugía convencional+linfadenectomía inguinal bilateral+quimioterapia+radioterapia | Fallecido en 10 meses debido a metástasis pulmonares de PCE |
| 10 | 83 | H | Cuarto dedo mano | Pólipo excrecente rojizo | 3 | 6 | Ninguno | CEA, EMA, CK19 (+) | Infiltrativo | 8,15 | Sí | 2 | Granuloma piógeno, melanoma, CEC, células de Merkel | Cirugía de Mohs+ecografía axilar (−) | Sin recidiva, 6 meses |
| 11 | 53 | H | Mejilla izquierda | Úlcera de bordes perlados eritematoviolácea | 1,5 | 12 | QA | CEA, EMA, CK19 (+) | Expansivo con focos pagetoides | 3,83 | No | 1 | CBC | Cirugía convencional | Sin recidiva, 4 años 6 meses |
CBC: carcinoma basocelular; CEC: carcinoma espinocelular; H: hombre; JD: juicio diagnóstico; M: mujer; ND: no determinado; PAAF: punción aspiración con aguja fina; PCE: porocarcinoma ecrino; QA: queratosis actínicas.
Datos de alto riesgo resaltados en negrita.
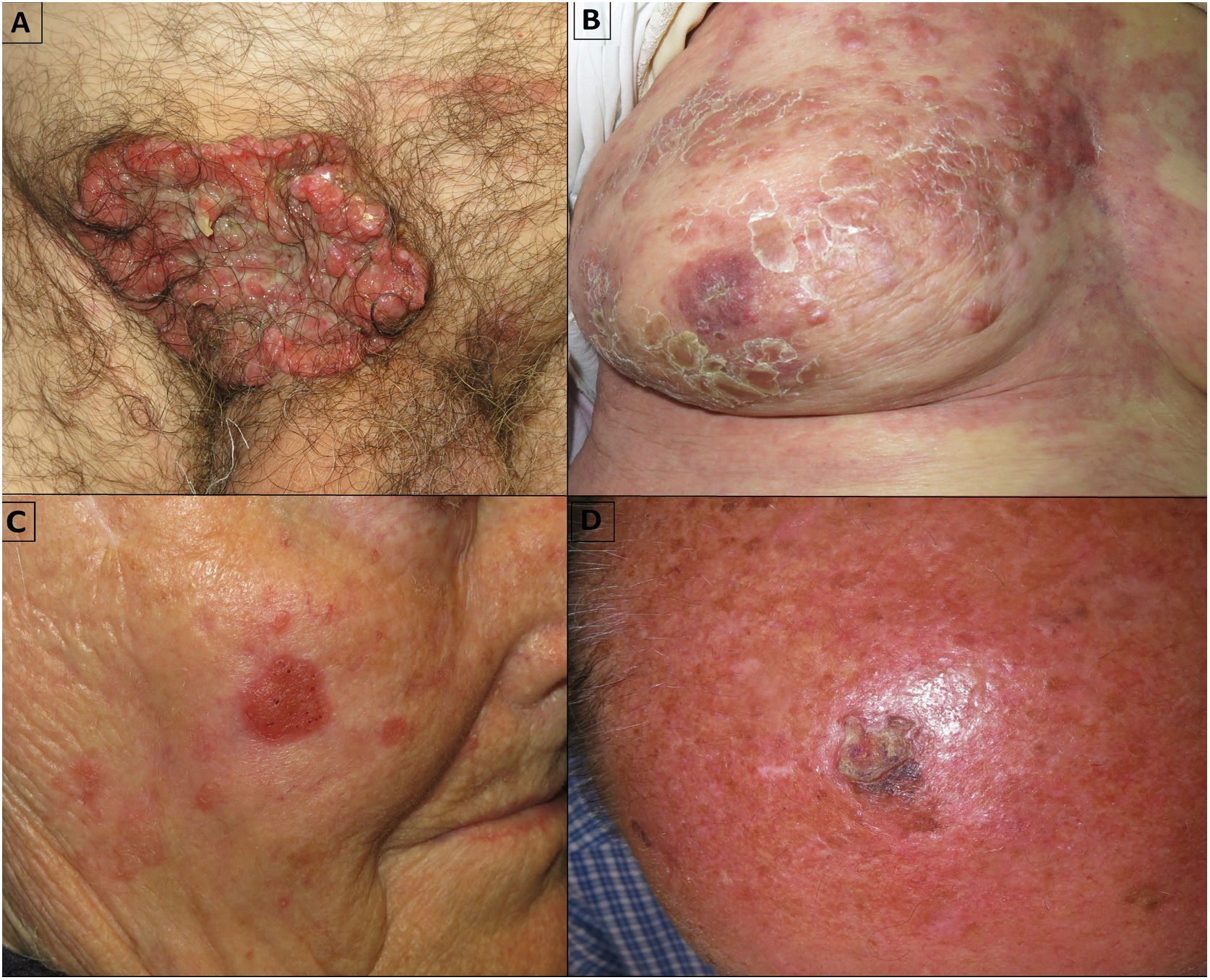
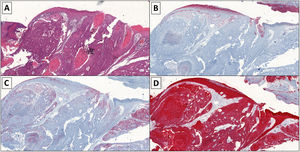
Un 81% tenía antecedentes de tumores cutáneos: 9 tuvieron queratosis actínicas, 2 carcinoma basocelular, 3 carcinoma espinocelular (CEC) y un paciente presentó un melanoma previo. Las localizaciones más frecuentes fueron las extremidades inferiores y la cabeza. El tiempo mediano de evolución de la lesión fue de 17,2 meses (intervalo: 2-48 meses). Su presentación clínica fue variada (fig. 1 A-D), aunque la más frecuente fue en forma de placa eritematosa hiperqueratósica.
El diagnóstico de sospecha más frecuente fue CEC; otros diagnósticos diferenciales fueron granuloma piógeno, melanoma o carcinoma basocelular.
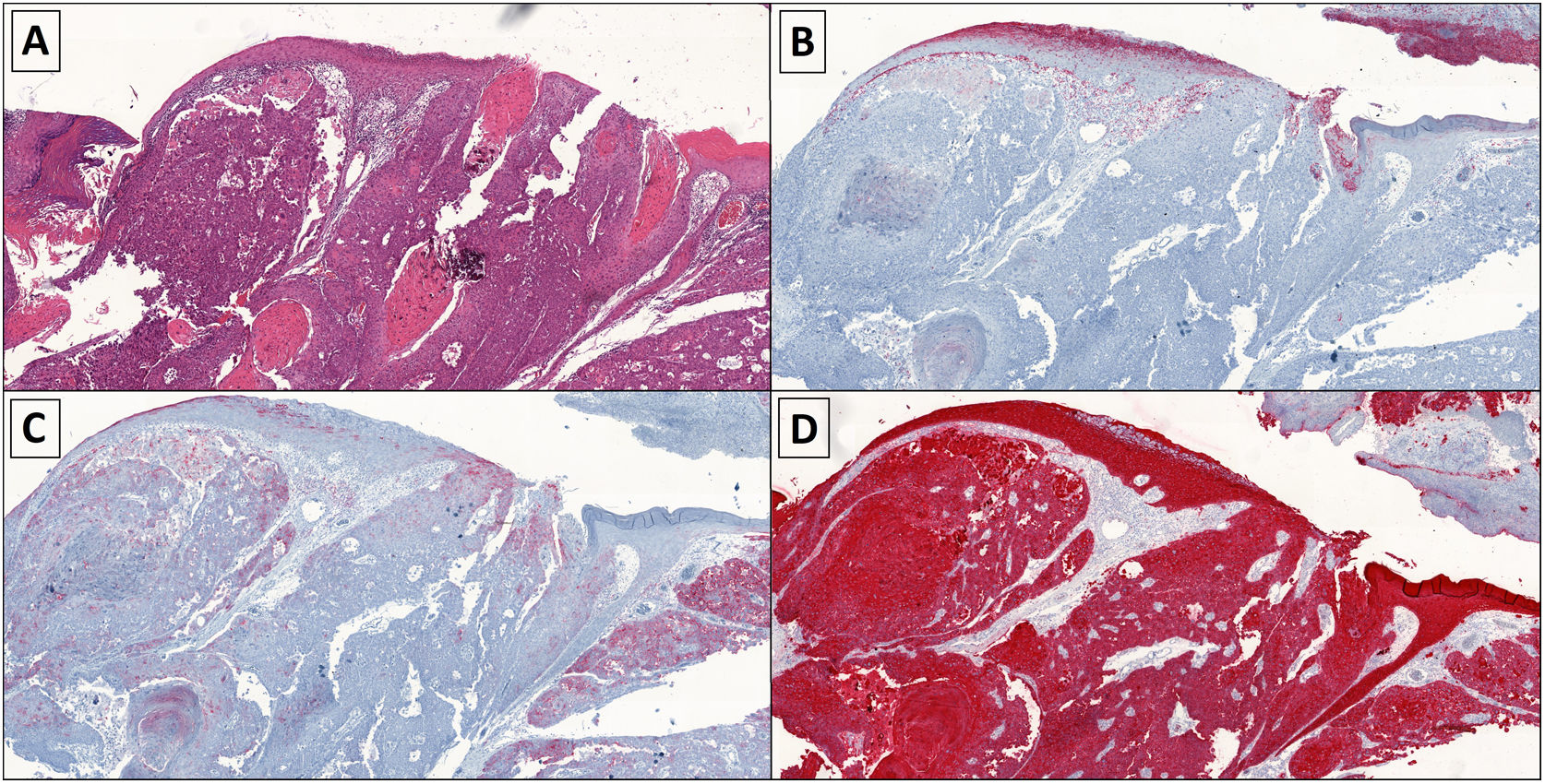
En la histopatología, 3 casos presentaron un patrón claramente infiltrativo. El espesor tumoral mediano fue de 4,68mm. Un caso tuvo más de 14 mitosis por campo de gran aumento. En 8 casos fue necesario realizar un estudio inmunohistoquímico adicional (CEA, EMA y CK AE1/AE3) (tabla 1; fig. 2 A-D).
A) H/E, ×4, se evidencian células grandes con núcleos vesiculosos, nucléolo visible y citoplasma amplio, atipias celulares y numerosas mitosis atípicas. Se disponen en trabéculas, cordones celulares y nidos. Áreas de necrosis tumoral. B) IHQ, ×4, CEA positividad débil. C) IHQ, ×4, EMA positivo. D) IHQ, ×4, citoqueratina AE1-AE3 positivo.
Cuatro pacientes cumplían criterios de PCE de alto riesgo (1, 4, 9 y 10 de la tabla 1). La paciente 1, en el momento de la consulta en nuestro centro, presentaba metástasis cutáneas extensas (fig. 1B), adyacentes a la cicatriz de un PCE extirpado un mes antes en otro centro. La paciente rechazó la realización del estudio de extensión y de terapias adicionales por su edad y comorbilidades, y falleció en menos de una semana por una descompensación de estas. El paciente 9 presentó un tumor ulcerado de gran tamaño en el pubis (fig. 1A); la biopsia inicial fue compatible con un CEC. Se trató con una exéresis tumoral amplia y una linfadenectomía inguinal bilateral. Dos meses después presentó una metástasis de PCE sobre la cicatriz quirúrgica, desarrolló metástasis pulmonares y, a pesar del tratamiento, falleció. El paciente 10 fue tratado con cirugía de Mohs y BSGC negativa y el paciente 4 fue tratado mediante cirugía convencional, sin recidiva hasta la fecha.
El tratamiento de los pacientes con tumor localizado fue la cirugía convencional; no han presentado recidivas tras una mediana de seguimiento de 22,6 meses (intervalo: 3-53).
En nuestra serie, las características clínico-histológicas fueron superponibles a lo descrito en la literatura7, excepto la mediana de edad, que fue mayor en nuestro estudio y fuera del rango encontrado en la literatura, donde es de 65 años (rango: 50-80). El diagnóstico definitivo se estableció por histología típica y tinciones inmunohistoquímicas compatibles8 (fig. 2 A?D).
La histología, además de aportar el diagnóstico de certeza, contiene información pronóstica útil para el manejo del paciente. Robson et al. determinaron que los patrones de crecimiento infiltrativo y/o pagetoide se asociaban a un mayor riesgo de recidiva local. Por otro lado, los tumores que presentan un espesor mayor de 7mm, un recuento elevado de mitosis (>14 mitosis por campo de gran aumento) y la presencia de invasión linfovascular se han asociado a un mayor riesgo de metástasis a distancia9. Algunos autores, como Belin et al., proponen realizar cirugía de Mohs en tumores con patrones infiltrativos y/o pagetoide10. Otros proponen realizar la BSGC en los tumores de alto riesgo6. Sin embargo, existe poca evidencia dada la escasez de casos documentados.
A pesar de ser un tumor raro, es posible esperar un aumento en la incidencia, por el envejecimiento de la población. Debido a su tendencia a la recidiva local y su potencial metastásico, es importante realizar un diagnóstico y tratamiento precoces. A la hora de proponer protocolos de tratamiento, probablemente sea necesario establecer una serie de factores pronósticos clínicos e histológicos que definan el PCE «de alto riesgo», similares a los existentes para otros tumores como el CEC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.