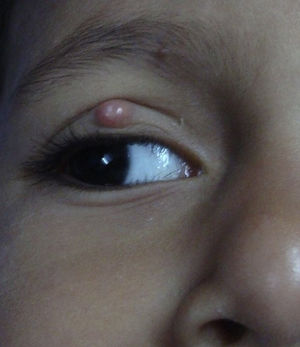
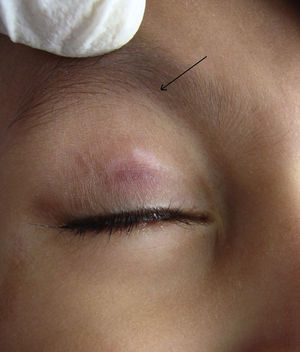
El molusco contagioso (MC) es una infección viral cutánea causada por el virus del molusco contagioso, el cual se observará con frecuencia en niños y en pacientes inmunodeprimidos. Se presenta como pápulas individuales o múltiples, blanquecinas o de color piel, de 1 a 5mm de diámetro y con una umbilicación central típica1. Las diversas modalidades de tratamiento disponibles para tratar la infección por MC incluyen el legrado, la crioterapia, la extracción con aguja y los tratamientos tópicos como la cantaridina, el hidróxido de potasio, el ácido salicílico, los retinoides, el nitrato de plata y los fenoles. La inmunoterapia con imiquimod, óxido nítrico y cimetidina también se han utilizado con una eficacia variable1,2.
La cantaridina es un terpenoide obtenido de un coleóptero que tiene la capacidad de formar ampollas por acantólisis, las que curarán sin dejar cicatrices; de ahí que tenga eficacia en las lesiones por MC2. Sin embargo, los datos acerca de su uso en los MC faciales son escasos, ya que en la actualidad su utilización en dicha localización no está recomendada3.
Se realizó un estudio de tipo intervencionista, prospectivo, abierto, no controlado, con la finalidad de evaluar la eficacia de la cantaridina en el tratamiento del MC facial sin tratamiento previo en niños ≤10 años. Se excluyeron los pacientes con infecciones bacterianas secundarias, inmunodeficiencias subyacentes e hipersensibilidad conocida a la cantaridina. En todos los pacientes se realizó un hemograma completo, determinación de la glucemia, examen de orina y anticuerpos contra el VIH. Los padres fueron informados y se obtuvo su consentimiento por escrito.
Cada lesión fue tratada con una solución de cantaridina al 0,7% (CANTHACUR®, Paladin Labs Inc.) utilizando un aplicador que tenía la punta de algodón. Se indicó a los pacientes que lavaran las áreas tratadas solo después de 4h. Se prescribió un jarabe de levocetirizina y pomada de mupirocina durante 5 días. La aplicación se repitió con un intervalo de 2 semanas, hasta en un máximo de 5 dosis. Se recomendó a los participantes y/o sus padres realizar una adecuada higiene de manos, evitar compartir ropa o artículos personales y no rascarse.
En cada visita, se evaluaron la respuesta clínica y los eventos adversos. Se contó el número de lesiones al inicio y al final del tratamiento. La respuesta al final del tratamiento se clasificó como completa (eliminación completa de las lesiones y no aparición de nuevas lesiones), moderada (eliminación de todas las lesiones tratadas, pero persistencia o aparición de nuevas lesiones), leve (eliminación de pocas, pero no todas las lesiones tratadas y persistencia de nuevas lesiones) y ninguna (sin respuesta).
Las diferencias entre las medias de las lesiones antes y después del tratamiento se compararon mediante la prueba de la t de Student para muestras emparejadas. El análisis estadístico se realizó utilizando el software de GraphPad Prism v.7.0.
Durante los 6 meses de reclutamiento, 71 de los pacientes que acudieron a la consulta cumplieron con los criterios de inclusión y no presentaban ningún criterio de exclusión. Sesenta y siete pacientes dieron su consentimiento para participar en el estudio, de los cuales 4 se perdieron durante el seguimiento. Tras una conversación telefónica con cada uno de ellos, se confirmó que los abandonos del estudio no tenían ninguna relación con los eventos adversos causados por la cantaridina. Por lo tanto, la población de estudio estuvo compuesta por un total de 63 pacientes, 45 varones y 18 mujeres (24%), con una mediana de edad de 6 años (rango: 1-10). La mediana de duración de la enfermedad fue de 4 meses (rango: de 1 a 10 meses). Sesenta pacientes (95%), presentaron una respuesta completa. En estos pacientes las lesiones cicatrizaron por completo con la formación de costras, las que se oscurecieron tras una semana (figs. 1 y 2). Cada uno de los pacientes presentó una respuesta moderada y una respuesta leve, mientras que un paciente no respondió. El recuento medio de las lesiones al inicio del estudio fue de 11,7±4,3 y después de 5 dosis (5 semanas) fue de 1,9±0,7 (p<0,001).
Como era de esperarse, 56 (90%) de los niños tratados presentaron ampollas en las áreas tratadas, las que se rompieron tras 3-4 días y luego presentaron una curación con una recuperación sin incidentes. Diez de los pacientes se quejaron de haber tenido un dolor de grado leve a moderado. Tres pacientes desarrollaron una infección bacteriana secundaria en los sitios tratados que requirieron antibióticos sistémicos y tópicos de corta duración. Dos pacientes desarrollaron hipo/despigmentación en el sitio tratado que curó sin dejar secuelas.
Se evidenció una buena aceptación de la terapia con cantaridina y la ansiedad de los pacientes en las visitas de seguimiento fue mínima. De manera llamativa, no se observaron cicatrices residuales después del tratamiento, efecto secundario que suele ser causa de preocupación cuando se utiliza la cantaridina en el área facial.
Debido a su naturaleza indolora, la cantaridina presentó alta eficacia y buena tolerabilidad, lo que a su vez conllevó a un grado de satisfacción del 60-90% entre los padres y del 92% entre los dermatólogos3. En diversos estudios se ha estudiado la eficacia de la cantaridina en el tratamiento del MC, pero en ninguno de ellos se ha analizado su uso en el área facial. Hasta la actualidad, se había realizado un único estudio de tipo retrospectivo en el cual se buscaba determinar la eficacia de la cantaridina en la infección por el MC localizado en área facial, estudio que demostró buenos resultados (tabla 1).
Las ventajas del uso de la cantaridina incluyen un inicio de acción rápido, la ausencia de dolor en el momento de la aplicación y, debido a que no hay traumatismo, un sangrado inexistente. Esto justifica las visitas de seguimiento y el tratamiento subsecuentes de los pacientes. Dentro de las limitaciones de nuestro estudio se puede incluir un pequeño tamaño muestral, la ausencia de aleatorización y la falta de controles.
En conclusión, cuando se aplica la cantaridina de manera adecuada y controlada, combinada con una correcta educación del paciente y de los padres, esta terapia será segura y eficaz en los MC infantiles que afectan la zona facial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.