El porocarcinoma ecrino es un tumor anexial cutáneo maligno poco frecuente, que deriva de la porción ductal de las glándulas sudoríparas. Predomina en pacientes de edad avanzada, pudiendo adoptar diversas presentaciones clínicas. El estudio histológico confirma el diagnóstico y establece factores pronósticos relevantes a la hora de decidir el tratamiento. El curso evolutivo es lento, pero su pronóstico es sombrío cuando aparecen metástasis linfáticas o viscerales. Presentamos 7 pacientes diagnosticados de porocarcinoma ecrino, y describimos los aspectos epidemiológicos, clínicos, histopatológicos y los datos relacionados con el tratamiento de cada uno de ellos. Comparamos los datos obtenidos con las mayores series de casos publicadas, obteniendo similares resultados. Ante la ausencia de algoritmos terapéuticos protocolizados se propone un esquema de tratamiento basado en la literatura revisada y la experiencia personal con nuestra serie, que tiene como ejes centrales los factores pronósticos histológicos y la biopsia selectiva de ganglio centinela.
Eccrine porocarcinoma is a rare, malignant cutaneous adnexal tumor that arises from the ducts of sweat glands. Found mainly in patients of advanced age, this tumor has diverse clinical presentations. Histology confirms the diagnosis, detects features relevant to prognosis, and guides treatment. Growth is slow, but the prognosis is poor if the tumor metastasizes to lymph nodes or visceral organs. We report 7 cases of eccrine porocarcinoma, describing patient characteristics, the clinical and histopathologic features of the tumors, and treatments used. Our observations were similar to those of other published case series. Given the lack of therapeutic algorithms or protocols for this carcinoma, we propose a decision-making schema based on our review of the literature and our experience with this case series. The algorithm centers on sentinel lymph node biopsy and histologic features.
El porocarcinoma ecrino (PE) fue descrito por Pinkus y Mehregan en 19631, pero fueron Mishima y Morioka quienes introdujeron el término en 19672. Se trata de una neoplasia poco frecuente (0,005-0,01% de los tumores malignos cutáneos)3, que aparece preferentemente en las extremidades inferiores4–6 y en la cabeza/cuello7–9 de pacientes de edad avanzada10, sin clara predilección por el sexo5,7. Puede adoptar múltiples presentaciones clínicas, considerándose un gran simulador. Además de confirmar el diagnóstico, el estudio histológico establece los factores pronósticos que determinarán la actitud terapéutica4. La mayoría de las publicaciones son casos aislados o series cortas, lo que dificulta la realización de una guía de tratamiento estandarizada más allá de la exéresis quirúrgica. Su pronóstico es sombrío cuando existe afectación metastásica11.
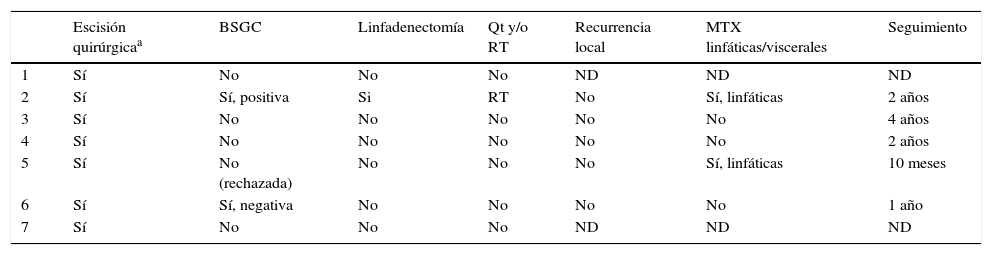
Casos clínicosSe presentan 7 pacientes diagnosticados de PE, evaluándose sus características demográficas y clínicas (tabla 1), histopatológicas (tabla 2) y los datos relacionados con el tratamiento y la evolución (tabla 3).
Aspectos demográficos y clínicos más relevantes de la serie
| Edada | Sexo | Localización | Tamañob | Clínica | Cambiosc | Evoluciónd | |
|---|---|---|---|---|---|---|---|
| 1 | 80 | M | ESD | 2 | Pápula queratósica | No | ND |
| 2 | 39 | V | EID | 1,2 | Pápula rosada | Sí | 6 |
| 3 | 75 | V | EII | 0,7 | Pápula pigmentada | No | ND |
| 4 | 65 | V | ESD | 1 | Pápula rosada | Sí | 4 |
| 5 | 91 | M | Tronco | 2 | Nódulo erosivo pigmentado | Sí | 60 |
| 6 | 88 | V | Cuello | 1,8 | Nódulo erosivo rosado | Sí | 2 |
| 7 | 47 | V | EID | 1,5 | Pápula rosada | Sí | 3 |
EID: extremidad inferior derecha; EII: extremidad inferior izquierda; ESD: extremidad superior derecha; M: mujer; ND: no disponible; V: varón.
Aspectos histológicos más relevantes de la serie
| Espesor tumorala | Patrón crecimiento | Extensión intraepidérmica | Necrosis (C o D) | Componente benigno | Mitosisb | Invasión linfovascular | IQ | ||
|---|---|---|---|---|---|---|---|---|---|
| CEA | EMA | ||||||||
| 1 | 5,12 | EXP | No | No | No | 1 | No | + | + |
| 2 | 7 | INF | No | No | No | 4 | No | + | + |
| 3 | 6,7 | EXP | No | C | Sí | 1 | No | ND | ND |
| 4 | In situ | NP | No | No | No | 1 | No | + | + |
| 5 | 5 | INF | Sí | No | No | 18 | Sí | + | + |
| 6 | 3,1 | EXP | No | No | No | 12 | No | + | + |
| 7 | 6 | EXP | No | C | No | 3 | No | ND | ND |
C: comedonecrosis; D: necrosis difusa; EXP: expansivo; INF: infiltrativo; IQ: inmunohistoquímica; ND: no disponible; NP: no procede.
Tratamiento y evolución de los pacientes de la serie
| Escisión quirúrgicaa | BSGC | Linfadenectomía | Qt y/o RT | Recurrencia local | MTX linfáticas/viscerales | Seguimiento | |
|---|---|---|---|---|---|---|---|
| 1 | Sí | No | No | No | ND | ND | ND |
| 2 | Sí | Sí, positiva | Si | RT | No | Sí, linfáticas | 2 años |
| 3 | Sí | No | No | No | No | No | 4 años |
| 4 | Sí | No | No | No | No | No | 2 años |
| 5 | Sí | No (rechazada) | No | No | No | Sí, linfáticas | 10 meses |
| 6 | Sí | Sí, negativa | No | No | No | No | 1 año |
| 7 | Sí | No | No | No | ND | ND | ND |
BSGC: biopsia selectiva de ganglio centinela; MTX: metástasis; ND: no disponible; QT: quimioterapia; RT: radioterapia.
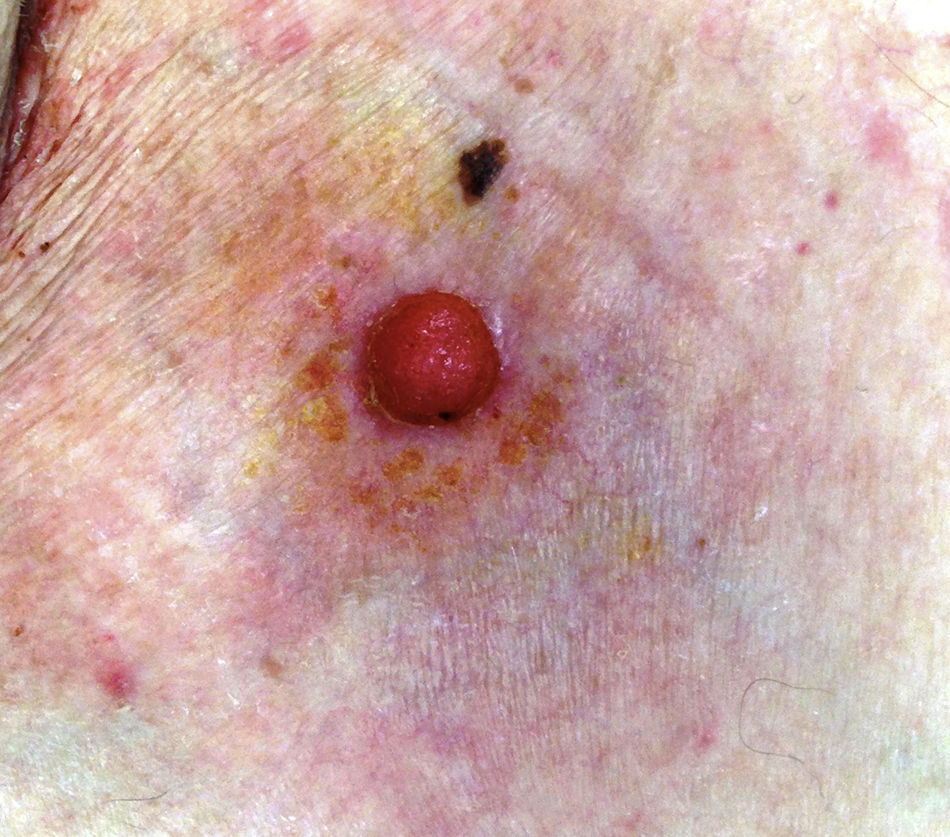
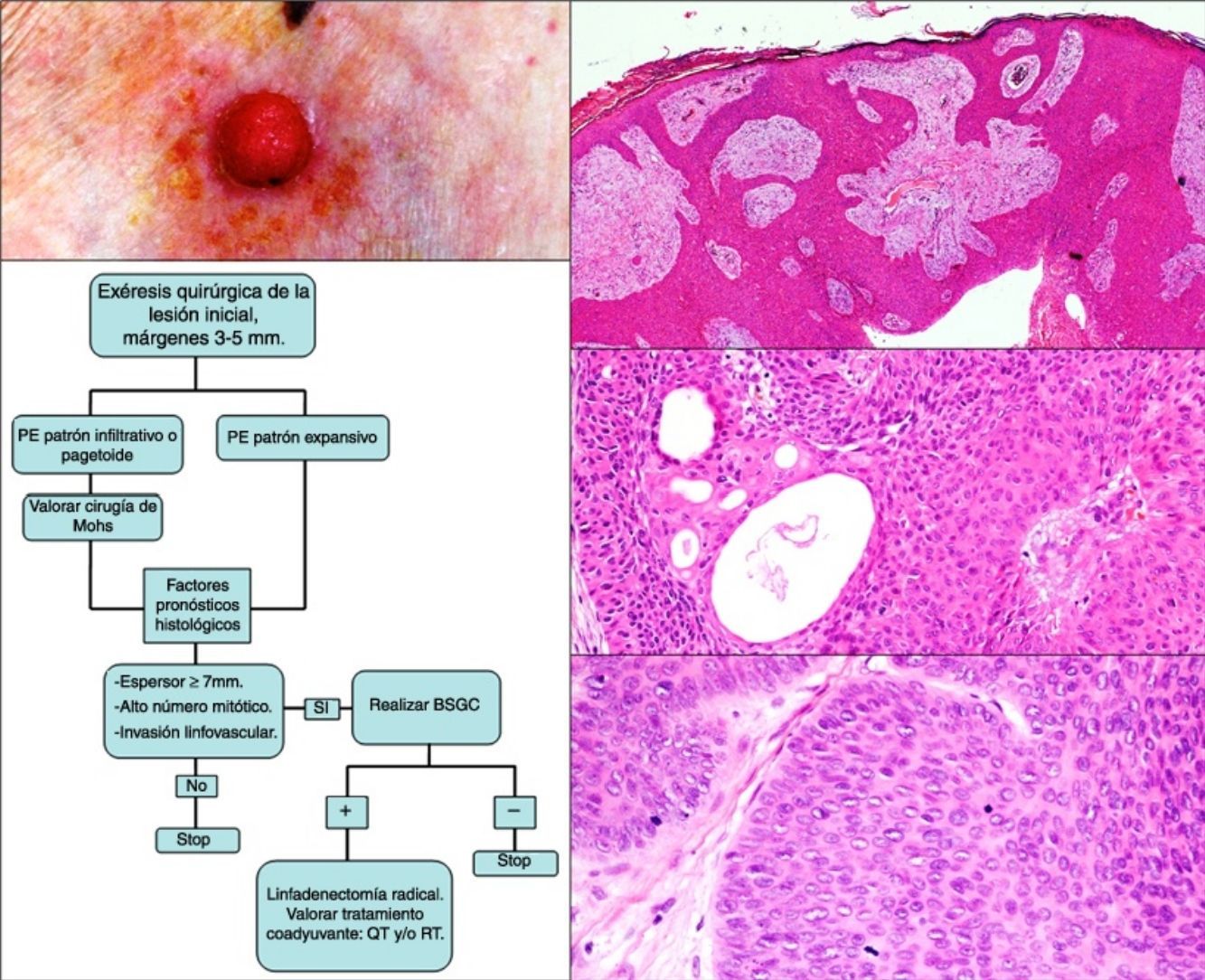
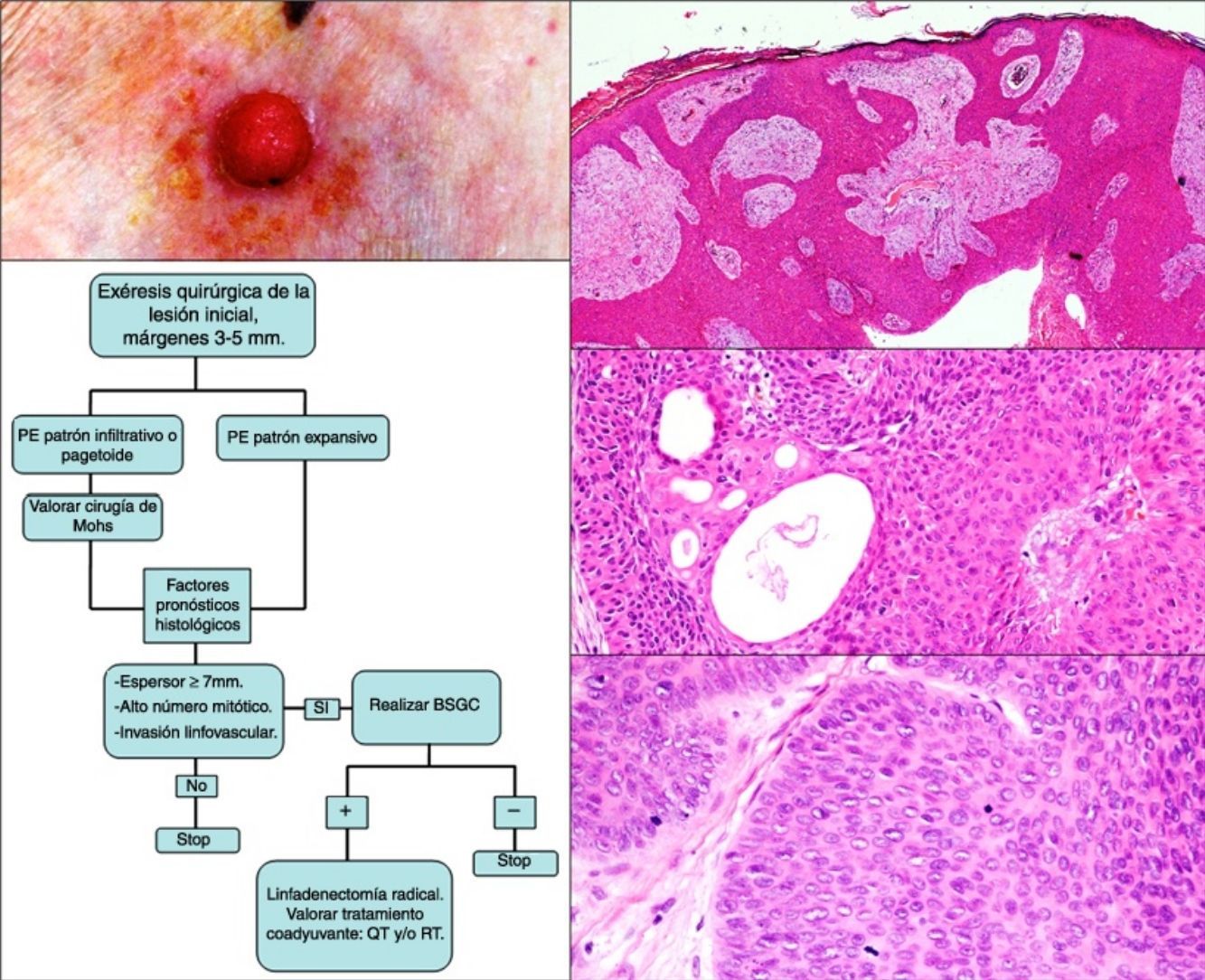
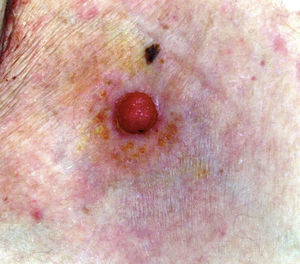
La edad media de la serie fue de 69 años (rango: 39-91; mediana: 75). El 71% fueron varones (5/7) y el 29% mujeres (2/7). La localización más frecuente fueron las extremidades inferiores (3/7; 43%). En todos los casos el tamaño fue igual o inferior a 2cm (media 1,46; mediana 1,5). El patrón clínico más repetido fue el papular rosado (3/7; 43% [fig. 1]). El 71% (5/7) de los pacientes referían cambios recientes en las lesiones. El tiempo de evolución osciló entre 2 y 60 años (media 15, mediana 4). Solo en un caso se sospechó PE (14%).
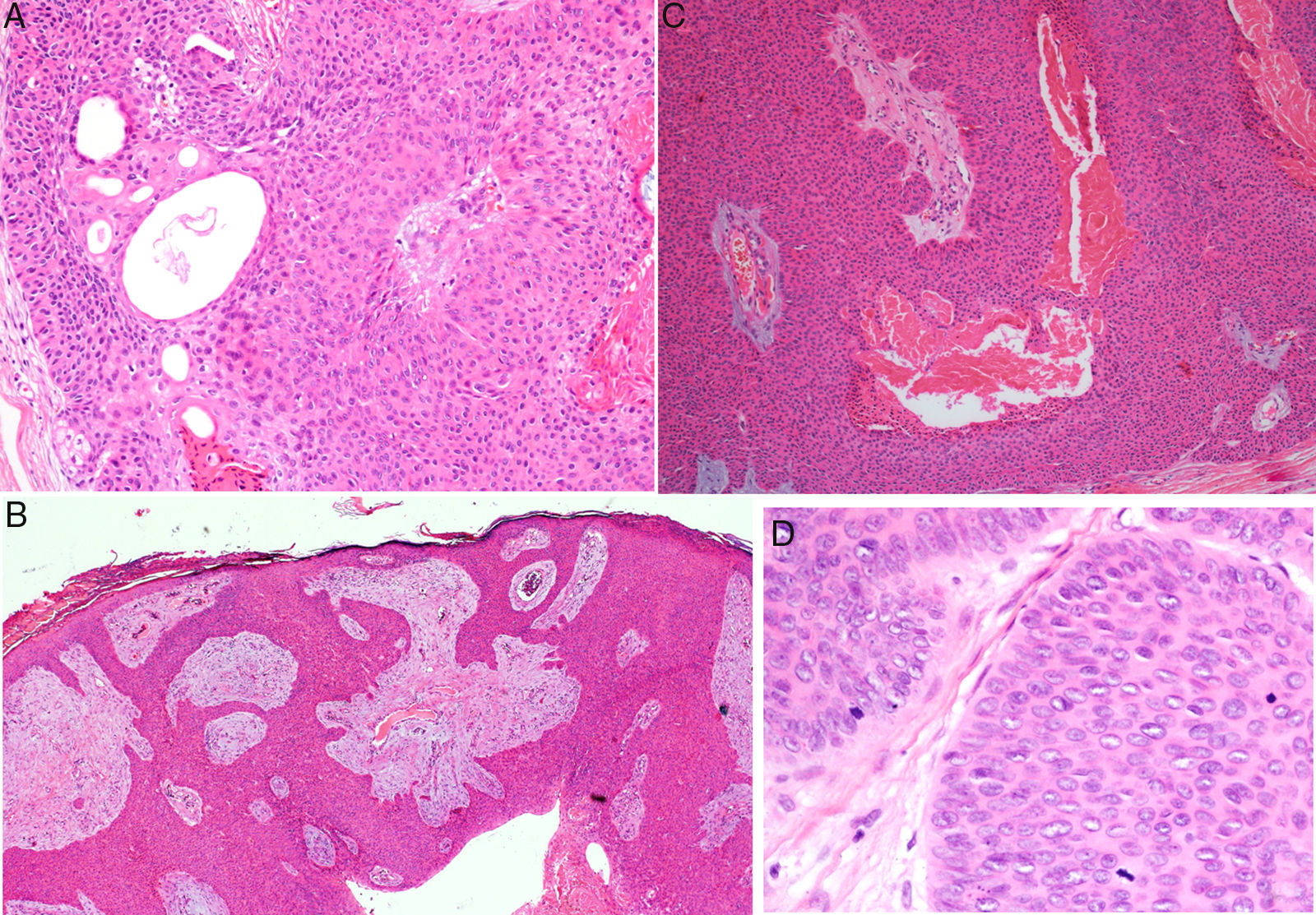
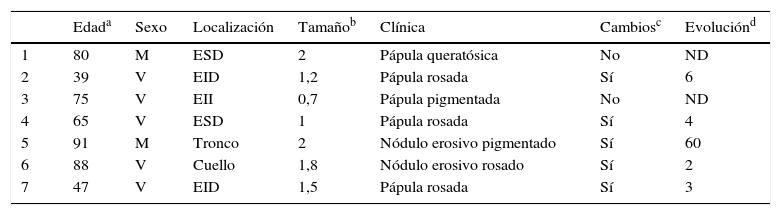
El estudio histológico permitió establecer el diagnóstico de PE en todos los casos, observándose cordones anchos anastomosados, columnas sólidas y nidos de células basaloides poligonales con núcleos hipercromáticos, nucléolo prominente y figuras de mitosis, con extensión desde la epidermis hacia la dermis papilar y reticular, invadiendo el estroma de manera asimétrica; acompañados de estructuras ductales dermales (luces intracitoplasmáticas o ductos maduros [fig. 2a]). Solo un caso fue PE in situ (14%), el resto presentaron un espesor tumoral medio de 5,49mm (rango 3,1-7; mediana 5,56). El patrón de crecimiento más frecuente fue el expansivo (4/7; 57%; fig. 2b), en el que los cordones de células neoplásicas avanzan «empujando» la dermis, con límites bien definidos. El patrón infiltrativo se presentó en el 43% (3/7) de los casos, con nidos tumorales mal delimitados introduciéndose en la dermis e incluso en la hipodermis. Se describió extensión intraepidérmica en un paciente (14%); presencia de necrosis en 2 (29% [fig. 2c]) y componente benigno (poroma) en un caso (14%). El número de mitosis por mm2 osciló entre 1 y 18 (media 5,7; mediana 3 [fig. 2d]); solo el caso 5 presentó invasión linfovascular (1/7; 14%). El estudio inmunohistoquímico se realizó en 5 pacientes, siendo positivo para EMA y CEA.
Estudio histológico del porocarcinoma ecrino (PE). a) Estructuras ductales propias del PE (hematoxilina-eosina [H-E] 4×); b) vista panorámica del tumor, en la que se observan cordones celulares anchos que avanzan con patrón expansivo (H-E 10×); c) necrosis focal o comedonecrosis (H-E 10×); d) figuras de mitosis y células tumorales con datos de atipia (H-E 20×).
El tratamiento inicial fue la exéresis quirúrgica de la lesión, con márgenes entre 3 y 5mm. Se planteó biopsia selectiva de ganglio centinela (BSGC) en 3 pacientes (43%) teniendo en cuenta sus características histológicas (espesor tumoral, mitosis e invasión linfovascular). En el caso 2 la BSGC fue positiva, realizándose linfadenectomía regional y tratamiento coadyuvante con radioterapia. El paciente 5 rechazó el procedimiento y en el caso 6 el resultado fue negativo. Las pruebas de imagen (ECO y/o TAC) solo evidenciaron las metástasis ganglionares en el caso 5. En el momento del diagnóstico el 29% de los casos presentaron diseminación linfática (2/7).
De los 5 pacientes en los que se realizó seguimiento uno falleció a los 10 meses del diagnóstico (caso 5). En el resto no se ha descrito recurrencia local o metástasis a distancia.
DiscusiónLos datos demográficos y clínicos de nuestra serie se asemejan a los descritos en las principales publicaciones1–10. El PE se presenta en pacientes de edad avanzada (el 71% de nuestros pacientes fueron mayores de 65 años)10. A pesar de que el 71% de nuestros casos fueron varones, existen discrepancias en cuanto a la predilección por género5,7. Las localizaciones más frecuentes son los miembros inferiores4–6 (43% en nuestra serie) y cabeza/cuello7–9. La presentación clínica papular rosada, con tamaño inferior a 2cm en el momento del diagnóstico, es la más repetida en la literatura y en nuestra serie10,12. Sin embargo, existen formas verrucosas, polipoides, ulceradas o pigmentadas, lo que obliga a realizar diagnóstico diferencial con granuloma piógeno, carcinoma epidermoide, melanoma, etc.7. El tiempo de evolución hasta el diagnóstico varía de meses a años5 (media de 15 años en nuestra serie), siendo frecuentes cambios como sangrado, crecimiento o prurito en los meses previos (71% de nuestros casos).
El estudio histológico es relevante para llegar al diagnóstico de certeza de PE, pero también para establecer los factores pronósticos que orienten la actitud terapéutica. Se observa un componente intraepidérmico y otro dermal. El componente intraepidérmico está constituido por nidos e islas de células basalioides, que presentan clara delimitación de los queratinocitos adyacentes, y se extienden de manera asimétrica hacia la dermis papilar y/o reticular formando nidos y columnas de células pleomórficas de tamaño grande, con variables cantidades de glucógeno PAS positivo y núcleos hipercromáticos con figuras de mitosis. En los nidos dermales se aprecian estructuras ductales, en forma de luces intracitoplaspámicas o ductos maduros (necesarias para el diagnóstico según algunos autores4). La invasión dérmica del tumor puede presentar un patrón expansivo (con márgenes bien delimitados), infiltrativo (nidos tumorales que se introducen en dermis e hipodermis sin clara separación con el tejido sano) o mixto7,12. También existen formas in situ (limitadas a epidermis) y otras con extensión intraepidérmica o pagetoide (células tumorales sueltas o en nidos dispersos a nivel intraepidérmico)13. Se ha descrito la presencia de necrosis difusa o focal (comedonecrosis)4 y de áreas con diferenciación escamosa (células claras). Pueden existir focos de poroma ecrino hasta en un 18% de casos4 (14% en nuestra serie), que presentan menor atipia citológica y figuras de mitosis, así como un patrón de crecimiento menos invasivo y asimétrico. Respecto a la inmunohistoquímica, el tumor es positivo para pancitoqueratinas, también para CEA y EMA en las estructuras ductales9.
Robson et al. determinaron las características histológicas con valor pronóstico estadísticamente significativo en su estudio de 69 pacientes, siendo corroboradas posteriormente por otros autores6,7,13. En primer lugar, los patrones de crecimiento infiltrativo y/o pagetoide se han asociado a un riesgo aumentado de recidiva local, relacionado con la ausencia de delimitación histológica del tumor. Por otro lado, un espesor tumoral igual o mayor a 7mm, un recuento elevado de mitosis por milímetro cuadrado (se propone superior a 14) y la presencia de invasión linfovascular se han asociado a mayor riesgo de metástasis a distancia. A diferencia de la mayoría de las publicaciones, en nuestra serie predomina el patrón expansivo (57%). Los promedios de espesor tumoral y número de mitosis se sitúan por debajo de las cifras asociadas a mal pronóstico y la invasión linfovascular aparece en un 14% de los casos (10-20% en otros estudios)5,8.
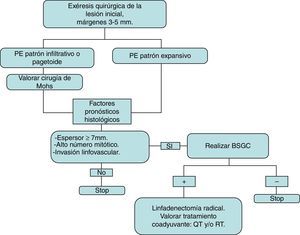
El tratamiento inicial del PE es quirúrgico, con márgenes de 3 y 5 mm6,13. Belin et al. proponen realizar cirugía de Mohs en los patrones infiltrativo y/o pagetoide, que tienen márgenes mal definidos y mayor riesgo de recidiva local. Es conocida la tendencia del PE a la diseminación linfática, por lo que la BSGC es fundamental en su detección precoz, tal y como proponen Borner y otros autores4,6,14. Para seleccionar los casos candidatos a BSGC se tienen en cuenta los factores pronósticos histológicos asociados a mayor riesgo de metástasis a distancia4,13. Solo se realizará linfadenectomía radical del territorio afecto si la BSGC es positiva14. Las pruebas de imagen (ECO y/o TAC) no siempre identifican las metástasis. La quimioterapia y la radioterapia se han empleado con éxito en algunos casos (la mayoría con factores de mal pronóstico) como tratamiento coadyuvante; se individualizará su administración15. Estas premisas han marcado nuestra actitud terapéutica en la serie presentada y quedan recogidas en la figura 3 como algoritmo de tratamiento. Tras la exéresis quirúrgica del tumor 3 pacientes (43%) fueron propuestos para BSGC (presentaban elevado espesor tumoral, alto número de mitosis y/o invasión linfovascular), realizándose finalmente en 2 de ellos. En uno se obtuvo resultado positivo que obligó a linfadenectomía regional.
Esquema de tratamiento seguido en la serie presentada y basado en la literatura revisada. La exéresis inicial se realiza con márgenes entre 3 y 5mm, que deben estar libres de tumor para continuar el algoritmo terapéutico.
BSGC: biopsia selectiva de ganglio centinela; QT: quimioterapia; RT: radioterapia.
El PE es un tumor agresivo cuando se presenta con afectación metastásica. Tiene un riesgo de recidiva local del 17-20%7, apareciendo metástasis linfáticas en el 20% de los casos y viscerales en el 11%4,11. En nuestra serie no existen casos de recurrencia local, pero 2 pacientes (29%) presentaron metástasis linfáticas en el momento del diagnóstico.
Las características demográficas, clínicas e histológicas de nuestra serie se asemejan a las descritas en las series más extensas. Ante la ausencia de un algoritmo terapéutico estandarizado, necesario en una neoplasia que puede ocasionar metástasis linfáticas y/o viscerales, se propone el esquema de tratamiento seguido en nuestros pacientes y basado en la literatura revisada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.

![Estudio histológico del porocarcinoma ecrino (PE). a) Estructuras ductales propias del PE (hematoxilina-eosina [H-E] 4×); b) vista panorámica del tumor, en la que se observan cordones celulares anchos que avanzan con patrón expansivo (H-E 10×); c) necrosis focal o comedonecrosis (H-E 10×); d) figuras de mitosis y células tumorales con datos de atipia (H-E 20×). Estudio histológico del porocarcinoma ecrino (PE). a) Estructuras ductales propias del PE (hematoxilina-eosina [H-E] 4×); b) vista panorámica del tumor, en la que se observan cordones celulares anchos que avanzan con patrón expansivo (H-E 10×); c) necrosis focal o comedonecrosis (H-E 10×); d) figuras de mitosis y células tumorales con datos de atipia (H-E 20×).](https://static.elsevier.es/multimedia/00017310/0000010800000004/v2_201705020105/S0001731016303052/v2_201705020105/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)