INTRODUCCION
Las porfirias son un conjunto de enfermedades de carácter hereditario o adquirido que cursan con déficit de las enzimas específicas que intervienen en la biosíntesis del grupo hemo y depósito de los productos intermedios de la cadena de formación a distintos niveles. La porfiria cutánea tarda (PCT) es el tipo más frecuente en la población general y se debe al déficit de uroporfirinógeno descarboxilasa, enzima que cataliza el paso de uroporfirinógeno a coproporfirinógeno, con formación intermedia de porfirinas hepta, hexa y pentacarboxiladas 1.
La pseudoporfiria es una entidad de reciente descripción cuyos hallazgos clínicos e histopatológicos no difieren de los descritos en la PCT y de la cual se distingue por el hecho de presentar unos valores de porfirinas en sangre, orina y heces normales o discretamente elevados 1. Este proceso se ha relacionado con la ingesta de determinados fármacos, el empleo de lámparas ultravioleta o la existencia de insuficiencia renal crónica (IRC) de larga evolución.
La presencia de fotosensibilidad es característica en ambas entidades. Presentamos el caso de una paciente con IRC que desarrolló un cuadro de lesiones fotoinducidas posterior al inicio del tratamiento con hemodiálisis.
DESCRIPCION DEL CASO
Una paciente de 41 años, con antecedentes de diabetes mellitus tipo 2, IRC secundaria a poliquistosis renal en hemodiálisis desde mayo de 1999, hiperparatiroidismo secundario, ovario poliquístico y apendicectomía con colectomía parcial consultó por lesiones cutáneas que comenzaron a aparecer en el dorso de las manos y posteriormente en ambas piernas y antebrazos aproximadamente un año tras el inicio del tratamiento con hemodiálisis en su país de origen. Asimismo, refería fragilidad cutánea especialmente en extremidades superiores y prurito generalizado. Recibía tratamiento oral con hidroxizina, atorvastatina, ácido acetilsalicílico y acarbosa. La paciente no refería historia familiar de lesiones cutáneas fotoinducidas y dos de sus tíos (por la rama paterna) padecían poliquistosis renal.
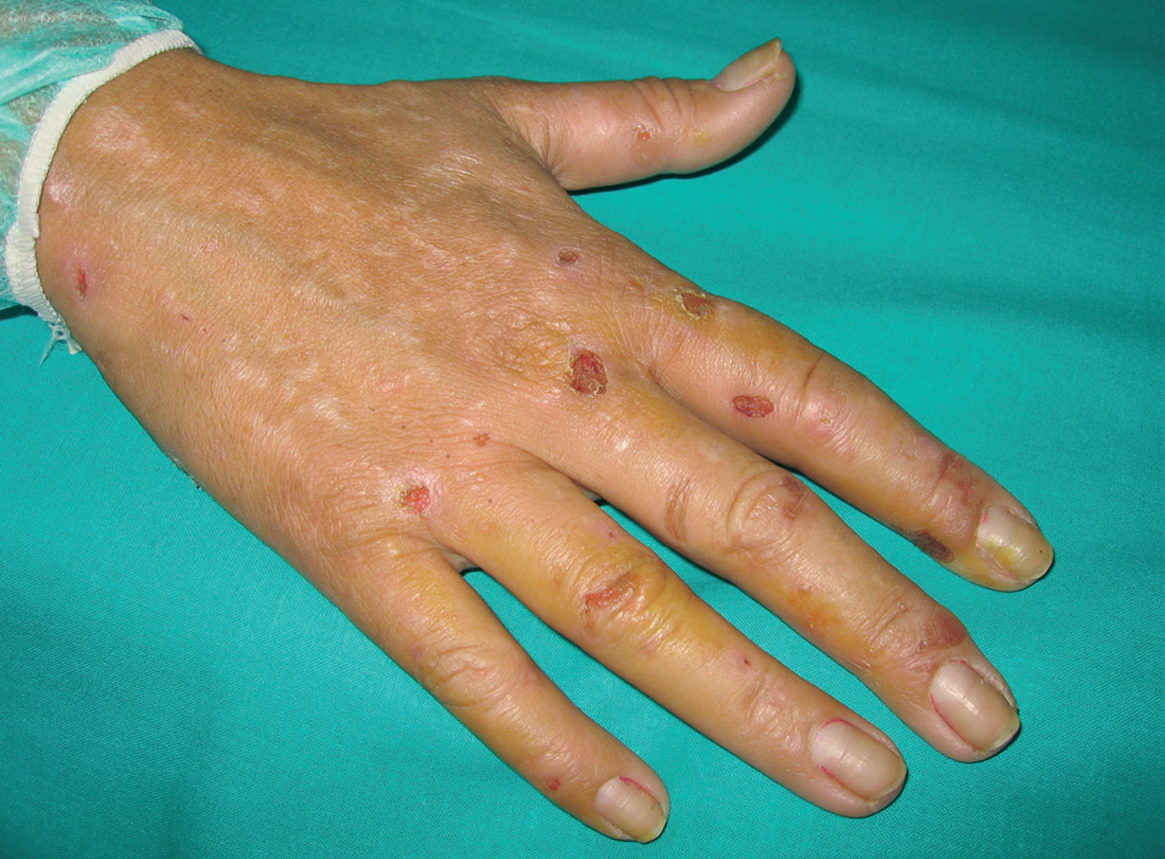
En la exploración dermatológica se observaban principalmente en el dorso de las manos (fig. 1) numerosas lesiones erosivas, la mayoría evolucionadas, cubiertas por costras serohemáticas engastadas, algunas desprendidas en la periferia, múltiples cicatrices hipopigmentadas de pequeño tamaño y aspecto estrellado y aislados quistes de millium. En la cara posterior de los antebrazos, anterior de las piernas y el dorso de los pies se observaban además lesiones de rascado. No presentaba lesiones de contenido líquido ni hipertricosis o hiperpigmentación significativas.
Fig. 1.--Lesiones erosivas cubiertas en su mayoría por costras hemáticas, numerosas cicatrices estrelladas hipopigmentadas y quistes de millium en el dorso de la mano derecha.
El hemograma realizado no presentaba alteraciones significativas (hemoglobina normal 12,5 g/dl) y en la bioquímica sanguínea ordinaria destacaba una urea de 76 mg/dl (12-44), creatinina 7,8 mg/dl (0,4-1,3), calcio 10,7 mg/dl (8,7-10,6), fósforo 8 mg/dl (2,7-5). Los niveles de hierro, ferritina y aluminio se encontraban dentro de la normalidad. Las serologías para virus hepatotropos y retrovirus resultaron negativas.
El estudio histopatológico de una de la lesiones en el dorso de las manos reveló la presencia de ampollas subepidérmicas, hiperqueratosis y esclerosis en la dermis. El estudio de inmunofluorescencia directo para inmunoglobulinas (IgG, IgA, IgM) y C3 resultó negativo.
La determinación de porfirinas en plasma mostró un valor de 631 μg/l (cifras normales en la población con función renal normal: 0-10 μg/l) con un pico a 621 nm en el espectro de emisión de fluorescencia (550-700 nm) para excitación a 405 nm. La paciente todavía realizaba micciones residuales, por lo que fue posible el estudio de porfirinas en orina de 24 h (muestra de 100 ml), que proporcionó un valor de 2.410 μg/g creatinina (normal hasta 115 μg/g creatinina), con una relación uroporfirina:coproporfirina de 4:1. Los niveles de porfirinas en heces se encontraban también elevados (coproporfirina 6,5 μg/g normal < 5; porfirina heptacarboxilada 1 μg/g normal < 0,5). La dosis eritema-mínimo (MED) fue considerada normal para su fototipo.
Las lesiones evolucionaron de forma favorable únicamente con la instauración de medidas de fotoprotección adecuadas. En la última revisión realizada la mayoría de las lesiones se encontraban ya en fase cicatricial, sin aparición de nuevas lesiones.
DISCUSION
Las manifestaciones cutáneas de la porfiria y la pseudoporfiria se deben al efecto de la radiación lumínica sobre las porfirinas acumuladas en la piel, con liberación de radicales libres que ocasionan daño tisular y determinan la aparición de ampollas en zonas fotoexpuestas.
El término «pseudoporfiria» fue acuñado por Korting en 1975 para hacer referencia a la aparición de ampollas, erosiones, prurito y fragilidad capilar en pacientes en hemodiálisis. Simultáneamente Gilchrest et al describieron una enfermedad ampollosa similar a la porfiria hepatocutánea tarda en 5 pacientes en hemodiálisis con valores normales de porfirinas, denominándola «dermatosis bullosa de los hemodializados» 1,2.
La mayor parte de los casos de pseudoporfiria se han descrito en asociación con el consumo de fármacos, siendo los antiinflamatorios no esteroideos los implicados con mayor frecuencia. La base de datos Pubmed contiene, desde octubre del año 2004 hasta julio de 2005, 20 referencias de pseudoporfiria en relación con naproxeno, dos relacionadas con derivados del ácido propiónico y casos aislados asociados a rofecoxib, celecoxib, ciclosporina, piridoxina, 5-fluorouracilo, amiodarona, flutamida, dapsona, nabumetona, voriconazol, anticonceptivos orales, furosemida, bumetanida, oxaprozina, clortalidona, retinoides orales y Coca-Cola 3. Otros factores predisponentes reconocidos son la exposición solar intensa, el uso de cabinas de bronceado y la PUVAterapia.
La IRC, asociada o no a diálisis, puede desencadenar la aparición de una porfiria o de una pseudoporfiria 3. Un aclaramiento renal reducido, la azoemia, la sobrecarga de hierro y el empleo de materiales de cloruro de polivinilo en la diálisis son factores que podrían contribuir a alterar el metabolismo de las porfirinas en la insuficiencia renal. Además de las porfirinas, otros cromóforos endógenos como citocromos y flavonoides, que liberan radicales libres mediante la absorción de radiación, pueden también estar implicados en la patogenia de la enfermedad 4. La toxicidad por aluminio en la insuficiencia renal se considera actualmente dudosa 5. Con independencia de los factores precipitantes, la radiación lumínica, especialmente la que presenta una longitud de onda de entre 400-410 nm (banda de Soret) parece desempeñar un papel indiscutible en la aparición de las lesiones cutáneas. La prevalencia de las lesiones ampollosas se sitúa actualmente entre el 1,2 y el 18 % en pacientes en programas de diálisis 6.
La PCT y la pseudoporfiria presentan manifestaciones clínicas comunes, con formación de lesiones de contenido líquido de tamaño variable, erosiones, cicatrices y marcada fotosensibilidad. La hipertricosis, la hiperpigmentación, la calcificación distrófica y los cambios esclerodermiformes parecen presentarse con mayor frecuencia en la PCT 3. Los valores de porfirinas en plasma (principalmente uroporfirina y porfirina heptacarboxílica) pueden encontrarse elevados en pacientes con insuficiencia renal sin lesiones cutáneas, debido a una excreción inadecuada y a un aclaramiento renal ineficaz. Esta elevación es más frecuente en los pacientes en hemodiálisis que en los tratados mediante sistemas de diálisis peritoneal continua ambulatoria 7, probablemente por un peor aclaramiento de moléculas de mayor peso molecular (como las porfirinas) mediante el primer sistema 8,9. La diferenciación entre porfiria y pseudoporfiria requiere la determinación de porfirinas en plasma, orina y heces. Los valores de estas se encontrarán muy elevados y mantendrán una proporción característica (uroporfirina:coproporfirina de 4:1, invertida con respecto a los individuos sin enfermedad) en la PCT y rebasarán ligeramente los límites de la normalidad en los casos de pseudoporfiria 10-13.
En la PCT se observa de forma característica una excreción aumentada de uroporfirinas I y III y de porfirinas heptacarboxiladas en orina y de isocoproporfirina y porfirinas de 5, 6 y 7 grupos carboxilo en heces 10. La detección de porfirinas en plasma se realiza mediante barrido fluorimétrico, que determinará la aparición de un pico de fluorescencia cuyo punto máximo se situará entre los 618 y los 622 nm en la PCT. El estudio de porfirinas en orina y heces se realiza mediante cuantificación espectrofotométrica 9.
Los hallazgos histopatológicos de ambas entidades son comunes 6 e incluyen la presencia de ampollas subepidérmicas, hiperqueratosis, hipergranulosis, acantosis y engrosamiento de los vasos de la dermis superior. La presencia de vasos engrosados hialinizados con material PAS+ en la pared, la esclerosis del colágeno dérmico y los cuerpos citoides (caterpillar bodies) se presentan con mayor frecuencia en la porfiria. La inmunofluorescencia indirecta resulta generalmente negativa. Mediante inmunofluorescencia directa pueden observarse depósitos granulares de IgG, IgM y C3 principalmente en la unión dermoepidérmica y en los vasos de la dermis superior 3.
El diagnóstico diferencial debe plantearse principalmente con la pseudoporfiria, otras enfermedades ampollosas (penfigoide ampolloso) y reacciones de fototoxicidad. El tratamiento de la porfiria en los pacientes con IRC resulta controvertido, puesto que la frecuente existencia de anemia crónica contraindica inicialmente la realización de flebotomías. Existen sin embargo autores que consideran adecuado el tratamiento de la PCT mediante flebotomías periódicas si los valores de hemoglobina se mantienen por encima de 10 g/dl, asociando dosis variables de eritropoyetina en caso de que la hemoglobina se encuentre por debajo de dicho nivel 14-16.
Declaración de conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Lidia Pérez. Departamento de Dermatología. Facultad de Medicina.
San Francisco, s/n. 15782 Santiago de Compostela. España.
mejaime@usc.es
Recibido el 11 de agosto de 2005.
Aceptado el 31 de enero de 2006.