INTRODUCCION
La heparina de bajo peso molecular (HBPM) comenzó a desarrollarse a finales de los años setenta. Procede de la división enzimática o química de la heparina no fraccionada y está formada por polisacáridos dispuestos linealmente. Ejerce su efecto anticoagulante a través de la activación de la antitrombina. Es cada vez más utilizada en la práctica clínica, siendo sus indicaciones actuales la profilaxis y tratamiento de la trombosis venosa profunda y el tratamiento de la angina inestable y del infarto agudo de miocardio. La HBPM presenta ventajas con respecto a la heparina no fraccionada, como son su respuesta anticoagulante más predecible y la menor incidencia de efectos secundarios sistémicos, como osteoporosis, riesgo de sangrado o trombopenia (1,2).
Las reacciones cutáneas secundarias al uso de HBPM son raras. Se han descrito casos de urticaria (3), necrosis cutánea (4) y placas eritematosas en los lugares de inyección de la heparina (5-12, 13, 16, 17). La aparición de placas eritematosas sin signos de necrosis en los lugares de inyección es una complicación poco frecuente mediada probablemente por un mecanismo de hipersensibilidad retardada (1).
DESCRIPCIÓN DEL CASO
Mujer de 69 años que ingresó en octubre de 1999 por arritmias supraventriculares recibiendo profilaxis de la enfermedad tromboembólica con enoxaparina sódica (Clexane®) subcutánea a dosis de 40 mg/24 h (10.000 UI/ml) durante 6 días, siendo luego suspendida. La paciente refería la aparición de lesiones cutáneas en los lugares de inyección que desaparecieron espontáneamente. Ingresó de nuevo 1 mes más tarde para la extirpación de un meningioma dorsal. Tras la intervención se inicia anticoagulación con HBPM: nadroparina cálcica (Fraxiparina®) subcutánea a dosis de 0,4 ml/24 h (9.500 UI/ml) durante 7 días y posteriormente enoxaparina sódica (Clexane®) subcutánea a dosis de 40 mg/12 h (10.000 UI/ml) durante 5 días.
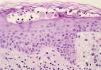
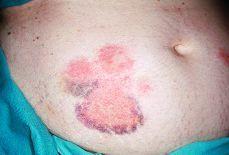
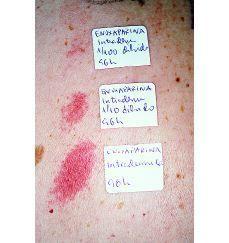
Dos días después de finalizar el tratamiento con enoxaparina sódica refiere la aparición en el abdomen de lesiones eritematosas muy pruriginosas coincidiendo con los sitios de inyección de la HBPM. A la exploración física se aprecian múltiples placas eritematosas de 10-15 cm de diámetro de bordes regulares con áreas equimóticas en su interior y ligeramente induradas a la palpación (Fig. 1). Las lesiones desaparecieron espontáneamente en 1 semana sin dejar lesión residual. El estudio anatomopatológico mostró una dermatitis espongiótica, edema en dermis papilar e infiltrado inflamatorio linfocitario con eosinófilos en dermis superficial (Fig. 2). No se apreciaron fenómenos trombóticos ni signos de vasculitis.
FIG. 1.--Placas eritematosas con áreas equimóticas localizadas en los lugares de inyección.
FIG. 2.--Dermatitis espongiótica, edema en dermis papilar e infiltrado linfocitario con eosinófilos en dermis superficial.
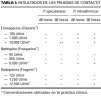
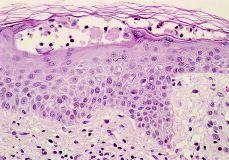
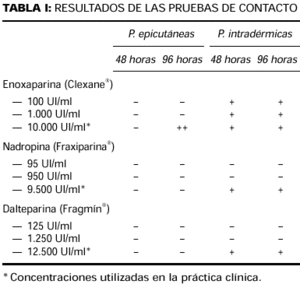
Cuatro meses después de la resolución de las lesiones se realizaron pruebas epicutáneas e intradérmicas. Se testaron con pruebas epicutáneas los alergenos de la batería estándar del GEIDC. Se realizaron pruebas epicutáneas e intradérmicas con enoxaparina sódica (Clexane®), nadroparina cálcica (Fraxiparina®) y dalteparina sódica (Fragmín®) a la concentración utilizada en la práctica clínica y con diluciones al 1/10 y 1/100 en su propio excipiente. Todas las pruebas epicutáneas fueron negativas, excepto la enoxaparina tal cual, que resultó positiva (++) a las 96 horas. Las pruebas intradérmicas con enoxaparina en sus tres concentraciones y con dalteparina y nadroparina en sus concentraciones máximas fueron positivas tanto a las 48 como a las 96 horas (Fig. 3). Los resultados se exponen en la tabla I.
FIG. 3.--Pruebas intradérmicas positivas con enoxaparina sódica.
Se realizaron 15 controles con pruebas epicutáneas con enoxaparina sódica tal cual y cinco con pruebas intradérmicas con enoxaparina, dalteparina y nadroparina a concentraciones utilizadas en la práctica clínica. La lectura a las 48 y 96 horas fue negativa en todos los casos.
DISCUSION
La aparición de placas eritematosas asociadas a la inyección subcutánea de HBPM, como las observadas en nuestro paciente, es un hecho infrecuente (7-12) y probablemente infradiagnosticado (1, 9, 11). Excepcionalmente pueden aparecer placas eritematosas a distancia (1). La morfología clínica de las lesiones puede estar condicionada por la profundidad de la inyección (l). El diagnóstico diferencial se establece fundamentalmente con fases precoces de necrosis cutánea en función de la evolución clínica y los estudios histológicos (6). Algunos autores han apoyado la teoría de que estas lesiones representan formas poco evolucionadas de necrosis cutánea (14), pero un mayor conocimiento de los mecanismos de producción de estos procesos nos permite reconocerlos como entidades distintas (1).
Ante la aparición de placas eritematosas en los lugares de inyección de HBPM es importante la realización de pruebas de contacto que nos permiten demostrar un fenómeno de hipersensibilidad retardada a la heparina utilizada y descartar reacción cruzada entre las distintas HBPM. No existen pautas establecidas a la hora de realizar este estudio, aunque se han propuesto estrategias diagnósticas (1). Las pruebas epicutáneas son poco sensibles en estos casos, aunque recientemente la heparina al 0,8% en vaselina se ha utilizado con resultados positivos (12). Las pruebas intradérmicas son más sensibles, recomendándose su realización con HBPM en varias diluciones (1). En nuestro paciente las pruebas intradérmicas resultaron positivas con las tres HBPM y sólo se obtuvo prueba epicutánea positiva con enoxaparina. Para algunos autores la prueba subcutánea, a pesar de ser la más fiable, sólo debe realizarse en caso de negatividad de las anteriores debido a la posibilidad de importantes efectos secundarios (1, 8). Otros, sin embargo, sugieren que la fiabilidad del test subcutáneo lo convierte en el siguiente paso diagnóstico tras las pruebas epicutáneas (11, 15, 17).
La placas eritematosas por HBPM subcutánea en nuestro paciente están probablemente mediadas al menos por un mecanismo de hipersensibilidad tipo IV, hecho apoyado fundamentalmente por los resultado positivos a las 48 y 96 horas de las pruebas de contacto y por la negatividad de las pruebas realizadas en los controles. Se ha demostrado un aumento de queratinocitos expresando HLA-DR en estudios inmunohistoquímicos y un número elevado de linfocitos T CD4 (1, 15). Debido a la naturaleza química de la heparina se ha sugerido que una reacción de hipersensibilidad tipo IV sólo puede explicarse si la heparina se une previamente a estructuras proteícas dérmicas o subcutáneas (1, 15). Todavía no se ha determinado la porción antigénica de la heparina (13, 17). En general, las lesiones secundarias a HBPM aparecen en los lugares de inyección tras semanas o incluso meses de tratamiento (1). En nuestra paciente las lesiones aparecen 7 días después de comenzar el tratamiento con enoxaparina sódica. Tanto la duración del tratamiento como el tiempo de latencia podrían considerarse cortos en relación con un mecanismo de hipersensibilidad retardada si no tenemos en cuenta la posibilidad de una sensibilización previa de la paciente a dicha
sustancia. La paciente sufrió una fractura de húmero 13 años antes que fue tratada mediante osteosíntesis, motivo por el cual recibió con gran probabilidad tratamiento con heparina.
En cuanto a las alternativas terapéuticas en estos pacientes, los derivados recombinantes de la hirudina son los únicos compuestos con los que se ha demostrado ausencia de reacción cruzada (1, 13, 16, 17). En diversos estudios se ha demostrado reacción cruzada entre los distintos tipos de HBPM (5, 7, 8, 10-12), así como con heparina no fraccionada (5-8, 10, 11, 17) y danaparoides (8, 17). Algunos autores proponen la utilización de premedicación con corticoides y antihistamínicos en caso de necesidad de utilización de heparina en estos pacientes (8).