La reciente resolución de la EMEA con respecto a la suspensión de efalizumab, ocurrida en febrero del año 2009, ha proporcionado una oportunidad única para comprobar la evolución de un grupo de pacientes en cuya selección no intervinieron los filtros ni los sesgos habituales de los estudios pivotales. El objetivo planteado fue evaluar el curso de la psoriasis tras la suspensión forzosa de efalizumab en un grupo de pacientes tratados en el ámbito clínico. Como objetivos secundarios se planteó investigar su perfil clínico, la respuesta y evolución durante el tratamiento y el curso evolutivo a las 12 y 24 semanas tras la suspensión.
Pacientes y métodosSe recogió información procedente de un grupo de pacientes tratados con efalizumab referida al perfil epidemiológico, al curso de la dermatosis durante el tratamiento y a su evolución al suspenderlo. Se llevaron a cabo estudios estadísticos con vistas a identificar variables predictivas de los distintos objetivos investigados.
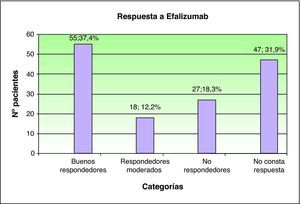
ResultadosSe incluyeron 147 pacientes procedentes de 12 centros hospitalarios nacionales. Durante el tratamiento un 4% de los pacientes fue diagnosticado de exacerbación inflamatoria generalizada. La mayor parte de los pacientes pudieron ser clasificados como buenos respondedores (55%) o respondedores moderados (18%). Un 30% de los pacientes presentaron rebote tras la suspensión de efalizumab. La probabilidad de rebote fue independiente del perfil clínico, la respuesta al tratamiento o la actitud terapéutica del dermatólogo al suspenderlo.
Discusión y conclusionesSe comprobó una elevada ocurrencia de fenómeno de rebote tras la suspensión de efalizumab, superior a la descrita en los ensayos clínicos pivotales y especialmente significativa si se tiene en cuenta la elevada incidencia de buenos respondedores durante el tratamiento, considerados de mejor pronóstico. Otros datos significativos son la superior perspectiva de respuesta clínica —presumiblemente condicionada por el tiempo medio de tratamiento—, y la elevada incidencia de episodios de exacerbación inflamatoria generalizada.
The withdrawal of marketing authorization for efalizumab by the European Medicines Agency in February, 2009 provided a unique opportunity to assess the course of disease in patients who were not subject to the selection criteria and biases that were common in the pivotal trials. The aim of this study was to evaluate the course of psoriasis following forced suspension of efalizumab in a group of patients treated in normal clinical practice. As secondary objectives, we sought to assess the relationships between clinical characteristics, treatment response, and disease course during efalizumab treatment and 12 and 24weeks after suspension.
Patients and methodsInformation on the epidemiological profile and disease course during treatment and following suspension of the drug was collected from a group of patients treated with efalizumab. Statistical analyses were performed to identify predictive factors.
ResultsOne hundred forty-seven patients from 12 Spanish hospitals were included in the study. During treatment, 4% of patients were diagnosed with generalized inflammatory flares. Most patients could be classified as having a good (55%) or moderate (18%) response to treatment. Rebound following withdrawal of efalizumab was observed in 30% of patients. The likelihood of rebound was independent of clinical characteristics, treatment response, or therapeutic approach used by the dermatologist following suspension.
ConclusionsThere was a high frequency of rebound following suspension of efalizumab, exceeding the rate reported in pivotal trials. This is particularly noteworthy given the large proportion of patients with a good response to treatment and therefore believed to have a better prognosis. Other significant findings were the higher frequency of positive treatment response than observed in previous studies (possibly influenced by the mean treatment duration) and the high frequency of generalized inflammatory flares.
La introducción de los fármacos biológicos en el tratamiento de la psoriasis se ha acompañado de un enorme esfuerzo investigador y divulgativo, que ha puesto a disposición de los dermatólogos una enorme cantidad de información de gran calidad, procedente de ensayos clínicos multicéntricos pivotales1,2. Esta información es revisada y evaluada de forma periódica en estudios de metaanálisis que suponen un salto cualitativo en cuanto al rigor informativo3–5. Sin embargo, y a pesar de los estrictos requisitos que preceden a cualquiera de estas publicaciones, los ensayos clínicos plantean situaciones y limitaciones que a menudo los alejan de la práctica clínica diaria. La reciente resolución de la EMEA (European Medicines Agency) con respecto a la suspensión de efalizumab, ocurrida en febrero del año 2009, ha supuesto una situación excepcional. De este modo, la suspensión forzosa de este fármaco en un corto periodo de tiempo, por razones ajenas a la respuesta terapéutica y de forma independiente a la evolución observada en cada paciente, ha proporcionado una oportunidad única para comprobar el curso de un grupo de individuos en cuya selección no intervinieron los filtros ni los sesgos habituales de los estudios pivotales. La evaluación de su perfil clínico, evolución durante el tratamiento y tras su suspensión permitirá conocer no sólo las características de los pacientes con psoriasis moderada y grave en tratamiento con fármacos biológicos en nuestro medio, sino también el curso evolutivo de la enfermedad al suspender efalizumab en relación con las distintas estrategias terapéuticas adoptadas, y de esta manera, compararlo con el esperado a partir de los estudios clínicos pivotales.
El objetivo principal consistió en evaluar el curso de la psoriasis al suspender el tratamiento con efalizumab, en particular con respecto al desarrollo de recaída y rebote, y estudiar su posible asociación estadística con respecto a diversas variables epidemiológicas, relacionadas con el curso del tratamiento y con la actitud adoptada al suspender el fármaco.
Como objetivos secundarios se planteó investigar el perfil clínico y epidemiológico de los pacientes tratados con efalizumab en nuestro medio, identificando factores pronósticos de respuesta terapéutica y del desarrollo de efectos secundarios relacionados con la psoriasis, así como contrastar el curso clínico de la psoriasis a corto y medio plazo tras la suspensión de efalizumab en relación con diversos parámetros clínicos y al curso evolutivo durante el tratamiento. Finalmente, se estudió la posibilidad de diferencias epidemiológicas, clínicas o pronósticas en función del tiempo de tratamiento con efalizumab.
Material y métodosSe trata de un estudio observacional, retrospectivo y multicéntrico. La recogida de los datos se llevó a cabo a través de un cuestionario remitido a los miembros del Grupo Español de Psoriasis. Este consistió en una tabla que incluía datos referidos al perfil epidemiológico del paciente, al curso del mismo durante y después del tratamiento con efalizumab y a la evolución de la psoriasis al suspender el tratamiento a las 12 y 24 semanas. Asimismo, se recogieron las estrategias planteadas por los dermatólogos una vez suspendido efalizumab con vistas a minimizar el impacto de esta actuación.
Para evaluar la respuesta a efalizumab se utilizó el porcentaje de mejoría del PASI en el momento de la suspensión con respecto al PASI al inicio del tratamiento. Se clasificaron los pacientes en función de la respuesta a efalizumab en tres categorías: buenos, moderados y no respondedores. Los pacientes en los que la mejoría del PASI fue superior al 75% se etiquetaron de buenos respondedores. Por el contrario, aquellos en los que la mejoría se situaba entre el 50 y el 75% se clasificaron como respondedores moderados, y los pacientes con mejoría inferior al 50% como no respondedores. En algunos puntos de los resultados y la discusión se agrupó a aquellos pacientes con respuesta buena y moderada bajo el epígrafe de «respuesta satisfactoria», en consonancia con esta consideración en algunos estudios pivotales. Con respecto a los efectos adversos ocurridos durante el tratamiento se tuvieron en cuenta en particular aquellos definidos como «relacionados con la psoriasis»: la erupción papular transitoria y la exacerbación inflamatoria generalizada6.
Las actuaciones terapéuticas de los dermatólogos al suspender el tratamiento se clasificaron en: a) suspensión brusca de efalizumab y seguimiento clínico («ver y observar»); y b) suspensión brusca de efalizumab con inicio inmediato de otro tratamiento sistémico sin transición ninguna, o superposición de efalizumab con otro fármaco antes de su suspensión definitiva.
Los parámetros evaluados tras la suspensión del tratamiento fueron el desarrollo de rebote y/o de recaída, así como el PASI medio a las 12 y 24 semanas. La recaída ha sido definida por la NPF (National Psoriasis Foundation) como la pérdida del 50% de la mejoría del PASI respecto al PASI basal en pacientes respondedores. De forma adicional, en los ensayos clínicos pivotales se consideró recaída sólo cuando esta pérdida ocurría en las primeras 12 semanas después de la suspensión de efalizumab6–8. Teniendo en cuenta la dificultad de homogeneizar este concepto entre todos los autores, y el carácter retrospectivo del estudio, se tuvo en cuenta la primera acepción. El rebote se conoce como el desarrollo de un PASI superior al 125% respecto al PASI basal, el cambio de morfología de la psoriasis o el desarrollo de artritis en pacientes que no la presentaban previamente, dentro los tres primeros meses tras la suspensión de efalizumab6,9. Se recogieron asimismo las estrategias terapéuticas ante los acontecimientos adversos relacionados con efalizumab, así como ante el desarrollo de recaída o rebote.
Para evaluar el curso de la psoriasis a las 12 y a las 24 semanas se tuvo en cuenta la determinación del PASI y BSA (Body Surface Area; porcentaje de área de piel afecta por psoriasis) en este momento. Estos resultados se contrastaron con el PASI al inicio y final del tratamiento con efalizumab.
Análisis estadísticoSe ha estudiado si existe relación estadísticamente significativa entre distintos parámetros y datos evaluados.
Para determinar si existían diferencias entre el PASI o BSA inicial, según los grupos de respuesta al tratamiento se utilizó el análisis no paramétrico de la varianza (Kruskal-Wallis).
Asimismo, para valorar si existía asociación entre la respuesta al tratamiento y los efectos adversos relacionados con la psoriasis (exacerbación inflamatoria generalizada y erupción papular transitoria) se empleó la prueba de Mann-Whitney.
Para determinar si había diferencias en cuanto al PASI inicial entre los diferentes grupos, según la actitud adoptada al finalizar el tratamiento, se utilizó la prueba de Kruskal-Wallis, al igual que para valorar la asociación entre la respuesta al tratamiento y la actitud adoptada.
En cuanto al análisis de los fenómenos de rebote y de recaída, y su posible asociación con otros datos descriptivos, se valoró mediante la prueba del Chi cuadrado. La asociación de estos sucesos con la respuesta al tratamiento y con el PASI al final del tratamiento se analizó mediante la prueba de Mann-Whitney.
Para evaluar si existían diferencias entre el PASI al final del tratamiento y las tres estrategias adoptadas tras la suspensión se utilizó el análisis de la varianza no paramétrico (prueba de Kruskal-Wallis), así como un análisis de la varianza paramétrico con los datos transformados por el logaritmo (para mejorar la aproximación a una distribución normal).
Para analizar si existían diferencias estadísticamente significativas en cuanto al PASI a las 12 y a las 24 semanas, según la actitud adoptada, se utilizó la prueba de Kruskal-Wallis.
Teniendo en cuenta que el prolongado tiempo medio de tratamiento podría haber seleccionado de forma positiva el grupo de buenos respondedores en nuestra serie, estos se subclasificaron para algunas determinaciones en 2 grupos, en función del tiempo de tratamiento. Para ello se tomó como referencia el intervalo de 6 meses, referido en los ensayos clínicos como el de máxima respuesta del fármaco10. El análisis de las posibles diferencias en cuanto al PASI o BSA inicial entre ambos grupos se llevó a cabo mediante la prueba de Mann-Whitney.
El análisis de las diferencias en cuanto a la respuesta terapéutica se llevó a cabo mediante la prueba de la Chi cuadrado y la prueba de Mann-Whitney.
Para las diferencias entre ambos grupos, en cuanto a la exacerbación inflamatoria generalizada y el rebote, se utilizó la Chi cuadrado y la prueba exacta de Fisher.
Las diferencias en cuanto al desarrollo de erupción papular transitoria y al desarrollo de recaída se analizaron mediante la Chi cuadrado.
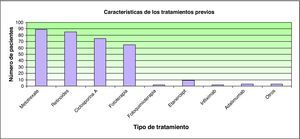
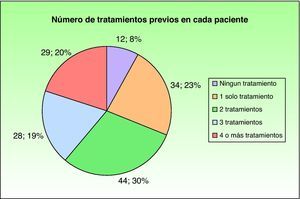
ResultadosHistoria de la enfermedad. Datos epidemiológicosEn total se incluyeron 147 pacientes procedentes de 12 centros hospitalarios nacionales. La edad media en el momento del tratamiento con efalizumab fue de 46 años (rango: 17-83; desviación estándar: 14) y el peso promedio fue de 76kg (rango: 46-118; desviación estándar: 14). El sexo no fue una variable recogida. Se registraron antecedentes familiares de psoriasis en el 36% (53 pacientes). La variante clínica más frecuente fue la forma «en placas» (135; 91%), seguida de la forma palmoplantar acompañada o no de placas (9; 6%), psoriasis en gotas (2; 1,3%) y finalmente psoriasis invertida asociada a una forma en placas (1; 0,6%). Sólo dos pacientes (1,3%) habían presentado de forma previa al inicio del tratamiento signos clínicos tributarios del diagnóstico de artropatía psoriásica. La mayoría (135; 91,8%) había recibido previamente tratamientos sistémicos por su dermatosis, aunque sólo un 6% (9 pacientes) había requerido ingreso hospitalario por esta causa (tabla 1). Los tratamientos previos administrados con mayor frecuencia fueron, por este orden, metotrexato, retinoides, ciclosporina A y fototerapia, seguidos de diversos fármacos biológicos (fig. 1). El 68% de los pacientes había recibido dos o más tratamientos sistémicos de forma previa a efalizumab (fig. 2).
Resumen de los resultados acerca del perfil clínico y epidemiológico de los pacientes incluidos en el estudio
| Ítems | Resultados |
| Número de pacientes (n) | 147 |
| Edad media | 46 años |
| Peso medio | 76 kg |
| Antecedentes familiares | 53 (36%) |
| Formas de psoriasis | En placas: 135 (91%)Palmoplantar: 9 (6%)En gotas: 2 (1,3%)Invertida: 1 (0,6%) |
| Atropatía psoriásica | 2 (1,3%) |
| Ingreso hospitalario | 9 (6%) |
| Tratamientos sistémicos previos | ≥ 1: 135 (91,8%)≥ 2: 101 (68,7%) |
| Metotrexato: 89 (60,5%)Retinoides: 85 (57,8%)Ciclosporina A: 75 (51%)Fototerapia: 67 (45,5%)Biológicos: 14 (9,5%) |
El tiempo medio de tratamiento acumulado con efalizumab fue de 18 meses (con un rango de 1 a 46 y una desviación estándar de 13,6). El PASI medio previo al inicio del tratamiento fue de 12,38 (recogido en 119 pacientes y con un rango de 0,2 a 50,7; desviación estándar: 8,25), mientras que el BSA medio en este momento fue de 17,6 (medido en 94 pacientes y con un rango de 1 a 74,4). A lo largo de los meses de tratamiento ningún paciente presentó signos de artropatía psoriásica atribuible por los investigadores al fármaco. Con respecto a los efectos secundarios relacionados con la psoriasis un 4% de los pacientes (6 de 147) presentó un episodio de exacerbación inflamatoria generalizada, mientras que el desarrollo de manifestaciones clínicas compatibles con erupción papular transitoria se recogió en el 12% de los casos (18 de 147). En el control de la exacerbación inflamatoria generalizada los facultativos emplearon de forma predominante tratamiento sistémico: en particular metotrexato, en 4 de los 6 pacientes, mientras que en los dos restantes se recurrió a tratamiento tópico. Los episodios de erupción papular transitoria requirieron tratamiento en el 77% de los casos (14 de 18), empleándose de forma mayoritaria los corticoides tópicos (12 casos), seguidos de acitretino (un caso) y tratamiento antihistamínico oral (un caso).
En el momento de la suspensión forzosa del tratamiento el PASI medio fue de 3,7 (rango 0-30; desviación estándar: 4,79; n: 113) y el BSA medio de 6,7 (rango 0-55; n: 89). La mejoría porcentual media del PASI entre el inicio y el fin del tratamiento fue del 70% y del BSA del 62%. En función de la diferencia entre el PASI inicial y el final, en aquellos pacientes en los que este dato estuvo disponible (en total 100 pacientes), la mayor parte pudieron ser clasificados como buenos respondedores (55%) o respondedores moderados (18%). Por el contrario, el 27% se consideró como no respondedor (fig. 3).
Factores clínicos predictivos de respuesta terapéuticaEn el análisis estadístico se pudo encontrar una relación estadísticamente significativa (p<0,01) entre el PASI inicial y la respuesta al tratamiento. De este modo, el PASI al inicio del tratamiento fue superior entre los buenos respondedores (media de 12,3) o respondedores moderados (media de 12,9) que entre los no respondedores (media de 6,1). Esta relación entre la afectación inicial y la respuesta al tratamiento se confirmó asimismo cuando se tomó el BSA como parámetro de la gravedad inicial de la psoriasis (p<0,05).
Por el contrario, aquellos pacientes que presentaron una exacerbación inflamatoria generalizada (6 de 147) tuvieron una respuesta inferior con respecto a los que no presentaron este efecto adverso (p<0,05). De hecho, de los pacientes que presentaron este efecto adverso y de los que tenemos constancia de la respuesta al tratamiento con efalizumab (4 en total), tres fueron considerados como no respondedores. Sin embargo, no se pudo demostrar una relación estadísticamente significativa entre la respuesta al tratamiento y el desarrollo de erupción papular transitoria.
Estrategia adoptada tras la suspensión de efalizumabEn un 39% de los pacientes (en 57 de 145 pacientes) el dermatólogo decidió suspender el tratamiento y seguir una conducta expectante. En el resto de los casos los facultativos optaron por realizar un tratamiento de superposición (en 44 de 145 pacientes, es decir, en el 30% de los casos) o suspendieron efalizumab para iniciar de forma inmediata otro tratamiento (en 44 de 145 pacientes, es decir, en otro 30% de los casos). Los tratamientos elegidos con mayor frecuencia para llevar a cabo tanto la superposición como el cambio fueron metotrexato, etanercept y ciclosporina (tabla 2). Las semanas de superposición variaron entre 1 y 20, con una media de 7.
Listado de los distintos tratamientos usados para realizar la transición o el cambio en el momento de la suspensión de efalizumab
| Fármaco utilizado | Estrategia | Total | |
| Overlap | Cambio | ||
| Metotrexato | 17 | 7 | 24 |
| Ciclosporina | 15 | 4 | 19 |
| Acitretino | 6 | 4 | 10 |
| UVB-BEa | 1 | 0 | 1 |
| PUVA | 1 | 1 | 2 |
| Etanercept | 2 | 19 | 21 |
| Adalimumab | 1 | 9 | 10 |
El índice PASI al inicio del tratamiento fue significativamente mayor (p<0,01) en aquellos casos en los que se optó por esperar y ver evolución (media de 14,48) y en los que se optó por superponer efalizumab con otro tratamiento (media de 13,29) con respecto a aquellos en los que se decidió suspender efalizumab y empezar otro fármaco de forma inmediata (media de 8,80).
No pudo establecerse relación significativa alguna entre la actitud adoptada y diversos parámetros epidemiológicos, la respuesta al tratamiento o con el desarrollo de efectos adversos en relación con la psoriasis (exacerbación inflamatoria generalizada y erupción papular transitoria).
No se encontraron diferencias estadísticamente significativas entre el PASI al final del tratamiento y las tres actitudes adoptadas.
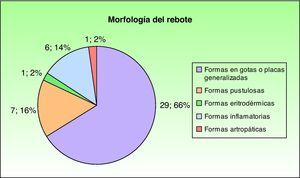
Evolución de la psoriasis al suspender el tratamientoUn 30% de los pacientes (44 de 142) presentó un cuadro catalogado como rebote tras una media de 6 semanas (de 1 a 12 semanas, con una mediana de 6), en su mayor parte en forma de un cambio de morfología con respecto a la psoriasis previa con aparición generalizada de psoriasis en gotas o pequeñas placas (66%; en 29 de 44 pacientes) o bien en forma pustulosa (16%; en 7 de 44). Otras variantes clínicas incluidas en la definición de rebote aparecen en la figura 4.
En el periodo de seguimiento establecido de 24 semanas un 45% adicional (62/137) presentó una recaída tras una media de 8 semanas (rango 1-20).
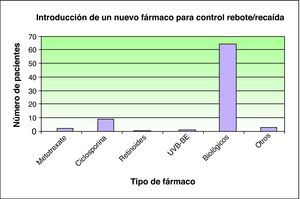
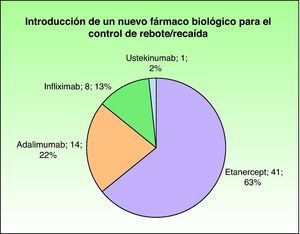
Con el fin de controlar de forma adecuada el desarrollo de rebote o recaída, un total de 27 pacientes requirieron la introducción de otro fármaco adicional para el control de su enfermedad, siendo los fármacos biológicos los más utilizados, en particular etanercept en el 62% de los casos. Los distintos fármacos aparecen en las figuras 5 y 6.
Los valores medios del índice PASI y del BSA a las 12 semanas tras la suspensión de efalizumab fueron de 6,87 (rango: 0-33,6; n: 114) y de 12,64 (rango: 0-80; n: 87), respectivamente. A las 24 semanas estos mismos valores pasaron a ser de 2,90 (rango 0-14,8; n: 63) y de 5,24 (rango: 0-43; n: 48).
Asociación entre los parámetros clínicos y la estrategia del dermatólogo y la posibilidad de rebote/recaídaNinguno de los parámetros clínicos evaluados pudo ser identificado como factor predictivo para el desarrollo de fenómeno de rebote o de recaída. Tampoco la estrategia adoptada por el dermatólogo después de la suspensión del fármaco condicionó el riesgo posterior de reaparición de la dermatosis en forma de rebote o recaída.
Asociación entre los parámetros clínicos y la estrategia del dermatólogo con la respuesta a las 12/ 24 semanasNo se encontró una asociación estadísticamente significativa entre la actitud adoptada y la respuesta a las 12 o las 24 semanas.
Relación entre el tipo de fármaco utilizado para el cambio/ solapamiento con la respuesta PASI a las 12 semanas y a las 24 semanas con respecto al PASI al finalizar el tratamientoNo se encontraron diferencias estadísticamente significativas entre la respuesta PASI a las 12 semanas (respecto del PASI final) en función del tratamiento iniciado tras la suspensión de efalizumab, así como tampoco con la respuesta a las 24 semanas.
Sin embargo, se observaron diferencias, aunque no estadísticamente significativas, en la respuesta PASI a las 12 semanas en función del tratamiento seleccionado. De este modo, se pudieron clasificar como respondedores (moderados y buenos) un 20,7% de los pacientes en los que se optó por realizar tratamiento con fármacos biológicos frente al 6,3% en los que se optó por los fármacos clásicos. Para dicho cálculo se aplicó un test bilateral (prueba exacta de Fisher) obteniendo una p de 0,14 y una potencia estadística de tan solo el 38,3%. El motivo por el cual las diferencias no alcanzaron el nivel mínimo de significación se atribuyó al pequeño tamaño de la muestra, requerido en 3 veces superior al disponible.
Relación de la evolución de la psoriasis a medio plazo con respecto al PASI inicial y al PASI al final del tratamiento con efalizumabSi se lleva a cabo una comparación del índice del PASI medio en los distintos momentos evolutivos, puede comprobarse cómo el PASI medio a las 12 y 24 semanas mejoró con respecto al PASI medio al inicio (un 45 y 80% más reducido, respectivamente). El valor medio del índice PASI a las 12 semanas de la suspensión fue superior al obtenido en el momento de suspender el tratamiento con efalizumab (empeoramiento medio del 83%). Sin embargo 12 semanas más tarde, la media del índice PASI se recuperó hasta llegar a ser un 35% inferior al observado al finalizar el tratamiento. No se encontraron diferencias en función de que los pacientes hubiesen sido o no respondedores a efalizumab (PASI a las 12 semanas 7,41 vs 7,50 y PASI a las 24 semanas 2,73 vs 2,26)
Teniendo en cuenta únicamente los pacientes en los que los datos a las 12 y 24 semanas post-suspensión de efalizumab estuvieron disponibles (en total 57 pacientes), y bajo los supuestos de mejoría de al menos un 50% del PASI, pudo comprobarse cómo un 43,85% (25 casos) podrían haber sido considerados como respondedores satisfactorios (buenos y moderados), de los cuales únicamente un 31% (18 casos) alcanzó el PASI 75 (buena respuesta). Al analizar la misma variable a las 24 semanas, los respondedores satisfactorios representaron un 82,45% (47 casos), la mayoría de los cuales alcanzaron un PASI 75 (68,42%; 39 casos).
Subclasificación de los pacientes en función del tiempo de tratamiento y relación con parámetros clínicos y evolutivosEn su conjunto, los pacientes tratados con efalizumab de forma prolongada (más de 6 meses) presentaron unos valores de BSA inicial significativamente más altos. Sin embargo, las diferencias en cuanto al PASI inicial no fueron significativas entre ambos grupos. Por otro lado, los pacientes tratados de forma prolongada durante más de 6 meses presentaron una mayor tendencia a una mejor respuesta terapéutica (p=0,07) y a una menor incidencia de exacerbación inflamatoria generalizada (p=0,06).
No se encontró relación estadística entre el tiempo de tratamiento y el desarrollo de rebote o recaída.
Limitaciones del estudioSe trata de un estudio descriptivo y retrospectivo en el que los distintos centros de reclutamiento aplicaron sus propios protocolos de seguimiento, por lo que existen ciertas limitaciones intrínsecas al diseño del trabajo, como el sesgo de selección de los pacientes. Probablemente por el carácter retrospectivo de la recogida de datos, el índice PASI/ BSA basal y final no estuvo disponible en algunos pacientes. Aunque en la evaluación estadística se ha considerado el impacto de estas ausencias, deben tenerse en cuenta estas limitaciones en la interpretación de los resultados.
Un dato a destacar en cuanto al tiempo de tratamiento con efalizumab es considerar que todos los pacientes acabaron al mismo tiempo, ya que se consideró que la fecha de finalización fue en febrero de 2009, sin tener en cuenta otras particularidades (transición de la medicación, tiempo en acudir a las consultas, etc.).
DiscusiónLa introducción de los fármacos biológicos ha modificado de forma profunda el manejo de los pacientes con psoriasis moderada-grave en nuestro medio.
El presente estudio, en el que se recoge de manera retrospectiva una muestra significativa de pacientes procedentes de 12 centros hospitalarios nacionales, resulta ilustrativo no sólo por la descripción de la evolución de la psoriasis con el tratamiento, sino también porque permite comprobar el perfil de los pacientes con psoriasis moderada y grave incluidos —al menos durante el periodo histórico recogido— en tratamiento biológico en nuestro ámbito. En este trabajo pudimos comprobar diferencias significativas entre las perspectivas procedentes de los estudios pivotales y el comportamiento del fármaco en la práctica clínica, en particular en el perfil de seguridad.
Desde un punto de vista epidemiológico debe destacarse el peso medio de los pacientes, significativamente inferior al de otras series1,11. Teniendo en cuenta que el sexo de los pacientes no fue una variable recogida, puede haber sesgos en este punto. En su mayoría se trataba de pacientes con psoriasis en placas, circunstancia que puede explicarse por la indicación en la ficha técnica del fármaco1. Sin embargo, debe destacarse la indicación en pacientes con psoriasis palmoplantar en un 6%. Esta circunstancia se justifica probablemente por la existencia de varios artículos en los que se preconizaba, en casos esporádicos y pequeñas series, la utilidad de efalizumab en esta difícil variante clínica de psoriasis, habiéndose puesto en marcha incluso un ensayo clínico específico que fue abortado coincidiendo con la suspensión del fármaco12–15. Otros antecedentes, como el PASI medio al inicio del tratamiento, la elevada incidencia de tratamientos sistémicos previos o la baja prevalencia de artropatía psoriásica se correspondían bien con la indicación del fármaco restringida a las manifestaciones cutáneas de la psoriasis —y no a la artropatía— y con los requisitos solicitados por la EMEA para la prescripción del fármaco1. La preferencia en cuanto a los fármacos sistémicos previos se corresponde con los habituales en nuestro medio, registrados en la base de datos BIOBADADERM16. La ausencia en la historia clínica de los pacientes de otros fármacos biológicos resulta fácilmente explicable en el contexto histórico, ya que efalizumab fue uno de los primeros del nuevo grupo de fármacos biológicos disponibles.
El tiempo medio de tratamiento del grupo estudiado fue de 18 meses, aunque algunos de los pacientes fueron tratados durante varios años. Teniendo en cuenta que las perspectivas de respuesta del fármaco resultaban máximas hacia los 6 meses de tratamiento, es lógico pensar que existe un claro sesgo de selección, ya que la mayor parte de los pacientes reclutados eran «buenos respondedores», mientras que los respondedores moderados y, en particular los no respondedores, habían sido trasladados en su mayoría hacia otras alternativas terapéuticas a los pocos meses de iniciar efalizumab. Esta circunstancia justifica probablemente que el porcentaje de respondedores en nuestra serie sea superior al observado tanto en series clínicas como en estudios pivotales1,17–20. En el estudio estadístico, un mayor PASI inicial se asoció a una mayor probabilidad de responder de forma satisfactoria. Este dato, aparentemente paradójico, puede explicarse si se tiene en cuenta que la diana para ello (PASI 75, esto es, mejoría del 75% del PASI con respecto al inicial) es más difícil de obtener si la afectación inicial es reducida.
Con vistas a limitar el impacto de este sesgo los pacientes fueron subclasificados en función del tiempo de tratamiento. Como cabía esperar, la respuesta fue inferior en el subgrupo de los pacientes tratados durante menos de 6 meses, aunque las diferencias no fueron significativas.
Una de las peculiaridades observadas durante el tratamiento con efalizumab fue el desarrollo de los llamados efectos secundarios «relacionados con la psoriasis»21. El más frecuente, y también el más leve, es la erupción papular transitoria. Este es un acontecimiento que se manifiesta típicamente dentro las primeras 4 a 8 semanas de haber iniciado efalizumab, de naturaleza papular, habitualmente afectando áreas previamente no implicadas y localizada de forma preferente en cuello, tórax o flexuras6,22,23. En la presente serie se diagnosticó erupción papular transitoria en el 11% de los pacientes. Esta cifra fue inferior a la esperada, situada entre el 25-33% de los individuos que recibieron efalizumab en los ensayos pivotales. Su curso fue, tal y como se recoge en la literatura, benigno en la mayoría de los pacientes, empleándose para su manejo corticoides tópicos o la simple abstención terapéutica6,22,23. De hecho, la benignidad del proceso hace probable que algunos de los casos más leves no quedasen reflejados en la historia clínica habitual, no sometida en este caso a la rigidez documental propia de los ensayos clínicos. Más infrecuente, aunque mucho más grave, es la exacerbación inflamatoria generalizada, descrita en la presente serie en el 4% de los pacientes (en 6 de 147), casi siempre a costa de un agravamiento inflamatorio de las placas de psoriasis previas, acompañado a veces de la aparición de lesiones en áreas previamente no afectadas. Este porcentaje contrasta con el previsto en los ensayos clínicos pivotales, de entre el 1 y el 3%6. A diferencia de la erupción papular transitoria, la exacerbación inflamatoria generalizada es un efecto adverso grave que se ha considerado más frecuente en los pacientes no respondedores a efalizumab6,24,25. A menudo requiere el empleo de fármacos sistémicos para su manejo y también con frecuencia condiciona la suspensión de efalizumab6. Según esto, resulta remarcable la elevada incidencia de exacerbación inflamatoria generalizada en la presente serie, en la que están sobre-representados los buenos respondedores, y que todavía tendría que ser superior si se hubiese considerado como referencia la población total que recibió efalizumab en algún momento de su enfermedad. De hecho, se observó en un 9,5% de los pacientes con un tiempo de tratamiento superior a los 6 meses, frente al 1,9% de los pacientes que llevaban un tiempo de tratamiento inferior. Sin embargo, las diferencias en cuanto a este efecto adverso en relación con el tiempo de tratamiento solo estuvo cerca de alcanzar el nivel de significación, probablemente por el escaso número absoluto de episodios registrados (p=0,06). Por el contrario, el desarrollo de exacerbación inflamatoria generalizada se asoció, en coherencia con lo descrito en la literatura,con una menor perspectiva de respuesta satisfactoria (p=0,08)6,24,25.
La descripción de la actitud terapéputica del dermatólogo al suspender el fármaco y el desarrollo posterior de rebote o recaída es uno de los puntos más interesantes del trabajo, ya que resulta una situación anómala en la práctica clínica habitual y que simula los condicionantes impuestos por los ensayos clínicos25–27.
En el momento de suspender el tratamiento la mayoría de los facultativos decidieron acompañar la suspensión de efalizumab con el inicio de algún otro tratamiento, bien solapando la suspensión de efalizumab con un fármaco clásico, bien haciendo coincidir la suspensión brusca con el inicio de un nuevo tratamiento. Esta circunstancia es razonable teniendo en cuenta el curso crónico de la psoriasis moderada-grave en la mayor parte de los pacientes. Tanto las pautas de solapamiento como los fármacos sugeridos para ella procedían de la experiencia personal de expertos o de pequeños estudios abiertos con escasa evidencia científica25,26,28. Tanto las semanas de superposición como los fármacos globalmente empleados se correspondieron también con los descritos en estos artículos y resultan coherentes con las perspectivas de inicio de respuesta para los distintos fármacos.
Sin embargo, debe destacarse que hasta en el 39% de los pacientes los dermatólogos decidieron suspender el tratamiento y esperar a la evolución natural. Esta actitud podría tener diversas explicaciones. Por un lado, los resultados de los ensayos clínicos permitían sugerir que la evolución natural era, en la mayor parte de los casos, benigna en los pacientes clasificados como buenos respondedores —la mayoría del presente grupo—, con un periodo de latencia hasta el reinicio de la enfermedad de más de 60 días y una muy baja incidencia de episodios de rebote6,22. Por otro lado, y teniendo en cuenta la gran variabilidad en el índice PASI al inicio del tratamiento, cabe suponer que un porcentaje no despreciable de pacientes presentase una psoriasis moderada y de curso estable, en el que la actitud expectante o el empleo complementario de tratamientos tópicos se estimase como suficiente en un primer momento.
En aquellos casos en los que el facultativo decidió la sustitución de efalizumab por otro agente biológico, la pauta más empleada fue la suspensión brusca y el inicio de un nuevo fármaco, actitud razonable si se tiene en cuenta la escasa evidencia acerca de la seguridad de la superposición de varios fármacos biológicos.
En el estudio estadístico efectuado puede parecer sorprendente que las pautas de superposición o de sustitución terapéutica fuesen más frecuentes en aquellos pacientes con PASI inicial inferior. Sin embargo, es posible que esta última circunstancia no refleje necesariamente una menor gravedad, ya que estos pacientes podrían estar en tratamiento activo con otros fármacos clásicos de forma previa a recibir efalizumab, decidiéndose el paso al fármaco biológico por comorbilidades, por respuesta insuficiente o por riesgo de toxicidad acumulada.
No se encontró ninguna relación estadística entre la actitud adoptada y los distintos parámetros clínicos evaluados, circunstancia que hace difícil establecer qué prioridades emplearon los dermatólogos responsables para tomar esta decisión.
Como datos más relevantes del presente estudio debemos destacar la elevada incidencia de fenómeno de rebote y recaída al suspender el tratamiento.
De este modo, hasta uno de cada tres pacientes presentó un episodio de rebote al suspender el tratamiento, que en la mayoría consistió en un cambio de morfología, también observado en otra serie de reciente publicación29, así como en una extensión superior a la psoriasis inicial. El fenómeno de rebote es una complicación descrita como posible, aunque infrecuente, tras la suspensión del tratamiento con efalizumab, cuya incidencia en su conjunto se había considerado del 14% en ensayos pivotales6,22. Sin embargo, este riesgo se describió como más probable en los malos respondedores, grupo en el que esta posibilidad se acercaba al 25%6. Por este motivo es especialmente significativa la elevada incidencia de rebote en nuestro grupo (33%), el cual estaba representado en su mayoría por buenos respondedores, y en los que en un 60% se llevaron a cabo actuaciones con vistas a minimizar esta posibilidad. Este dato es coherente con el estudio estadístico efectuado, según el cual ninguno de los parámetros clínicos evaluados ni la actitud terapéutica escogida por el dermatólogo permitió predecir el desarrollo de este efecto adverso, aunque fue más frecuente cuando la actitud fue expectante al suspender el tratamiento. Tampoco se hallaron diferencias estadísticamente significativas en cuanto al rebote o a la recaída en función del tiempo de tratamiento.
Mientras que la evaluación a las 12 semanas indica una pérdida de respuesta con respecto al PASI al suspender el tratamiento con efalizumab, aquel vuelve a reducirse a las 24 semanas, de forma presumible por la adición de nuevos fármacos. El PASI al inicio del tratamiento con efalizumab no fue un factor que condicionara la posterior evolución de la psoriasis a las 12 y a las 24 semanas de la retirada de efalizumab, como tampoco lo fue, en su conjunto, la respuesta o no a efalizumab. La variedad de fármacos empleados y lo heterogéneo de las pautas impide evaluar si algún fármaco en particular permitió mejores resultados que el resto, si bien los resultados a corto plazo —12 semanas— fueron algo mejores cuando se emplearon fármacos biológicos.
Sea como fuere, y de forma indistinta al fármaco y estrategia empleados, el control de la psoriasis a las 24 semanas desde la suspensión de efalizumab fue comparable, e incluso superior, al obtenido con este último (porcentaje de pacientes con al menos un PASI 50 de 82,45 vs 73%), circunstancia que permite comprobar la validez de los diversos recursos terapéuticos disponibles para los dermatólogos para el control de la psoriasis moderada y grave.
De los resultados de nuestro estudio destacan, en particular, una incidencia de acontecimientos adversos relacionados con la psoriasis durante el tratamiento con efalizumab y un desarrollo de rebote tras la suspensión del mismo superior a lo esperado.
De ello puede deducirse que los estudios pivotales, aun cuando resultan de indudable valor y peso científico, no siempre predicen con fidelidad, bien por el perfil de los pacientes incluidos, por su diseño o por el limitado seguimiento, los resultados observados en la práctica clínica.
Conflicto de interesesAbbott Laboratories ha contribuido en el trabajo a través de la financiación del estudio estadístico. Sin embargo, este estudio ha sido realizado por una empresa independiente. Abbot no ha tenido conocimiento ni ha participado en la elaboración de los datos presentados en este manuscrito de forma previa a su publicación.
José M. Carrascosa, Carlos Ferrándiz, Eduardo Fonseca, Isabel Belinchón, José L. López Estebaranz, Gregorio Carretero, Marta Ferrán, Manuel Sánchez-Regaña, Esteban Daudén y Lluís Puig han recibido honorarios en concepto de conferenciantes y/o asesores y/o como investigadores en ensayos clínicos esponsorizados por algunas de las siguientes compañías: Merck-Serono, Wyeth Pharmaceuticals (Pfizer), Schering-Plough, Abbott, Janssen, Novartis, Leo Pharma, Amgen, Astellas, Biogen, Centocor Ortho Biotech Inc., Galderma, Glaxo, Stiefel, 3M y Celgene.
Los demás autores no presentan ningún potencial conflicto de intereses con el contenido del presente trabajo.
A ALCE Ingeniería, por su asesoramiento estadístico.
A Laboratorios Abbot, por su colaboración, gracias a la cual se ha llevado a cabo el análisis estadístico.
A todos los centros participantes en el estudio, por su colaboración en la recogida de datos.