El Birt Hogg Dubé es un síndrome que predispone a la aparición de hamartomas del folículo pilosebáceo y a mayor riesgo de presentar tumores renales de diversa extirpe, quistes pulmonares y neumotórax espontáneos.
Presentamos el caso de una mujer de 54 años que presenta desde hace años pápulas blanquecinas centrofaciales e historia familiar de esas mismas pápulas.
Tras biopsia y estudio genético de la paciente se detecta una nueva mutación en el gen implicado en este síndrome.
Patients with Birt-Hogg-Dube syndrome have an increased risk of developing hamartomas of the pilosebaceous unit, renal tumors of various types, lung cysts, and spontaneous pneumothorax. We present the case of a 54-year-old woman with a long history of whitish papules in the central region of the face and a family history of similar lesions. Biopsy and genetic study revealed a new mutation of the gene involved in Birt-Hogg-Dube syndrome.
El síndrome de Birt Hogg Dubé (BHD) es una genodermatosis de herencia autonómica dominante descrita por primera vez en 1977 como la asociación de tres manifestaciones cutáneas: fibrofoliculomas, tricodiscomas y acrocordones que aparecen entre la 3.a y la 4.a década de la vida. Años mas tarde cobró mayor interés al descubrirse su asociación a tumores renales y quistes pulmonares. Actualmente se sabe que el síndrome se debe a la mutación en la línea germinal del gen BHD (FLCN), este codifica una proteína llamada foliculina1,2.
Los fibrofoliculomas y tricodiscomas se presentan clínicamente como múltiples pápulas cupuliformes del color de la piel o blanquecinas, habitualmente en cara cuello y más raramente en parte superior del tronco y parte proximal de las extremidades inferiores. Hoy en día se cree que el fibrofoliculoma y el tricodiscoma son un espectro de una misma lesión.
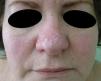
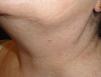
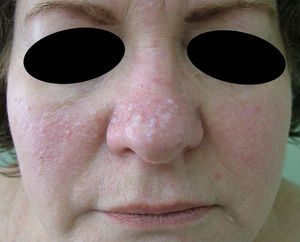
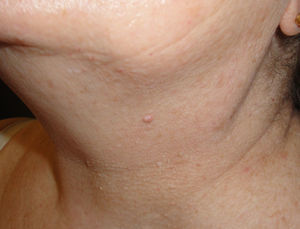
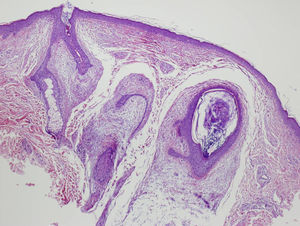
Caso clínicoPresentamos el caso de una paciente de 54 años que consulta por la aparición, 20 años atrás, de múltiples pápulas blanquecinas en mejillas, pirámide nasal (fig. 1) y cuello. (fig. 2).
Intervenida de mioma uterino y de un melanoma en muñeca derecha hace 20 y 18 años respectivamente. En el último año le habían extirpado de ambas axilas 18 acrocordones en otro centro.
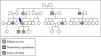
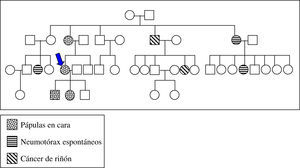
Entre sus antecedentes familiares destacan la presencia de lesiones similares en cara en su madre y dos de sus hijos. Una tía y dos primos por línea materna habían presentado neumotórax espontáneos en la juventud; un tío materno y una de sus hijas habían sido intervenidas de neoplasia renal (fig. 3).
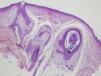
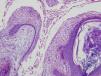
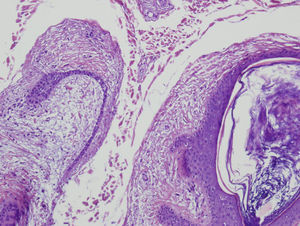
Se biopsia de una de las lesiones en cuello y otra de mejilla izquierda. El estudio anatomopatológico de ambas es compatible con el diagnóstico de fibrofoliculoma (figs. 4 y 5).
Con los datos de la historia clínica, familiar e histopatológicos llegamos al diagnóstico de BHD.
Se realiza radiografía de tórax y ecografía abdominal que descartan quistes pulmonares y masas renales.
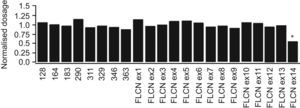
El estudio genético molecular realizado mediante Multiplex ligation-probe amplification (MPLA) puso de manifiesto la presencia de una delección del exón 14 del gen FLCN en la muestra de la paciente (fig. 6). Esta mutación no ha sido previamente descrita en la literatura, pero debido a la pérdida de la señal Poli A, se puede esperar que sea responsable de este síndrome.
DiscusiónLa existencia del síndrome BHD fue discutida por algunos autores alegando que probablemente los fibrofoliculomas y tricodiscomas se tratasen de una misma entidad y que los acrocordones fuesen una asociación casual al ser estos tan frecuentes en la población general3. Es en 1999 cuando Toro et al4 alertan sobre la asociación de este síndrome con la aparición de tumores renales familiares, recomendando la realización de un escáner o ecografía abdominal a los pacientes y a sus familiares.
En 2002 Zbar et al5 asocian el BHD al aumento de incidencia familiar de neumotórax espontáneos en la juventud, asociación ya intuida por Binet et al6.
Se han descrito otras asociaciones al BHD como la poliposis colónica o el carcinoma de colon, llegándose a publicar que el síndrome de BHD y el de Hornstein Knickenberg se trataban de un mismo síndrome7. Sin embargo, un amplio estudio posterior no encontró un riesgo significativo de padecer pólipos y cáncer de colon en el BHD5.
El locus responsable del síndrome fue localizado en el cromosoma 17p11.2 mediante segregación genética con lo que se identificó la línea germinal mutada en un nuevo gen llamado FLCN1,8.
Se ha medido la expresión de mRNA del gen BHD en gran variedad de tejidos entre ellos la piel y anejos, la nefrona distal y el pulmón9.
Estudios subsiguientes en familias con este síndrome permitieron detectar diferentes inserciones, delecciones y mutaciones sin sentido en dicho gen que daban lugar a la producción defectuosa de una proteína: la foliculina2.
La foliculina es una proteína de 579 aminoácidos, cuya función no se conoce con exactitud, se cree que actúa como supresora oncogénica. Se ha identificado la proteína con la que interactúa: FNIP1, que a su vez interactúa con la protein kinasa activada por 5-AMP (AMPK), un importante sensor de energía en las células que regula negativamente la diana de la rapamicina en mamíferos (mTOR) que es la pieza clave en el crecimiento celular y la proliferación10.
El gen FLCN está formado por 14 exones. En la última revisión de Toro et al11 se recogen las 73 mutaciones en línea germinal publicadas donde puede verse que el exón 11 es la localización más frecuente de las mutaciones, en concreto a nivel del nucleótido 1733. Se han descrito mutaciones en el resto de exones a excepción del 8 y el 10. Hasta el momento la única mutación encontrada en el exón 14 es a nivel del nucleótico 2034. La nueva mutación descrita en nuestro caso, la delección completa del exón 14, no había sido descrita previamente en la literatura.
Recientemente la European BHD Consortium ha propuesto unos criterios diagnósticos para el síndrome BHD12 (tabla 1).
Criterios diagnósticos de European BHD Consortium.
Mayores:
|
Menores:
|
| Para diagnóstico de BHD se requiere la presencia de un criterio mayor o dos menores. |
También queremos destacar la asociación en esta paciente del BHD con un melanoma cutáneo. En la literatura hay descritos otros 4 casos en los que el BHD aparece asociado a melanoma1,4,13,14. Nos ha parecido interesante esta asociación teniendo en cuenta que la producción defectuosa de foliculina (una proteína que actuaría como antioncogen) en este síndrome, quizás también estuviese implicada en la protección del organismo frente a otros tumores como el melanoma.
ConclusionesAdemás de describir una nueva mutación en el gen BHD, nos parece interesante recordar que este síndrome, caracterizado por lesiones cutáneas de aspecto banal en cara y cuello, está asociado a patología pulmonar y neoplasia renal que pueden ser diagnosticadas de forma precoz con el seguimiento de estos pacientes mediante ecografías y escáneres periódicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.