Hemos leído con mucho interés la carta científico-clínica de Sardoy et al.1 y creemos que puede complementarse con algunos aspectos interesantes de las alteraciones genéticas de este tipo de lesiones. Existen múltiples variedades clínicas e histológicas de nevus azul, siendo una variante infrecuente el nevus azul agminado, caracterizado por la agrupación de múltiples lesiones azuladas bien delimitadas2.
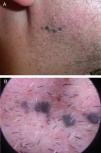
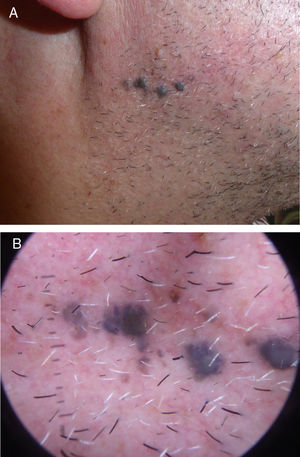
Describimos el caso de un paciente de 52 años de edad, sin antecedentes personales ni dermatológicos relevantes, que acudió a nuestro servicio para la valoración de unas lesiones pigmentadas asintomáticas en la rama mandibular derecha de 10 años de evolución, que progresaban en número (fig. 1A y B). Se realizó una extirpación en bloque para su análisis histológico (fig. 2). Se realizaron tinciones inmunohistoquímicas adicionales con PRreferentially expressed Antigen in Melanoma (PRAME), que fue negativa, y con Ki-67, que mostró un índice de proliferación bajo. Se realizó estudio de secuenciación completa del exón 5 de GNAQ que no mostró alteraciones.
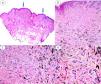
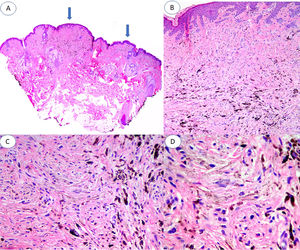
A) Panorámica de la lesión en la que se observan 2 áreas de nevus azul, una de unos 3mm y otra de aproximadamente 1mm (flechas). B) Nidos compactos de melanocitos fusiformes, localizados en dermis papilar y reticular alta sin presencia de nidos en la unión dermoepidérmica (H&E ×4). C) Detalle de la distribución de melanina, con gránulos más densos en la parte más profunda de la lesión (H&E ×10). D) Detalle de los melanocitos que muestra núcleos monomorfos, ausencia de mitosis o necrosis (H&E ×20).
Con todos estos datos clínicos e histopatológicos se realizó el diagnóstico de nevus azul agminado.
Esta presentación infrecuente de nevus azul genera interés por las dudas diagnósticas, principalmente clínicas, que puede plantear con las metástasis de un melanoma. En su estudio, son de interés las alteraciones genéticas potencialmente compartidas con el melanoma uveal, el nevus de Ota o el nevus de Ito3-7.
La mutación genética más frecuentemente descrita en los nevus azules, que aparece hasta en el 83% de los mismos, es la mutación somática en GNAQ y GNA11 (subunidades alfa que forman parte de las proteínas G heterotriméricas implicadas en señalización celular mediada por receptores acoplados a proteínas G), considerada una mutación driver. Esta mutación produce una actividad constitutiva de estas proteínas, que activan de forma permanente la vía de señalización de Ras, implicada en la regulación del ciclo y la proliferación celular, actuando por tanto como oncogenes3. Consecuentemente, en los nevus azules con esta mutación, aumenta la actividad de la proteína Erk-2, activada por MEK.
En la literatura solo hay un caso de nevus azul agminado publicado con una mutación demostrada, localizada en c.626A>T (p.Glu209Leu) en GNAQ8.
En algunos de los casos, como el nuestro, en los que no se detecta mutación en GNAQ, se han descrito mutaciones activadoras en el receptor cysteinyl leukotriene receptor 2(CYSLTR2), implicado en una vía de señalización análoga a la de GNAQ, con activación final de los mismos procesos intracelulares. Se trata de otra mutación driver, mutuamente excluyente con GNAQ6.
Sobre ambas mutaciones driver,GNAQ/GNA11 o CYSLTR2 se pueden producir otras mutaciones adicionales en diferentes vías celulares, que favorecerían la progresión y malignización de las lesiones4–7. La más ampliamente conocida es la mutación en la proteína ligando de BRCA1 (BAP1).BAP1 actúa como un supresor tumoral y está implicada en procesos de reparación de ADN, el sistema ubiquitina-proteasoma, la regulación de la transcripción y la modulación de la cromatina5. La inactivación de esta proteína, bien por deleción parcial del locus del BAP1 en el cromosoma 3 o por una alteración en la fosforilación o ubiquitinización de su cadena proteica, suponen una progresión de la proliferación celular que puede producir la transformación maligna del nevus azul5.
Además, estas alteraciones descritas para el nevus azul y para el melanoma imitando nevus-azul guardan una estrecha relación con las encontradas en otros procesos patológicos como el melanoma uveal. Por ejemplo, la mutación en GNAQ se ha descrito en el 46% de los melanomas uveales, actuando también como mutación driver sobre la que se desarrollaran otras mutaciones en BAP1 u otras vías implicadas en la inestabilidad cromosómica5.
El conocimiento de las alteraciones genéticas y en las vías de señalización intracelular en estas lesiones no es solo de interés diagnóstico, sino que puede tener implicaciones terapéuticas. Por ejemplo, el uso de inhibidores de MEK, asociado o no con inhibidores de PI3K o MTOR, ha sido sugerido como una posible terapia para el tratamiento del melanoma uveal y podría serlo para nevus azul con progresión a melanoma4.
Finalmente, la tinción inmunohistoquímica PRAME es un marcador que ha sido recientemente propuesto como útil en el diagnóstico diferencial entre nevus y melanoma y que, además, se ha identificado como un biomarcador de riesgo metastásico en melanoma uveal9,10. En nuestro caso, su negatividad, concuerda con el resto de datos histopatológicos que favorecen la consideración de nuestro caso como nevus azul y, hasta dónde hemos podido revisar, nuestro caso es el primero de nevus azul agminado teñido con PRAME.
El conocimiento de la genética de los nevus azules con una presentación clínica atípica, como nuestro caso de nevus azul agminado, es importante dadas sus potenciales implicaciones diagnósticas y terapéuticas. La inmunohistoquímica con PRAME y el estudio genético incrementan la especificada diagnóstica de las lesiones melanocíticas atípicas.
Conflictos de interesesLa Dra. Llamas ha sido ponente y consultora para Janssen-Cilag, AbbVie, Celgene, Pfizer, Novartis, Lilly, Almirall y Leo-Pharma, y ha participado en ensayos clínicos. El resto de autores no tienen conflictos de intereses.
A todo el equipo de Friedrichshafen por su apoyo incondicional, a la Dra. Gabriele Palmero, al Dr. Maximiliano Aragües y al Dr. Javier Fraga.