Los primeros estudios publicados en 2005 y 2006 hallaron una ausencia de efectividad de imatinib en pacientes con melanoma metastásico1,2. Sin embargo, en un estudio publicado en 2006, en el que se analizaron 102 melanomas primarios, se encontraron mutaciones o aumento del número de copias de KIT en el 39% de los melanomas mucosos, en el 36% de los acrales, el 28% de los melanomas localizados en la piel con daño solar crónico y en el 0% de los melanomas localizados en la piel sin daño solar crónico3. Aparte de casos aislados de pacientes con melanomas metastáticos con KIT mutado en los que se lograron regresiones parciales o completas con imatinib4,5, recientemente se han publicado los resultados de 2 series de pacientes con melanoma metastásico que recibieron imatinib tras comprobar que sus tumores tenían alteraciones genéticas en KIT (mutaciones o amplificaciones)6,7. Carvajal et al. consiguieron una tasa de respuestas globales duraderas del 16% en un grupo de 25 pacientes6. Por otra parte, Guo et al., en un grupo de 43 pacientes de origen asiático, hallaron una tasa de control de enfermedad del 53,5% (respuesta parcial en 10 pacientes y enfermedad estable en 13)7. En una publicación reciente en Lancet, Romano et al. manifestaban que en su experiencia en el Memorial Sloan-Kettering, las mutaciones en los exones 11 y 13 en KIT predicen mejor la respuesta al tratamiento con imatinib que las amplificaciones en este gen8. Diversos estudios han aclarado que la mera expresión inmunohistoquímica de KIT no se correlaciona con la respuesta a imatinib.
Dada la reciente y limitada experiencia sobre imatinib en el tratamiento del melanoma metastásico consideramos relevante dar a conocer nuestros datos sobre la frecuencia de mutaciones en KIT (tabla 1), así como los resultados obtenidos con imatinib en un pequeño grupo de pacientes con mutación confirmada. Describimos el caso de un paciente tratado con imatinib en el que se consiguió una respuesta parcial temporal con reducción en el número y tamaño de sus metástasis viscerales. En la tabla 2 resumimos los datos fundamentales de otros 2 pacientes tratados con imatinib.
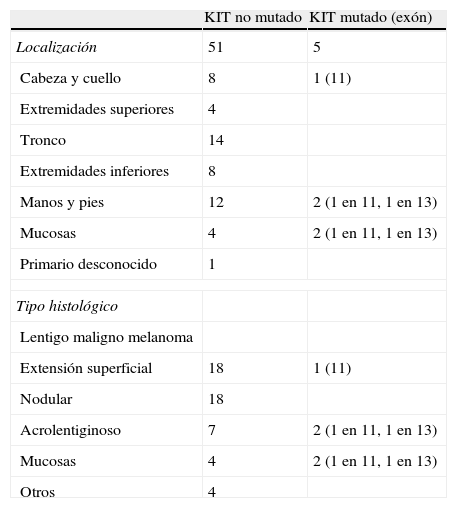
Resultados de la evaluación mediante biología molecular del estado de KIT en 56 pacientes con melanoma divididos por localización y tipo histológico
| KIT no mutado | KIT mutado (exón) | |
| Localización | 51 | 5 |
| Cabeza y cuello | 8 | 1 (11) |
| Extremidades superiores | 4 | |
| Tronco | 14 | |
| Extremidades inferiores | 8 | |
| Manos y pies | 12 | 2 (1 en 11, 1 en 13) |
| Mucosas | 4 | 2 (1 en 11, 1 en 13) |
| Primario desconocido | 1 | |
| Tipo histológico | ||
| Lentigo maligno melanoma | ||
| Extensión superficial | 18 | 1 (11) |
| Nodular | 18 | |
| Acrolentiginoso | 7 | 2 (1 en 11, 1 en 13) |
| Mucosas | 4 | 2 (1 en 11, 1 en 13) |
| Otros | 4 | |
El ADN fue extraído del tumor primario, o cuando este no estaba disponible de cualquier otro implante metastásico, y se realizó una secuenciación de los exones 9, 11, 13 y 17.
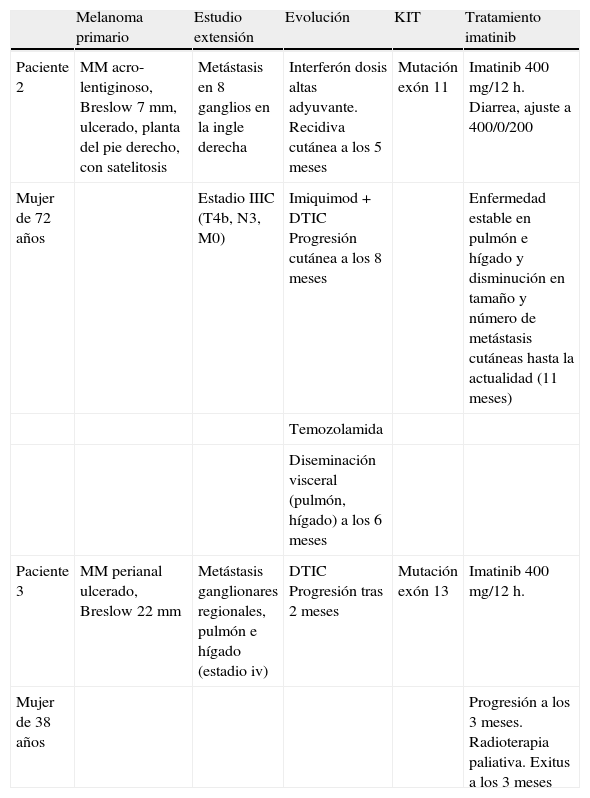
Resumen de la historia clínica y respuesta al tratamiento con imatinib en los pacientes 2 y 3
| Melanoma primario | Estudio extensión | Evolución | KIT | Tratamiento imatinib | |
| Paciente 2 | MM acro-lentiginoso, Breslow 7mm, ulcerado, planta del pie derecho, con satelitosis | Metástasis en 8 ganglios en la ingle derecha | Interferón dosis altas adyuvante. Recidiva cutánea a los 5 meses | Mutación exón 11 | Imatinib 400mg/12h. Diarrea, ajuste a 400/0/200 |
| Mujer de 72 años | Estadio IIIC (T4b, N3, M0) | Imiquimod+DTIC Progresión cutánea a los 8 meses | Enfermedad estable en pulmón e hígado y disminución en tamaño y número de metástasis cutáneas hasta la actualidad (11 meses) | ||
| Temozolamida | |||||
| Diseminación visceral (pulmón, hígado) a los 6 meses | |||||
| Paciente 3 | MM perianal ulcerado, Breslow 22mm | Metástasis ganglionares regionales, pulmón e hígado (estadio iv) | DTIC Progresión tras 2 meses | Mutación exón 13 | Imatinib 400mg/12h. |
| Mujer de 38 años | Progresión a los 3 meses. Radioterapia paliativa. Exitus a los 3 meses |
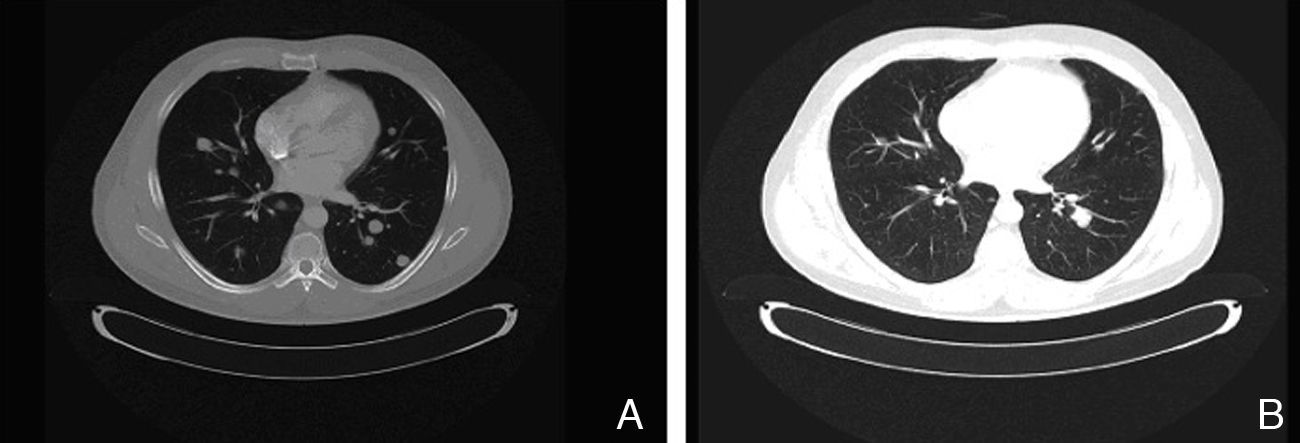
El caso clínico que comentamos corresponde al paciente número 1. Se trata de un varón de 49 años con melanoma en el pene (Breslow de 9mm, ulceración y 6 mitosis/mm2) y múltiples metástasis inguino-ilíacas bilaterales (estadio iiiC; pT4b, N3, M0). Tras realizar tratamiento quirúrgico se inició tratamiento adyuvante con interferón a dosis altas. En el séptimo mes de tratamiento con interferón se evidenciaron metástasis cutáneas en el escroto, pulmonares y ganglionares en la ingle izquierda. La enfermedad progresó tras 2 líneas de quimioterapia (dacarbazina y posteriormente carboplatino). En este momento se estudió mediante biología molecular KIT en el tumor del paciente identificando una mutación en el exón 11, por lo que se inició tratamiento con imatinib 400mg, 2 veces al día. Durante la evolución del paciente se había evidenciado una elevación progresiva en los niveles de S100 (hasta 2,49, VN: <0,4μg/l) y LDH (hasta 434, VN: 100-250 U/l). Tras un mes de tratamiento con imatinib se apreció clínicamente una respuesta parcial de las lesiones cutáneas y ganglionares, así como normalización de las cifras de S100 (0,22) y disminución de LDH (303). Tres meses más tarde una TAC identificó también una respuesta parcial en las metástasis pulmonares (fig. 1). Sin embargo, transcurridos 3 meses se observó un nuevo aumento de S100 (0,71) y de LDH (378), confirmándose a las 4 semanas progresión de la enfermedad pulmonar y metástasis nuevas en el mediastino. El paciente fue tratado en última instancia con ipilimumab. A las pocas semanas se evidenciaron metástasis múltiples en el SNC, por lo que se administró radioterapia paliativa y corticoides sistémicos, falleciendo el paciente a los 2 meses.
A la vista de nuestros resultados (una respuesta parcial temporal, una estabilización duradera de la enfermedad y una progresión) consideramos que los fármacos que actúan inhibiendo KIT deben ser valorados en aquellos pacientes con un melanoma que haya progresado con la quimioterapia convencional, y en los que se haya demostrado que existe una mutación de KIT. Nuestra tabla confirma los resultados obtenidos por otros grupos sobre los tipos de melanomas en los que podemos hallar esta mutación: acrales y mucosos. Aunque uno de los melanomas en los que encontramos una mutación de KIT correspondía a un tipo histológico de extensión superficial, el tumor estaba localizado en la frente de una paciente de 55 años, con un grado de elastosis solar moderado. Si bien los melanomas acrales y mucosos son relativamente infrecuentes, en ellos no suelen hallarse mutaciones en BRAF, y por tanto no son susceptibles a los nuevos tratamientos con inhibidores de esta tirosín-cinasa, como vemurafenib. La confirmación de una mutación en KIT ofrece por tanto una posibilidad adicional de tratamiento en este grupo de melanomas. Los nuevos inhibidores de KIT, así como la asociación de estos fármacos con los quimioterápicos tradicionales, mejorarán probablemente en un futuro próximo los resultados hasta ahora alcanzados.