La fototerapia es una opción terapéutica empleada en dermatitis atópica (DA) y recomendada en múltiples guías.
ObjetivosEvaluar la eficacia de las distintas modalidades de fototerapia y fotoquimioterapia en el tratamiento de pacientes con DA moderada-grave, mediante una revisión sistemática.
Material y métodosConsideramos los ensayos clínicos aleatorizados (ECA) realizados en pacientes con DA, aceptando cualquier medida de desenlace. Localizamos los artículos mediante una búsqueda electrónica, utilizando Medline (vía Ovid), Embase y Cochrane Central Register of Controlled Trials. Adicionalmente, buscamos los ensayos clínicos registrados en Current Controlled Trials y en la WHO International Clinical Trials Registry Platform.
ResultadosIncluimos 21 ECA en el análisis cualitativo (961 pacientes). Dos ECA incluyeron niños y adolescentes (32 pacientes). Las modalidades UVBBE y UVA1 mostraron resultados de eficacia similares en diversas medidas de desenlace. Dos ECA incluyeron la terapia PUVA. No se describieron efectos secundarios graves. En general, el riesgo de sesgos fue elevado y la calidad de las publicaciones baja, en cuanto a comunicación de la metodología empleada y los resultados obtenidos.
ConclusionesExiste evidencia para el uso de UVBBE y UVA1 en DA moderada-grave. La evidencia para el uso de PUVA en DA es mínima, así como los datos del uso de la fototerapia en la infancia. En futuros estudios sería recomendable estandarizar los criterios de gravedad de la DA y las escalas de valoración de los pacientes, homogeneizar las técnicas de irradiación y establecer un periodo de seguimiento mínimo.
Phototherapy is a treatment option for atopic dermatitis recommended by several guidelines.
ObjectiveTo perform a systematic review of the efficacy of different modalities of phototherapy and photochemotherapy in moderate to severe atopic dermatitis.
Material and methodsWe considered all randomized clinical trials (RCTs) performed in patients with atopic dermatitis, and accepted all outcome measures. Articles were identified via an online search of the MEDLINE (via Ovid) and Embase databases and the Cochrane Central Register of Controlled Trials. We also searched for clinical trials registered in Current Controlled Trials and in the World Health Organization's International Clinical Trials Registry Platform.
ResultsTwenty-one RCTs (961 patients) were included in the qualitative analysis. Two of the trials included children and adolescents (32 patients). The efficacy of narrow-band UV-B and UV-A1 phototherapy was similar for the different outcome measures contemplated. Two RCTs assessed the efficacy of psoralen plus UV-A therapy (PUVA). No serious adverse events were described. In general, the publications reviewed were characterized by a high risk of bias and poor reporting of methodology and results.
ConclusionsThere is evidence for the use of narrow-band UV-B and UV-A1 phototherapy in moderate to severe atopic dermatitis. Evidence supporting the use of PUVA in atopic dermatitis is scarce and there is little information on the use of phototherapy in childhood. For the purpose of future studies, it would be advisable to use comparable criteria and scales for the evaluation of disease severity and patients, to standardize radiation methods, and to establish a minimum follow-up time.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica y recidivante que afecta a individuos de cualquier edad, fundamentalmente durante la infancia y a los adultos jóvenes1.
Las guías terapéuticas aconsejan un enfoque individualizado, incluyendo recomendaciones sobre hidratación cutánea, corticoides y/o inhibidores de la calcineurina por vía tópica, antihistamínicos sistémicos y antibióticos tópicos o sistémicos cuando se precisen. Los casos más complejos suelen requerir tratamiento con fotoquimioterapia, corticoides sistémicos y/o inmunosupresores, en ocasiones en combinación1,2.
La fototerapia ha sido ampliamente empleada en la DA desde la década de los 70 del siglo pasado, introduciéndose con el paso de los años diferentes modalidades con luz ultravioleta (UV): UVA y psoralenos (PUVA o fotoquimioterapia), UVB de banda ancha (UVBBA 280-315nm), UVB de banda estrecha (UVBBE=pico 311nm), UVA (315-400nm), UVA1 (340-400nm) y UVAB (UVA seguida de UVB o ambas exposiciones simultáneas). Son escasos los datos sobre eficacia de la fototerapia, basados en ensayos clínicos controlados.
En 2007 se publicó la primera revisión sistemática (RS) sobre fototerapia en el manejo de la DA3. Recientemente ha sido publicada otra RS4 que, junto con la presente, actualiza los resultados de nuevos ensayos clínicos publicados en los últimos años e incluye la modalidad PUVA.
El objetivo principal de este trabajo es evaluar la eficacia de las distintas modalidades y regímenes de fototerapia y fotoquimioterapia en el tratamiento de pacientes con DA moderada-grave, mediante una revisión sistemática de la literatura.
Material y métodosLocalización de los estudiosUtilizamos las bases de datos Medline (vía Ovid), Embase y Cochrane Central Register of Controlled Trials (CENTRAL) para localizar los artículos hasta la semana 7 de 2013 (Embase) y hasta el 18 de febrero de 2013 (Medline y CENTRAL). Los términos relacionados con el tipo de pacientes y las intervenciones fueron términos MeSH y términos libres. Los términos relacionados con el tipo de diseño se basaron en la estrategia Cochrane de búsqueda altamente sensible5. Los resultados se limitaron a estudios realizados en humanos y publicados en inglés, francés y español. Antes de realizar las búsquedas electrónicas se localizaron 2 artículos que cumplían con los criterios de inclusión, y que deberían ser recuperados por las búsquedas en todas las bases de datos6,7. Las estrategias de búsqueda pueden solicitarse al autor de la correspondencia.
Adicionalmente, se realizó una búsqueda en «PubMed clinical queries» con el filtro narrow search, una búsqueda manual de las referencias potencialmente relevantes citadas en los estudios incluidos, y se contactó con un experto en el tratamiento con fototerapia de DA (Dr. José Manuel Carrascosa), que revisó nuestros resultados para detectar la posible ausencia de estudios relevantes.
Finalmente, se localizaron los ensayos clínicos registrados en Current Controlled Trials (www.controlled-trials.com) y en WHO International Clinical Trials Registry Platform (ICTRP) (ht@@tp://apps.who.int/trialsearch/).
Criterios de inclusión de estudiosSe consideraron aquellos ensayos clínicos aleatorizados (ECA) realizados en pacientes diagnosticados de DA, según criterios clínicos, y sin límite de edad. Se aceptó como intervención cualquier modalidad de fototerapia, o su combinación con psoralenos (fotoquimioterapia). Se excluyeron los estudios realizados en animales, y aquellos en los que la intervención se aplicaba en zonas localizadas (manos o pies) o que el empleo de corticoides tópicos y/o sistémicos e inmunosupresores no estuviera sistematizado o controlado. Se aceptó cualquier medida de resultado, con preferencia de medidas de mejoría de la enfermedad o de la calidad de vida de los pacientes, antes que medidas económicas o de laboratorio.
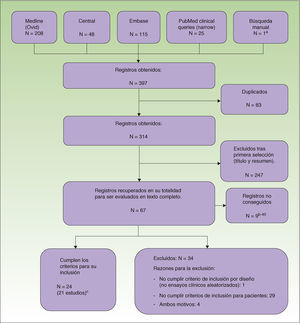
Manejo y extracción de datosLos resultados obtenidos por las búsquedas fueron descargados a un procesador de referencias bibliográficas (EndNote®, Thomson Reuters, 2011), donde los revisores filtraron los artículos en función del título y el resumen. Los artículos potencialmente relevantes fueron evaluados en su totalidad de forma independiente por parejas de revisores. Para la extracción de datos se empleó un cuestionario que incluía un formulario de calidad de los estudios, basado en la herramienta Cochrane risk of bias5. Durante este proceso todas las referencias duplicadas, descartadas y seleccionadas fueron registradas en el diagrama de flujo de la declaración PRISMA (fig. 1).
Diagrama de flujo de artículos durante el proceso de la revisión.
a Kowalzick et al. 32
b Kowalzick et al.32; David 33; Der-Petrossian et al.34; Granlund Het 35; Niedner y Iliev36; Potekaev et al.37; Raap et al.38; Schiener et al.39; Sowden et al.40
c Heinlin et al.6; Der-Petrossian et al.28; Reynolds et al.30
Se excluyeron 34 artículos del análisis por presentar un diseño diferente de ECA y/o no cumplir el criterio de inclusión de pacientes (fig. 1).
Estudios incluidosSe incluyeron 24 registros (correspondientes a 21 ECA) en el análisis (961 pacientes). Tres de los estudios8–10 fueron además publicados en forma de resumen de congreso11–13. Dos estudios14,15 incluyeron niños y adolescentes (32 pacientes). Dos estudios se realizaron en Asia14,16 y el resto en Europa. Tres fueron multicéntricos6,17,18. La mayoría de los estudios comparaban distintas modalidades de fototerapia, incluyendo UVA1 a altas dosis (UVA1AD), a dosis medias (UVA1DM), UVB, combinación de UVA y UVB (UVAB), UVBBE y PUVA. Otras modalidades fueron LASER Excimer (LE)8, fototerapia Full-Spectrum-Light (FSL)16 y balneofototerapia sincrónica (BFTS)6. Un estudio evaluó la utilidad de la reflectancia cutánea para reducir la dosis acumulada de radiación UVB19. Tres estudios compararon fototerapia con otros tratamientos: ciclosporina17, pimecrolimus tópico14 y corticoterapia tópica asociada a fototerapia15. El periodo de seguimiento mínimo fue de 4 semanas9,14,20 y el máximo de 66,21 a 12 meses7,17. En varios estudios no se realizó periodo de seguimiento10,15,18,19,22–27. La mayoría utilizaron como medidas de desenlace variaciones en diversas escalas clínicas. Las más empleadas fueron el SCORingAtopic Dermatitis (SCORAD)o el SCORAD modificado6,7,9,16,17,19,21,28, la escala de Costa10,15,18,27, la escala de Leicester15,27, o el score de severidad29 de Hanifin y Rajka23–26. Algunos incluyeron escalas de calidad de vida (Eczema Disability Index17, Sickness Impact Profile6) y de evaluación del prurito8,14,20,22,27. La dosis acumulada fue utilizada como medida de desenlace en un estudio19 y la duración de la remisión fue empleada en 2 estudios7,21.
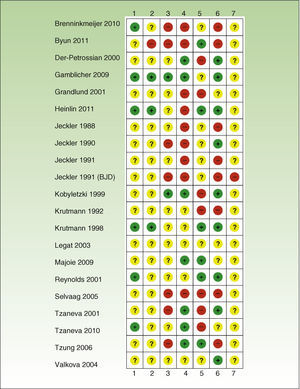
Riesgo de sesgos en los estudios incluidosEn general, el riesgo de sesgos fue elevado, siendo frecuente la ausencia de información relevante en las publicaciones (tablas 1–6 y fig. 2).
Estudios que comparan UVA, UVB, UVAB
| Jekler y Larkö 198824: UVB vs. luz visible, 8 semanas o hasta curación | |||||
|---|---|---|---|---|---|
| Estudio 1: 0,5 ó 1,0 DEM-UVB vs. luz visible (LV); 28 pacientes | Medida desenlace:Puntuación total*Variable PruritoValoración globalEscala de curación** | Basal9,9 (6,5-19)2,2 (1-3)1,5 (1-3)- | UVB5 (1-9)0,8 (0-2)0,7 (0-1,5)1,9 | LV8 (4-13)1,8 (0,5-3)1,4 (0,5-2)0,7 | p<0,001 p<0,001N.S.p<0,0001 |
| Estudio 2: 0,8 DEM-UVB vs 0,4 DEM-UVB. 31 pacientes. | Puntuación total*Variable PruritoValoración global | Basal10,7 (6-19)2,4 (1-3)1,5 (1-3) | 0,8 DEM7 (0-21)1,2 (0-3)0,7 (0-1,5) | 0,4 DEM6,6 (0-21)1,2 (0-3)1,4 (0,5-2) | p<0,01N.S.N.S. |
| COMENTARIO: Las pérdidas son elevadas en ambos estudios (11 en el 1° y 6 en el 2°). Estudio 1: Alto riesgo de sesgo de detección (el evaluador era el IP). No proporcionan los resultados en función de la DEM. Estudio 2: el análisis estadístico no mostró diferencias en la eficacia de ambos tratamientos. Notificación selectiva (no proporcionan los cambios en la superficie afectada). | |||||
| Jekler y 199025: UVB vs. UVAB, 3 sesiones/s., 8 s. 39 pacientes | |||||
|---|---|---|---|---|---|
| Medida desenlace:Puntuación total*Variable PruritoValoración global | Basal10,8 (7-19)2,4 (1-3)1,7 (1-3) | UVB6,1 (0-17)1,2 (0-3)0,80 (0-3) | UVAB5,2 (0-15)1,0 (0-3)0,65 (0-2) | P=0,002P=0,04P=0,03 | |
| Escala de curación** (sobre 30 pacientes, UVB vs. UVAB)Valoración subjetiva de eficacia:Mayor uso de hidrocortisonaEfectos adversos: | “3” 4 vs 6; “2” 21 vs 20; “1” 4 vs 3; “0” 0; “–1” 1 vs 1.“mejor UVAB” 14, “igual ambos” 10.Lado UVB (3/20), lado UVAB (1/20), igual ambos 16/20.Xerosis leve y moderada 15 vs 13. Xerosis grave 5 vs 2.Quemaduras: leve y moderada 15 vs 3; grave 6 vs 0 | ||||
| COMENTARIO: Posible superioridad en la terapia combinada UVAB con respecto a UVB con esta pauta. Riesgo de sesgos: aleatorización no detallada, alto riesgo de sesgo de detección de los participantes, de los investigadores y del evaluador del resultado. | |||||
| Jekler 199126: UVA vs. UVB, 3 sesiones/s, 8 s. o hasta curación; 33 pacientes. | |||||
|---|---|---|---|---|---|
| Medida desenlace:Puntuación total*Variable PruritoValoración global | Basal10,3 (6-18)2,2 (1-3)1,8 (1-3) | UVA5,5 (1-12)1,1 (0-2)1 (0-2) | UVB6,4 (3-15,5)1,3 (0-2)1,3 (0,5-2,5) | p<0,02p=0,01 | |
| Escala de curación** (UVA vs UVB)ExtensiónValoración subjetiva de eficacia | “3” 1 vs 0; “2” 14 vs 13 “1” 6 vs 6; “0” 0 vs 2; “–1” 0 vs 0.10,1% a 5,4% (UVA) y de 10% a 6,2% (UVB) (P<0,05)13 “mejoría en la zona UVA” y 4 no notaron diferencia. | ||||
| COMENTARIO: Posible superioridad UVA con esta pauta. Aleatorización no detallada. Elevado riesgo de sesgos de realización, detección y notificación selectiva: solo se analizaron algunas de las variables; 4 pacientes no completaron su valoración subjetiva de la eficacia de las intervenciones. | |||||
| Jekler 199123 | |||||
|---|---|---|---|---|---|
| Estudio 1:Bajas dosis de UVB vs UVAB.20 pacientes | Medida de desenlacePuntuación total*Variable pruritoValoración global | Basal10,8 (7-15,5)2,4 (1-3)1,9 (1-2,5) | UVB8,8 (4,5-14)1,5(0-2)1,8 (1-2,5) | UVAB5,3 (1,1-11)0,8 (0-2)0,9 (0-2) | p<0,001p<0,001p<0,001 |
| Escala de curación** (grupo UVB vs UVAB, pacientes): “3” 0 vs 2; “2” 5 vs 15; “1” 11 vs 1; “0” 2 vs 0; “-1” 0 en ambos. | |||||
| Estudio 2:UVA vs UVAB. 28 pacientes. | “Mejores resultados en la puntuación total y la valoración global con UVAB frente a UVA. Sin diferencias en cuanto al prurito.” | ||||
| COMENTARIO: Aparente superioridad de UVAB frente a UVB o UVA. Elevado riesgo de sesgos: de detección (cegamiento del evaluador de los resultados), desgaste (no se realiza análisis por ITT con los individuos excluidos, faltan cuestionarios de pacientes) y notificación (registran más variables de las que se analizan; no proporcionan resultados concretos del estudio 2). | |||||
Abreviaturas: CC: corticosteroides; DA: dermatitis atópica; DEM: dosis eritemática mínima; IP: investigador principal; ITT: Intención de tratar; LV: luz visible; s.: semana; UVA: Ultravioleta A; UVB: Ultravioleta B; UVAB: Asociación UVA y UVB.
Estudios que comparan UVA1 a altas dosis (UVA1AD, 130J/cm2) y UVA1 a dosis medias (UVA1DM)
| Krutmann 199210,13: UVA1AD (130J/cm2) vs. UVAB, 15 sesiones (25 pacientes) | |||
|---|---|---|---|
| Medidas de desenlace:Total en la escala de Costa*Score de gravedadScore topográfico | Basal53±1,936,4±1,718,7±1,4 | UVA1AD14±3,28,9±1,16,3±0,8 | Diferencias estadísticamente significativas (P<0,01) en las 3 medidas comparando UVA1AD con UVAB |
| COMENTARIO. UVA1AD parece efectivo para exacerbaciones agudas en comparación con UVAB. Elevado riesgo de sesgos de desgaste y de notificación: no se especifican los resultados del grupo UVAB (solo los basales), los valores basales descritos en la tabla inicial discrepan de los reflejados en el texto. El análisis más adecuado sería la comparación de las diferencias entre el valor basal y final, para cada medida de desenlace, en lugar de las comparaciones en cada momento. No se especifican de forma sistemática los eventos adversos. Se desconoce si el 10° paciente del grupo UVAB, que abandonó el tratamiento al 3° día, fue incluido en el análisis. | |||
| Krutmann 199818: UVA1AD vs. UVAB vs. crema o pomada de fluocortolona 0,5%, 10 días (53 pacientes). | |||
|---|---|---|---|
| Medidas de desenlace: Escala de Costa | Descenso significativo en la escala de Costa comparando UVA1AD o fluocortolona frente a UVAB (p<0,0001 en ambos casos), así como comparando UVA1AD frente a fluocortolona (p<0,002) | ||
| COMENTARIO: UVA1AD parece superior a UVAB, y al menos igual de eficaz al tratamiento tópico con fluorocortolona. Se hace explícito el uso de secuencia de aleatorización y se realiza aleatorización en bloque. Riesgo alto de sesgo de desgaste: no se especifican los resultados, solo el nivel de significación estadística de las diferencias obtenidas y su representación en una figura. El análisis más adecuado sería la comparación de las diferencias entre el valor basal y final, en lugar de las comparaciones en cada momento. No se describen los efectos adversos. | |||
| Tzaneva 200121: UVA1AD (130J/cm2 o dosis equivalente a 1 MED si era<130J/cm2, con incrementos de 10J/cm2 hasta máximo 130J/cm2) vs. UVA1DM (50% del régimen UVA1AD), 5 sesiones/semana, 3 semanas de duración y 6 meses de seguimiento | |||
|---|---|---|---|
| Medidas de desenlace:SCORADm** semana 1SCORADm semana 2SCORADm semana 3 | UVA1AD33,4% (8,8-52,7%)38,4% (1,5-56,7%)34,7%(0-46,9%) | UVA1DM29,7% (8,3-46,8%)36,4% (12,6-56,6%)28,2% (0-46,9%) | En todos los casos p>0,05. |
| “Recidivas”: tras 2, 4 y 12 semanas (6 pacientes), un paciente en remisión a los 6 meses.No hubo diferencias bilaterales en cuanto al tiempo hasta la recidiva o su intensidad | |||
| COMENTARIO: No hubo diferencias estadísticamente significativas en la eficacia de los 2 tratamientos, aunque la muestra es pequeña. De 10 pacientes iniciales solo se siguió a 7 y las recurrencias fueron frecuentes. Riesgo de sesgos: de aleatorización (se desconoce el procedimiento), no hay enmascaramiento de pacientes, no se definen las “recidivas” | |||
| Kobyletzki 19999,12: UVA1-cl Vs. UVA1 Vs. UVAB 5 sesiones/semana, 3 semanas de tratamiento y 4 de seguimiento | |||
|---|---|---|---|
| Medidas de desenlace:RCAcl 90%Acl 60%SCORAD*** basalSCORAD semana 3SCORAD semana 7 | UVA1-cl85,4%27,1%58,3%71,7±12,623,3±10,6 (P<0,05)24,9±10,2 | UVA177,3%15,9%61,4%69,8±10,228,8±6,9 (P<0,05)30,8±9,2 | UVAB37,5%6,3%31,3%71±9,441,4±9,9 (P<0,05)52,3±11,4 |
| Pérdidas: 5 pacientes en grupo UVA1 (malestar, prurito y exacerbación). | |||
| COMENTARIO: UVA1-cl parece superior a UVA1 y ambos superiores a UVAB, aunque el descenso en SCORAD es significativo en los 3. El SCORAD tras 4 semanas de seguimiento se mantuvo en niveles más bajos con UVA1-cl. Se desconoce el modo de aleatorización. No se realiza análisis por ITT y las pérdidas son elevadas en algunos grupos. | |||
Escala de Costa: consta de un score de severidad con 10 variables que se puntúan de 0 a 6 (eritema, edema, vesículas, exudación, costras, liquenificación, descamación, prurito y pérdida de sueño) y un score topográfico con 10 localizaciones (cara, cuello, tronco anterior o posterior, nalgas, brazos, manos, piernas, rodillas, pies) que se puntúa de 0 a 3 según el grado de extensión.
SCORAD (SCORing Atopic Dermatitis): Evalúa la gravedad de la dermatitis atópica en 3 aspectos: extensión o superficie afectada, intensidad (se puntúa de 0 a 3 la severidad del eritema, edema/pápulas, excoriaciones, exudación, liquenificación y xerosis) y repercusión del prurito y problemas de sueño (de 0-10).
SCORAD modificado (SCORADm): Se excluyó de la valoración el grado de afectación facial, pues dicha localización solo se irradió con UVA1, y la valoración subjetiva de la repercusión en el sueño.
Abreviaturas: Acl 90%: Aclaramiento del 90%; Acl 60%: aclaramiento del 60%; DA: dermatitis atópica, ECP (eosinophil cationic protein) (los niveles se proporcionan en 10-6g/L): UVA1AD: UVA a altas dosis, UVA1DM (UVA1 a dosis medias) UVA1-cl: UVA1 cold-ligth; N.S.: no significativo; RC: remisión completa.
Estudios que comparan UVBBE con UVA1DM
| Reynolds 200130: UVBBE vs. UVA1DM (máx. 15J/cm2) vs. LV (2 sesiones/s., 12 s., seguimiento 3 meses); 73 pacientes. | |||
|---|---|---|---|
| Medidas de desenlace:Reducción media en la actividad total de la DA*Disminución del prurito:Mejoría en el sueño:Disminución en el uso de CCT | UVBBE9,4 puntos>que LV (IC95% 3,6-15,2)y 5 puntos>que UVA1 (95% CI -0,6-10,5).90%71%65% | UVA1DM4.4 puntos>que LV(IC 95% -1-9,8).63%53%56% | |
| Reducción media en la extensión de la DA: con UVBBE fue 7,8%>UVA1DM (IC 95%: 2,8-12,7) y 6,7>LV (IC 95%: 1,5-11,9).A los 3 meses actividad total de la DA menor con UVBBE que con UVA1DM y LV (respectivamente –36% [7 frente a 65] y –36% [8 frente a 64]). | |||
| COMENTARIO: UVBBE fue superior en el control de la DA, con resultados mantenidos a 3 meses de seguimiento. La aleatorización se realizó mediante un programa informático y el investigador no intervino en la evaluación de los pacientes. No consta cómo se realizó el enmascaramiento de los pacientes ni de los evaluadores | |||
| Legat 200327: UVBBE vs. UVA1DM (dosis máx 50J/cm2) (2 sesiones/s., 8 s.) 9 pacientes. | |||
|---|---|---|---|
| Medidas de desenlace:% Reducción en la escala de Costa**:% Reducción en la escala de Leicester***:% Reducción VAS lesiones cutáneas:% Reducción VAS pruritoEvaluación global del efecto del tto | UVBBE40 (2-61) (P=0,004)50 (2-74) (P=0,01)71 (3-98) (P=0,004)67 (−8-98) (P=0,055)6,4 (1,2-9,2) | UVA1DM33 (8-48) (P=0,055)30 (9-63) (P=0,1)40 (7-99) (P=0,04)34 (9-97) (P=0,15)4,5 (0,5-9,1) | |
| Pérdidas: 2 pacientes a las 4 y 6 s., por puntuaciones con UVB-BE<30% que con UVA1DM. | |||
| COMENTARIO: Mayor eficacia de UVBBE sobre UVA1DM, estadísticamente significativa en las escalas de Costa y Leicester y en la evaluación de las lesiones (VAS). Sin seguimiento a largo plazo. Posibles sesgos de realización, detección (en la aleatorización y el enmascaramiento), se desconoce si se incluyeron en el análisis los 2 pacientes perdidos. | |||
| Majoie 200920: UVBBE vs. UVA1DM (30J/cm2 hasta máx. 45J/cm2) (3 sesiones/s., 8 s. de duración y 4 de seguimiento); 13 pacientes. | |||
|---|---|---|---|
| Medidas de desenlace:Reducción en la escala de Leicester (mediana):Reducción VAS de prurito (mediana) | UVBBEde 18 a 10de 7 a 1,8 | UVA1DMde 19 a 12de 7 a 4,1 | (P<0,01)(P<0,01) |
| Disminución significativa de hallazgos histológicos inmunohistoquímicos sugestivos de inflamación, sin diferencias significativas al comparar entre intervenciones. | |||
| COMENTARIO: UVA1DM y UVBBE parecen efectivos en el control de la DA moderada-grave a nivel clínico y de marcadores inflamatorios. No se analizaron los resultados obtenidos tras el seguimiento por el uso no controlado de CC tópicos. Riesgo desconocido de sesgo de realización (se desconoce cómo se realizó la aleatorización). No se detallan efectos adversos. | |||
| Gamblicher 200922: UVBBE vs. UVA1DM (50J/cm2) sobrecruzamiento: 3 sesiones/s×6s → (lavado 8 s. mínimo) →3 sesiones/s.×6 s. 47 pacientes. | |||
|---|---|---|---|
| No se encontró interacción entre la secuencia de ttos y los efectos de los mismos (p=0,81). | |||
| Medidas de desenlace:Reducción relativa (RR) de SASSAD****RR-VAS prurito:RR-Skindex | UVBBE39,4% (±24,1%)25,2% (±30,5%)16,5% (±17,6%) | UVA1DM43,7% (±31,4%)16% (±61,8%)12,7% (±18,8%) | P=0,4P=0,49P=0,35 |
| Efectos adversos: eritema leve, 1 en grupo UVA1DM y 3 en grupo UVBBE. | |||
| COMENTARIO: Elevado número de pérdidas de seguimiento, aunque equilibradas en ambos grupos. Tiempo de seguimiento muy limitado. Bajo riesgo de sesgos: generación por ordenador y ocultación de la aleatorización, enmascaramiento, recogida de efectos adversos, protocolo registrado y comunicación de los resultados previstos. | |||
Tras 24 tratamientos. La actividad de la enfermedad fue medida según la escala modificada descrita por Sowden y colaboradores40.
Estudios que incluyeron PUVA entre sus intervenciones
| Der-Petrossian 200028.Baño-PUVA con 8-MOP vs. UVBBE, 3 d/semana×6 semanas; 12 pacientes. | |||
|---|---|---|---|
| Medidas de desenlace: Disminución del SCORADm (%)Semana 2Semana 4Semana 6 | Baño-PUVA32,9%47,1%65,7% | UVBBE24,3%44,5%64,1% | p=0,09p=0,51p=0,48 |
| COMENTARIO: No se proporcionan intervalos de confianza para poder valorar la diferencia clínica observada. Bajo poder estadístico se precisarían estudios con mayor número de pacientes. Riesgo incierto de sesgo de selección y detección (sin cegamiento de pacientes). Sin análisis por ITT (2 pacientes excluidos, uno de ellos por reagudización con ingesta de corticosteroides orales). | |||
| Tzaneva 20107: UVA1DM (5 d/semana×3 semanas, 70J/cm2) vs. PUVA (5-MOP 1,2mg/kg; 3 d/semana×5 semanas).40 pacientes. | |||
|---|---|---|---|
| Medidas de desenlace:Duración media de la remisión (semanas):Reducción media del SCORAD desde la visita basal: | UVA1DM437,7±22,8% | PUVA1254,3±25,7% | p=0,012p=0,041 |
| Efectos adversos: eritema palmoplantar leve (UVA1DM: 2, PUVA: 9); foliculitis (UVA1DM: 1, PUVA: 2); calor y quemazón (UVA1DM: 7); foto-onicólisis (PUVA: 2). | |||
| COMENTARIO: PUVA parece superior que dosis medias de UVA1 en la reducción del SCORAD y en la duración de la remisión. Utilizan 5-MOP en lugar de 8-MOP. La diferencia en la duración de cada tratamiento (3 semanas vs. 5 semanas) podría influir en los resultados. Riesgo de sesgos: la asignación a las intervenciones fue por lanzamiento de moneda, pero se desconoce cómo se ocultó de la secuencia de asignación (sesgo de selección). Sesgo de realización incierto en cuanto al enmascaramiento de los investigadores, no hubo enmascaramiento de los pacientes. La segunda fase del estudio se iniciaba en caso de recaída substancial (SCORAD≥50% del basal) o a petición de los pacientes. | |||
Abreviaturas: PUVA: Psoralenos +UVA; UVA1DM: UVA1 dosis medias; DEM: dosis eritemática mínima. DPM dosis fototóxica mínima. ITT: análisis por intención de tratar; MOP: Metoxipsoraleno; SCORAD (SCORing Atopic Dermatitis): Evalúa la gravedad de la dermatitis atópica en 3 aspectos: extensión o superfi cie afectada, intensidad (se puntúa de 0 a 3 la severidad del eritema, edema/pápulas, excoriaciones, exudación, liquenifi cación y xerosis) y repercusión del prurito y problemas de sueño (de 0-10); SCORAD modifi cado (SCORADm): Se excluyó de la valoración el grado de afectación facial, pues dicha localización solo se irradió con UVA1, y la valoración subjetiva de la repercusión en el sueño.
Estudios que comparan fototerapia vs. otras modalidades de tratamiento de DA
| Granlund 200117: UVAB (máx. 15J/cm2 UVA y 0,26J/cm2 UVB, 2-3 veces/semana) vs Ciclosporina A (4mg/kg/d, con subida o bajada de 1mg/kg/d según respuesta), 12 meses, 72 pacientes. | |||
|---|---|---|---|
| Medidas de desenlaceDías en remisiónUso de CE tópico*:Uso de emolientes*Evaluación del tratamiento como bueno o muy buenoCalidad de vida (Eczema Disability Index-EDI)Efectos adversos globales | Ciclosporina A186±8445±7475±166Pacientes 86%Investigadores 91%A las 4 semanas: (–17)±11A las 8 semanas: (–17)±27Al final del estudio (–13)±3235 | UVAB114±11843±9941±28760%44%(–9)±9(–12)±13(–12)±1232 | p<0,01p<0,001p<0,001p<0,01N.S.N.S. |
| COMENTARIO: Resultados a favor de ciclosporina en un estudio con elevado riesgo de sesgos: la fluencia que se utiliza, tanto de UVA como de UVB es relativamente baja (posible infratratamiento en el brazo de fototerapia). Sesgo de selección incierto (aleatorización). No hay enmascaramiento de los evaluadores. Sesgo de desgaste: muchas pérdidas de seguimiento, especialmente en el grupo UVAB y menor número de ciclos de tratamiento en el brazo UVAB. Financiado por Novartis (fabricante de Ciclosporina A). | |||
| Tzung 200614: GRUPO 1: Pimecrolimus/UVBBE vs. pimecrolimus. GRUPO 2: Pimecrolimus/UVBBE vs. UVBBE durante 6 semanas+4 de seguimiento, 26 pacientes. | |||
|---|---|---|---|
| Medidas de desenlace:% de reducción de EASI: | GRUPO 1:56 vs 53% (p=0,084) | GRUPO 2:59 vs 55% (p=0,059 tras semana 6 y p=0,09 tras semana 4 de seguimiento) | |
| Reducción de score de prurito (media): UVBBE/pimecrolimus 3,1; pimecrolimus 3; UVBBE 3 (p<0,001, p=0,002 y p=0,004, respectivamente). | |||
| COMENTARIO: No se demuestra superioridad de la combinación de ambos tratamientos. No especifican claramente los criterios de inclusión/exclusión. Riesgo incierto de sesgos de selección (aleatorización), realización (no hay cegamiento de los participantes) y desgaste (no se explican los abandonos). Comunicación selectiva: miden los brotes tras el tratamiento, variable que no consta en la sección de métodos. No proporcionan medidas de dispersión. | |||
| Valkova 200415: UVAB vs. UVAB/CE tópico (fluticasona o butirato de hidrocortisona), 5 sesiones/semana durante 12 semanas, 31 pacientes. | |||
| Medidas de desenlaceReducción media del score de severidadScore topográficoScore generalNúmero de sesiones Dosis media UVB (J/cm2)Duración de remisión | UVAB659,8±62,6 a 132±28,8 (p<0,0001),46,2±4,8 a 9,7±1,8 (p<0,0001)360,4±37,6 a 37,9±6,7 (p<0,0001)18,3±0,8 (p=0,02);2,3±0,12 (p=0,03);4,5±0,4 (p=0,39) | UVAB/CC682,5±50,5 a 136,9±33,2 (p<0,0001),43,6±3,9 a 8,9±1,8 (p<0,0001)395,4±35 a 36,9±7,3 (p<0,0001)15,6±0,6 (p=0,02);1,9±0,14 (p=0,03);4,1±0,4 (p=0,39) | |
| COMENTARIO: Ambos tratamientos inducen una mejoría significativa; la adición del CC tópico disminuye la dosis total de UVB y la duración del tratamiento sin influir en la duración de las remisiones ni la frecuencia de los efectos adversos. No se cuantifica la cantidad de CC aplicado ni la duración del tiempo de seguimiento. Alto riesgo de sesgo de detección (enmascaramiento) y riesgo incierto de sesgo de selección (aleatorización). | |||
Abreviaturas: CC: corticoesteroide; EASI: Eczema Area and Severity Index; NS: no especificado; Tto: tratmiento.
Estudios que emplearon modalidades de fototerapia menos extendidas
| Brenninkmeijer 20108,11: LE 308-nm (2 veces/s.) vs. PC 0,05% (1 vez/d), 10 s. y seguimiento hasta s. 34; 13 pacientes | |||
|---|---|---|---|
| Medidas de desenlace:PAIS: BasalS. 10S. 5-34***Mejoría>40% PAIS s. 34:PRURITO S. 34:PGA s. 34 (“casi aclarado”)PaGA s. 34Preferencia del paciente | LE:12,80±1,57,5±2,9*8,38±2,5*8 lesionesReducción 63%6 pacientes7 mejor LE8 mejor LE | PC:12,90±1,28,0±3,2**9,30±2*3 lesionesReducción 49%2 pacientes4 mejor PC2 mejor PC | |
| Efectos adversos: leves y transitorios, 2 exacerbaciones. | |||
| COMENTARIO: LE podría ser una alternativa para el prurigo atópico. Elevado riesgo de sesgos. El cegamiento del evaluador no fue posible (hiperpigmentación por LE), por ello se estudiaron cambios histopatológicos en las semanas 0 y 10 en los últimos 5 pacientes incluidos. No se hizo ITT, 2 pacientes se perdieron por exacerbación y uno por falta de cumplimiento. | |||
| Byun 201116: FSL (320-5000nm, 2 sesiones/s.)/emoliente vs. emoliente×4 s., 38 pacientes. | |||
|---|---|---|---|
| Cambios en el SCORADŦBasalS. 4S. 8Valoración subjetiva por pacientes a la s. 4. | FSL/emoliente47,8736,81 (–23,1%, p<0,01)30,76 (–35,7%, p<0,001)“Excelente” 6/20 “bueno” 9/20 | Emoliente39,4735,3933,85, p=0,2367/18 y 7/18 | |
| Efectos adversos grupo FSL: eritema (6/20), sequedad (6/20), prurito (4/20), sensación quemazón (2/20). Exacerbación transitoria en 6 pacientes (2 primeras semanas) | |||
| COMENTARIO: Alto riesgo de sesgos de realización y detección (estudio abierto, sin cegamiento, aleatorización no especificada). Características basales no similares (diferencia en SCORAD basal grupo FSL 47,87, mientras que el grupo control de 39,79). | |||
| Heinlin et al. 20116: BFTS vs UVBBE, 3-5 sesiones/s. hasta curación o 35 sesiones. Seguimiento 6m; 180 pacientes | |||
| mr-SCORADŦ: BasalSesión 351 mes seguimiento6 meses seguimientoSIPŦ: BasalSesión 351 mes seguimiento6 meses seguimientoPGI: Sesión 351 mes seguimiento6 meses seguimiento | BFTS:61,8±14,125,6±2219,0±17,618,0±16,46,3±84,6±6,83,7±6,34,3±7,476,3%73,6%77,5% | UVBBE61,5±12,434,6±22,331,1±19,625,3±21,95,5±5,64±5,53±3,63,3±5,755,4%52,6%49% | p=0,004p=<0,0001p=0,04p=0,77p=0,98p=0,98p=0,99p=0,002p=0,004p=0,002 |
| COMENTARIO: BFTS fue superior a UVBBE, manteniendo su beneficio a los 6m. Bajo riesgo de sesgos, no hubo cegamiento de los evaluadores, que eran de distintas clínicas privadas. | |||
| Selvaag 200519: UVB vs. UVBr, máximo 6 s. o hasta SCORAD<10; 20 pacientes. | |||
|---|---|---|---|
| Dosis UVB, SED (×10mJ/cm2): | UVBInicial 2,6 (1,9-2,8)Final 9,1 (4,7-14,7)Acumulada: 124 (29-186) | UVBr3,4 (2,6-5,8)4,9 (3,1-9,2)39 (16-88) | p<0,01p<0,01 |
| COMENTARIO: UVBr redujo la dosis de radiación y la dosis acumulada. Estudio abierto con elevado riesgo de sesgos de realización y de detección. No se proporcionan datos concretos de los efectos adversos (se menciona que no hubo diferencias). | |||
*p<0,001, **p<0,01, ***p<0,05 entre LE y PC, ŦMedia±desviación estándar.
Abreviaturas: BFTS: Balneofototerapia sincrónica; FSL: fototerapia “Full Spectrum Light”; ITT: análisis por intención de tratar; LE: Laser Excimer; m.: mes; mr-SCORAD: mejoría relativa de SCORAD; NS: no significativo; PC: propionato de clobetasol; PAIS: Physician Assessment of Individual Signs; PGA: Physical Global Assesment; PaGA: Patient Global Assessment; PGI: impresión global del paciente sobre el tratamiento; s.: semana; SED: standard erythema dosis; SIP: Sickness Impact Profile; UVBr: UVB guiada por reflectancia cutánea.
Riesgo de sesgos.
+: riesgo de sesgos bajo’; ?: riesgo de sesgos desconocido;–: riesgo de sesgos elevado; 1: generación aleatoria de la secuencia de asignación (sesgo de selección); 2: asignación a la intervención (sesgo de selección); 3: enmascaramiento de participantes y personal (sesgo de realización); 4: enmascaramiento del evaluador (sesgo de detección); 5: datos de resultado incompletos (sesgo de atrición); 6: comunicación selectiva (sesgo de publicación); 7: otros sesgos; BJD: British Journal of Dermatology.
La dosis óptima de radiación UVB fue evaluada en 2 ECA. El primero aplicó dosis de 0,5 veces la dosis eritemática mínima (DEM) frente a una DEM y a luz visible (LV). El segundo comparó 0,8 DEM frente a 0,4 DEM. La UVB mostró eficacia frente a LV, sin hallar, en el segundo ECA, diferencias entre ambas DEM24. Otro ECA comparó UVB frente a UVAB, obteniendo diferencias estadísticamente significativas en favor de UVAB en la mayoría de variables empleadas25. En otro ECA UVA mostró superioridad frente a UVB en la puntuación total y en la valoración global, pero no en la variable prurito26. Dos estudios adicionales compararon UVAB frente a UVB y frente a UVA, respectivamente, mostrando resultados más favorables hacia la UVAB (tabla 1)23.
Ultravioleta A1 a altas dosis y ultravioleta A1 a dosis medias (tabla 2)Un ECA realizado en pacientes con brote agudo de DA10 obtuvo un descenso estadísticamente significativo en la escala de Costa en los días 6.° y decimoquinto con UVA1 a altas dosis (UVA1AD), en comparación con UVAB. Otro ECA multicéntrico comparó UVA1AD (130J/cm2), UVAB o fluocortolona 0,5% tópica18. Se obtuvo un descenso significativo en la escala de Costa al 5.° y 10.° día, comparando los grupos UVA1AD o fluocortolona frente a UVAB y UVA1AD frente a fluocortolona, aunque no se proporcionan cifras absolutas de los resultados. Un estudio piloto evaluó UVA1 a dosis medias (UVA1DM) frente a UVA1AD21. La reducción del SCORADm tras 3 semanas de tratamiento fue del 34,7% con UVA1AD y del 28,2% con UVA1DM (p>0,05), sin diferencias bilaterales en el tiempo hasta la aparición de recidivas o su intensidad. La modalidad UVA1 cold light (UVA-cl) disipa la carga excesiva de calor generado por UVA1. UVA-cl fue la modalidad más eficaz en el aclaramiento de las lesiones y su duración, comparando con UVA1 y con UVAB. El SCORAD en la semana 3 se redujo en los 3 grupos (p<0,05), aunque en el grupo de pacientes tratados con UVA-cl el descenso fue más llamativo (23,3±10,6 frente a 28,8±6,9 y 41,4±9,9, respectivamente) (tabla 2)9.
Ultravioleta B de banda estrecha (tabla 3)Un ECA mostró superioridad de UVB de banda estrecha (UVBBE) frente a UVA y LV, con resultados mantenidos a 3 meses30. Un ECA piloto, en pacientes con DA crónica, comparó UVBBE en un hemicuerpo frente a UVA1DM en el otro hemicuerpo27. Las zonas tratadas con UVBBE registraron una reducción de puntuación estadísticamente significativa en las escalas de Costa y Leicester y en la evaluación de la severidad de las lesiones. Otro ECA incluyó pacientes que recibieron UVBBE en un hemicuerpo y UVA1 en el otro hemicuerpo20. Ambos tratamientos disminuyeron la puntuación en las escalas de Leicester y en una escala visual analógica de prurito, sin diferencias significativas entre ambos. En un ECA doble ciego, con sobrecruzamiento de UVA1 y UVBBE, no se hallaron diferencias estadísticamente significativas22.
Psolarenos y luz ultravioleta A (tabla 4)Un ECA con bajo poder estadístico comparó baño-PUVA con 8-MOP (8-metoxipsoraleno) frente a UVBBE sin encontrar diferencias significativas, aunque los resultados son compatibles con la posibilidad de diferencias clínicamente relevantes28. Otro ECA, con diseño cruzado, comparó UVA1 y PUVA oral con 5-MOP (5-metoxipsoraleno). El periodo mínimo de lavado fue de 4 semanas y el periodo de seguimiento fue de hasta 12 meses tras el primer tratamiento7. Con UVA1 la mediana de duración de la remisión fue 4 semanas y con PUVA de 12 semanas. La reducción media del SCORAD fue mayor en el lado PUVA.
Estudios que comparan fototerapia con otros tratamientos para la dermatitis atópica (tabla 5)Un estudio multicéntrico comparó ciclosporina A frente a UVAB17. El grupo tratado con ciclosporina A presentó mayor número de días en remisión que el grupo tratado con UVAB (186±84 frente a 114±118). Pacientes e investigadores valoraron más positivamente el tratamiento con ciclosporina. Un ECA evaluó pimecrolimus 1% crema frente a UVBBE en pacientes de 5-17 años. Ambas intervenciones resultaron beneficiosas, sin hallar superioridad en su asociación14. Otro ECA comparó la asociación de fluticasona o butirato de hidrocortisona tópicos con UVAB, frente a UVAB sola. Ambos grupos presentaron una mejoría significativa. El grupo de pacientes que empleó el corticoide precisó de menos sesiones y la dosis media empleada de UVB fue menor15.
Otros estudios (tabla 6)Un estudio piloto comparó LE 308nm frente a pomada de propionato de clobetasol 0,05% en pacientes con DA y nódulos de prúrigo atópico, presentando LE resultados óptimos (escalas PAIS, PGA, PaGA y del prurito)8. La fototerapia Full-spectrum-light (FSL), que aplica longitudes de onda de 320-5000nm, junto con un emoliente, mostró una mejoría significativa en el SCORAD a las 4 semanas, frente a la aplicación exclusiva del emoliente16. Un ECA comparó la asociación de baño en solución salina del Mar Muerto al 10% con UVBBE (balneofototerapia sincrónica [BFTS]) frente a UVBBE6. El descenso del SCORAD fue mayor con BFTS que con UVBBE (tabla 6), manteniendo su superioridad al mes y a los 6 meses del tratamiento. Un ECA evaluó la reflectancia cutánea como método para establecer la dosis de UVB (UVBr). En un hemicuerpo la dosis se fijaba en cada sesión en función de la pigmentación cutánea, medida por reflectancia, comparando con un calendario convencional de UVB en el otro hemicuerpo. Se obtuvo una reducción de la dosis acumulada de radiación UVB en el grupo UVBr, sin menoscabo del resultado clínico del tratamiento19.
Estudios registrados realizándose en la actualidad (tabla 7)De los ECA que se están realizando actualmente, registrados en Current Controlled Trials y en ICTRP, 2 cumplían con los criterios de selección. Un ECA evalúa UVBBE en monoterapia frente a baño-PUVA y frente a UVBBE con sales de baño. Otro ECA compara fototerapia UVAB frente a UVB en pacientes con diversas dermatosis inflamatorias pruriginosas, incluyendo la DA.
Estudios en realización
| ID | NCT01402414 |
|---|---|
| Título | “Narrow-band (NB)-UVB vs. Bath-PUVA and NB-UVB Plus Salt Water Baths in Atopic Dermatitis” |
| Método | Ensayo clínico aleatorizado, ciego para el observador, con sobrecruzamiento. |
| Fecha de registro | 19/07/2011 |
| Estado actual | Reclutando |
| Fecha estimada de finalización | Septiembre de 2014 |
| Participantes | Pacientes con dermatitis atópica |
| Intervenciones | Grupo 1: UVBBEGrupo 2: baño-PUVAGrupo 3: UVBBE más sales de baño |
| Medidas de desenlace | Primarias:1. Mejoría clínica medida por índice SASSAD.Secundarias:2. Evaluación del prurito y pérdida de sueño por escalas analógicas visuales (de 0 a 10).3. Satisfacción del paciente, seguridad y calidad de vida mediante Skindex-29.4. Parámetros inmunohistoquímicos y serológicos. |
| Contacto | Sarah Terras, MD (s.terras@klinikum-bochum.de) |
| ID | NCT01254240 |
| Título | “Efficacy study of two choices of phototherapy on itching skin diseases” |
| Método | Ensayo clínico aleatorizado doble ciego |
| Fecha de registro | 02/12/2010 |
| Estado actual | Reclutando |
| Fecha estimada de finalización | Junio 2012 (finalización de la recogida de datos de la variable principal) |
| Participantes | Pacientes con dermatosis inflamatorias pruriginosas (dermatitis atópica, otros tipos de eccema, psoriasis, prurigo simple subagudo). |
| Intervenciones | Fototerapia UVAB vs. UVB |
| Medidas de desenlace | Primarias: 5-D Pruritus score y escala analógica visual en la semana 16. |
| Contacto | Guenther Hofbauer, MD, Leading Physician University Hospital Zurich, Division of Dermatology (hofbauer@usz.ch);Alexander A. Navarini, MD PhD (alexander.navarini@usz.ch) |
Abreviaturas: UVBBE: UVB de banda estrecha; PUVA (psoralenos+UVA); UVAB: Asociación de UVA y UVB.
Esta es la primera RS publicada en lengua española sobre fototerapia en DA. Se han analizado 21 trabajos que cumplían los criterios de inclusión, lo que supone 961 pacientes, de los cuales 32 corresponden a menores de 18 años.
La utilización de las diferentes modalidades de fototerapia ha tenido una distribución cronológica. En las décadas de los años 80 y 90 del pasado siglo predominaron los trabajos con fototerapia UVA, UVB y UVAB. Posteriormente se incorporaron PUVA, UVBBE y UVA1 y, finalmente, emergieron otras modalidades como LE o FSL.
La combinación UVAB obtuvo diferencias estadísticamente significativas en algunos estudios frente a UVA o UVB (tabla 1). Posteriormente, UVA1AD se mostró superior a UVAB10,18. Estudios posteriores demostraron eficacia similar y menos efectos adversos al utilizar dosis medias de UVA1 en lugar de dosis altas9,21 (tabla 2).
Las intervenciones más homogéneas son las que comparan UVA1 con UVBBE (tabla 3). Dos estudios encontraron superioridad en el grupo UVBBE27,30. Esta superioridad se mantuvo durante los 3 meses de seguimiento en un ECA con mayor número de participantes y bajo riesgo de sesgo de selección30. Los 2 estudios restantes no encontraron diferencias importantes entre ambas modalidades20,22. Debe tenerse en cuenta que en los 4 estudios se empleó un régimen no habitual de UVA1 (2-3 sesiones semanales en lugar de 5), por lo que la efectividad de UVA1 podría ser superior.
En cuanto a la terapia PUVA, un trabajo sin periodo de seguimiento compara baño-PUVA con 8-MOP y UVBBE. Los resultados son compatibles con diferencias clínicamente relevantes entre ambos tratamientos, pero el poder estadístico del ECA es bajo28. En comparación con UVA1, PUVA oral (5-MOP) mostró una duración de la remisión estadísticamente significativa, aunque las diferencias en la duración y frecuencia de aplicación de las intervenciones podrían influir en los resultados obtenidos7.
Técnicas más novedosas, como FSL o LE, han sido evaluadas cada una en un ECA con resultados óptimos, aunque podrían deberse al sesgo de publicación8,16. La evidencia en cuanto a terapias combinadas es también escasa, incluyendo la BFTS, que mostró superioridad frente a UVBBE6, la asociación de corticoides tópicos a UVAB, que podría disminuir la dosis de UVB y la duración del tratamiento15 y pimecrolimus tópico, cuya aplicación combinada con UVBBE no demostró un beneficio añadido en un ECA realizado en niños14. Únicamente un ECA comparó un tratamiento inmunosupresor, ciclosporina A, con UVAB17. Los resultados fueron significativamente mejores para la primera, pero las dosis de UVAB fueron subóptimas y el riesgo de sesgos del estudio fue elevado.
En general, todas las modalidades de fototerapia fueron descritas como bien toleradas, aunque pocos ECA registraron los efectos adversos de forma sistemática. La ausencia de protocolos estandarizados para la aplicación de las técnicas (dosis de inicio según fototipo o DEM, escalado de dosis, frecuencia de las sesiones, etc.) complican la interpretación y comparación de los resultados. Dado que los tratamientos fueron heterogéneos y la comunicación de resultados deficiente, no se realizó metaanálisis.
Calidad de la evidenciaEn general, los estudios presentaron un riesgo elevado o incierto de sesgos5 y ausencia de información relevante en su publicación. Muchos incluyeron un bajo número de participantes, un método de aleatorización poco claro y exclusión de las pérdidas del análisis estadístico. En la mayoría no se realizó periodo de seguimiento o este fue corto. En los ECA con comparación intrapaciente un posible sesgo a tener en cuenta es el posible efecto sistémico de la fototerapia recibida en cada lado.
Los criterios de inclusión y exclusión de los pacientes fueron variables, y los criterios de Hanifin y Rajka no fueron empleados unánimemente en todos los ECA. En un ECA no se mencionaron explícitamente los criterios de inclusión y exclusión14.
Sesgos potenciales en el proceso de revisiónPara intentar recopilar el máximo posible de estudios revisamos la base de datos The Global Resource of Eczema Trials (Centre of Evidence Based Dermatology, http://www.greatdatabase.org.uk/), sin encontrar ECA no incluidos en nuestros resultados. Sin embargo, aplicamos una restricción por idiomas al inglés, francés y español. Un experto en el tratamiento con fototerapia (Dr. José Manuel Carrascosa) revisó nuestros resultados, detectando únicamente la ausencia de estudios en alemán. En otra RS recientemente publicada4 se incluyó únicamente un artículo en alemán31.
Finalmente, es posible un sesgo de publicación, dado el resultado positivo de la mayoría de los estudios incluidos para la modalidad probada, si bien este sesgo es menos probable al no haber estudios contra placebo.
Diferencias y similitudes con revisiones sistemáticas previasSe han publicado previamente 2 RS sobre fototerapia en DA. La primera no incluyó estudios con PUVA y sus conclusiones fueron que la fototerapia UVA1, si estaba disponible, estaría indicada en las formas agudas de DA y UVBBE sería más recomendable para las formas crónicas3. En nuestra opinión es difícil extraer estas conclusiones, ya que en los estudios referenciados estas diferencias clínicas no están bien establecidas. Con respecto a la RS más reciente4 hay una diferencia de 4 ECA con la nuestra; 2 estudios que comparan terapia tópica con fototerapia que nosotros incluimos y que ellos obviaron, al considerar que el diagnóstico de DA era dudoso8,14, un estudio que evalúa la utilidad de la reflectancia cutánea para reducir la dosis de UVB19 y un estudio que nosotros no incluimos por estar publicado en alemán31.
ConclusionesImplicaciones para la práctica- •
Hay evidencia para el uso de fototerapia UVBBE y UVA1 en formas moderadas-graves de DA. La evidencia existente para el uso de PUVA es escasa.
- •
Modalidades como LE en prurigo atópico, fototerapia Full-Spectrum-Light o BFTS podrían encontrar sus indicaciones, aunque son necesarios más estudios.
- •
Los datos del uso de la fototerapia en la DA de la infancia son limitados, por lo que en este grupo de edad debería ser utilizada con precaución. No se han encontrado datos de evidencia para el uso de fototerapia en embarazadas con DA.
- •
Apenas hay datos de efectos a largo plazo de la fototerapia en DA, incluidos posibles efectos carcinogénicos.
- •
No se han encontrado ECA que valoren la fototerapia contra corticoides orales.
- •
Los estudios que comparan terapias sistémicas inmunosupresoras y fototerapia son escasos (un ECA), y no incluyen las modalidades que mayor evidencia presentan (UVBBE y UVA1).
- •
Sería recomendable estandarizar los criterios de gravedad de la DA, homogeneizar las técnicas de irradiación y unificar escalas de valoración y otras medidas de desenlace. La iniciativa Harmonizing Outcome Measures for Eczema tiene este objetivo (http://homeforeczema.org/).
- •
Dado el impacto de la DA, llama la atención que solo 2 estudios incluyan medidas de calidad de vida (Skindex y EDI) y otros 2 escalas de valoración subjetiva.
- •
Debería incluirse un periodo de seguimiento mínimo y registrar parámetros de tolerabilidad y efectos adversos.
- •
La comunicación de los resultados debería ajustarse a la declaración Consolidated Standards of Reporting Trials.
A todos los bibliotecarios de los distintos hospitales, que consiguieron todos los artículos a evaluar en texto completo.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.