El fibroxantoma atípico (FXA) y el sarcoma pleomórfico dérmico (SPD) son neoplasias de origen mesenquimal poco frecuentes. Debido a la baja incidencia del SPD y a una nomenclatura históricamente confusa existe poca información acerca de la verdadera agresividad de este tumor. Realizamos el presente estudio con el objetivo de identificar qué características clínicas y/o histológicas del SPD son predictoras de riesgo de recidiva.
Material y métodoSe diseñó un estudio bicéntrico observacional retrospectivo de 31 casos de SPD diagnosticados y tratados en el Hospital Clínico Universitario de Valencia y el Instituto Valenciano de Oncología, entre los años 2005 y 2020. Se realizó un análisis descriptivo de las características clínicas e histológicas, un análisis inferencial univariado y un análisis multivariado mediante la regresión de Cox.
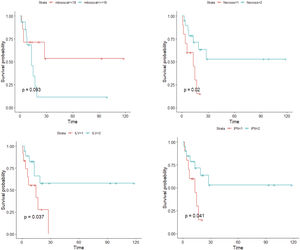
ResultadosEn el análisis univariado, la recidiva tumoral (p<0,001), la necrosis (p=0,020), la infiltración linfovascular (p=0,037), la infiltración perineural (p=0,041) y el número de mitosis (categorizado en categorizado en <18 y ≥18 por 10 campos de gran aumento) (p=0,093), se asociaron a una menor supervivencia libre de enfermedad. En el análisis multivariado, el número de mitosis (categorizado en <18 y ≥18) y la infiltración linfovascular (p<0,05) se asociaron a una menor supervivencia libre de enfermedad.
ConclusiónEl SPD es un tumor agresivo, en el que la presencia de un alto recuento mitótico (≥18) y/o invasión linfovascular se asocian a un mayor riesgo de recidiva y a una peor supervivencia libre de enfermedad. La necrosis y la infiltración perineural, también son hallazgos que probablemente se asocien a una mayor agresividad tumoral.
Atypical fibroxanthoma and pleomorphic dermal sarcoma (PDS) are rare mesenchymal tumors. Due to the low incidence of PDS and a historically confusing nomenclature, little is known about the true aggressiveness of this tumor. The aim of this study was to investigate clinical and histologic risk factors for recurrence in PDS.
Material and methodsRetrospective, observational, bicentric study of 31 PDSs diagnosed and treated at Hospital Clínico Universitario de Valencia and Instituto Valenciano de Oncología in Valencia, Spain, between 2005 and 2020. We described the clinical and histologic features of these tumors and performed univariate analysis and multivariate Cox regression analysis.
ResultsIn the univariate analysis, tumor recurrence (P<.001), necrosis (P=.020), lymphovascular invasion (P=.037), perineural invasion (P=.041), and mitotic count (<18 vs ≥18 mitoses per 10 high-power fields) (P=.093) were associated with worse disease-free survival. In the multivariate Cox regression analysis, mitotic count and lymphovascular invasion retained their significance as predictors of worse disease-free survival (P<.05).
ConclusionsPDS is an aggressive tumor in which a high mitotic count (≥18) and lymphovascular invasion are associated with a higher risk of recurrence and worse disease-free survival. Necrosis and perineural invasion are also probably linked to increased tumor aggressiveness.
El fibroxantoma atípico (FXA) y el sarcoma pleomórfico dérmico (SPD) son neoplasias de origen mesenquimal poco frecuentes1–4. Ambas aparecen en la piel fotoexpuesta de pacientes ancianos, y se caracterizan por una proliferación dérmica de células fusiformes y epitelioides, con un índice mitótico elevado y un marcado pleomorfismo2,5,6. Mientras que el FXA presenta un comportamiento clínico benigno, el SPD es un tumor con una potencial agresividad local y una capacidad de metastatizar a distancia2–4. Históricamente, la clasificación de estos tumores ha sido confusa y se ha basado en una terminología cambiante y poco precisa, empleándose de manera variable, e incluso superponible, los términos de FXA y de histiocitoma fibroso maligno (HFM)2,4,7,8. En el año 2012 se acuñó el término SPD para describir a las neoplasias dérmicas sin una clara línea de diferenciación celular, y con unas características clínico-patológicas generales superponibles a las del FXA, pero que, además, presentaba unas características histológicas de agresividad2,7. La presencia de necrosis, invasión linfovascular o perineural, y/o invasión evidente del tejido celular subcutáneo constituyen los criterios histopatológicos definitorios del SPD, debiendo estar presente al menos uno de ellos para su diagnóstico9. Actualmente, FXA y SPD se consideran parte del espectro de una entidad común, con unas características epidemiológicas e histológicas generales superponibles, pero con un comportamiento clínico y un grado de agresividad diferente7,10,11. Incluso hay quien propone abandonar completamente el concepto de SPD, y en su lugar utilizar los términos de FXA y de FXA con criterios histológicos de alto riesgo (sustituyendo a SPD)7. Debido a la baja incidencia del SPD y a una nomenclatura históricamente confusa existe poca información acerca de la verdadera agresividad de este tumor. La gran mayoría de los estudios publicados son descriptivos y solo 2 series recientes identifican potenciales factores pronósticos. Realizamos el presente estudio con el objetivo de identificar qué características clínicas y/o histológicas del SPD son predictoras de riesgo de recaída.
Material y métodoSe diseñó un estudio bicéntrico observacional retrospectivo de 31 casos de SPD diagnosticados y tratados en la Fundación Instituto Valenciano de Oncología, y en el Hospital Clínico Universitario de Valencia, entre los años 2005 y 2020. Todos los datos fueron obtenidos del historial clínico de los pacientes y de la base de datos de los servicios de anatomía patológica de ambos centros. El diagnóstico de SPD se estableció en función de las siguientes características: 1) La presencia de una neoplasia mesenquimal constituida por células pleomórficas fusiformes y/o epitelioides, con ausencia de una línea de diferenciación celular definida en el estudio inmunohistoquímico (ausencia de expresión de citoqueratinas [CKAE1-AE3], proteína S100, desmina/caldesmon y CD34), y 2) La identificación de al menos una de las siguientes características histológicas: infiltración franca del tejido celular subcutáneo, infiltración perivascular, infiltración perineural y/o necrosis. Estas características fueron estudiadas en secciones teñidas con hematoxilina-eosina. Los estudios inmunohistoquímicos adicionales realizados en algunos de los casos incluyeron las siguientes tinciones: actina de músculo liso (SMA), vimentina, CD10, CD68 y CD99. También se estudiaron la profundidad de invasión tumoral (índice de Breslow) y el número de mitosis por 10 campos de gran aumento (×400). Dos dermatólogos (Dra. Ríos-Viñuela y Dr. Pons Benavent) y dos dermatopatólogos (Dr. Traves y Dr. Sanmartín) revisaron todas las muestras histológicas de los casos procedentes del Instituto Valenciano de Oncología. Dos dermatólogos (Dra. Ríos-Viñuela y Dr. Pons Benavent) revisaron todas las muestras histológicas de los casos procedentes del Hospital Clínico Universitario de Valencia. Respecto a los últimos, se realizó una validación de la correlación interobservador con un dermatopatólogo (Dr. Monteagudo), obteniéndose un coeficiente kappa de Cohen global de 0,7. Todas las características clínicas e histológicas evaluadas están recogidas en el material suplementario (Ver material suplementario1. Tablas suplementarias 1 y 2). Se empleó el programa IBM-SPSS® 25.0 para realizar un análisis estadístico de la muestra, incluyendo un análisis descriptivo de las características clínicas e histológicas, un análisis inferencial univariado (obteniéndose las curvas de supervivencia de Kaplan-Meier) y un análisis multivariado mediante la regresión de Cox. La descripción detallada del estudio estadístico realizado está recogida en el material suplementario (Materiales suplementarios 1 y 2).
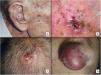
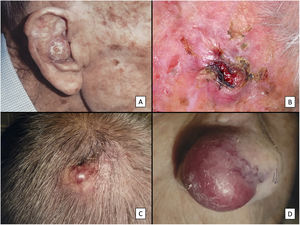
ResultadosCaracterísticas clínico-patológicasEl estudio incluyó un total de 31 pacientes, 3 de ellos mujeres, con una mediana de edad de 82 años. Casi todos ellos (29 pacientes; 93,5%) tenían antecedentes de exposición solar crónica intensa y 23 pacientes (74,2%) tenían antecedentes de otros cánceres de piel no melanoma. La gran mayoría de los tumores se localizaron en el cuero cabelludo (22 casos; 71%) (fig. 1). La mediana del diámetro mayor del tumor fue de 23mm y la mediana del tiempo de evolución hasta el diagnóstico fue de 3 meses. Diecinueve pacientes (61%) fueron diagnosticados inicialmente como FXA. Todos los pacientes salvo 2 (tratados mediante cirugía de Mohs) fueron intervenidos inicialmente con cirugía convencional, obteniéndose márgenes quirúrgicos libres en 14 casos (45%).
Características clínicas del SPD. A) Tumoración nodular de gran tamaño que ocupa la totalidad de la concha auricular infiltrada a planos profundos. B) Tumor de aspecto carnoso y friable, ulcerado, localizado en el cuero cabelludo de un varón con evidente daño solar. C) Tumor nodular con vascularización prominente en el cuero cabelludo de un varón anciano. D) Tumor eritemato-violáceo de gran tamaño, con vascularización prominente en el ala nasal de una mujer anciana, con infiltración transmural del cartílago alar.
Cinco pacientes (16%) presentaron una recidiva y 9 (29%) lo hicieron en 2 o más ocasiones. La mediana de tiempo hasta la primera recidiva fue de 7 meses. Ocho (25%) tumores fueron localmente avanzados (presentaban infiltración en planos profundos, más allá del tejido celular subcutáneo) y 4 casos (13%) presentaron metástasis (ganglionares, pulmonares y/o cerebrales). La mediana de seguimiento fue de 20 meses.
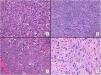
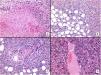
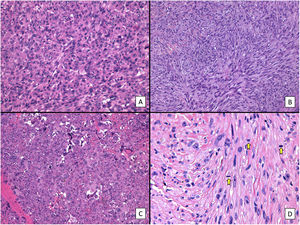
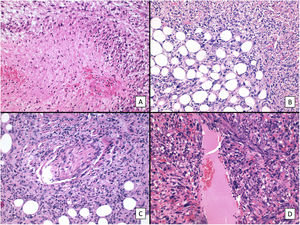
Respecto a las características histológicas (figs. 2-4), el espesor tumoral tenía 7,2mm de mediana. El número de mitosis por 10 campos de gran aumento fue de 18 de mediana. Diecinueve (60%) tumores presentaron ulceración histológica y 22 (73%) un patrón de crecimiento infiltrativo. Diez casos (33%) presentaron necrosis, 12 (39%) invasión linfovascular y 10 (33%) infiltración perineural. El total de características clínico-patológicas evaluadas, así como el análisis estadístico descriptivo realizado, están recogidos en el material suplementario (Ver material suplementario 1. Tablas 1 y 2, y Material suplementario 2).
Características histológicas del SPD (hematoxilina-eosina). A) Proliferación densamente celular constituido por sábanas de células epitelioides, con nucléolo prominente, que presentan además marcado pleomorfismo y atipia celular (×200). B) Proliferación densamente celular constituido por fascículos de células de aspecto fusiforme, de nuevo con marcado pleomorfismo y atipia celular (×200). C) Células de aspecto monstruoso con núcleos grandes y atípicos, con nucléolo prominente, y citoplasmas amplios y de aspecto xantomizado. Se observan numerosas células multinucleadas, así como núcleos marcadamente picnóticos (×200). D) Proliferación celular con marcado pleomorfismo y atipia, similar a las imágenes previas, en la que son evidentes múltiples figuras de mitosis (señaladas por flechas amarillas; ×400).
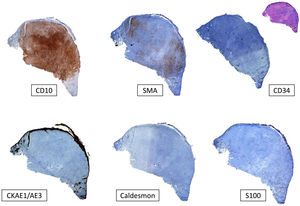
Panel de inmunohistoquímica típico del SPD. Para el diagnóstico del SPD, siempre es necesario descartar otros tumores indiferenciados: el carcinoma epidermoide cutáneo con tinción de citoqueratinas negativa (CKAE1-AE3); el melanoma maligno con S100 y/o otros marcadores melanocíticos negativos; y el leiomiosarcoma (caldesmon negativo). Aunque no es específico, el marcador CD10 suele ser positivo. También puede haber positividad focal para la actina (SMA), y para la vimentina (no mostrada en la imagen).
En primer lugar, se realizó un análisis mediante las curvas de supervivencia de Kaplan-Meier para cada una de las variables. En el caso de las variables continuas, se realizaron regresiones de Cox univariadas, analizando si se cumplía el supuesto de linealidad. En caso contrario, se realizaron bucles iterativos, buscando el punto de corte que crease grupos que difiriesen significativamente en la supervivencia de los individuos. Se consideró p<0,1 como valor de significación estadística. Las variables que se asociaron a una menor supervivencia libre de enfermedad de modo estadísticamente significativo fueron: la recidiva tumoral (p<0,001), la necrosis (p=0,020), la infiltración linfovascular (p=0,037), la infiltración perineural (p=0,041) y el número de mitosis (categorizado en categorizado en <18 y ≥18) (p=0,093) (fig. 5). La edad, el tamaño tumoral, y el espesor tumoral (índice de Breslow), no se asociaron a diferencias significativas en la supervivencia. Cabe destacar que solo uno de los tumores primarios (con un diagnóstico inicial de SPD) recurrió, mientras que en el resto de los casos se trató de tumores diagnosticados inicialmente como FXA. Tampoco recidivó ningún caso con un recuento mitótico menor de 10.
Posteriormente, se realizó un análisis multivariado mediante regresión de Cox multivariada, incluyendo las variables previamente identificadas como significativas: necrosis, infiltración linfovascular, infiltración perineural y número de mitosis. La variable recidiva no se incluyó en la regresión de Cox multivariada, para evitar perder potencia estadística en dicho análisis (ver material suplementario 2). Las variables que se asociaron a una menor supervivencia en el análisis multivariado fueron las siguientes: el número de mitosis (categorizado en <18 y ≥18) y la infiltración linfovascular (p<0,05). Cabe destacar que se identificó una probabilidad 5 veces mayor de recaída en los individuos con un recuento mitótico de ≥18, frente a los de <18 mitosis por 10 campos de gran aumento.
DiscusiónDebido a su escasa incidencia, y a la confusión que históricamente ha rodeado a su nomenclatura, el verdadero potencial agresivo del SPD y su pronóstico son desconocidos1,4,6,8,12. Mientras que existe un mayor número de trabajos que evalúan el comportamiento y pronóstico del FXA, así como su manejo, la mayoría de la información disponible en la literatura respecto al SPD procede de casos clínicos o de series cortas, y los pocos estudios que incluían series más largas eran, en su mayoría, descriptivos2–4,13,14. En primer lugar, es interesante destacar que, en nuestra serie, solo uno de los SPD primarios recidivó, mientras que en el resto de los casos que presentaron recidivas fueron tumores diagnosticados inicialmente como FXA. Este hallazgo enfatiza la necesidad de realizar un estudio histológico preciso de estos tumores, puesto que son morfológicamente superponibles y la evaluación de los criterios de agresividad del SPD requiere de una muestra histológica lo suficientemente amplia (idealmente, la extirpación completa)14. En otro trabajo publicado por los autores, el 75% de los casos de SPD (12/16) tuvieron el diagnóstico previo de FXA, lo que probablemente condicionó un tratamiento menos agresivo y un seguimiento menos estrecho, con la consecuente evolución adversa de muchos estos tumores4.
A pesar de que la mayoría de los estudios de SPD realizados hasta la fecha son descriptivos, cabe destacar 2 estudios analíticos de reciente publicación. En un estudio multicéntrico de 92 pacientes, Persa et al. identificaron la exéresis quirúrgica con menos de 2cm de margen y la ausencia de ulceración histológica, como los factores pronósticos asociados a una menor supervivencia libre de enfermedad1. Más recientemente, el estudio de la base de datos de la Surveillance, Epidemiology and End Results Program (SEER), realizado con 1.911 casos, identificó la edad avanzada, el tamaño tumoral de >4cm y la presencia de metástasis, como factores pronósticos asociados a una menor supervivencia específica12. En nuestro estudio, el análisis univariado mediante regresión de Cox identificó la presencia de necrosis, infiltración perineural, infiltración linfovascular y la recidiva tumoral con una menor supervivencia libre de enfermedad. El número de mitosis (categorizado en ≥10 y<10) también se asoció a una menor supervivencia libre de enfermedad. En el análisis multivariado, la infiltración linfovascular y un alto recuento mitótico (categorizado en ≥18 y<18) se asociaron a una menor supervivencia libre de enfermedad, con un riesgo de recaída significativamente mayor en los casos con un recuento mitótico de ≥18 (5 veces mayor). Finalmente, cabe destacar que, a pesar de que la presencia de unos márgenes quirúrgicos afectos en la primera exéresis no se identificó como factor pronóstico en el presente análisis estadístico, este es un importante predictor de recidiva local, y 3 de los 4 pacientes con enfermedad metastásica presentaron márgenes afectos, y una o más recidivas locales del tumor. Estos hallazgos son concordantes con los de estudios previos1–3. Es posible que, en nuestro estudio, la presencia de márgenes afectos no haya resultado un factor significativo en el análisis estadístico debido al sesgo inherente del centro oncológico (Instituto Valenciano de Oncología), del que proceden la mayoría de los casos. Muchos de los casos de este centro no eran tumores primarios, sino tumores que habían recidivado, derivados de otros centros.
En los sarcomas de tejidos blandos, se han identificado como principales factores pronósticos el tamaño y la profundidad tumoral, el estadio tumoral y el estadio o grado histológico. El sistema de graduación más ampliamente empleado para los sarcomas de partes blandas, el de la Fédération Nationale des Centres de Lutte Contre Le Cancer (FNCLCC), considera 3 factores pronósticos independientes para determinar la graduación de un sarcoma: la presencia de necrosis, el grado de diferenciación y el número de mitosis (categorizado en <10, de 10 a 20 y ≥20)15–17. Los sarcomas de origen cutáneo, más superficiales, y en general de mucho mejor pronóstico, no están recogidos dentro de estos sistemas de clasificación. No obstante, parece lógico pensar que los criterios asociados a un peor pronóstico en otros tumores relacionados por estirpe, aunque más profundos, puedan tener un significado similar en el SPD. La necrosis, la infiltración linfovascular y un mayor número mitótico son hallazgos que están considerados como factores pronósticos independientes que determinan la potencial agresividad de un sarcoma de partes blandas15. Y, según nuestros resultados, también estarían relacionados con una mayor agresividad del SPD, expresada en una menor supervivencia libre de enfermedad. Cabe destacar, además, que ninguno de los pacientes del estudio con un número de mitosis inferior a 10 por 10 campos de gran aumento presentó una recidiva y que los individuos con un recuento mitótico de al menos 18 tuvieron un riesgo de recidiva 5 veces mayor. Por ello, según nuestros resultados, un alto recuento mitótico sería el factor pronóstico más significativo. Por otro lado, la presencia de infiltración perineural no ha sido identificada como un factor pronóstico en otros estudios, ya sea en sarcomas cutáneos o de partes blandas. Sin embargo, es bien conocido que la presencia de esta sí es un factor de agresividad importante en otras neoplasias malignas, siendo algunas de las más frecuentes y mejor caracterizadas el carcinoma epidermoide de cabeza y cuello y el carcinoma epidermoide cutáneo18–20. A pesar de que el presente estudio es una de las series de SPD con un mayor número de pacientes hasta la fecha (las principales series de SPD publicadas hasta ahora tenían entre 16 y 92 pacientes, excluyendo la de la SEER), continúa tratándose de una muestra relativamente pequeña y, por ello, en ausencia de otros trabajos con hallazgos similares que pudieran corroborar nuestros resultados, no podemos especular acerca del verdadero valor pronóstico de la presencia de infiltración perineural en el SPD. No obstante, se debe subrayar que el hecho de que un tumor tenga capacidad para invadir las fibras nerviosas constituye, lógicamente, un rasgo de agresividad (independientemente de su categoría como factor pronóstico o no). Por tanto, sería esperable que su identificación implique, necesariamente, una mayor agresividad. En el análisis multivariado, solo la invasión linfovascular y un alto recuento mitótico (categorizado en <18 y ≥18) mantuvieron su asociación significativa a una menor supervivencia libre de enfermedad. Sin embargo, aunque el resto de las variables identificadas en el análisis univariado (la infiltración perineural y la necrosis) no lo hicieron, sí que se acercaron al nivel de significación estadística. Esto puede ser debido al hecho de que el presente estudio constituye una muestra relativamente pequeña y es probable que, de mantenerse la tendencia, con la inclusión de un mayor número de pacientes, estas variables resultasen significativas. Finalmente, es interesante señalar que de los 4 criterios de agresividad que distinguen al SPD del FXA, todos salvo uno (la infiltración del tejido celular subcutáneo) se asociaron a una menor supervivencia libre de enfermedad en el presente trabajo. En nuestra serie, la invasión del tejido celular subcutáneo fue el criterio definitorio de SPD más frecuente, estando presente en todos los casos salvo en uno. Probablemente, la infiltración de la grasa sea el menos estricto de estos criterios, puesto que no hay acuerdo respecto a cuán marcada ha de ser esta invasión para cumplirlo (en este estudio, la invasión focal y/o aislada del tejido celular subcutáneo no se consideró como criterio único de SPD). Además, muchos tumores benignos o de comportamiento intermedio pueden presentar este hallazgo, sin que implique necesariamente un comportamiento clínico agresivo13. De este modo, en base a nuestros resultados, especulamos que mientras que la invasión del tejido celular subcutáneo tiene probablemente una menor importancia pronóstica, la presencia de cualquiera de los otros tres criterios de SPD (necrosis, infiltración perineural y/o invasión linfovascular), implica realmente una potencial mayor agresividad tumoral, asociándose a una menor supervivencia libre de enfermedad.
ConclusionesEl SPD es un tumor agresivo, en el que la presencia de un alto recuento mitótico (≥18 por 10 campos de gran aumento) y/o invasión linfovascular se asocian a un mayor riesgo de recidiva y a una peor supervivencia libre de enfermedad. La necrosis y la infiltración perineural, también son hallazgos que probablemente se asocien a una mayor agresividad tumoral. Es esencial realizar un diagnóstico inicial preciso y evitar el diagnóstico erróneo de FXA en tumores que cumplan criterios histológicos de agresividad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.