El carcinoma de células basales (CBC) es el cáncer más prevalente. Una minoría de CBC tiene un comportamiento agresivo (CBCla) y puede requerir inhibidores de la vía hedgehog, como sonidegib como tratamiento.
ObjetivoDescribir el uso de sonidegib en un gran número de pacientes y aportar más datos sobre su perfil de eficacia y seguridad en la vida real.
MétodosRealizamos un estudio retrospectivo y multicéntrico que incluyó pacientes tratados con sonidegib. Se recogieron datos epidemiológicos, de eficacia y de seguridad.
ResultadosSe incluyeron un total de 82 pacientes con una edad media de 73,9 años. Diez pacientes tenían síndrome de Gorlin. La mediana de duración del tratamiento fue de seis meses. La mediana de duración del seguimiento fue de 34,2 meses. Globalmente, 81,7% de los pacientes mostró mejoría clínica (52,4% respuesta parcial y 29,3% respuesta completa), 12,2% estabilidad clínica y 6,1% progresión de la enfermedad. No hubo diferencias estadísticamente significativas en la mejoría clínica entre la posología de sonidegib de 24 h y de 48 h. Después de seis meses de tratamiento, 48,8% de los pacientes suspendió sonidegib. El tratamiento previo con vismodegib y el CBC primario recurrente se asociaron con una peor respuesta a sonidegib. A los seis meses de tratamiento, 68,3% de los pacientes experimentó al menos un efecto adverso.
ConclusiónSonidegib muestra un perfil de eficacia y seguridad mejor de lo esperado en la práctica clínica habitual.
Basal cell carcinoma (BCC) is the most prevalent cancer. A minority of BCCs have an aggressive behaviour (laBCC) and may require hedgehog pathway inhibitors such as sonidegib as its treatment.
ObjectiveTo describe the use of sonidegib in a large number of patients and provide more data on its real-life efficacy and safety profile.
MethodsWe conducted a retrospective and multicentric study that included patients treated with sonidegib. Epidemiological, effectiveness and safety data were collected.
ResultsA total of 82 patients with a mean age of 73.9 years were included. Ten patients had Gorlin syndrome. Median treatment duration was 6 months. Median follow-up duration was 34.2 months. Globally, 81.7% of the patients showed clinical improvement (52.4% partial response and 29.3% complete response), 12.2% clinical stability and 6.1% disease progression. There was no statistically significant difference in clinical improvement between the 24 h and 48 h sonidegib posology. After 6 months of treatment, 48.8% of the patients discontinued sonidegib. Prior vismodegib treatment and recurrent primary BCC were associated with a poorer response to sonidegib. At 6 months of treatment, 68.3% of the patients experienced at least one adverse effect.
ConclusionSonidegib shows good effectiveness and acceptable safety profile in usual clinical practice.
El carcinoma basocelular (CBC) es el cáncer más prevalente en la población caucásica a nivel mundial, pero en la mayoría de los casos su comportamiento no es agresivo1. Desafortunadamente, en una minoría de pacientes2 el CBC será considerado como un CBC localmente avanzado (CBCla) y puede progresar a una invasión tisular local y, en casos remotos, a metástasis3. Dado que una señalización alterada de la vía hedgehog es la condición sine qua non para el desarrollo de la mayoría de los CBC4, los inhibidores de la vía hedgehog (IHh) son actualmente el tratamiento de elección en aquellos casos de CBCla que no son susceptibles de tratamiento quirúrgico o de radioterapia5. El sonidegib (Odomzo®, Sun Pharmaceutical Industries, Inc.; Cranbury, NJ, EE. UU.) es el último IHh aprobado por la Food and Drug Administration (FDA) y la European Medicines Agency (EMA) para el CBCla basado en los resultados del estudio clínico BOLT6. Si bien carece de una comparación directa con el otro IHh aprobado, el vismodegib, el sonidegib tiene una acumulación más extensa dentro de los tejidos y una concentración plasmática más baja, lo que sugiere un perfil farmacodinámico más favorable que podría explicar las diferencias en eficacia y en seguridad7. En una comparación indirecta de ensayos clínicos, el sonidegib demostró una tasa de respuesta objetiva (ORR) ligeramente más alta y una mayor duración de la respuesta y la supervivencia libre de progresión que el vismodegib7. En términos de perfil de tolerabilidad, el sonidegib mostró una menor incidencia de la mayoría de los efectos adversos (EA), un tiempo más prolongado hasta el inicio de los EA y una menor gravedad en comparación con el vismodegib7. Además, el sonidegib es el único IHh con un régimen alternativo con la pauta de 200 mg en días alternos para controlar los efectos secundarios8. Más recientemente, el análisis de riesgo-beneficio mostró que es más probable que el sonidegib logre una respuesta terapéutica que desarrolle EA que lleven a su suspensión9. Sin embargo, aún hay escasos datos acerca del uso de sonidegib en la vida real y los estudios observacionales publicados hasta ahora incluyen un pequeño número de pacientes10. El objetivo de este estudio es describir el uso del sonidegib en un mayor número de pacientes y proporcionar más datos sobre su perfil de eficacia y seguridad en la vida real, sobre la correlación entre la respuesta y las características clínicas y la subpoblación Gorlin.
Material y métodosSe diseñó un estudio retrospectivo, multicéntrico y descriptivo en 15 centros de toda España. Se incluyeron pacientes tratados con sonidegib durante > 3 meses por CBCla (estadio III de la clasificación de la Asociación Europea de Dermato-Oncología [EADO]11) desde el 1 de enero de 2021 hasta el 30 de abril de 2022. El estudio fue aprobado por el Comité de Ética local (aprobación número: 214/17). Se recogieron datos epidemiológicos, de eficacia y de seguridad. Los investigadores evaluaron la respuesta clínica de manera similar a otros estudios de la vida real12 con respuesta completa (RC) cuando no había tumor visible; respuesta parcial (RP) cuando el tumor disminuyó al menos 50% de tamaño; enfermedad estable (EE) cuando la reducción del tumor fue inferior a 50%, o menos de 20% de aumento en el área del tumor; enfermedad progresiva (PE), cuando el tumor aumentó su tamaño al menos 20%.
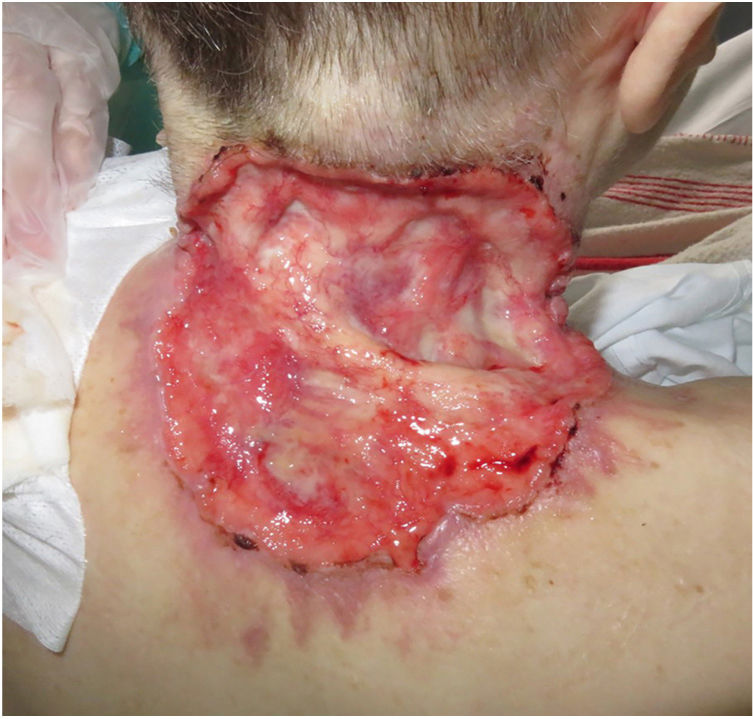
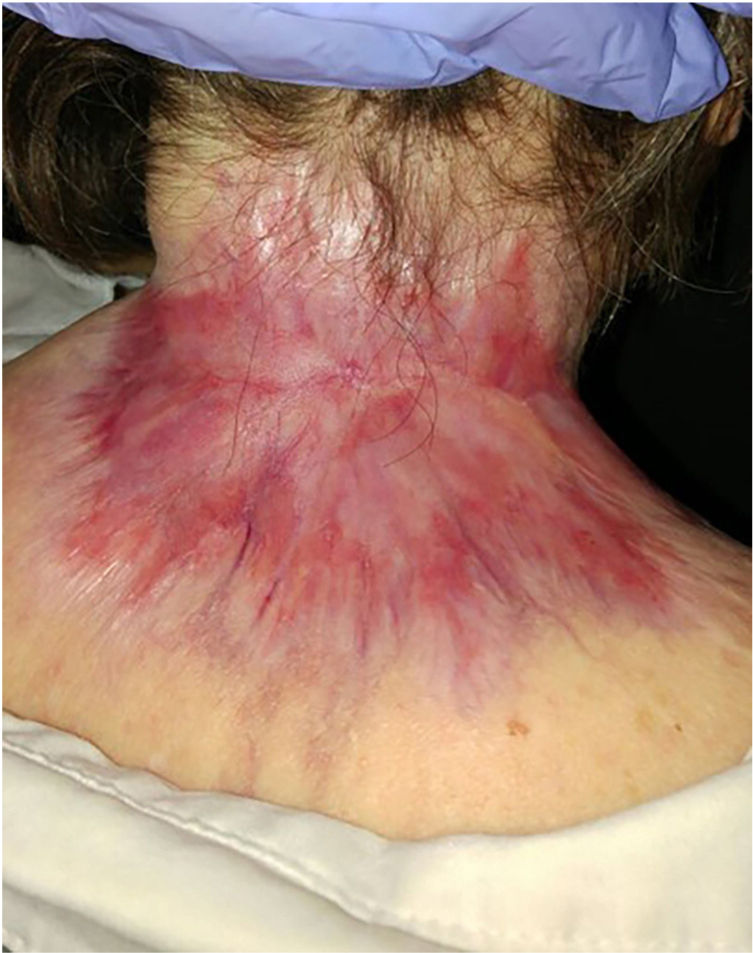
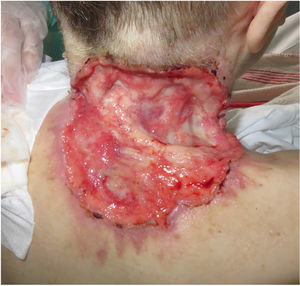
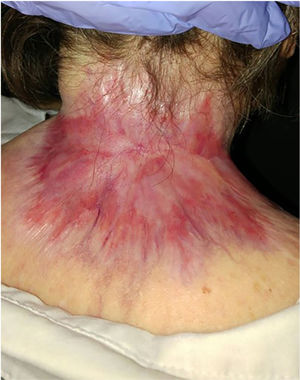
ResultadosSe incluyeron un total de 82 pacientes (39 mujeres [47,6%] y 43 hombres [52,4%]) con una mediana de edad de 71 años [rango 33-100]). La tabla 1 muestra las características epidemiológicas y clínicas de los pacientes. La mayoría de los pacientes (98,8%) eran caucásicos. La mediana de peso fue de 73,5 kg. Veintinueve por ciento de los pacientes no eran independientes para las actividades básicas de la vida diaria y 10 pacientes (12,2%) tenían un diagnóstico psiquiátrico subyacente. Diez pacientes (12,2%) tenían diagnóstico de síndrome de Gorlin. Estos pacientes eran significativamente más jóvenes (mediana de edad de 45,4 años, p = 0,001). El número total de CBC tratados fue de 221, con una mediana de diámetro de 43,6 mm y una mediana de superficie de 2.257,1 mm2; 61% de los casos presentó ulceración, 6,1% infiltración perineural y 14,6% invasión ósea. El subtipo histológico de CBC predominante fue el infiltrante (65,8%), seguido del nodular (28%) y el basoescamoso (6%). En 36,6% de los casos, el CBC estaba situado en la cara, mientras que en 8,5% de los casos en el cuero cabelludo, 32,9% periorbitario, 6,1% en el tronco, 1,2% en los brazos y 9,8% en las piernas. En 56,1% de los pacientes el CBC fue recurrente. El tratamiento previo fue la cirugía (42,7%), radioterapia (18,3%), vismodegib (19,5%) u otros tratamientos (11%; imiquimod local o criocirugía). De los pacientes que se sometieron a una cirugía previa, 7,3% recibió cirugía de Mohs y la mediana de cirugías realizadas por CBCla fue de tres (rango 1-18). En relación con el tratamiento previo con vismodegib, se realizó cambio de fármaco a sonidegib por falta de respuesta (83,3%) y EA (16,6%). En cuanto al tratamiento con el sonidegib, la mediana de días transcurridos desde el diagnóstico del CBCla y el inicio de IHh fue de 60 días. El sonidegib se inició como tratamiento único en 92,4% de los casos, como tratamiento neoadyuvante en 6,1% y como tratamiento coadyuvante en 2,4% de los pacientes. La posología de tratamiento inicial fue de 200 mg diarios excepto en 6,1% de los casos en los que se tomó en días alternos por recomendación del investigador (principalmente pacientes que previamente habían tenido EA con vismodegib). La mediana de duración del tratamiento con sonidegib fue de seis meses (rango 3-16). La mediana de duración del seguimiento fue de 34,2 meses (rango 11-60 meses). Cincuenta y tres fueron la mediana del número de días (rango 10-225) requeridos para mostrar alguna mejoría clínica. Globalmente, 81,7% de los pacientes mostró una mejoría clínica (52,4% respuesta parcial y 29,3% respuesta completa [figs. 1 y 2]), 12,2% estabilidad clínica y 6,1% progresión de la enfermedad. Todos los pacientes que progresaron habían recibido tratamiento previo con vismodegib, pero 37,5% de los pacientes previamente tratados con vismodegib experimentaron una mejoría clínica. No hubo diferencias estadísticamente significativas en la mejoría clínica (p = 0,8) entre la posología de sonidegib de 24 h y 48 h.
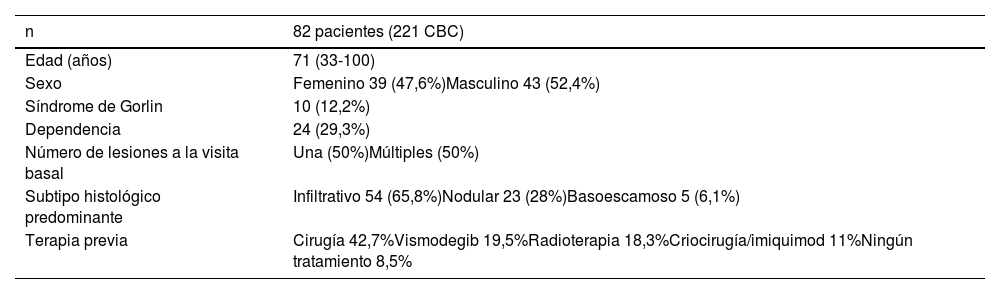
Características clínicas y epidemiológicas de los pacientes
| n | 82 pacientes (221 CBC) |
|---|---|
| Edad (años) | 71 (33-100) |
| Sexo | Femenino 39 (47,6%)Masculino 43 (52,4%) |
| Síndrome de Gorlin | 10 (12,2%) |
| Dependencia | 24 (29,3%) |
| Número de lesiones a la visita basal | Una (50%)Múltiples (50%) |
| Subtipo histológico predominante | Infiltrativo 54 (65,8%)Nodular 23 (28%)Basoescamoso 5 (6,1%) |
| Terapia previa | Cirugía 42,7%Vismodegib 19,5%Radioterapia 18,3%Criocirugía/imiquimod 11%Ningún tratamiento 8,5% |
CBC: carcinoma basocelular.
Tras seis meses de tratamiento, 48,8% de los pacientes suspendieron el sonidegib, de los cuales, 26,8% fue por EA, 20,7% por respuesta completa y 1,2% por progresión de la enfermedad. La respuesta clínica al sonidegib no se asoció estadísticamente con la edad, el sexo, el peso, las características del CBCla (es decir, la invasión local, el subtipo histopatológico, el número de CBC, la enfermedad de Gorlin, el tiempo de aparición del CBC o la ubicación del tumor) o el tratamiento previo, excepto en el caso de tratamiento previo con vismodegib (tasa de respuesta de 56,2%, p = 0,001) y el CBC primario recurrente (tasa de respuesta de 72,7%, p = 0,003), que se asociaron con una peor respuesta al fármaco. A los seis meses de tratamiento, 56 pacientes (68,3%) experimentaron al menos un EA. Los espasmos musculares estuvieron presentes en 22% (n = 18) de los pacientes, mientras que 18,3% (n = 15) informó disgeusia, 14,6% (n = 12) presentó fatiga, 8,5% (n = 7) pérdida de cabello, 3,7% (n = 3) pérdida de peso, 2,4% (n = 2) tenían hepatitis y náuseas cada uno, y 1,2% (n = 1) un incremento de la creatina cinasa. Todos los EA fueron leves (grados I y II), excepto los dos casos de hepatitis, categorizados como grado III. No se encontró relación estadísticamente significativa entre la mejoría clínica y la presencia de algún EA (p = 0,43). Los pacientes que tomaron sonidegib cada 48 h tuvieron menos EA (20%), en comparación con el grupo de 24 h (68,3%) (p = 0,01). En cuanto al tiempo de aparición del EA, los espasmos musculares aparecieron a los 67 (rango 15-165) días, la hiporexia a los 94 (rango 60-150) días, la disgeusia a los 49 (10-150) días, la astenia a los 46 (rango 1-135) días, la pérdida de cabello en 120 (rango 12-270) días y la hepatitis en 50 (45-60) días después del inicio de sonidegib. Los EA que requirieron la suspensión del fármaco fueron la hepatitis (100%), los espasmos musculares (33,3%), la astenia (25%) y la disgeusia (25%). En total, 20,7% de los pacientes requirieron el ajuste de dosis por EA. Los espasmos musculares requirieron ajuste de dosis en 33,3%, la astenia en 28,1%, la disgeusia en 26,5% y la caída del cabello en 11,3% de los casos cuando se presentaron.
El ajuste de la dosis consistió en la toma de sonidegib cada 48 h en 96,5% de los casos y la suspensión del fármaco entre uno y dos meses en el resto de los pacientes. Todos los EA, incluida la hepatitis, se resolvieron. En 90,9% de los casos en los que se suspendió el sonidegib y luego se reinició a la misma dosis, reapareció el mismo EA con la misma gravedad. Analizamos más a fondo a los pacientes con síndrome de Gorlin y no encontramos diferencias estadísticamente significativas con respecto a la respuesta o la aparición de EA (tabla 2), en comparación con los pacientes sin Gorlin. En cuanto al seguimiento de los pacientes, la exploración clínica se realizó mensualmente en 59,8% de los pacientes, cada dos meses en 18,3%, cada tres meses en 6,1% y más de tres meses en 15,9% de los pacientes. Los análisis de sangre se realizaron cada mes (53,7%), cada dos meses (14,6%), cada tres meses (4,9%) o más de tres meses en 14,6% de los pacientes. En 12,2% de los pacientes no se realizaron análisis de sangre. La imagen radiológica no se realizó en 64,6% de los casos, mientras que se realizó cada mes (3,7%), cada dos meses (3,7%) o más de tres meses en 28% restante de los pacientes. Por último, los controles histopatológicos (biopsias incisionales) se realizaron mensualmente en 65,9% de los pacientes, cada dos meses (1,8%), cada tres meses (1,8%) y en más de tres meses (28%).
DiscusiónLos datos de la vida real sobre la seguridad y eficacia de un fármaco pueden ser útiles para detectar heterogeneidades clínicas en comparación con los ensayos clínicos fundamentales. En la práctica clínica habitual, el candidato habitual para el tratamiento con IHh es un paciente mayor que durante muchos años no ha consultado por su CBC. En repetidas ocasiones, esto ocurre porque el paciente no es independiente y requiere de los cuidados de terceros. Así lo demuestra nuestro estudio, ya que casi uno de cada cuatro pacientes presenta algún grado de dependencia y aproximadamente 10% alguna patología psiquiátrica. En estos pacientes, la importancia de las lesiones cutáneas tiende a minimizarse y el CBC adquiere un perfil de CBCla tras años de evolución sin ningún control13. Es importante tener en cuenta la situación de vulnerabilidad de los pacientes, ya que la principal limitación del sonidegib es la aparición de EA.
En el estudio BOLT se notificó una mayor frecuencia y gravedad de EA que los encontrados en nuestra cohorte de casos a los seis meses (todos los EA notificados en 95% de los pacientes en el estudio BOLT vs. 68,3% en nuestro estudio; EA grado III-IV en 30% de los casos en el estudio BOLT vs. 2,4% en nuestro estudio)6–14. Este hallazgo no es sorprendente ya que hoy en día los pacientes que inician un tratamiento con un IHh reciben una importante educación sanitaria (por ejemplo, ejercicio y pautas dietéticas) para prevenir o minimizar los EA. Este hecho explica la razón por la que se observó una menor frecuencia de EA prevenibles, como son la pérdida de peso o la disgeusia, evidenciados entre nuestros datos en comparación con los ensayos pivotales. Además, no encontramos ningún predictor del desarrollo de EA y, por lo tanto, debemos considerar a todos los pacientes susceptibles y asesorarlos en consecuencia. Sin embargo, encontramos una tasa de interrupción del fármaco debido a EA similar a la de los ensayos pivotales en un corte a los seis meses14 (22% en el estudio BOLT vs. 26,8% en este estudio), lo que puede implicar que, aunque los EA pueden minimizarse o prevenirse, el sonidegib, como otros tratamientos IHh, tiene una limitación inherente en su perfil de tolerabilidad. Este hecho podría cambiar la percepción del sonidegib de un tratamiento crónico a un tratamiento de tipo episódico, es decir, que puede repetirse según sea necesario.
Cabe señalar que los EA tienden a reaparecer después de la reintroducción del fármaco y parecen depender de la dosis. Nuestros datos muestran unos EA significativamente menores y una eficacia clínica comparable entre la dosis diaria y la dosis en días alternos, lo que es consistente con el análisis realizado en el estudio BOLT en un subconjunto de pacientes con dosis reducida del fármaco15 y en la vida real16. Por lo tanto, en el sonidegib la ingesta de 200 mg en días alternos es una opción atractiva, especialmente en pacientes en los que un perfil tolerable a largo plazo es de suma importancia (por ejemplo, pacientes con Gorlin o pacientes vulnerables con una respuesta parcial al fármaco). Además, esta dosis podría tener un riesgo hipotético menor de desarrollar resistencia adquirida al fármaco que el tratamiento intermitente episódico. Cabe señalar que la mayoría de los EA tienden a aparecer en el momento en que el tumor responde a la medicación y, por lo tanto, se debe programar cuidadosamente un marco de tiempo apropiado para la visita de seguimiento clínico. Cabe señalar que nuestros datos muestran una heterogeneidad significativa de los controles de seguimiento de los pacientes y, por lo tanto, una guía de consenso mundial para el manejo de IHh podría ayudar a estandarizar su seguimiento clínico. No obstante, con base en los resultados de eficacia y seguridad, se debe proponer al paciente la primera visita de seguimiento antes de las ocho semanas de tratamiento.
Las ORR, según la revisión del investigador en pacientes que recibieron sonidegib 200 mg diarios para los CBCla, fueron de 67%14 (tabla 3). Curiosamente, 81,7% de nuestros pacientes tuvieron una mejoría clínica tras seis meses de tratamiento. Esto podría explicarse por los criterios RECIST modificados más estrictos (mRECIST) utilizados en el estudio BOLT17, pero similar a otras efectividades reportadas en la práctica clínica real18. El tiempo hasta la respuesta del tumor (53,1 días) es consistente con los datos previos (1,9-3,9 meses)17.
Estudios Comparativos de tratamiento con 200 mg de sonidegib
| EstudioBOLT | Este estudio | Villani et al.12 | Herms et al.24 | |
|---|---|---|---|---|
| n | 79 | 82 | 54 | 21 |
| Tiempo de estudios | 6 meses | 6 meses | 7 meses | 18,7 meses (mediana) |
| Tipo de estudio | Estudio clínico | Descriptivo de vida real | Descriptivo de vida real | Descriptivo de vida real |
| ORR | 67% (50-80) | 81,7% | 92,6% | 80,95% |
| Frecuencia de EA | 95% | 68,3% | 85,1% | 100% |
| Discontinuación debido a EA | 22% | 26,8% | No valorable | 44% |
| Ajuste de dosis debido a EA | 32% | 20,7% | No valorable | 10% reducción de dosis y 19% interrupción temporaria |
El análisis BOLT a los seis meses utilizó los criterios mRECIST que son más estrictos que los criterios utilizados en los estudios de la vida real.
EA: efecto adverso; ORR: tasa de respuesta objetiva.
Encontramos que la efectividad del sonidegib fue en gran medida independiente de distintas situaciones clínicas (por ejemplo, edad, peso, sexo, invasión local, subtipo histopatológico [incluido el basoescamoso], número de CBC, enfermedad de Gorlin, tiempo de aparición o ubicación del tumor), excepto en dos escenarios: tratamiento previo con vismodegib y CBC recurrente. Una respuesta más pobre a un CBC recurrente no es sorprendente, ya que generalmente indica que las características del tumor son desfavorables o que el tratamiento previo (es decir, cirugía o radioterapia) podría dificultar la llegada del fármaco al tumor debido a una anatomía y vascularización modificadas secundarias a la fibrosis. Este hallazgo podría tener implicaciones clínicas directas, ya que en los CBC avanzados, clasificados recientemente como estadio III por la EADO11, podrían beneficiarse del tratamiento con IHh como tratamiento neoadyuvante con posibilidad de rescate quirúrgico si fuera necesario. Una peor respuesta después del tratamiento con el vismodegib podría explicarse por la selección de CBC resistentes a IHh después del tratamiento con vismodegib o CBC intrínsecamente peores de los que responden a IHh debido a las características del tumor. Sin embargo, dado que 37,5% de los pacientes que usaron vismodegib en el pasado experimentaron una mejoría clínica con sonidegib, debe considerarse como un abordaje terapéutico interesante, principalmente en pacientes con EA insoportables debido al vismodegib. Una posible implicación de estos hallazgos es que el médico puede enfatizar las visitas de seguimiento de los pacientes con un CBC recurrente o un CBC previamente tratado con el vismodegib, pero no se debe de considerar a los pacientes con mala respuesta con tumores clásicos citados como de alto riesgo (por ejemplo, invasión ósea).
Además encontramos una respuesta similar y la aparición de EA entre los pacientes con Gorlin y los que no lo son, lo que nuevamente implica que la respuesta al fármaco parece ser independiente de las variables clínicas. La eficacia del sonidegib en la subpoblación de Gorlin ya se demostró en un estudio en el que se estudiaron ocho pacientes con síndrome de Gorlin en la semana 16 de tratamiento con 400 mg de sonidegib19 y en reportes de casos20,21.
Por último, encontramos que la mediana de días transcurridos desde que se realiza un diagnóstico de CBC en el estadio III hasta que se inicia el tratamiento con sonidegib fue de 60 días y, por lo tanto, se debe hacer más énfasis en reducir este tiempo.
ConclusiónEl sonidegib muestra una buena efectividad y un perfil de seguridad aceptable en la práctica clínica habitual. El CBC recurrente y el uso previo del vismodegib fueron las únicas características clínicas asociadas con una peor respuesta al sonidegib. Curiosamente, los pacientes con Gorlin y los pacientes con histopatología basoescamosa tuvieron un perfil de eficacia y seguridad similar al de la población general, lo que indica que el sonidegib es una opción útil en estas dos subpoblaciones. Los EA siguen siendo el factor limitante para su uso y se debe asesorar adecuadamente a los pacientes para prevenirlos o minimizarlos. La tolerabilidad del fármaco aumentó significativamente con una posología de cada 48 h sin una disminución significativa de la eficacia, probablemente debido a su alta distribución en la piel8 y, por lo tanto, la dosis aprobada del sonidegib en días alternos (48 h) es un enfoque terapéutico atractivo. Se pueden aplicar otras estrategias para mejorar la tolerabilidad, como interrupciones temporales o tratamiento médico de EA específicos16–18,22,23. Se deben realizar más estudios para caracterizar adecuadamente la efectividad del fármaco en la práctica clínica.
FinanciaciónEste estudio ha sido financiado por Sun Pharmaceutical Industries.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.