El lentigo maligno es el melanoma más frecuente en la cara.
El diagnóstico del lentigo maligno es complicado porque los signos clínicos y dermatoscópicos asociados a lentigo maligno pueden verse en otras lesiones cutáneas faciales.
La microscopia confocal de reflectancia es una técnica de imagen que permite detectar hallazgos característicos del lentigo maligno. En la epidermis encontramos la pérdida del patrón en panal de abejas y células pagetoides con tendencia al foliculotropismo. Estas células pagetoides suelen ser de morfología dendrítica, aunque también pueden presentarse como células redondas mayores de 20μm con núcleos atípicos. En la unión dermoepidérmica las papilas dérmicas pueden estar mal delimitadas y haber células atípicas. Estas células pueden formar puentes que parecen estructuras mitocondriales. Además, podemos ver engrosamientos junturales con células atípicas localizados alrededor de los folículos simulando una cabeza de medusa.
La microscopia confocal de reflectancia es muy útil en el diagnóstico del lentigo maligno.
Lentigo maligna is the most common type of facial melanoma. Diagnosis is complicated, however, as it shares clinical and dermoscopic characteristics with other cutaneous lesions of the face. Reflectance confocal microscopy is an imaging technique that permits the visualization of characteristic features of lentigo maligna. These include a disrupted honeycomb pattern and pagetoid cells with a tendency to show folliculotropism. These cells typically have a dendritic morphology, although they may also appear as round cells measuring over 20μm with atypical nuclei. Poorly defined dermal papillae and atypical cells may be seen at the dermal-epidermal junction and can form bridges resembling mitochondrial structures. Other characteristic findings include junctional swelling with atypical cells located around the follicles, resembling caput medusae. Reflectance confocal microscopy is a very useful tool for diagnosing lentigo maligna.
El lentigo maligno (LM) es un melanoma in situ que suele diagnosticarse en la piel fotoexpuesta (cabeza y cuello) de personas de edad avanzada. El LM supone el 80% de los melanomas in situ, siendo el tipo más frecuente en la cara, y cuando se hace invasivo pasa a denominarse LM melanoma (LMM)1.
El diagnóstico de LM es difícil porque sus signos clínicos y dermatoscópicos iniciales son sutiles y no patognomónicos. Además, existe un gran número de lesiones pigmentadas con las que es necesario hacer el diagnóstico diferencial, como los lentigos solares (LS), los lentigos simples, las queratosis seborreicas planas (irritadas o no), las queratosis liquenoides, las queratosis actínicas (sobre todo su variante pigmentada), la enfermedad de Bowen y los epiteliomas basocelulares pigmentados2,3.
La microscopia confocal de reflectancia (MCR) es una técnica de diagnóstico por imagen no invasiva que permite la visualización de la epidermis y la dermis papilar con una resolución celular cercana a la histología convencional. La MCR es excelente para analizar y establecer el diagnóstico de las lesiones maculosas faciales. A continuación, se describirán las principales características por microscopia confocal asociadas al diagnóstico de LM.
Características clínicas, histológicas y dermatoscópicas del lentigo malignoEl LM se caracteriza clínicamente por la presencia de máculas pigmentadas de lento crecimiento. El diagnóstico clínico diferencial con los lentigos solares, las queratosis actínicas pigmentadas y las queratosis seborreicas planas es a veces complejo. Es mucho más fácil distinguir el LM de los nevus melanocíticos de localización facial debido a que estos en pacientes de edad avanzada suelen ser papulosos y de coloración de la piel normal (nevus tipo Miescher).
Histológicamente, también puede ser difícil el diagnóstico diferencial entre el LM y las hiperplasias melanocíticas atípicas asociadas a daño solar, sobre todo en biopsias de pequeño tamaño. Es fundamental una buena correlación clínico-patológica para no errar en el diagnóstico, sobre todo en localizaciones de daño solar como la cara y el cuello en personas de edad avanzada y en lesiones de gran tamaño4. Si sospechamos clínicamente LM y el diagnóstico histológico es de nevus juntural, nevus displásico o nevus lentiginoso atípico, debemos revisar bien la histología. Además, el tratamiento quirúrgico suele ser también complicado al ser lesiones grandes, de bordes mal definidos y de localización facial. No es infrecuente que recidiven con formas amelanóticas.
La dermatoscopia es una técnica que aumenta la sensibilidad y la especificidad en el diagnóstico de lesiones faciales pigmentadas. Los signos dermatoscópicos clásicos asociados al LM fueron descritos por Stolz et al. en el año 2002 e incluyen: la pigmentación folicular asimétrica, la presencia de puntos y glóbulos grisáceos de pequeño tamaño distribuidos de forma irregular alrededor del folículo (patrón anular-granular), las estructuras romboidales pigmentadas y las áreas homogéneas que obliteran los folículos5. Las queratosis actínicas pigmentadas, los LS y las queratosis liquenoides también pueden presentar un patrón anular-granular (puntos/glóbulos grises). Las estructuras romboidales y sobre todo las áreas homogéneas que obliteran los folículos son más específicos del LM y se asocian sobre todo a LM ya invasivos6.
Pralong et al. publicaron en 2012 las características de 125 LM/LMM en pacientes de raza blanca, ratificaron la utilidad de los signos clásicos de LM e identificaron más signos dermatoscópicos asociados al LM, que son: el aumento de la densidad vascular en el área del LM con respecto a la piel circundante, la presencia de estructuras romboidales rojas, la presencia de estructuras en diana y el oscurecimiento de la lesión cuando se mira con el dermatoscopio con respecto a la exploración clínica7.
El aumento de la densidad vascular y las estructuras romboidales rojas pueden verse también en las queratosis actínicas.
Las líneas angulosas o en zigzag descritas en el LM se corresponden con el inicio de la formación de estructuras romboidales8. En algunos LM extrafaciales el único signo dermatoscópico pueden ser esas líneas en zigzag9. La presencia de puntos finos similares a los que se ven en el patrón anular-granular, pero de color marrón y de distribución no anular, se ha asociado al fracaso del tratamiento con radioterapia o imiquimod10.
Características por microscopía confocal de reflectancia del lentigo malignoLa MCR es una técnica de diagnóstico por imagen no invasiva que permite la visualización de la epidermis y la dermis papilar con una resolución celular cercana a la histología convencional. El diagnóstico diferencial tanto clínico como dermatoscópico de lesiones faciales maculosas como el LS, la queratosis seborreica, la queratosis actínica, la enfermedad de Bowen, el epitelioma basocelular y el LM es a veces dificil y en esos casos la MCR es muy útil para establecer el diagnóstico correcto. La mayoría de los cambios en el LM se localizan en la epidermis y en la unión dermoepidérmica, y la MCR permite ver con precisión las características arquitecturales y citológicas típicas del LM porque obtiene imágenes desde la epidermis a la dermis papilar11. Además de para el diagnóstico, la MCR sirve también para delimitar los márgenes del LM previo al tratamiento12-14 como de forma intraoperatoria15. Además, la MCR permite la detección de recidivas tras la cirugía o valorar la respuesta a tratamientos no quirúrgicos10,12,16,17.
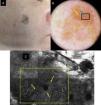
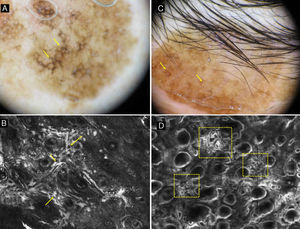
En la epidermis de los LM por microscopia confocal se detecta una pérdida focal o global de la arquitectura en panal de abejas y la presencia de células atípicas que se corresponden con la infiltración celular pagetoide en la histología. Las células presentes son sobre todo de morfología dendrítica (células grandes y pleomórficas con dendritas prominentes) y son muy indicativas de LM si doblan el tamaño de los queratinocitos, son abundantes y atípicas y se disponen alrededor de los folículos (fig. 1). Las células pagetoides también pueden ser redondas, grandes, atípicas con núcleos evidentes. Las células redondas son menos frecuentes que las dendríticas en el LM pero si miden más de 20μm son más específicas.
a) Mácula facial policroma de 3 años de evolución en un varón de 68 años. b) Imagen dermatoscópica con aperturas foliculares asimétricas (flecha amarilla), aumento de la densidad vascular (recuadro amarillo) y estructuras romboidales marrones (flecha azul). c) Imagen con MCR correspondiente al área del recuadro negro por dermatoscopia de 1×1,5mm que muestra en la abundantes células dendríticas (recuadro amarillo) con disposición perifolicular (flechas amarillas). A la izquierda de la imagen se observa la pérdida del patrón en panal de abejas en la capa espinosa; a la derecha la imagen se corresponde con la capa córnea.
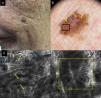
En la unión dermoepidérmica lo habitual es encontrar la pérdida del patrón en anillos. La presencia de papilas de contornos mal delimitados con células atípicas es muy indicativa de LM. Hay que diferenciar la no visualización de las papilas característica de la localización facial de la presencia de papilas de contornos mal definidos. Las células dendríticas en la unión dermoepidérmica pueden formar puentes que simulan mitocondrias. Estas estructuras son frecuentes en los melanomas in situ (fig. 2)18. También podemos encontrar en el LM engrosamientos junturales con células atípica. Estos engrosamientos junturales pueden situarse radialmente alrededor de los folículos simulando cabezas de medusa19,20 (fig. 2 d).
a) Imagen clínica en la que se aprecia una lesión pigmentada en un varón de 80 años. b) Imagen dermatoscópica con abundantes estructuras romboidales azul-grisáceas (flechas amarillas) y vascularización (flecha azul). c) Imagen con MCR en el área del recuadro negro por dermatoscopia de 1×1mm que muestra en la unión dermoepidérmica engrosamientos junturales con células atípicas (flechas amarillas); también se observa la disposición de las células dendríticas formando puentes que constituyen estructuras que simulan mitocondrias (flechas azules). d) Imagen por MCR de 1×1mm en la que vemos su disposición alrededor del folículo simulando una cabeza de medusa (recuadro amarillo).
En la dermis papilar en ocasiones pueden verse células atípicas nucleadas.
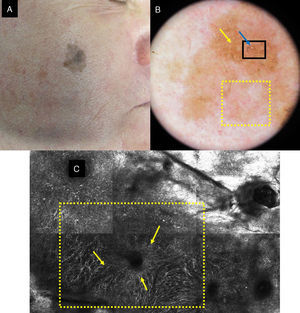
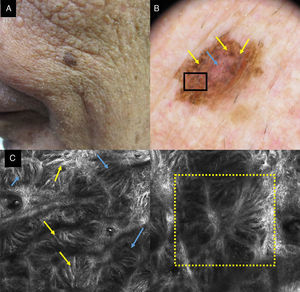
La MCR nos permite distinguir el LM del LS, que es la entidad principal con la que es necesario hacer el diagnóstico diferencial (fig. 3). En el LS el principal hallazgo se localiza en la unión dermoepidérmica, ya que los cambios se observan en las papilas dérmicas y en las crestas epidérmicas. Hay un aumento en la densidad de las papilas dérmicas que se presentan como cordones brillantes adoptando una morfología policíclica (papilas de contornos policíclicos). Esos cordones también reciben el nombre de proyecciones bulbosas y están formados por células monomorfas, brillantes, reflectantes y sin atipia que contienen melanina y melanosomas. Las estructuras cordonales vistas por MCR se corresponden en dermatoscopia con la huella digital. En el estrato granuloso y espinoso los LS mantienen el patrón en panal de abejas constituido por células poligonales monomorfas de núcleo oscuro y citoplasma claro y en las papilas dérmicas pueden verse melanófagos y linfocitos. El patrón de panal de abejas se pierde de forma focal o global en los LM. Los LM además suelen mostrar células atípicas pagetoides de hábito dendrítico con foliculotropismo además de pérdida de las papilas y engrosamientos junturales no homogéneos con células atípicas21.
a) Imagen dermatoscópica de una lesión de 3 años de evolución en la mejilla de una mujer de 72 años. Se observan estructuras romboidales marrón oscuras en gran parte de la lesión (flechas amarillas). b) Imagen por MCR que muestra engrosamientos junturales irregulares con células atípicas (flechas amarillas). c) Imagen dermatoscópica de una lesión supraciliar de 10 años de evolución en una mujer de 50 años. Se observa pigmentación folicular asimétrica (flechas amarillas). d) Imagen por MCR que muestra áreas (cuadrados amarillos) con un aumento en la densidad de las papilas dérmicas que adoptan contornos policíclicos y geométricos que reciben el nombre de contornos papilares policíclicos (también pueden llamarse proyecciones bulbosas).
El microscopio confocal también permite el diagnóstico de las queratosis liquenoides que son lesiones clínicamente maculosas que por dermatoscopia muestran regresión azul grisácea distribuida por toda la lesión. Con la MCR no se observan células pagetoides ni atipia celular y sí células algodonosas abundantes que a veces se agrupan y que se corresponden con melanófagos que no suelen tener núcleo visible22.
Guitera et al. publicaron en 2010 un estudio prospectivo en el que analizaron 64 signos observados por MCR en lesiones faciales de difícil diagnóstico (se incluyeron 81 LM y 203 lesiones benignas). Describieron las características confocales de los LM, identificaron 6 parámetros que se relacionaron con el diagnóstico de LM y establecieron un algoritmo diagnóstico. Este incluía 2 criterios mayores que puntuaban cada uno 2 puntos y 4 menores: 3 de ellos daban un punto positivo y uno era un criterio negativo que protegía del diagnóstico de LM restando un punto. Los criterios mayores incluían la pérdida del patrón en anillos reflectante típico de la unión dermoepidérmica y la presencia de células redondeadas pagetoides mayores de 20 micras. Los criterios menores positivos eran: la presencia de 3 o más células atípicas en 5 cuadrados de 0,5 por 0,5mm en la unión dermoepidérmica, la distribución perifolicular de las células atípicas y el hallazgo de células nucleadas en las papilas dérmicas. El criterio menor negativo incluía la presencia de un patrón epidérmico engrosado. Una puntuación superior o igual a 2 obtenía una sensibilidad del 85% y una especificidad del 76% en el diagnóstico de LM19 (tabla 1).
Algoritmo diagnóstico de lentigo maligno de Guitera et al19
| Criterios mayores (puntúan 2 puntos positivos) | Papilas de contornos mal delimitados |
| Células pagetoides redondas mayores a 20μm | |
| Criterios menores positivos (suman 1 punto) | Más de 3 células atípicas en la unión en 5 imágenes |
| Localización perifolicular de las células atípicas o células atípicas en la unión | |
| Células con núcleo dentro de la papila | |
| Criterios menores negativos (restan 1 punto) | Panal de abejas engrosado |
Un resultado mayor de 2 tiene una sensibilidad del 85% y una especificidad del 76% en el diagnóstico de LM.
De Carvalho et al. analizaron retrospectivamente 60 lesiones maculosas pigmentadas faciales incluyendo LM, LMM, LS/queratosis seborreicas planas, queratosis liquenoides y queratosis actínicas pigmentadas. Relacionando las características dermatoscópicas con los hallazgos por MCR, encuentran que el patrón en huella digital se encontró solo en lesiones benignas y se correspondía por MCR con cordones papilares policíclicos. El patrón anular-granular estaba presente tanto en las lesiones benignas como en los LM. Las estructuras romboidales azules o negras y las manchas azules o negras se veían casi exclusivamente en los LM/LMM y sobre todo en lesiones no incipientes. En los pocos casos de lesiones benignas con manchas u áreas homogéneas, estas se correspondían con un patrón en empedrado en la epidermis y cordones papilares policíclicos constituidos por células basales hiperpigmentadas localizados en la unión dermoepidérmica, típicas de los LS y de las queratosis seborreicas planas. En los LM/LMM se observó la proliferación intraepidérmica de células dendríticas (rara vez observada en lesiones benignas) con tendencia al foliculotropismo. Además encontraron engrosamientos junturales constituidos por células atípicas que se localizaban de forma radial alrededor de los folículos adoptando una estructura en cabeza de medusa23.
En relación con la utilidad de la MCR en el seguimiento de los tratamientos no invasivos del LM, Guitera et al. estudian a 99 pacientes diagnosticados de LM que habían sido tratados con radioterapia o imiquimod. La dermatoscopia mostró una sensibilidad del 80% y una especificidad del 56%, mientras que aplicando el algoritmo diagnóstico de LM por MCR obtuvieron una especificidad del 94% y una sensibilidad del 100%. Los 2 signos dermatoscópicos que más se asociaron con el diagnóstico histológico de melanoma fueron las aperturas foliculares asimétricas y la presencia los puntos marrones finos (similar al punteado del patrón anular-granular pero sin distribución anular). Este punteado marrón se correspondía con el hallazgo por MCR de células pagetoides, a diferencia de los puntos grisáceos finos, que por MCR mostraban melanófagos10.
ConclusionesLa MCR es una técnica muy eficaz en el diagnóstico del LM. La presencia de células atípicas en la epidermis (de localización predominantemente perifolicular) o en la unión dermoepidérmica, así como la pérdida de la arquitectura de la piel normal en la epidermis y en la unión dermoepidérmica, son claves en el diagnóstico del LM.
La MCR nos permite analizar toda la superficie de la lesión, además de poder correlacionar sus hallazgos con las características dermatoscópicas. La MCR es una técnica excelente para elegir las áreas a biopsiar, permite delimitar los márgenes de la lesión (incluso en lesiones amelanóticas), así como evaluar la respuesta al tratamiento y detectar las recurrencias y todo de forma no invasiva.
Por todo ello, creemos que la MCR no solo es clave en el diagnóstico, sino también en el seguimiento del LM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.