La dermatopatología incluye una larga lista de entidades, algunas con una histopatología muy similar. La immunohistoquímica representa una importante herramienta de ayuda en el diagnóstico, diagnóstico diferencial y pronóstico de muchas de las neoplasias cutáneas. La inmunohistoquímica es también la mejor técnica para determinar el origen de un tejido o la diferenciación de las células neoplásicas. En muchos casos, la inmunohistoquímica permite un diagnóstico más preciso de los distintos procesos infiltrando la piel. Este artículo revisa el papel de la inmunohistoquímica en el estudio de la diferenciación y el comportamiento biológico de la mayoría de las neoplasias que pueden afectar a la piel. Se revisan las técnicas de inmunoperoxidasa, se discute la utilidad de los anticuerpos utilizados con mayor frecuencia y se presentan una serie de problemas diagnósticos en los que la immunohistoquímica puede resultar muy útil. En cada caso, la finalidad es llegar a un diagnóstico concreto y definitivo. En esta segunda parte de nuestra revisión se analizan los anticuerpos más útiles y específicos en el estudio de las infecciones cutáneas, así como de las neoplasias epiteliales, musculares, vasculares, linfohematológicas, neurales, neuroendocrinas y melanocíticas afectando a la piel. Al final, se incluye una breve revisión del perfil inmunohistoquímico de las metástasis cutáneas de neoplasias malignas viscerales.
Dermatopathology includes a long list of disorders, some of which have very similar histopathology. Immunohistochemistry is an important auxiliary tool for diagnosis and differential diagnosis, and for predicting the outcome of many skin tumors. It is also the main technique for determining the origin of a tissue or the differentiation of neoplastic cells. In many cases, immunohistochemistry provides a more accurate diagnosis of the different processes that infiltrate the skin. This review examines the role of immunohistochemistry in studying the differentiation and biological behavior of the majority of tumors that can involve the skin. We review immunoperoxidase techniques, discuss the utility of the most commonly used antibodies, and highlight a number of diagnostic problems in which immunohistochemistry may be very useful. In each case, the goal is to reach a specific and definitive diagnosis. In the second part of our review, we examine the most useful and specific antibodies in the study of skin infections and of epithelial, muscular, lymphatic and hematologic, neural, neuroendocrine, and melanocytic neoplasms that affect the skin. Finally, we include a brief review of the immunohistochemical profile of skin metastases of malignant visceral tumors.
Solo un pequeño grupo de estos marcadores son realmente útiles en dermatopatología, ya que habitualmente otros métodos diagnósticos como el cultivo o la reacción en cadena de la polimerasa (PCR) son de mayor rendimiento diagnóstico. Además, la identificación inmunohistoquímica de estos microorganismos o sus antígenos requiere un diagnóstico previo de presunción muy específico1.
El anticuerpo anti-citomegalovirus (CMV) muestra un patrón de tinción nuclear en infecciones tempranas y nuclear más citoplasmático en las infecciones tardías.
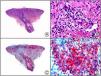
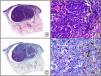
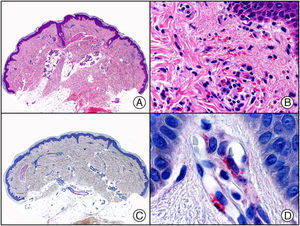
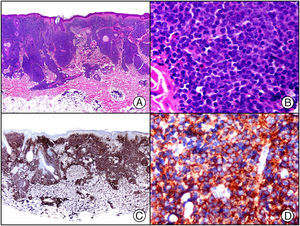
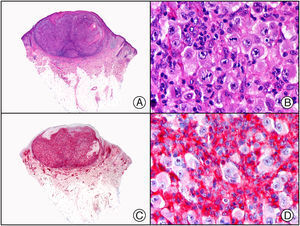
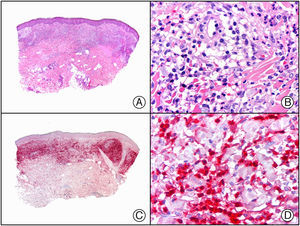
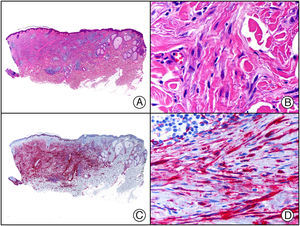
En la actualidad existen anticuerpos comercializados que permiten detectar material genómico por separado de los virus herpes simple 1 y 2 (VHS1 y VHS2) (fig. 1), así como del virus varicela-zóster (VVZ) en las infecciones cutáneas por estos virus. En todos estos casos se observa un patrón de tinción tanto citoplasmática como nuclear. Sin embargo, la mayor positividad se detecta en células diferentes según cual sea el tipo de virus herpes responsable, ya que las infecciones por VHS1 y VHS2 muestran positividad en los queratinocitos epidérmicos, mientras que en los casos de infecciones por VZV la máxima inmunotinción se observa en las células de la vaina radicular externa del folículo piloso y en los sebocitos de la glándula sebácea; por el contrario, los queratinocitos epidérmicos suelen resultar negativos para el VVZ, al menos en las fases iniciales de la infección2.
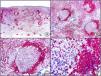
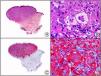
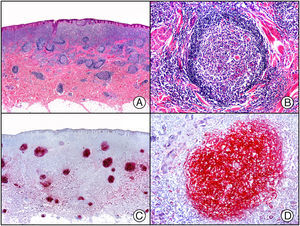
Herpes simple. A) Visión panorámica. B) Característico efecto citopático del virus herpes simple, mostrando núcleos de los queratinocitos con marginación periférica de su cromatina. C) El mismo caso estudiado inmunohistoquímicamente con anticuerpo anti-VHS-1. D) Positividad para el anticuerpo anti-HSV-1 en las mismas células que mostraban el efecto citopático herpético.
La inmunotinción para la proteína latente de membrana del virus de Epstein-Barr (VEB) (latent membrane protein/LMB, EBV) muestra un patrón de tinción citoplasmático. Este marcador resulta útil en el diagnóstico de la enfermedad linfoproliferativa postrasplante, el linfoma de Hodgkin y otros linfomas. Resulta, además, positivo en el 25-50% de los carcinomas de cavum. En dermatopatología, además de en el estudio de los linfomas previamente citados, también es útil para demostrar la presencia de material genómico del VEB en lesiones de leucoplasia vellosa de los pacientes con sida3,4.
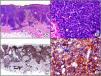
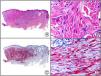
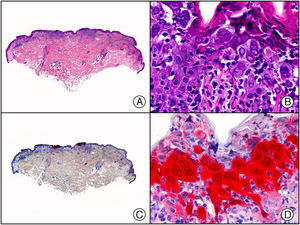
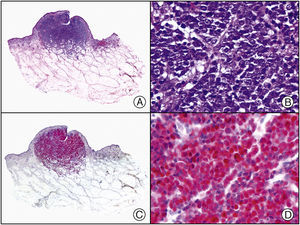
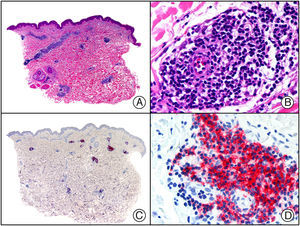
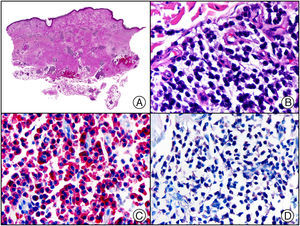
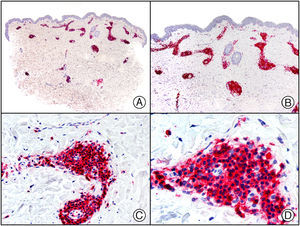
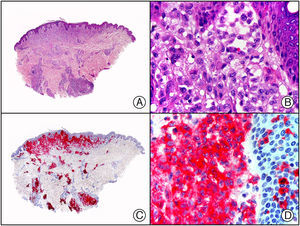
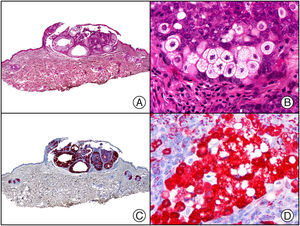
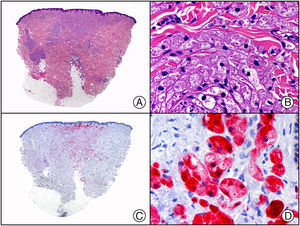
El anticuerpo anti-virus herpes 8 (HHV8) muestra un patrón de tinción nuclear. El virus herpes 8 es capaz de infectar distintos tipos celulares en los que generalmente se encuentra en forma latente como una estructura episómica nuclear. El anticuerpo anti-HHV8 permite la detección del antígeno nuclear latente (LNA) del herpes virus 8 humano implicado en la patogenia de algunas neoplasias, como el sarcoma de Kaposi (fig. 2), la enfermedad de Castleman sistémica y los linfomas primarios de cavidades, resultando muy útil para su diagnóstico y el diagnóstico diferencial histopatológico con sus simuladores5,6.
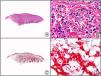
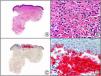
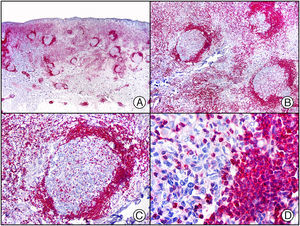
Sarcoma de Kaposi en fase nodular. A) Visión panorámica. B) Detalle de la morfología fusiforme de las células neoplásicas con algunos hematíes entre ellas. C) El mismo caso estudiado inmunohistoquímicamente con HHV-8. D) Positividad de la mayoría de los núcleos de las células neoplásicas para el HHV-8.
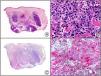
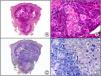
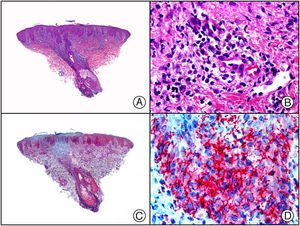
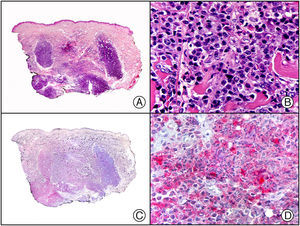
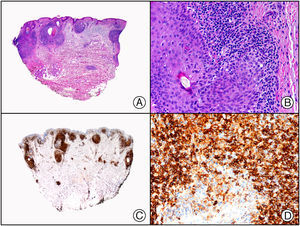
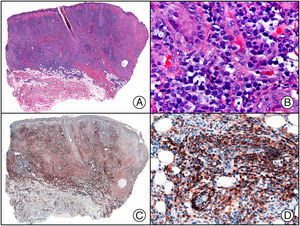
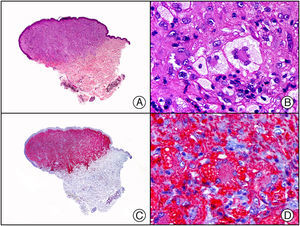
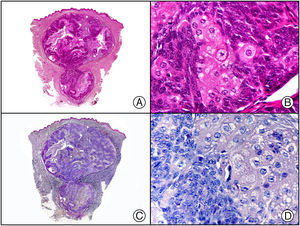
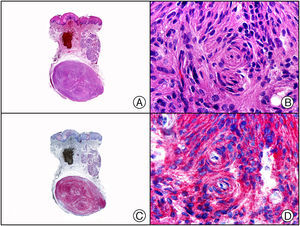
Recientemente, se ha demostrado la integración clonal de un nuevo poliomavirus en el núcleo de las células del tumor de Merkel y el DNA de este virus puede demostrase en las células tumorales, tanto por PCR como por inmunohistoquímica7 (fig. 3). Este poliomavirus no es absolutamente específico del tumor de Merkel, porque también se ha encontrado en algunos carcinomas espinocelulares de pacientes inmunodeprimidos, pero parece desempeñar un papel etiológico fundamental en la histogénesis del tumor de Merkel.
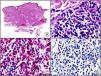
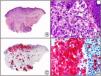
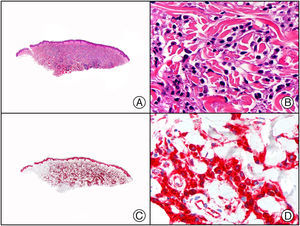
Tumor de Merkel. A) Visión panorámica. B) Detalle de las células neoplásicas mostrando una cromatina nuclear finamente granular. C) El mismo caso estudiado inmunohistoquímicamente con anticuerpo anti-poliomavirus. D) Detalle de la intensa positividad para el poliomavirus en el núcleo de las células neoplásicas.
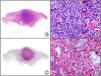
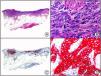
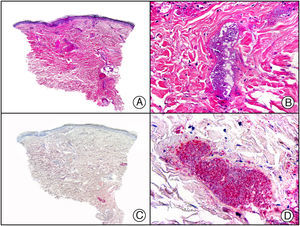
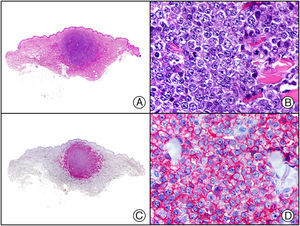
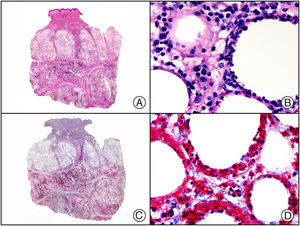
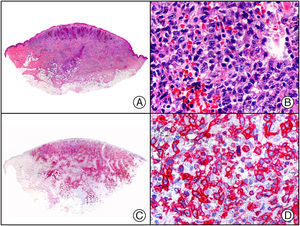
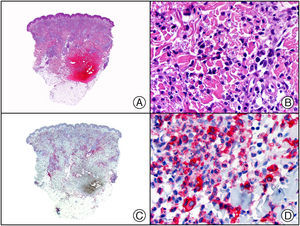
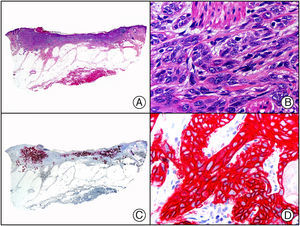
El parvovirus B19 (PVB19) puede demostrarse inmunohistoquímicamente en el endotelio de los capilares congestivos de la dermis papilar de las lesiones cutáneas del síndrome de púrpura en guantes y calcetines (fig. 4) y de eritema infeccioso8–10.
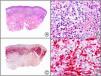
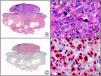
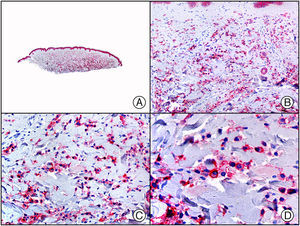
Síndrome de púrpura en guantes y calcetines. A) Visión panorámica. B) Infiltrado linfocitario y hematíes extravasados alrededor de las vénulas poscapilares de la dermis superficial. C) El mismo caso estudiado inmunohistoquímicamente con anticuerpo anti-PVB19. D) Positividad en el citoplasma de las células endoteliales para el PVB19.
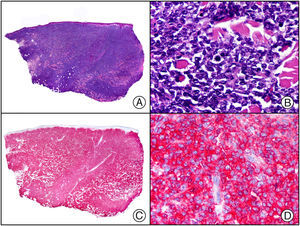
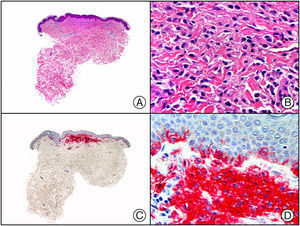
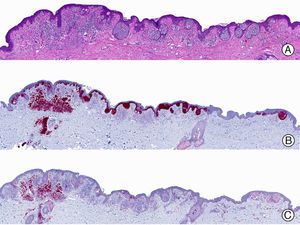
Recientemente se ha comercializado un anticuerpo policlonal antitreponemas que permite la identificación mediante inmunohistoquímica del agente etiológico de la sífilis, el Treponema pallidum (T. pallidum), sobre tejido fijado en formol e incluido en parafina, proporcionando mayor sensibilidad y especificidad que las técnicas histoquímicas clásicas de impregnación argéntica como las tinciones de Steiner o Warthin-Starry1. Se ha descrito un patrón de inmunotinción diferente en las lesiones cutáneas o mucosas de sífilis primaria y secundaria: las lesiones del chancro sifilítico muestran mayor número de treponemas dispuestos en la interfase entre el epitelio epidérmico y la dermis subyacente, así como también perivascularmente alrededor de los vasos sanguíneos de la dermis papilar en las lesiones cutáneas y del corion en lesiones mucosas, mientras que las lesiones de sífilis secundaria muestran mayor abundancia de treponemas solo en la interfase entre el epitelio de la epidermis o la mucosa y la dermis o el corion subyacente11 (fig. 5). Sin embargo, no debemos olvidar que este anticuerpo no es absolutamente específico, ya que tiñe también otras espiroquetas además del T. pallidum, por lo que puede dar falsos positivos cuando se sospeche sífilis en lesiones mucosas.
Sífilis secundaria. A) Visión panorámica. B) Endotelios prominentes e infiltrado perivascular con alguna célula plasmática. C) El mismo caso estudiado inmunohistoquímicamente con anticuerpo anti-Treponema pallidum (T. pallidum). D) A gran aumento se observan numerosas espiroquetas salpicando el epitelio epidérmico que muestran una intensa positividad con el anticuerpo anti-T. pallidum.
El anticuerpo policlonal anti-bacilo de Calmette-Guérin (anti-BCG, B124) ha demostrado ser de una gran utilidad como técnica de cribaje en biopsias cutáneas cuando se sospecha una infección bacteriana o micótica, ya que, además de todas las micobacterias, tiñe también prácticamente todas las bacterias, tanto las Gram positivas como las Gram negativas (fig. 6), así como las esporas e hifas de los dermatofitos y otras infecciones micóticas cutáneas. Sin embargo, no tiñe las leishmanias ni los virus. Podría decirse de una manera coloquial, que la inmunotinción con este anticuerpo equivale a una tinción que sumase en una sola los resultados de las tinciones con Gram y PAS12.
Ectima gangrenoso. A) Visión panorámica. B) A gran aumento se observa un granulado basófilo en la luz y las paredes de los vasos que corresponde a numerosos microorganismos de Pseudomona aeruginosa (P. aeruginosa). C) El mismo caso estudiado inmunohistoquímicamente con anticuerpo anti-BCG. D) Detalle de la positividad con anti-BCG de la P. aeruginosa en la luz y la pared de un vaso de la dermis profunda.
El CD45 es una glicoproteína transmembrana con actividad tirosinfosfatasa. Es también conocido como antígeno común leucocitario (LCA, del inglés leukocyte common antigen) y se expresa tanto en células leucocitarias de la serie mieloide (fig. 7) como en algunas células de la serie linfoide, así como en las neoplasias hematológicas tales como el linfoma de Hogdkin, linfomas no Hodgkin, mieloma múltiple o incluso en las neoplasias no hematológicas como el sarcoma histiocítico o en metástasis de tumores neuroendocrinos. Las 2 isoformas de CD45 de mayor importancia son CD45RO y CD45RA. La isoforma CD45RA es la isoforma de mayor peso molecular y se expresa en los linfocitos T naive circulantes, que son reconocidos por anticuerpos monoclonales anti-CD45RA. La isoforma CD45RO es la forma de menor peso molecular, se expresa en los linfocitos T circulantes tras su activación y se asocia con la adquisición de memoria inmunológica (células T de memoria)13.
El CD20 es un marcador específico de células B. Se expresa aproximadamente en el 98% de los linfomas de células B y de la leucemia linfática crónica B (fig. 8), en el 50% de las leucemias B agudas linfoblásticas y solo en el 10% de los linfomas plasmablásticos, mielomas y plasmocitomas. Este marcador se expresa también en el 20% de las células de Reed-Sternberg de la enfermedad de Hodgkin. Es importante recordar que los linfomas B tratados con el anticuerpo monoclonal anti-CD20 (rituximab) pueden perder la expresión de CD2014.
La expresión de CD79a precede a la expresión de CD20 durante la ontogenia de la célula B y desaparece después del CD20 en estadios tardíos de su diferenciación, por lo tanto las células plasmáticas resultan positivas para CD79a y negativas para CD20. El CD79a marca células B maduras e inmaduras, identificando la mayoría de neoplasias de células B, incluyendo la leucemia B aguda linfoblástica (pre-B LLA), linfomas B tratados con rituximab y el 50% de la neoplasias de células plasmáticas15 (fig. 9).
Los factores específicos de transcripción de células B Pax5, BOB1, Blimp-1, OCT2, MUM1, Bcl6 y CD10 pueden utilizarse también como marcadores diagnósticos. El Pax5 se expresa en estadios tempranos del desarrollo, mientras que el OCT1 y el BOB1 se expresan en células B maduras y el MUM1 y el Blimp-1 están asociados con diferenciación plasmocítica. Este Pax5 codifica la síntesis de un factor de transcripción específico de células B que se expresa en las células pre-B y posteriormente en todos los estadios de desarrollo de las células B hasta célula plasmática (en las que se encuentra regulado negativamente y, por lo tanto, no se expresa). Este marcador tiñe con patrón nuclear casi todos los linfomas de células B, incluidos la leucemia linfática aguda pre-B, el linfoma B difuso de células grandes sin diferenciación plasmocítica (CD20 negativo) y los linfomas postratamiento con rituximab CD20 negativos. Resulta negativo en los tumores con diferenciación de células plasmáticas15.
El MUM1/IRF4 es una proteína nuclear de 50kDa codificada por el gen MUM1, que se identificó originalmente en el mieloma múltiple. La expresión de la proteína MUM1 está limitada a las células de linaje linfocítico y melanocítico. Se trata de un marcador de células B posfoliculares y de células activadas, especialmente útil en la caracterización de la histogénesis de los linfomas B de célula grande. Se expresa, por tanto, además de en el mieloma múltiple (fig. 10), en el linfoma B difuso de células grandes y en células T activadas. El estudio de la expresión de MUM1, junto con el de CD10 y Bcl-6, permite delimitar 2 categorías con distinto pronóstico, los linfomas B de tipo centro germinal y los linfomas B de tipo células activadas, que son mucho más agresivos. También se ha observado que la expresión de MUM1 y OCT2 es mucho más intensa en el linfoma primario cutáneo de células B de tipo piernas en comparación con la observada en el linfoma primario cutáneo de células B folicular, pudiendo ser ambos positivos para Bcl615.
El Bcl6 es un protooncogén que codifica una proteína de 95kDa que se expresa en las células B de los centros germinales normales de la amígdala y en los linfomas relacionados. Está implicado en el reordenamiento 3q27 de los linfomas no Hodgkin, así como en linfomas de célula grande de tipo B, linfoma de Burkitt y en el linfoma de Hodgkin de predominio linfocítico o esclerosis nodular. Este marcador es negativo en el linfoma cutáneo primario de células B de la zona marginal y positivo en el linfoma cutáneo de células B centrofolicular (LCCB)16 (fig. 11).
El Bcl2 es una proteína inhibidora de la apoptosis. El protooncogén Bcl-2 se expresa en la mayoría de células T, pero no se expresa en los linfocitos B normales activados17. Identifica los LCCB de la zona marginal, la mayoría de los LCCB de células grande de tipo piernas y es negativo en la mayoría de los LCCB foliculares (fig. 12). Además, nos puede ayudar en el diagnóstico del origen de un linfoma B folicular cutáneo, ya que un intenso marcaje para este marcador en un linfoma B folicular indica generalmente que se trata de un linfoma de origen ganglionar que se ha extendido secundariamente a la piel y, por tanto, de peor pronóstico16. En la tabla 1 se resume la utilidad de estos factores de transcripción de células B en el diagnóstico de linfomas B cutáneos.
La expresión de Bcl1/ciclina D1 es relativamente sensible (50-70%) y específica de linfomas B de células del manto.
El CD38 (fig. 13) y el CD138 (Syndecan-1) (fig. 14) son marcadores que se expresan en las células plasmáticas normales, además del 60-100% de los mielomas múltiples y los linfomas plasmoblásticos, pero en menos del 5% de otros linfomas de célula grande con diferenciación plasmocitoide15.
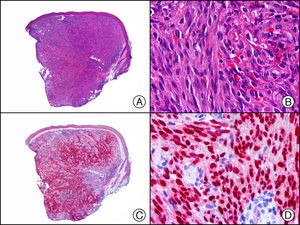
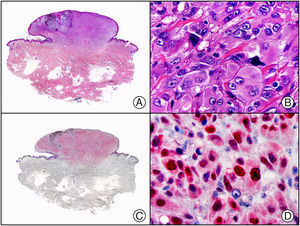
El CD10 es una glicoproteína también denominada neprilisina o endopeptidasa neutra, que se expresa en la superficie celular. Se ha observado expresión de CD10 en una gran variedad de tejidos normales, como en el borde en cepillo de los enterocitos de la parte superior del tracto gastrointestinal, en los conductillos biliares, en el epitelio glomerular del riñón y en el borde en cepillo de las células de los túbulos proximales, en células mioepiteliales mamarias, salivales y sudoríparas, en células glandulares prostáticas, en células estromales endometriales, en algunas células endoteliales, en células trofoblásticas placentarias y en una minoría de miofibroblastos (incluyendo células perianexiales cutáneas). También se detecta en la metaplasia apocrina mamaria. En la médula ósea se expresa en la superficie de las stem cells y en células mielopoyéticas (incluidos los neutrófilos). En los tejidos linfoides no neoplásicos, el CD10 se expresa intensamente en las células de los centros foliculares (folículos secundarios). Puede encontrarse también en algunos linfocitos B maduros y en una subpoblación de linfocitos T parafoliculares. Marca centros germinales normales y aproximadamente el 90% de las leucemias linfáticas agudas pre-B y de las crisis blásticas en las leucemias mieloides crónicas. Resulta igualmente positivo en el linfoma de Burkitt y en la mayoría de linfomas del centro folicular, en algunos casos de linfoma difuso de célula grande y algunos linfomas del manto. Sin embargo, es negativo en el linfoma B de la zona marginal16. Recientemente se ha demostrado la expresión de CD10 en otros muchos tumores cutáneos de estirpe muy variada, como el dermatofibroma, el dermatofibrosarcoma protuberans, el carcinoma espinocelular, el fibroxantoma atípico (fig. 15), el carcinoma basocelular, el tricoepitelioma y el melanoma. Además, también se expresa en otras neoplasias extracutáneas, como el carcinoma de células renales, el carcinoma de endometrio o el hepatocarcinoma18.
Fibroxantoma atípico. A) Visión panorámica. B) Detalle de las células neoplásicas mostrando un núcleo atípico y pleomórfico y un citoplasma amplio de apariencia espumosa. C) El mismo caso estudiado inmunohistoquímicamente con CD10. D) Positividad de muchas de las células neoplásicas para el CD10.
El CD23 es un receptor de baja afinidad de la inmunoglobulina E (IgE), y se cree que participa en la regulación de la respuesta de la IgE y la activación de linfocitos B. Se expresa en linfocitos B maduros, linfocitos B maduros de zona del manto y, en bajos niveles, en linfocitos T, linfocitos citolíticos naturales, células de Langerhans y plaquetas. A pesar de su positividad para células del manto ha sido históricamente clasificado como negativo en los linfomas del manto (con rangos de positividad que van del 0-13% de las muestras según distintos artículos). Sin embargo, trabajos más recientes encuentran una positividad para el CD23 de cerca del 25% de estos linfomas usando técnicas más sensibles como el inmunofenotipo por citometría de flujo e incluso sugieren que esta positividad es signo de un mejor pronóstico19.
El estudio de la restricción de cadenas ligeras kappa y lambda (κ y λ) resulta muy útil en la demostración de monoclonalidad de las proliferaciones de linfocitos B y células plasmáticas. Con las técnicas inmunohistoquímicas habituales, a menudo, los resultados son difíciles de interpretar debido a la frecuente e intensa tinción de fondo, pero las técnicas de hibridación in situ son mucho más específicas que las tinciones inmunohistoquímicas para este propósito. Una restricción de estas cadenas, con expresión de solo una de ellas, kappa o lambda, indica monoclonalidad (fig. 16). En contraste, la expresión de ambas cadenas en un infiltrado linfoide indica policlonalidad B y habitualmente se trata de una proceso reactivo (no neoplásico).
Linfoma B primario cutáneo de la zona marginal con diferenciación hacia células plasmáticas (el antiguamente denominado plasmocitoma cutáneo primario). A) Visión panorámica. El aspecto eosinófilo y homogéneo de la dermis se debe al abundante depósito de amiloide AL. B) Detalle de las células plasmáticas neoplásicas. C) Intensa positividad para las cadenas ligeras kappa en el citoplasma de las células neoplásicas. D) Negatividad para las cadenas ligeras lambda en las células neoplásicas.
Los anticuerpos monoclonales anti CD2, CD3, CD4, CD5, CD7 y CD8 son los marcadores más frecuentemente utilizados en el estudio de infiltrados de linfocitos T. El CD4 es un marcador de células T colaboradoras y se expresa en la mayoría de linfomas T periféricos, la micosis fungoide (fig. 17), el síndrome de Sezary, el linfoma T CD4+ de células medianas, el linfoma T HTLV1+ y la neoplasia blástica de células dendríticas plasmocitoides. La pérdida de expresión de algunos de estos marcadores T, como CD2, CD5 o CD7, generalmente indica malignidad y puede ayudarnos en el diagnóstico de linfoma periférico de células T, aunque hay que tener en cuenta que la pérdida de CD7 puede ocurrir también en el infiltrado de algunas enfermedades inflamatorias, como la psoriasis o algunas dermatitis liquenoides20. En el caso de la micosis fungoide, su infiltrado está compuesto básicamente por linfocitos maduros CD4+, por tanto su diagnóstico vendrá apoyado por una relación CD4/CD8 elevada y una relación CD8/CD3 baja, generalmente menor del 25%.
Micosis fungoide foliculotropa. A) Visión panorámica mostrando una distribución perifolicular del infiltrado. B) Detalle de los linfocitos salpicando las hileras periféricas de la vaina radicular externa del folículo piloso. C) El mismo caso estudiado inmunohistoquímicamente con CD4. Obsérvese la intensa positividad del infiltrado. D) Detalle de los linfocitos CD4 positivos salpicando el epitelio folicular.
El CD8 es un marcador de las células T citotóxicas y de algunas células natural killer (NK). Dentro de los linfomas cutáneos de células T (LCCT), el CD8 se expresa en las células neoplásicas del linfoma T paniculítico (fig. 18), en el linfoma epidermotropo de células T CD8+ y en algunos casos de linfoma de células T γ-δ15.
Linfoma T subcutáneo de tipo paniculítico. A) Visión panorámica mostrando una afectación más intensa del tejido celular subcutáneo. B) Linfocitos atípicos de núcleo hipercromático alrededor de los adipocitos necróticos. C) El mismo caso estudiado inmunohistoquímicamente con CD8. D) Detalle de la positividad para CD8 en los linfocitos neoplásicos. Obsérvese la presencia de citofagocitosis.
El CD43 es un anticuerpo dirigido frente a sialoforina que marca células T normales y neoplásicas. Se expresa en casi todos los casos de leucemia mieloide aguda, en la mayoría de los linfomas T y, como expresión aberrante, en algunos casos de linfoma B de la zona marginal y en leucemias linfáticas crónicas de células B (fig. 19). Resulta también útil en la identificación de células T cuando se usa con un panel que incluya marcadores pan-B15.
El mismo caso ilustrado en la figura 8 de infiltración cutánea por leucemia linfática crónica de células B, mostrando expresión aberrante de CD43.
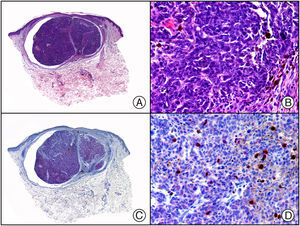
El CD56 es una molécula de adhesión de las células nerviosas que se expresa también en células NK. Identifica el linfoma de células T/NK de tipo nasal extranodal (fig. 20), las neoplasias de células dendríticas plasmocitoides y un pequeño subgrupo de otros linfomas T agresivos.
Linfoma NK de tipo nasal. A) Visión panorámica mostrando una infiltración difusa de todo el espesor de la dermis. B) A gran aumento se observan linfocitos pleomórficos de tamaño mediano. C) El mismo caso estudiado inmunohistoquímicamente con CD56. D) Detalle de la positividad para CD56 de los linfocitos neoplásicos.
La granzima, la perforina y la TIA-1 (T-cell restricted intracellular antigen-1) son marcadores de linfocitos T citotóxicos.
El CD25 es un marcador del receptor α de la IL-2 y se trata de una proteína transmembrana que está presente en los linfocitos T y B activados, algunos timocitos, células precursoras mieloides y oligodendrocitos. Se expresa en la mayoría de las neoplasias de células B, algunos tipos de leucemia linfocítica aguda, neuroblastomas e infiltrados tumorales linfocitarios de estirpe diversa. Su forma soluble, llamada sIL-2R suele estar elevada en estas enfermedades y sus niveles en suero se utilizan ocasionalmente para seguir la progresión de la enfermedad. El CD25 se expresa también en el linfoma T HTLV1+ y en un subgrupo de micosis fungoide.
La expresión de CD30/Ki1 se observa tanto en las células T como en las B activadas. Identifica el linfoma anaplásico de las células grandes, la papulosis linfomatoide (fig. 21), la micosis fungoide en transformación a linfoma de células grandes y la enfermedad de Hodgkin. Sin embargo, también se expresa en las células linfoides activadas del infiltrado de algunos procesos reactivos cutáneos, como la sarna, las picaduras de insecto, algunas erupciones medicamentosas o los infiltrados de infecciones víricas como herpes simple, herpes zóster, orf o molusco contagioso21-24. Por lo tanto, los resultados de la expresión de CD30 en un infiltrado linfoide cutáneo deben interpretarse con precaución; la expresión de CD30 en grupos celulares es propia de procesos neoplásicos, mientras que la expresión de CD30 en procesos reactivos suele ser en células aisladas salpicadas en el infiltrado25–27. En el diagnóstico diferencial entre el linfoma anaplásico de células grandes, tanto primario cutáneo como ganglionar con extensión cutánea, y la papulosis linfomatoide, lo fundamental es la clínica, pero en general la expresión de CD30 en las células del linfoma anaplásico de células grandes, tanto primario como secundario, se observa en más del 75% de las células neoplásicas, mientras que en la papulosis linfomatoide el número de células CD30+ suele ser menor15.
El CD21 y el CD35 son marcadores de los receptores complementarios C3d y C3b que marcan las células dendríticas foliculares y sus neoplasias.
Finalmente, el βF1 (TCRβ chain) es un marcador específico y bastante sensible de neoplasias de células T de inmunofenotipo α/β, de comportamiento clínico mucho menos agresivo que cuando el infiltrado T expresa receptores γ/δ.
El CD123 es el marcador del receptor de la cadena alfa de la interleucina 3. Esta citocina promueve la progresión del ciclo celular y la diferenciación, mientras que inhibe la apoptosis de las células hematopoyéticas. Se expresa en las células precursoras mieloides, macrófagos, células dendríticas plasmocitoides, mastocitos, basófilos y megacariocitos. Se expresa también intensamente en múltiples blastos leucémicos y en células madre leucémicas y parece ser por tanto una excelente diana terapéutica de las mismas28. Estudios recientes han demostrado que este marcador se expresa intensamente en las células madre de pacientes con leucemia mieloide aguda y que se correlaciona en estos casos con un peor pronóstico29. También se expresa ampliamente en la médula ósea de pacientes con un síndrome mielodisplásico. Resulta además útil en el diagnóstico de trastornos de células B con linfocitos vellosos circulantes, ya que su expresión es típica en la leucemia de células pilosas30. Pero quizá su mayor aplicación es en el diagnóstico de la neoplasia blástica de células dendríticas plasmocitoides31 (fig. 22).
Neoplasia blástica de células dendríticas plasmocitoides. A) Visión panorámica mostrando una infiltración difusa de todo el espesor de la dermis. B) Características de las células neoplásicas, mostrando un infiltrado monomorfo de células de apariencia blastoide de tamaño mediano. C) El mismo caso estudiado inmunohistoquímicamente con CD123. D) Detalle de la positividad de las células neoplásicas para el CD123.
La coexpresión de mieloperoxidasa, lisozima, CD45, CD43 y CD74 apoya el diagnóstico de infiltrado neoplásico mieloide cutáneo. Sin embargo, la ausencia de expresión de marcadores mieloides, como lisozima y mieloperoxidasa, y la expresión aberrante de marcadores de células T, como el CD45RO, en algunos infiltrados leucémicos en la piel puede dar lugar a errores diagnósticos. Tampoco la expresión de estos marcadores es absolutamente característica de infiltrado leucémico de la piel, porque existen casos de procesos reactivos, como el denominado síndrome de Sweet histiocitoide32 (fig. 23), en los que el infiltrado dérmico está constituido por células mieloides inmaduras precursoras de granulocitos, que muestran un inmunofenotipo muy similar al de la verdadera leucemia mieloide infiltrando la piel.
Síndrome de Sweet histiocitoide. A) Visión panorámica mostrando un infiltrado en banda en la dermis superficial. B) Detalle de las células mononucleares del infiltrado. C) El mismo caso estudiado inmunohistoquímicamente con mieloperoxidasa. D) Detalle de la positividad para mieloperoxidasa en muchas de las células mononucleares del infiltrado.
El anticuerpo anti-CD68 detecta una glicoproteína de 110kDa de peso molecular, localizada en el citoplasma celular y concretamente en los lisosomas. Se observa positividad para este marcador en células de distinta diferenciación, incluyendo células de estirpe mieloide, monocítica e histiocítica y sus tumores33. Son positivos los macrófagos de tipo monocitario y las células precursoras mieloides de la médula ósea, los histiocitos del tejido linfoide normal y las células de Kupffer hepáticas, aunque también se expresa en los mastocitos y en las células de la microglía34. El CD68 se expresa en proliferaciones histiocitarias como el xantogranuloma juvenil (fig. 24), así como en la histiocitosis de células de Langerhans y en ciertos subtipos de leucemias mieloides (según el anticuerpo utilizado), pero también en varios tumores epiteliales y en las células epitelioides de algunos melanomas. Este marcador se expresa además en más del 70% de melanomas y en otras neoplasias cutáneas, como angiosarcomas, fibroxantomas atípicos, carcinomas espinocelulares y leiomiosarcomas. De los 2 clones comercializados de este anticuerpo, PGM1 y Kp1, el primero tiene mayor especificidad que el segundo en el reconocimiento de células de estirpe histiocitaria.
El CD163 muestra una gran especificidad en la identificación de células del sistema monocito-macrofágico en comparación con el CD68 (fig. 25). Sin embargo, no es buen marcador en lesiones de sarcoma mieloide o de leucemia mieloide aguda de origen monocítico34.
El CD34, como ya hemos comentado, es un glicoproteína transmembrana que se expresa principalmente en las células endoteliales, en fibroblastos dendríticos y además en la superficie de células madre hematopoyéticas. Normalmente solo existe un 1,5% de células positivas en la médula ósea y menos del 0,5% en sangre periférica. Los precursores eritroides, mieloides y megacariocíticos son CD34 positivos, lo mismo que las células linfoides inmaduras TdT positivas, por lo que es un buen marcador para leucemias agudas y células precursoras recogidas para el transplante de médula ósea. Entre las neoplasias hematopoyéticas, está presente en las leucemias agudas linfoblásticas B y T y en las leucemias agudas mieloblásticas35–37. En los síndromes mielodisplásicos su expresión es predictiva de trasformación y, por tanto, de un mal pronóstico. Además, estudios recientes han confirmado su valor como factor de mal pronóstico también en la leucemia mieloide aguda38.
El Leu M1/CD15 reacciona con antígenos presentes en neutrófilos maduros, monocitos y un subgrupo de células T. Es un marcador reconocido de células de Reed-Sternberg en linfoma de Hodgkin clásico, y no se observa en el subtipo de predominio linfocítico nodular. Este marcador es negativo en la mayoría de los linfomas no Hodgkin, con la excepción de algunos linfomas anaplásicos de células grandes, sobre todo cutáneos, y algunos linfomas T periféricos. Se observa marcación en el 60% de los adenocarcinomas. En el diagnóstico de leucemias resulta de gran ayuda, ya que puede identificar prácticamente todas las proliferaciones neoplásicas mieloides o mielocíticas, aunque existen patrones de tinción variables con los distintos anticuerpos comercializados. Se ha descrito la pérdida de este marcador en algunas recidivas de leucemias mieloides agudas, relacionándolo por tanto con un peor pronóstico. Resulta positivo en casi todos los casos de leucemia mieloide crónica durante la fase crónica y en aproximadamente el 50% de los casos de leucemia linfoblástica aguda. Su expresión es mayor en las leucemias agudas linfoblásticas antígeno común negativo (CALLA-negativo), procesos que generalmente tienen un peor pronóstico que aquellos que son CALLA-positivo. Identifica también el sarcoma granulocítico, al igual que CD3439.
MastocitosEl CD117/c-Kit y la triptasa constituyen los mejores marcadores inmunohistoquímicos de mastocitos. El protooncogén c-kit codifica un receptor transmembrana de 145kDa, con actividad tirosin-cinasa, que interviene en la hematopoyesis, la gametogénesis y la melanogénesis. Está estrechamente relacionado con el proceso de malignización y la patogenia de algunas neoplasias. El CD117 y la triptasa resultan positivos en la mayoría de las células neoplásicas (>95%) de todos los tipos de mastocitosis40 (fig. 26).
Urticaria pigmentosa. A) Visión panorámica. B) Características citológicas de los mastocitos infiltrando la dermis. C) El mismo caso estudiado con CD117. D) Detalle de la intensa positividad para CD117 de los mastocitos de la dermis. Obsérvese también la positividad en los melanocitos dendríticos de la unión dermoepidérmica.
El CD1a es un antígeno de superficie expresado por células de Langerhans y resulta por tanto útil en el diagnóstico de la histiocitosis de células de Langerhans. Conviene recordar no obstante, que podemos encontrar también un número muy elevado de este tipo de células en gran cantidad de procesos reactivos15.
La langerina (CD207) es un marcador muy específico de las células de Langerhans (más aún que el CD1a), ya que tiñe los gránulos de Birbeck, y resulta positivo en la histiocitosis de células de Langerhans (fig. 27) y en un subgrupo de sarcomas histiocíticos41.
Histiocitosis de células de Langerhans. A) Visión panorámica. B) Detalle de las características citológicas de las células de Langerhans del infiltrado. C) El mismo caso estudiado inmunohistoquímicamente con langerina. D) Detalle de la positividad con langerina de las células del infiltrado. Obsérvese también la positividad de alguna célula aislada intraepidérmica.
p53 es el anticuerpo que reconoce el epítopo N-terminal de la proteína p53 que es codificada por el gen supresor p53 del cromosoma 17. Su detección inmunohistoquímica se asocia a mutaciones y se utiliza como factor predictivo en diversas formas de cáncer.
El gen pRb/retinoblastoma codifica la síntesis de una fosfoproteína nuclear que juega un papel crucial en el control del ciclo celular, interaccionando con el factor de transcripción conocido como E2F. Su pérdida de expresión se ha relacionado también con el pronóstico de algunas neoplasias.
p16 (INK4a) es una proteína codificada por el gen supresor CDKN2 que participa en la regulación de la fase G1 del ciclo celular. Las mutaciones en este gen incrementan el riesgo de desarrollar una variedad de neoplasias, especialmente melanomas, al perderse su capacidad como gen supresor de tumores. La expresión de esta proteína está estrictamente regulada en las células normales, en las que se expresa a niveles muy bajos, no llegando a detectarse mediante inmunohistoquímica. Sin embargo, sí se expresa en proliferaciones melanocíticas benignas, como el nevo de Spitz. La pérdida de su expresión (fig. 28), junto con altos índices de proliferación (como el Ki67) y la expresión aumentada de p53, se utilizan como marcadores de progresión en el melanoma.
Melanoma con grandes nidos en la unión dermoepidérmica. A) Visión panorámica. B) El mismo caso estudiado inmunohistoquímicamente con proteína S-100. C) El mismo caso estudiado inmunohistoquímicamente con p16. Obsérvese la pérdida de expresión de p16 en muchos de los nidos de la unión dermoepidérmica.
Como ya hemos comentado, uno de los marcadores más sensibles para las neoplasias melanocíticas es la proteína S-100. Sin embargo, su falta de absoluta especificidad nos obliga a incluir en la batería diagnóstica de estas lesiones otros marcadores como Melan-A, HMB45, MiTF-1, Sox-10 y tirosinasa. Además, resulta de gran utilidad en el diagnóstico diferencial entre proliferaciones benignas y malignas el estudio de marcadores de proliferación como el Ki67 y el pHH3. Algunos de estos marcadores ya han sido comentados previamente y en la tabla 2 se resumen las aplicaciones de los distintos marcadores inmunohistoquímicos en el estudio de las neoplasias melanocíticas.
Inmunohistoquímica en tumores melanocíticos
| Marcador | Patrón | Aplicación |
| S-100 | Nuclear/citoplásmico | Marcador más sensible para melanoma y melanoma de células fusiformes/melanoma desmoplásico |
| HMB45 | Citoplásmico | Mayor especificidad que S-100 para melanoma. Puede ayudar en el diagnóstico entre melanoma y nevo melanocítico |
| Melan-A | Citoplásmico | Sensibilidad y especificidad similar a HMB45, tinción más difusa e intensa |
| Tirosinasa | Citoplásmico | Gran sensibilidad y especificidad para melanoma, sin embargo la sensibilidad decrece al aumentar el estadio del tumor y en las metástasis |
| Ki67 | Nuclear | Marca menos del 5% de células en nevos melanocíticos, entre el 13-30% en melanoma (importantes porcentajes también en nevo de Spitz) |
| Sox-10 | Nuclear | Más sensible que la S-100 al marcar melanomas S-100 negativos. Útil para diferenciar melanoma desmoplásico de proliferación de melanocitos en cicatrices |
| MiTF-1 | Nuclear | Alta sensibilidad, pero menor especificidad. Muy útil en la identificación de núcleos de melanocitos en neoplasias melanocíticas muy pigmentadas después de blanquearlas |
La tirosinasa es un enzima implicado en el último paso de la biosíntesis de la melanina. Dada su especificidad y su alta sensibilidad es un marcador aceptable de estirpe melanocítica, junto con la proteína S-100, el HMB45 y el Melan-A. Aunque su sensibilidad en el diagnóstico de melanoma se reduce con la progresión del estadio del tumor y también en las metástasis1.
Estudios recientes han postulado que la investigación de la expresión inmunohistoquímica del CD99 puede ser útil en el diagnóstico diferencial entre nevo de Spitz y melanoma, sin embargo son necesarios estudios adicionales para confirmar estos hallazgos1. Mayor utilidad en este diagnóstico diferencial histopatológico parecen tener los hallazgos recientemente descritos por Garrido-Ruiz et al. Estos autores estudiaron marcadores del ciclo celular, de la apoptosis, de las proteínas reparadoras de DNA y de receptores de membrana en 28 nevos de Spitz y 62 melanomas cutáneos primarios en fase de crecimiento vertical. Sus resultados demostraron una hiperexpresión de ciclina D1 y p21 en nevo de Spitz comparado con melanoma, una mayor expresión de Ki67 y topoisomerasa iia (otro marcador de proliferación) en las áreas profundas de los melanomas en comparación con los nevos de Spitz, y una mayor expresión de survivina nuclear en los melanomas, por lo que estos 5 marcadores parecen ser los más útiles desde el punto de vista inmunohistoquímico en el diagnóstico diferencial histopatológico entre melanoma y nevo de Spitz42.
El COX-2 es una enzima inducible involucrada en la producción de prostaglandinas en varios procesos inflamatorios. Se le atribuye un papel importante en la patogenia de los tumores de diversos órganos, incluidos colon y recto, estómago, mama, vejiga y pulmón. También aparece sobreexpresado en tumores malignos cutáneos, entre ellos el carcinoma espinocelular, el carcinoma basocelular, la enfermedad de Bowen, la queratosis actínica y el melanoma maligno. Estudios recientes han demostrado una expresión de este marcador mucho mayor en el melanoma que en los nevos melanocíticos; por lo tanto, COX-2 sería de gran utilidad, aunque por supuesto no de forma aislada, en el complejo campo del diagnóstico diferencial histopatológico entre los tumores melanocíticos benignos y malignos43.
Como ya hemos comentado al hablar de los marcadores de linfocitos B, el MUM1 es una proteína nuclear de 50kDa codificada por el gen MUM1 que se identificó originalmente en el mieloma múltiple1. Sin embargo, se ha comprobado que el MUM1 es también positivo en el melanoma y sus metástasis, pero no en otras neoplasias malignas. Su expresión es también intensa en nevos melanocíticos benignos, incluido el nevus de Spitz, pero no en el melanoma desmoplásico. Resulta ser pues un marcador muy sensible para algunos tumores melanocíticos44.
El Ki67/ Mib-1 es el marcador más utilizado para el estudio de la proliferación prácticamente en todas las neoplasias y su investigación es muy útil en el diagnóstico diferencial de lesiones melanocíticas benignas y malignas. Su expresión nuclear en proliferaciones melanocíticas benignas suele ser inferior al 5% de las células neoplásicas y generalmente se observa mayor expresión en las células de la unión dermoepidérmica. Debe tenerse especial cuidado en no contabilizar como positivos los núcleos de queratinocitos de la hilera basal de la epidermis, que normalmente muestran un alto índice proliferativo45. En general, las neoplasias melanocíticas malignas muestran positividad para el Ki67 en más del 5% de las células neoplásicas, y es frecuente observar positividad nuclear en muchas de las células de las áreas profundas de la lesión (fig. 29).
Melanoma nodular de células epitelioides. A) Visión panorámica. B) Detalle de las características citológicas de las células neoplásicas mostrando núcleos pleomórficos y amplio citoplasma eosinófilo. C) El mismo caso estudiado inmunohistoquímicamente con Ki67. D) Positividad de muchos de los núcleos de las células neoplásicas para Ki67.
El pHH3 es probablemente el marcador más específico de mitosis. La histona H3 es una proteína del núcleo celular. Su fosforilación es máxima durante la mitosis, mínima durante la interfase celular e inexistente durante la apoptosis. Esto lo convierte en un marcador muy sensible de mitosis (fig. 30), aunque no es específico de ningún tipo celular. A veces, para evitar confusión es necesario realizar un doble inmunomarcaje con un marcador específico de la estirpe celular estudiada. Estudios recientes han apoyado su utilidad en el estudio de las proliferaciones melanocíticas1.
Recientemente se ha postulado el estudio de la elastina en el diagnóstico diferencial histopatológico entre nevo melanocítico y melanoma, ya que la elastina se expresa en los nidos dérmicos de los nevos melanocíticos pero no de los melanomas46.
A veces se plantea el diagnóstico diferencial histopatológico entre una proliferación melanocítica en la cicatriz de extirpación previa de un melanoma, la existencia de melanoma residual en la cicatriz y un melanoma desmoplásico. Los melanocitos de todas estas lesiones expresan la proteína S-100. Sin embargo, la presencia de células tumorales positivas para HMB-45, MiTF o Melan-A debe orientarnos hacia el diagnóstico de melanoma residual. El problema es que estos últimos marcadores son habitualmente negativos en el melanoma desmoplásico. Ya hemos señalado la utilidad del estudio de la proteína S-100 y del Sox-10 en el melanoma desmoplásico. También el estudio del receptor del factor de crecimiento nervioso (NGFR/p75) demuestra positividad en la mayoría de los melanomas desmoplásicos y neurotrópicos (fig. 31), de forma más intensa incluso que la proteína S-10015,45.
Melanoma desmoplásico. A) Visión panorámica mostrando una infiltración difusa de todo el espesor de la dermis salpicada de nódulos linfoides. B) Detalle de la morfología fusiforme de las células neoplásicas. C) El mismo caso estudiado inmunohistoquímicamente con p75. D) Positividad de las células neoplásicas con el p75.
Aproximadamente el 50% de las metástasis de melanoma que son negativas con proteína S-100, resultan ser MiTF1 y/o Sox-10 positivas, por lo que su uso combinado puede ser útil en algunos casos. Un estudio reciente también preconiza en estos casos la investigación del marcador KBA.62, que al parecer se expresa en la mayoría de los melanomas desmoplásicos y fusocelulares y hasta en el 91% de las metástasis de melanoma47.
Como ya hemos señalado anteriormente, a veces el diagnóstico diferencial histopatológico en una piel con daño actínico entre una queratosis actínica pigmentada y un melanoma maligno in situ puede resultar muy difícil. El Melan-A tiñe tanto los melanocitos dendríticos como algunos queratinocitos basales pigmentados, por lo que la interpretación de este marcador en este contexto debe llevarse a cabo con precaución. En general, en el melanoma se observa un patrón de melanocitos en nidos confluentes o formando una cenefa continua a lo largo de la unión dermo-epidérmica, mientras que en la piel con daño actínico crónico o en la queratosis actínica pigmentada se observan melanocitos atípicos aislados y salpicados a lo largo de la hilera basal de la epidermis y en capas altas de la epidermis. De todas formas, es mejor no utilizar Melan-A en este contexto y las tinciones con proteína S-100, HMB-45 y Sox-10 son más útiles y más fáciles de interpretar, ya que marcan los melanocitos dendríticos del verdadero melanoma in situ, pero no los queratinocitos atípicos pigmentados de la queratosis actínica pigmentada45,48.
Neoplasias de células fusiformesEn neoplasias cutáneas indiferenciadas, a menudo localizadas en la cara de pacientes ancianos con un importante daño actínico crónico, resulta muy difícil el diagnóstico diferencial histopatológico entre las distintas neoplasias cutáneas de células fusiformes basándose únicamente en el estudio histopatológico convencional. En la mayor parte de los casos el diagnóstico definitivo solo puede establecerse mediante el perfil inmunohistoquímico de la neoplasia en cuestión (tabla 3).
Diagnóstico diferencial inmunohistoquímico entre las neoplasias cutáneas de células fusiformes
| Marcador | Melanoma | Fibroxantomaatípico | Carcinoma espinocelular sarcomatoide | Leiomiosarcoma |
| S-100 | + | − | − | − |
| CK903 | − | − | + | − |
| P63 | − | ± | + | ± |
| CD10 | ± | + | ± | Desconocido |
| Desmina | − | − | − | + |
El carcinoma espinocelular de células fusiformes o sarcomatoide es un carcinoma espinocelular mal diferenciado, que habitualmente expresa las CKs 903, 34βE12, 5/6 y MNF116. Sin embargo, este tipo de carcinoma también expresa vimentina, lo que unido a su morfología fusiforme puede llevar a un diagnóstico erróneo de sarcoma superficial. El p63 ha demostrado ser un marcador útil en el diagnóstico diferencial entre esta variante de carcinoma espinocelular, el FXA y el leiomiosarcoma cutáneo, ya que es positivo en la mayoría de los carcinomas espinocelulares sarcomatoides, pero solo se expresa en el 20% de los FXA y en el 50% de los leiomiosarcomas15.
En general, el diagnóstico de FXA se establece por exclusión, después de descartar la posibilidad de un carcinoma espinocelular mal diferenciado (por la negatividad de las CKs), un melanoma de células fusiformes (por la negatividad de la proteína S-100 y el Sox-10) y de un leiomiosarcoma cutáneo (por la negatividad de la actina y la desmina). La mayoría de las lesiones de FXA expresan marcadores histiocíticos, como el CD68. También el CD99 ha demostrado su utilidad, ya que según algunos estudios se expresa hasta en un 73% de los FXA, mientras que solo se observa en un 10% de los melanomas desmoplásicos y no marca los carcinomas espinocelulares de células fusiformes49. El CD10 es positivo de forma intensa y difusa en la mayoría de las células neoplásicas del FXA (fig. 15). Sin embargo, este marcador debe interpretarse con precaución cuando se estudian neoplasias cutáneas de células fusiformes, ya que también se ha descrito positividad en el melanoma, el dermatofibrosarcoma protuberans y el carcinoma espinocelular18. La actina de músculo liso es positiva en el 45% de los FXA, mientras que la desmina es casi siempre negativa15.
En el diagnóstico diferencial entre dermatofibroma y dermatofibrosarcoma protuberans, el CD34 y el factor xiiia son los marcadores más utilizados. El factor xiiia marca la mayoría de los dermatofibromas, pero no las lesiones de dermatofibrosarcoma protuberans, mientras que el CD34 se expresa en la mayoría de las células proliferantes del dermatofibrosarcomas protuberans, y es negativo en las del dermatofibroma. Sin embargo, no hay que olvidar que el poder discriminatorio de estos 2 anticuerpos no es absoluto, ya que se ha observado también tinción focal para el CD34 en la periferia de algunos dermatofibromas, especialmente en lesiones profundas y densamente celulares. También se han descrito ejemplos de dermatofibrosarcoma protuberans negativos para el CD3415.
El fibromixoma acral superficial es una lesión constituida por células fusiformes que focalmente pueden adoptar una disposición estoriforme y plantear el diagnóstico diferencial histopatológico con el dermatofibrosarcoma protuberans. Las células neoplásicas de ambas proliferaciones expresan CD34, pero la apolipoproteína D (ApoD) se expresa exclusivamente en las células del dermatofibrosarcoma protuberans, mientras que el EMA y el CD99 suelen ser positivos en el fibromixoma acral superficial y negativos en el dermatofibrosarcoma protuberans.
El fibroma celular digital es otra neoplasia benigna constituida por células fusiformes monomorfas dispuestas en un patrón estoriforme, inmersas en un estroma con abundante colágeno, y que son positivas para el CD34, por lo que la imagen histopatológica recuerda a la de un dermatofibrosarcoma protuberans. Sin embargo, con una biopsia adecuada que incluya los márgenes de la tumoración, el diagnóstico diferencial histopatológico con el dermatofibrosarcoma protuberans se realiza fácilmente ya que el fibroma celular digital es una lesión superficial y bien delimitada que asienta en la dermis reticular, pero no se extiende al tejido celular subcutáneo. Desde el punto de vista inmunohistoquímico, las células fusiformes del fibroma celular digital, además de la intensa positividad para el CD34, muestran grados variables de positividad para el factor xiiia, mientras que el EMA y el CD99 suelen ser negativos50.
Neoplasias sebáceasComo hemos señalado anteriormente, el EMA marca en la piel normal la glándula sebácea, tanto en su ducto excretor como en los sebocitos de los lóbulos sebáceos, tiñendo las microvacuolas lipídicas del citoplasma de estos últimos. Lo mismo sucede en las neoplasias con diferenciación sebácea. Sin embargo, la positividad del EMA no se restringe a las neoplasias sebáceas, observándose también en el carcinoma espinocelular y en otras neoplasias anexiales. Por eso, a veces para poder establecer la diferenciación sebácea de una neoplasia son necesarios otros marcadores.
La adipofilina es un anticuerpo monoclonal que resulta muy útil en la identificación de lípidos intracitoplasmáticos, como los que se encuentran en los sebocitos. Resulta de especial utilidad en la identificación de carcinomas sebáceos mal diferenciados, y en casos difíciles con pequeñas biopsias de los carcinomas sebáceos perioculares. La observación del patrón de tinción es esencial para este marcador, ya que la tinción específica de las neoplasias sebáceas se observa en la membrana que delimita las vacuolas lipídicas intracitoplásmicas múltiples de pequeño tamaño (fig. 32). Sin embargo, es posible observar patrones de tinción débiles y focales y de morfología granular en otras células normales y en algunas neoplasias no sebáceas de células claras. Este marcador también se expresa en los histiocitos espumosos de las lesiones xantomatosas y en las células epiteliales de las metástasis cutáneas del carcinoma renal que, además de glucógeno, contienen múltiples vacuolas lipídicas en su citoplasma. Sin embargo, los adipocitos y sus tumores son adipofilina negativos, ya que este anticuerpo no marca la membrana de la única y gran vacuola lipídica que ocupa la totalidad del citoplasma de las células adiposas51.
Los adenomas sebáceos, los sebaceomas y los carcinomas sebáceos son neoplasias infrecuentes, pero su diagnóstico específico es importante porque a veces constituyen marcadores cutáneos del síndrome de Muir-Torre (SMT). Este síndrome es el resultado de una mutación germinal en uno o más de los genes reparadores del DNA (MMR mismatch repair) MSH-2, MLH-1, MSH-6 y PMS2, que pueden estudiarse inmunohistoquímicamente en material fijado en formol e incluido en parafina. Se ha calculado que el estudio combinado de estas proteínas posee un valor predictivo positivo del 55% para el diagnóstico del SMT en una neoplasia sebácea que muestre pérdida de MSH-2 (fig. 33) y MSH-6, y un valor predictivo positivo del 100% si la pérdida es de MLH-1 y MSH-6 o bien de los 3 marcadores a la vez52–54.
Sebaceoma quístico en un paciente con síndrome de Muir-Torre. A) Visión panorámica. B) Detalle de un grupo de sebocitos en distintos estadios de maduración. C) El mismo caso estudiado imunohistoquímicamente para MSH2. Los núcleos de los queratinocitos epidérmicos expresan MSH2, como control interno positivo. D) A gran aumento se observa como los núcleos de las células neoplásicas del este sebaceoma no expresan MSH2.
En la literatura, la mayoría de los autores que han escrito sobre neoplasias anexiales cutáneas ecrinas y apocrinas añaden, de manera casi automática, el calificativo de «ecrino» a cualquier neoplasia anexial. Términos como poroma ecrino, espiradenoma ecrino o carcinoma ecrino siringoide constituyen buenos ejemplos de esta circunstancia. Sin embargo, hasta la fecha nadie ha definido con rigor y exactitud cuáles son los criterios histopatológicos que debe mostrar una determinada neoplasia para poder afirmar su diferenciación ecrina. Desde un punto de vista teórico, podremos decir que una neoplasia muestra diferenciación ecrina cuando la neoplasia en cuestión reproduzca, con mayor o menor éxito dependiendo de su grado de diferenciación, alguna de las estructuras de la glándula ecrina normal. Sin embargo, quizá con la excepción del tumor mixto ecrino, no se ha descrito ninguna neoplasia que reproduzca la porción secretora de las glándulas ecrinas, es decir, que esté constituida por estructuras glandulares tapizadas por una sola hilera de células epiteliales columnares en la que alternan células claras y células oscuras y una hilera periférica discontinua de células mioepiteliales. Pero el mayor problema lo plantean las neoplasias ductales, que son, con mucho, la gran mayoría de las neoplasias con diferenciación ecrina o apocrina. En el momento actual no podemos saber si una neoplasia ductal es ecrina o apocrina sencillamente porque, hasta la fecha, el ducto ecrino y el apocrino son indistinguibles uno de otro desde el punto de vista histológico, inmunohistoquímico y ultraestructural. Únicamente en glándulas ecrinas y apocrinas normales, si observamos que un conducto excretor desemboca libre en la epidermis podemos afirmar que ese conducto es ecrino, o si por el contrario el conducto desemboca en el infundíbulo de un folículo piloso podemos afirmar con seguridad que ese conducto es apocrino. Pero, en la mayoría de las neoplasias ductales, tanto benignas como malignas, solo podemos afirmar que se trata de neoplasias ductales, y una calificación adicional como ecrina o apocrina basada en las características histopatológicas de esos ductos es pura imaginación. La inmunohistoquímica prometía resolver este problema y diversos autores han propuesto diferentes marcadores inmunohistoquímicos para distinguir entre diferenciación ductal ecrina y diferenciación ductal apocrina. Sin embargo, en la práctica ninguno de estos marcadores consigue diferenciar de manera constante y repetible el ducto ecrino del apocrino en glándulas ecrinas y apocrinas normales, por lo que su aplicación en el estudio de la diferenciación en las neoplasias ductales sigue siendo controvertida. En la tabla 4 se resumen los marcadores inmunohistoquímicos más frecuente utilizados en la investigación de la diferenciación de las neoplasias anexiales cutáneas.
Marcadores inmunohistoquímicos más frecuentemente utilizados en neoplasias anexiales para investigar su diferenciación
| Marcador | Patrón | Aplicación |
| CEA | Citoplásmico | Marcador de diferenciación glandular, puede ayudar en el diagnóstico de la enfermedad de Paget extramamaria |
| GCDFP15 | Citoplásmico | Marcador de diferenciación apocrina, aunque también marca las unidades ecrinas |
| EMA | Citoplásmico | Marcador de neoplasias ductales ecrinas malignas y en ocasiones apocrinas, además de la mayoría de las sebáceas |
| CK7 | Citoplásmico | Sensible y específico para la enfermedad de Paget mamaria y extramamaria |
| AE1/AE3 | Citoplásmico | Pan-citoqueratina presente en neoplasias glandulares |
| Calretinina | Citoplasmático | Marcador de la capa interna de la vaina radicular externa del folículo, del ducto sebáceo y de la porción secretora ecrina. Se expresa en proliferaciones con diferenciación tricolémica, sebácea ductal y ecrina secretora |
| CD34 | Citoplasmático | Diferenciación hacia la vaina radicular externa del folículo piloso (diferenciación tricolémica). Marca también los fibrocitos perianexiales de la dermis |
| Adipofilina | Citoplasmático, microvacuolado | Marcador de diferenciación sebácea |
| Ber-EP4 | Citoplásmico | Positivo en epitelioma basocelular, negativo en carcinoma espinocelular y tricoblastoma. Marca también neoplasias sebáceas |
| Bcl-2 | Citoplásmico | Marca la capa basal de la epidermis y puede ayudar en el diagnóstico diferencial entre epitelioma basocelular y tricoepitelioma |
Algunos diagnósticos diferenciales histopatológicos merecen un comentario específico. A veces neoplasias constituidas por cordones epiteliales basaloides inmersos en un estroma desmoplásico plantean el diagnóstico diferencial entre carcinoma basocelular morfeiforme, tricoepitelioma desmoplásico, carcinoma espinocelular trabecular indiferenciado, carcinoma anexial microquístico y carcinoma siringoide. La mayoría de los carcinomas basocelulares muestran positividad para el CD10 en sus células neoplásicas, pero el carcinoma basocelular morfeiforme solo muestra una débil inmunotinción para el CD10 en las células del estroma tumoral. Además, los fibrocitos del estroma del tricoepitelioma desmoplásico también expresan CD1055. En estos casos puede ser útil el estudio inmunohistoquímico del BerEp4, que marca el epitelio neoplásico de casi todas las variantes histopatológicas del carcinoma basocelular (fig. 34), pero no el del tricoblastoma o el del carcinoma espinocelular56–59. Las tinciones para CEA y EMA nos permitirán detectar pequeñas formaciones ductales del carcinoma anexial microquístico o del carcinoma siringoide.
La distinción histopatológica entre un carcinoma anexial primario y una metástasis cutánea de adenocarcinoma visceral es también un problema frecuente. En este sentido, se ha propuesto el estudio de la CK5/6, el p63 y la podoplanina como los marcadores inmunohistoquímicos que se expresan preferentemente en carcinomas primarios, mientras que suelen ser negativos en las metástasis de adenocarcinomas viscerales60. Sin embargo, la capacidad discriminatoria de estos marcadores no es absoluta, ya que estudios recientes han demostrado que puede existir una expresión relativamente frecuente de p63 en metástasis cutáneas de adenocarcinoma y hasta un 5% de los casos muestran expresión focal de podoplanina61,62. El GCDFP-15 tiene una sensibilidad y especificidad del 99% para metástasis de adenocarcinoma de mama, pero se expresa también en carcinomas ecrinos y apocrinos cutáneos63.
Estudio inmunohistoquímico de metástasis cutáneasEn la tabla 5 se enumeran las características inmunohistoquímicas de la mayoría de las metástasis cutáneas de neoplasias viscerales malignas64.
Marcadores inmunohistoqumicos utilizados en la investigación del origen en metástasis cutáneas de tumores malignos internos
| Origen | Histopatología | Marcadores inmunohistoquímicos | |
| Positivos | Negativos | ||
| Mama | Carcinoma ductal | CK7, receptores de estrógenos, receptores de progesterona, GCDFP-15, CEA, c-erbB-2, mamaglobina, E-cadherina | CK20, CK5/6 |
| Carcinoma lobulillar | CK7, receptores de estrógenos, receptores de progesterona, GCDFP-15, CEA, EMA, mamaglobina | S-100, E-cadherina, podoplanina, p63 | |
| Carcinoma inflamatorio | CD31, podoplanina | ||
| Carcinoma telangiectásico | CD31 | Podoplanina | |
| Enfermedad de Paget mamaria | MUC1, CK7 | MUC2, MUC5AC, CK20 | |
| Pulmón | Carcinoma escamoso | CK5/6 | CK7, CK20, TTF-1, CEA |
| Adenocarcinoma | CK7, TTF-1, Ber-EP4, CEA, surfactante de apoproteína A | CK5/6, CK20 | |
| Carcinoma de células pequeñas | TTF-1, CAM 5.2, CK8/18, Ber-EP4,ENS | CK7, CK20, CD99 | |
| Mesotelioma | CK5/6, calretinina, vimentina | CEA, TTF-1, S-100, CD31 | |
| Colorrectal | Adenocarcinoma | CK20, CEA, CDX2 | CK7 |
| Intestino delgado | Carcinoma escamoso | CK20, EMA, AE1/AE3 | CK7 |
| Adenocarcinoma | CEA, EMA | ||
| Estómago | Adenocarcinoma | CK20, CEA, EMA, CDX2, HIK1083 | CK7+/- |
| Esófago | Carcinoma escamoso/adenocarcinoma | CK5/6, Ber-EP4 | CK7, CK20 |
| Hígado | Carcinoma hepatocelular | Alfa-fetoproteína, CEA policlonal, Hep Par-1, arginasa-1 | CKs, EMAMonoclonal, CEA |
| Sistema biliar | Adenocarcinoma | CK7, CK20 | CDX2 |
| Páncreas | Adenocarcinoma | CA19,9, CK7, CK8, CK18, CK19 | CK20 |
| Riñón | Carcinoma renal | AE1/AE3, MNF116, CD31, RCC-Ma (>2/3), vimentina CD10, EMA, S-100, adipofilina, PAX8 | Inhibina, Melan-A TTF-1, CK7, CK20 |
| Vejiga y uretra | Carcinoma de epitelio transicional | CK7, CK19, CK20, CK14 (50%), trombomodulina, uroplaquina iii, CD10 | |
| Próstata | Adenocarcinoma | Antígeno prostático específico (PSA), fosfatasa ácida, AMACR (P504S/Alpha-methylacyl-CoA racemase), ERG | CK7, CK20, trombomodulina |
| Testículo | Coriocarcinoma | Beta-HCG | |
| Ovario | Carcinoma | CA125, CK7, PAX8 | CK20 (excepto algunos carcinomas mucinosos) |
| Cuello uterino y vagina | Carcinoma | CK7, EMA+/- | CK20, CEA |
| Endometrio | Carcinoma | CK7, PAX8 | CK20, p63, podoplanina |
| Tiroides | Papilar | Tiroglobulina, TTF-1, PAX8 (50%)Tiroglobulina, TTF-1, PAX8 (50%) | |
| Folicular | |||
| Anaplásico | Tiroglobulina ± | ||
| Medular | Calcitonina | Tiroglobulina, PAX8 | |
| Tumor carcinoide | Carcinoma enterocromoafin | Enolasa neuronal específica (ENS), cromogranina, sinaptofisina, CDX2 (origen intestinal), TTF-1 (origen pulmonar) | CK5/6, CK7, CK20, p63 |
| Neuroblastoma | ENS, cromogranina, sinaptofisina, periferina, alfa-internexina, proteína asociada a microtúbulos 1B (MAP-1B) | CD99, desmina, miogenina | |
| Sarcomas de partes blandas | Leiomosarcoma | Actina de músculo liso (SMA), desmina | |
| Rabdomiosarcoma | Desmina, SMA, MYOD1, vimentina, miogenina, antígeno común leucocitario (CD45) | ||
| Angiosarcoma | CD31, ERG, podoplanina, amplificación de c-MycEn variantes epitelioides: CKs y EMA | ||
| Condrosarcoma | CD99, vimentina, S-100 (focal), podoplanina, YKL-40, SMA, desmina, CAM5.2 | AE1/AE3, SMA, CD117 | |
| Sarcoma de Swing | Vimentina, ENS, CD99, LEU7/CD57, FLI-1 | Podoplanina | |
| Osteosarcoma | Ezrina, SMA, C-erbB-2 (50%) | ||
| Glándulas salivares | Carcinoma adenoide-quístico | CKs, CEA, S-100, CD117/cKit, SMA, vimentina (en el componente mioepitelial) | |
| Carcinoma mucoepidermoide | CK5/6, EMA, CEA | ||
| Laringe y tráquea | Carcinoma | AE1/AE3, p53 | |
| Nasofaringe | Carcinoma | RNA del VEB | |
| Glioblastoma | GFAP, EGFR (±), vimentina, YKL-40 | Neurofilamentos, HMB45, Melan-A, CKs | |
| Meduloblastoma | Sinaptofisina, ENS | Neurofilamentos | |
| Meningioma | Vimentina, EMA, S-100, receptores de progesterona, CKs, CEA | ||
| Glándula suprarrenal | Carcinoma | ENS, inhibina, sinaptofisina (focal), A103, cromogranina, calretinina | Melan-A, CD10 |
Comentaremos brevemente los marcadores más útiles en dermatopatologia. El TTF-1 marca aproximadamente 2 tercios de los carcinomas de pulmón y sus metástasis. La combinación de receptores de estrógenos y GCDFP-15 resulta muy útil en el diagnóstico del cáncer de mama. CDX-2 es un marcador intranuclear expresado en la mayoría de carcinomas colorrectales, aunque también marca un número limitado de otros adenocarcinomas como el carcinoma gástrico, biliopancreático y carcinoma mucinoso de ovario. El antígeno prostático específico (PSA) se utiliza para confirmar el origen prostático de las metástasis cutáneas, aunque también es positivo en otros tumores, como el melanoma metastático. La CK7 y CK20 se utilizan en el diagnóstico de la enfermedad de Paget extramamaria primaria y secundaria (metástasis epidermotropas en piel anal o genital). El Pax8 es un factor de transcripción que intervine en la maduración embriológica de estructuras del sistema Mülleriano y muestra una expresión intensa en metástasis cutáneas de carcinoma de ovario no mucinoso, carcinoma endometrial y carcinoma renal. Sin embargo, resulta negativo en metástasis de carcinoma de mama, pulmón, tracto biliar, colon y próstata. Tampoco se expresa en adenocarcinomas anexiales cutáneos primarios y sus metástasis en piel65. La arginasa 1 es una enzima característica del tejido hepático que cataboliza la hidrólisis de arginina a ornitina y urea. Se expresa en tejido hepático normal y en tumores benignos y malignos de hepatocitos, pero resulta negativa en muchos otros tumores, incluyendo carcinoma renal, tumores neuroendocrinos, melanoma, carcinomas gástricos y carcinomas suprarrenales66. El HER2/neu, conocido también como erbB2 es un oncogén localizado en el cromosoma 17 que se expresa en aproximadamente 25-30% de los casos de cáncer de mama, en otros adenocarcinomas y en carcinomas de células transicionales. La expresión de este oncogén en el cáncer de mama está asociada a la progresión y evolución desfavorable del mismo. Las pacientes con cáncer de mama con amplificación de Her2/neu tienen una gran probabilidad de resistencia al tratamiento con tamoxifeno (hormonoterapia). Sin embargo, responden mejor al tratamiento combinado de quimioterapia con trastuzumab, un anticuerpo monoclonal humanizado que se dirige contra el dominio extracelular del receptor Her2/neu. En dermatopatología resulta de utilidad en el diagnóstico diferencial de metástasis cutáneas y como marcador diferenciador de enfermedad de Paget de melanoma in situ con células pagetoides67.
Las claudinas son proteínas integrales de membrana que intervienen en la formación de uniones celulares estrechas, y son un componente variable y específico de cada tejido. La claudina-1 es positiva en células epiteliales y perineurales; muchos de los tumores que se incluyen en el diagnóstico diferencial del perineuroma (como el dematofibrosarcoma protuberans, sarcoma fibromixoide de bajo grado y fibromatosis) son claudina-1 negativos68. La claudina-3 es positiva en epitelio pulmonar y hepático, la claudina-5 en células endoteliales, y la claudina-18 en las células neoplásicas del adenocarcinoma de páncreas, pero no en el epitelio pancreático normal69.
La E-cadherina es una glicoproteína transmembrana de 120kDa implicada en la adhesión celular de los epitelios. La pérdida de la expresión de esta molécula está asociada con la progresión de varios carcinomas70,71. Su expresión en el melanoma es mayor en la lesión primaria que en las metástasis72. En patología mamaria, la pérdida completa de expresión de E-cadherina, que ocurre tanto en carcinomas lobulillares in situ como invasivos, permite distinguirlos del carcinoma ductal, que conserva intacta la expresión de esta glicoproteína. Se ha descrito también su utilidad en el panel de diagnóstico diferencial entre mesotelioma epitelioide y adenocarcinoma pulmonar73.
Neoplasias nerviosas y neuroendocrinasAlgunas neoplasias cutáneas con diferenciación neural o neuroendocrina merecen un breve comentario. En la tabla 6 se resumen los marcadores inmunohistoquímicos más frecuentemente utilizados en el estudio histopatológico de estas neoplasias.
Marcadores inmunohistoquímicos de neoplasias cutáneas neurales y neuroendocrinas
| Marcador inmunohistoquímico | Patrón | Aplicaciones |
| Proteína S-100 | Nuclear/citoplásmico | Gliomas, tumores neuroectodérmicos primitivos, schwannoma, neurofibroma, tumores neurales y condroides |
| Enolasa neuronal específica | Citoplásmico | Células neuroendocrinas, células del tumor de Merkel |
| EMA | Citoplasmático | Células perineurales |
| PGP9.5 | Citoplasmático | Pan-neuronal |
| Proteína ácida gliofibrilar (GFAP) | Citoplasmático | Células de Schwann |
| CK20 | Perinuclear | Células del tumor de Merkel |
| Neurofilamentos | Perinuclear | Axones, células neuroendocrinas, células del tumor de Merkel |
| Cromogranina | Citoplásmico | Células neuroendocrinas, células del tumor de Merkel |
| Sinaptofisina | Citoplásmico | Células neuroendocrinas, células del tumor de Merkel |
| TTF-1 | Nuclear | Negativo en las células del tumor de Merkel |
Clásicamente, se ha observado que los neurofibromas contienen axones que se tiñen con neurofilamentos, mientras que las células de Schwann expresan proteína S-100, CD57 (Leu-7) y la proteína básica de mielina y los fibroblastos muestran reactividad con el factor xiiia. Los neurofibromas expresan también varios factores de crecimiento y sus receptores, como la molécula de adhesión de células neurales CD56 o factores de crecimiento endotelial. Las células neoplásicas de los schwannomas expresan vimentina, proteína S-100 y proteína básica de mielina, pero no neurofilamentos ni factor xiiia. Recientemente se ha descrito una intensa positividad de las células de Schwann y de los schwannomas con el anticuerpo Sox-10, que desgraciadamente tampoco es absolutamente específico, ya que también tiñe los melanocitos y tumores melanocíticos benignos y malignos. Un escaso número de células de los schwannomas expresan la proteína ácida gliofibrilar. La capsula periférica que rodea la lesión está constituida por células perineurales que expresan EMA. Sin embargo, recientemente se ha demostrado que más del 50% de los schwannomas convencionales contienen axones positivos para neurofilamentos, en una proporción variable de unos casos a otros, por lo que actualmente se aconseja que el diagnóstico diferencial entre neurofibroma y schwannoma en casos dudosos no se base únicamente en el estudio inmunohistoquímico de neurofilamentos74. Los schwannomas muestran una intensa positividad para calretinina y podoplanina, mientras que los neurofibromas solo muestran una positividad débil y focal para estos marcadores. De todas formas, en los últimos años se han descrito varios ejemplos de neoplasias híbridas entre neurofibroma y schwannoma75,76 y entre neurofibroma y perineuroma77, por lo que la separación entre los distintos tumores de las vainas de nervios periféricos no parece ser tan nítida como se había considerado clásicamente.
Las células neoplásicas de los tumores de células granulares expresan proteína S-100, enolasa neuronal específica, PGP 9.5, NKI/C3, CD68, receptor del factor de crecimiento neural 5 (NGFR-5), calretinina (fig. 35), Glut-115, MiTF-1 y alfa-inhibina.
Las células neoplásicas del perineuroma de tejidos blandos también expresan vimentina, EMA (fig. 36), claudina-168, y CD1055, mientras que en la variante desmoplásica la mayoría de las células expresan, además del EMA, GLUT-1, claudina-1, colágeno tipo iv, CD99, actina muscular específica, actina alfa de músculo liso y citoqueratinas en menor proporción62. Característicamente las células neoplásicas resultan negativas para la proteína S-100, el CD57 (Leu-7), la proteína ácida gliofibrilar, los neurofilamentos, la desmina, la enolasa neuronal específica y la cromogranina.
Existen 2 variantes histopatológicas de mixoma de la vaina nerviosa o neurotecoma, la variante clásica o mixoide y el denominado neurotecoma celular. Ambas neoplasias muestran un perfil inmunohistoquímico diferente. En el neurotecoma mixoide todos los hallazgos inmunohistoquímicos apoyan una diferenciación neural y concretamente schwanniana de las células que componen la lesión, ya que la mayoría expresan proteína S-100, CD57 (Leu-7), enolasa neuronal específica y proteína ácida gliofibrilar, y están rodeadas individualmente por colágeno tipo iv. Algunos fibroblastos del interior de los lóbulos tumorales expresan CD34 y factor xiiia, y en su periferia se suelen observar algunas células positivas para el antígeno de membrana epitelial (EMA), que corresponden a células perineurales. Las células tumorales del neurotecoma mixoide no expresan citoqueratinas, HMB45, actina-alfa de músculo liso, desmina, antígeno carcinoembrionario, CD68, CD31, sinaptofisina ni cromogranina. En contraste, las células que componen el neurotecoma celular no expresan proteína S-100, proteína ácida gliofibrilar, CD57 (Leu-7) ni antígeno de membrana epitelial, que son los marcadores mayoritariamente considerados como indicativos de diferenciación neural, por lo que la histogénesis de esta variante celular permanece desconocida. Los únicos marcadores habitualmente positivos en las células del neurotecoma celular son el NK1C3 (inicialmente considerado como específico de melanocitos, y que hoy sabemos se expresa en todas las células con abundantes lisosomas), el PGP 9,5 (marcador pan-neuronal), y la proteína S-100A6. La expresión de estos 2 últimos marcadores es el único argumento inmunohistoquímico en favor de una diferenciación neural del neurotecoma celular. Algunas células del neurotecoma celular también expresan enolasa neuronal específica y el MITF-1, pero estos resultados varían de unos casos a otros. En resumen, mientras que los hallazgos inmunohistoquímicos apoyan la idea de que el neurotecoma mixoide está mayoritariamente constituido por células de Schwann, se desconoce la verdadera naturaleza de las células neoplásicas del neurotecoma celular78–85.
Finalmente, ya hemos señalado anteriormente el perfil inmunohistoquímico del tumor de Merkel. Conviene recordar aquí que las lesiones cutáneas primarias de este tumor resultan negativas para el TTF-1, lo que permite diferenciarlas de una metástasis cutánea de un carcinoma microcítico de pulmón, que puede mostrar una histopatología muy similar. Estudios recientes han postulado también la utilidad del estudio del MASH1, un gen crucial en el desarrollo embriológico de células del cerebro y del sistema neuroendocrino, en el diagnóstico diferencial entre las metástasis cutáneas del carcinoma microcítico de pulmón y el tumor de Merkel, sobre todo en los raros casos de tumor de Merkel positivos para el TTF-1. El tumor de Merkel primario cutáneo no expresa MASH1, mientras que la mayoría de los carcinomas microcíticos pulmonares resultan positivos con este marcador86.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.