INTRODUCCION
Las micobacterias atípicas se aislaron por primera vez en 1931 por Pinners, pero su importancia como patógenos no se conoció hasta la década de los cincuenta. Las infecciones por micobacterias atípicas están adquiriendo cada vez una mayor importancia, existiendo un número creciente de casos registrados tanto en inmunodeprimidos como en huéspedes sanos. Con frecuencia no se llega al diagnóstico correcto de estas infecciones por su presentación clínica inespecífica o sutil, sobre todo en inmunodeprimidos, junto con un bajo índice de sospecha y técnicas de biopsia y cultivo inadecuadas. Deben sospecharse en pacientes con úlceras, nódulos o placas crónicas, sobre todo en inmunodeprimidos. El tratamiento varía en función del microorganismo causal.
El Mycobacterium marinum produce enfermedad en múltiples peces de agua fría o templada, dulce o salada, y la infección en humanos se produce tras el contacto con éstos o agua contaminada. La infección habitualmente queda limitada a la piel, pero puede extenderse a estructuras profundas. La diseminación es rara.
Presentamos un nuevo caso de infección por Mycobacterium marinum en un paciente inmunodeprimido por fármacos que respondió favorablemente al tratamiento médico.
CASO CLINICO
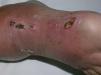
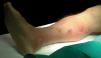
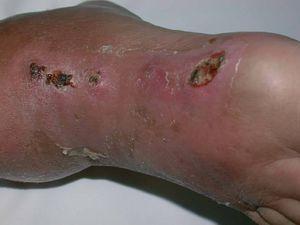
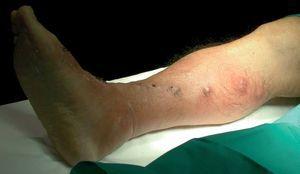
Varón de 74 años con antecedentes personales de espondilitis anquilopoyética y una miopatía de ambas cinturas, en tratamiento con metotrexate y azatioprina. Presenta desde hace dos semanas una lesión ulcerada de pequeño tamaño, junto con eritema y edema, en el dorso del pie derecho. Refiere el antecedente de un traumatismo con una roca en el mar. En la exploración inicial se observa una lesión nodular ulcerada, de 1,5 cm de diámetro, de borde bien delimitado, cubierto por una costra hemorrágica y centro exudativo, localizada en el dorso del pie derecho, asociada a eritema y edema de la zona (fig. 1). Se inicia tratamiento con amoxicilina-ácido clavulánico sin evidenciarse mejoría clínica, incluso con aparición de nuevas lesiones en la semana siguiente. En la exploración física presenta lesiones nodulares ulceradas, similares a la del dorso del pie, en la cara anterointerna de la pierna derecha, siguiendo un trayecto lineal a lo largo de la cadena linfática (distribución esporotricoide) (fig. 2). Además existe edema y eritema desde el dorso del pie hasta la raíz de la extremidad inferior derecha. No se palpan adenopatías regionales. El paciente no refiere sintomatología general.
Fig. 1. Lesión nodular ulcerada, de 1,5 cm de diámetro, de borde bien delimitado, cubierta por una costra hemorrágica y centro exudativo, localizada en el dorso del pie derecho, asociada a eritema y edema
Fig. 2.--Lesiones nodulares múltiples, algunas ulceradas, siguiendo un trayecto lineal a lo largo de la cara anterointerna de la pierna derecha (distribución esporotricoide).
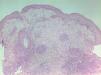
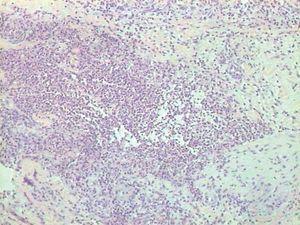
Dado el antecedente de una herida traumática en el mar y la toma de fármacos inmunosupresores, se sospecha una infección por Mycobacterium marinum y se realiza una biopsia para estudio histológico y microbiológico. En la anatomía patológica (figs. 3 y 4) se observan cúmulos de neutrófilos en la dermis y parte superior de la hipodermis que forman abscesos. No se aprecian granulomas supurativos. Sí se observa un granuloma de cuerpo extraño. Con las técnicas de Ziehl, ácido peryódico de Schiff (PAS) y Gram no se objetivan microorganismos. En el cultivo, tras 4 semanas de incubación, se aísla Mycobacterium marinum y sobreinfección por Staphylococcus aureus.
Fig. 3.--En la anatomía patológica se observan cúmulos de neutrófilos en la dermis y parte superior de la hipodermis que forman abscesos. No se aprecian granulomas supurativos. Sí se observa un granuloma de cuerpo extraño.
Fig. 4.--Detalle de un área de la biopsia donde se observa un absceso.
Se realizó tratamiento con doxiciclina oral a dosis de 100 mg/12 horas durante 4 meses. Además, en consenso con el Servicio de Reumatología se suspendieron temporalmente los fármacos inmunosupresores, con buena evolución y desaparición progresiva de las lesiones.
DISCUSION
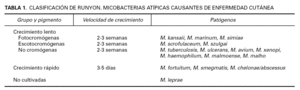
El Mycobacterium marinum es una micobacteria atípica que pertenece al grupo I de la clasificación de Runyon (tabla 1) 1, es fotocromógena y de crecimiento lento. Fue descrita por primera vez por Aronson en 1926 en peces de agua salada en un acuario de Filadelfia y en 1951 se aisló como patógeno en nadadores de una piscina en Suecia 2-5. La infección tiene una distribución mundial, pero con mayor prevalencia en regiones cálidas 2. Vive en ambientes acuáticos, tanto en agua salada como en agua dulce, sobre todo estancada, por eso la infección por Mycobacterium marinum se denomina también granuloma de las piscinas o de los acuarios 3,5. Una adecuada cloración ha disminuido el número de casos adquiridos en las piscinas, en cambio, están aumentando los casos relacionados con los acuarios 6.
Los factores de riesgo más importantes asociados a esta infección son el virus de la inmunodeficiencia humana (VIH), los medicamentos inmunosupresores, alcoholismo, tabaco, enfermedad pulmonar obstructiva crónica (EPOC), la reducción de la inmunidad cruzada entre las micobacterias al existir un menor número de casos de contacto con el Mycobacterium tuberculosis y, el más importante, el contacto con ambientes acuáticos. Todos estos factores han propiciado un mayor espectro de personas susceptibles a la enfermedad 2.
La infección se adquiere como resultado de la inoculación directa del microorganismo a través de heridas o erosiones cutáneas en contacto con agua contaminada de acuarios y piscinas 3. No se transmite de persona a persona 1.
La micobacteria penetra en la piel a través de una solución de continuidad, y tras un periodo de incubación de aproximadamente 2-3 semanas (puede oscilar entre 1 semana y 2 meses) se inicia la clínica. El Mycobacterium marinum es la micobacteria atípica que afecta la piel con más frecuencia.
Las formas clínicas de presentación habituales son la forma nodular y la diseminada 7-11: la forma nodular es la más frecuente (65 %), consiste en un nódulo inflamatorio único, una pústula, una úlcera costrosa, un absceso supurativo o un nódulo verrucoso, en el lugar de la inoculación. Afecta con mayor frecuencia a las extremidades superiores, sobre todo a las manos, probablemente porque la temperatura corporal a nivel acro es similar a la óptima (32 °C) para el crecimiento de la micobacteria. Pueden afectarse estructuras subyacentes, como el hueso o las articulaciones, dando lugar a tenosinovitis, bursitis, artritis u osteomielitis 12. El 35 % de los pacientes presentan lesiones nodulares múltiples, que por lo general siguen el recorrido de los linfáticos, con una disposición lineal a partir de la lesión de inoculación; se trata del patrón linfocutáneo o esporotricoide 13.
Se han descrito también infecciones diseminadas 7,14,15 en pacientes con inmunosupresión severa (linfoma, leucemia y VIH). Estos pacientes presentan afectación visceral y además lesiones cutáneas que pueden estar localizadas o diseminadas. Las lesiones pueden aparecer en cualquier localización, no sólo en zonas acras. Clínicamente se observan foliculitis y/o forúnculos, nódulos, abscesos, úlceras o placas inflamatorias. La participación cutánea puede ser la primera manifestación de la infección diseminada; otros pacientes tienen una infección interna ya conocida y se estudian las lesiones cutáneas puesto que son más accesibles.
Las infecciones por Mycobacterium marinum están infradiagnosticadas, por lo que el retraso en el tratamiento es frecuente. Las características clínicas junto con el antecedente de contacto con acuarios, peces o actividades relacionadas con ambientes acuáticos sugieren la posibilidad de una infección por Mycobacterium marinum 3,9,16.
En el estudio histológico 4,17, en estadios iniciales se observa un infiltrado inflamatorio linfo-histiocitario perivascular en la dermis, que en lesiones más evolucionadas forma granulomas y algunas veces abscesos. No es frecuente encontrar bacilos ácido-alcohol resistentes. Pueden verse cambios epidérmicos como acantosis, hiperplasia pseudoepiteliomatosa, exocitosis y úlceras.
El diagnóstico se confirma mediante el estudio microbiológico 2,11,16. Las micobacterias tienen una cubierta cérea que las hace resistentes a la mayoría de las tinciones. Éstas además son ácido-alcohol- resistentes, es decir, que no se decoloran de manera fácil con ácidos después de la tinción de Ziehl-Neelsen. Aunque la especificidad del examen directo es elevada, la diferenciación entre las diferentes especies de micobacteria es imposible. El cultivo, positivo en el 70-80 % de los casos 16,18, es el método diagnóstico más sensible. El Mycobacterium marinum es una micobacteria de crecimiento lento y fotocromógena (cuando se exponen a la luz los cultivos de la micobacteria producen un pigmento amarillento en un 50 % de los casos) (fig. 5). Crece en los medios de cultivo habituales para micobacterias a 30-33 °C y su crecimiento se inhibe a 37 °C. Se dispone de dos tipos de medios de cultivo: sólidos (Lowenstein-Jensen) y líquidos, cuya combinación ofrece una mayor sensibilidad diagnóstica. La prueba de la tuberculina es generalmente positiva debido a la existencia de una reacción cruzada con Mycobacterium tuberculosis. Hay estudios que demuestran la existencia de similitudes entre Mycobacterium marinum y tuberculosis6.
Fig. 5.--Cultivo en medio especial para micobacterias. Tras la exposición a la luz el cultivo adquiere una coloración amarillenta en el 50 % de los casos, indicando que se trata de una micobacteria fotocromógena.
Otros métodos diagnósticos para la identificación rápida de micobacterias son los moleculares. Son muy útiles cuando el cultivo es negativo. Se basan en la reacción en cadena de la polimerasa y consisten en la amplificación de secuencias específicas de ADN, la más estudiada es el gen hsp65 4,9,16.
El diagnóstico diferencial debe realizarse con otras micobacterias atípicas, esporotricosis, micosis profundas, nocardiosis, infecciones por Leishmania, tuberculosis verrucosa, sífilis terciaria, tularemia, enfermedad por arañazo de gato, etc. 19.
Aunque la infección por Mycobacterium marinum tiene un pronóstico benigno y los casos con lesiones únicas pueden curar espontáneamente, sin embargo, es recomendable tratar las lesiones, pues es más frecuente que sean persistentes o que tiendan a extenderse 3. El tratamiento óptimo no está aún bien establecido 9. Éste se basa en la experiencia personal y en las preferencias de algunos autores, ya que no existen amplios estudios que comparen los resultados con distintos antibióticos 10,14. Los tres regímenes antibióticos utilizados habitualmente son las tetraciclinas, la rifampicina asociada o no a etambultol y el cotrimoxazol. La rifampicina (15 mg/kg/día-300 mg/día) asociada a etambutol (25 mg/kg/día) han demostrado ser los fármacos más efectivos, y es la combinación más utilizada 10,20. Para otros autores el tratamiento de elección siguen siendo las tetraciclinas 9,18-22: minociclina y doxiciclina a dosis de 200 mg/día. Se han empleado también las quinolonas, el cotrimoxazol (160-800 mg/12 horas) y los macrólidos. Dentro de estos últimos la claritromicina (500 mg/12 horas) parece ser el más eficaz 23-27. El problema reside en que son los mismos antibióticos los que al mismo tiempo fallan en el tratamiento de otros pacientes 8. Por esto, no se puede establecer un tratamiento estandarizado. En los últimos años se han realizado varios estudios 28,29 para determinar la susceptibilidad antibiótica del Mycobacterium marinum. Estos estudios comparan la actividad, in vitro, de los antibióticos utilizados habitualmente en las infecciones por Mycobacterium marinum (tetraciclinas, rifampicina, etambutol y cotrimoxazol) con otros antibióticos. Se confirma una susceptibilidad moderada-alta a las tetraciclinas, siendo la actividad de la minociclina mayor que la de la doxiciclina. El Mycobacterium marinum es susceptible también a rifampicina, rifabutina, amikacina e imipenen. Clásicamente, se pensaba que la micobacteria era resistente a las quinolonas, esto es así para ciprofloxacino, levofloxacino y ofloxacino, pero se ha visto que moxifloxacino y esparfloxacino sí son eficaces. En cuanto a los macrólidos, se recomienda utilizar claritromicina porque es más activa que cualquier otro macrólido. Se comprueba además que el Mycobacterium marinum es resistente a algunos fármacos antituberculosos (isoniacida, etambutol y pirazinamida).
Tampoco existe unanimidad en cuanto a la duración del tratamiento. La respuesta al tratamiento es lenta, por lo que los antibióticos deben mantenerse varios meses. Se recomienda mantenerlos un mínimo de 4-6 semanas tras la resolución clínica 10,26.
En los casos con afectación de tejidos profundos o de enfermedad persistente puede ser necesario asociar tratamiento quirúrgico 5,12,26,30. Sin embargo, existe contradicción acerca de si la cirugía puede ayudar a la extensión de la micobacteria a estructuras profundas 20. Se ha descrito así mismo el tratamiento con aumento de la temperatura local. Hisamichi et al 22 presentan el caso de una infección por Mycobacterium marinum tratada con minociclina y aumento de la temperatura local, que se realizaba cada día durante 5-6 horas con un calentador de bolsillo desechable.
Como conclusión, la rifampicina asociada a etambutol, las tetraciclinas, la claritromicina, la rifabutina, la amikacina y el imipenem parecen ser buenos candidatos para el tratamiento de las infecciones por Mycobacterium marinum, pero son necesarios nuevos estudios que comparen los resultados obtenidos in vitro e in vivo.
Declaración de conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Carmen Rosa García Acebes.
Servicio de Dermatología.
Hospital Clínico San Carlos.
Profesor Martín Lagos, s/n. 28040 Madrid. España.
carmen_rgacebes@yahoo.es
Recibido el 14 de enero de 2006.
Aceptado el 28 de junio de 2006.