La dermatitis herpetiforme es una enfermedad ampollosa autoinmune que aparece como expresión cutánea de la intolerancia al gluten. Forma parte de un abanico de patologías que tienen en común la sensibilidad a este componente, entre las cuales se encuentra la celiaquía y la ataxia por gluten. Los pacientes con dermatitis herpetiforme presentan una erupción papulovesicular pruriginosa de predominio en superficies de extensión y nalgas. El estudio inmunológico demuestra la presencia de anticuerpos específicos IgA antiendomisio y antitransglutaminasa. El hallazgo de depósitos granulares de IgA en la unión dermoepidérmica es patognomónico de la dermatitis herpetiforme. El tratamiento se basa en dos pilares: mantener indefinidamente una dieta estricta libre de este componente (la cual mejora todas las formas clínicas de la sensibilidad al gluten) y la dapsona, fármaco que es eficaz solo para las manifestaciones cutáneas.
Dermatitis herpetiformis is an autoimmune blistering disease that appears as a cutaneous manifestation of gluten intolerance. It is one of a group of disorders that have gluten sensitivity in common, including celiac disease and gluten ataxia. Patients with dermatitis herpetiformis present with a pruritic papulovesicular rash on extensor surfaces and on the buttocks. Immunological studies demonstrate the presence of specific immunoglobulin (Ig) A antiendomysial and antitransglutaminase antibodies. The finding of granular deposits of IgA along the dermal-epidermal junction is pathognomonic of dermatitis herpetiformis. Treatment of dermatitis herpetiformis is based on a life-long, strict gluten-free diet, which improves all clinical aspects of gluten sensitivity, and dapsone, a drug that is only effective for the skin manifestations.
La dermatitis herpetiforme (DH) es una enfermedad crónica autoinmune que cursa con una erupción papulovesicular pruriginosa de predominio en superficies de extensión y caracterizada histológicamente por microabscesos papilares de neutrófilos. La DH se asocia a enteropatía sensible al gluten (ESG)1 y remite tras la introducción de una dieta exenta de este.
InmunogenéticaTanto la celiaquía como la DH se correlacionan fuertemente con los haplotipos HLA-DQ2 y DQ8, de forma que alrededor del 90% de los pacientes son DQ2+ y la mayor parte de los restantes son DQ8+2–4. En concreto, ambas formas de ESG manifiestan los alelos HLA de clase ii DQA1¿0501 y DQB1¿0201, presentes en el cromosoma 65–7. Estos alelos son poco específicos, sin embargo, presentan un altísimo valor predictivo negativo en el diagnóstico de la DH. Es decir, su negatividad virtualmente excluye este diagnóstico.
Otros alelos asociados, tales como HLA-DR3, B8 y A1, explicarían la alta incidencia relativa de otras enfermedades autoinmunes en los pacientes con ESG, tales como trastornos tiroideos, lupus eritematoso sistémico y diabetes mellitus insulinodependiente8,9.
Basándose en estos alelos, se ha descrito recientemente un modelo animal de DH con ratones transgénicos NOD HLA DQ8+10, de gran interés para el estudio de los mecanismos fisiopatogénicos de la DH.
EpidemiologíaLa DH puede aparecer a cualquier edad9, con un pico máximo en la tercera década11. Es excepcional en niños menores de 3 años12. A diferencia de la celiaquía, es algo más frecuente en varones13. Se cree que alrededor de un 5% de pacientes celíacos desarrollarán una DH a lo largo de su vida13.
Afectación digestivaTodos los pacientes con DH presentan sensibilidad al gluten, sin embargo, la inmensa mayoría de ellos se encuentran asintomáticos desde el punto de vista digestivo14. En una serie reciente de casi 300 enfermos con DH, solo el 13% de ellos presentaban sintomatología digestiva9, en forma de diarrea, dolor abdominal o retraso de crecimiento en niños. En el resto de casos, solo la realización de una biopsia intestinal puede llegar al diagnóstico de ESG. En las diversas series publicadas, entre un 60 y un 75% de pacientes con DH manifiestan alteraciones histopatológicas en la biopsia intestinal9,15,16. No existe hasta el momento ningún estudio prospectivo que muestre la frecuencia real de ESG en pacientes con DH.
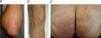
Manifestaciones cutáneasLa erupción es muy pruriginosa y presenta una distribución típica en superficies de extensión y nalgas (fig. 1). Los codos son la región más frecuentemente afecta. Las lesiones cutáneas consisten en pápulas eritematosas, vesículas pequeñas, excoriaciones y cicatrices frecuentemente hiperpigmentadas. Las vesículas intactas pueden ser difíciles de encontrar, y la presentación de ampollas francas es excepcional, lo cual puede dificultar un diagnóstico adecuado. Existen formas de presentación atípicas que vale la pena recordar: lesiones purpúricas palmares en edad infantil, y afectación de mucosas oral y genital en adultos13.
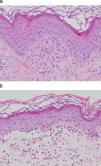
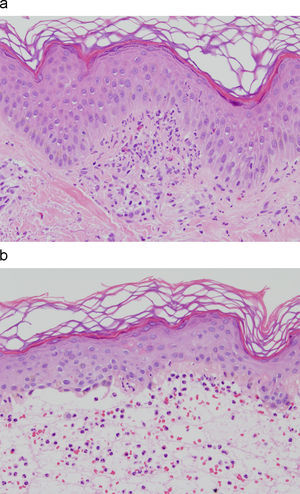
Histopatología y hallazgos de inmunofluorescenciaEl estudio de biopsias de piel afecta muestra microabscesos de neutrófilos en puntas papilares (fig. 2), infiltrados inflamatorios variables en dermis superficial y ocasionalmente vesículas subepidérmicas. Estos hallazgos son inespecíficos y se describen en otras enfermedades ampollosas autoinmunes.
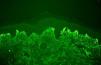
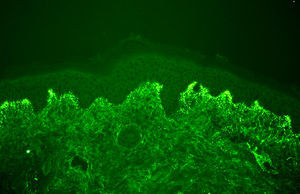
El diagnóstico de certeza se basa en el hallazgo —patognomónico— de un depósito granular de IgA (con/sin C3) en la unión dermoepidérmica mediante estudio de inmunofluorescencia directa de una muestra de piel sana perilesional (fig. 3, tabla 1)17,18. Estos depósitos suelen acentuarse —e incluso localizarse exclusivamente— en las puntas de las papilas dérmicas. La sensibilidad de esta prueba oscila entre el 90 y 95% de pacientes9.
Pruebas diagnósticas en la dermatitis herpetiforme
| 1. Biopsia cutánea |
|
| 2. Estudio inmunológico |
|
| 3. Tipaje HLA clase ii (opcional) |
|
| 4. Estudio digestivo (opcional) |
|
La negatividad del estudio de inmunofluorescencia directa debe hacernos dudar de este diagnóstico. En tal caso, será necesario repetir la biopsia sobre piel sana perilesional y asegurarse de que el paciente no sigue todavía una dieta libre de gluten. Si el enfermo ya está en dieta, no tiene erupción visible y el estudio de inmunofluorescencia es negativo, puede ser necesaria una prueba de provocación oral con gluten, la cual suele acompañarse de un brote de lesiones sugestivas en pocos días. Si aún así, sigue siendo negativa, es fundamental descartar algún fallo en la realización de la técnica11.
Autoantígenos y estudios inmunológicosRecientemente, se han descubierto los autoantígenos endomisiales específicamente reconocidos en ambas enfermedades: la transglutaminasa tisular (TGt) en la celiaquía19,20, y la transglutaminasa epidérmica (TGe) en la DH21. Los anticuerpos anti-TGt presentan una especificidad mayor del 90% y una sensibilidad que oscila entre el 50 y el 95% según los estudios disponibles11 (tabla 1).
Los autoanticuerpos IgA antiendomisio de músculo liso son altamente específicos de ESG (celíacos o con DH)22–24. Su especificidad alcanza casi el 100% y su sensibilidad oscila entre el 50 y el 100% según las series9,11,20,22,23.
Todos estos autoanticuerpos son de subclase IgA1 (IgA antiendomisio, IgA anti-TGt e IgA anti-TGe) y disminuyen drásticamente con la dieta exenta en gluten. Son por tanto de gran utilidad, no solo en el diagnóstico sino también en el seguimiento de la adherencia a la dieta de estos pacientes19,21,23,25.
Recientemente se ha desarrollado un nuevo test que detecta anticuerpos contra péptidos deamidados de la gliadina26,27. Esta técnica, de uso todavía no rutinario, podría convertirse en breve plazo en la técnica serológica de elección en los pacientes con celiaquía o DH.
Aunque actualmente no se recomienda su determinación sistemática, se pueden detectar además anticuerpos antirreticulina y antigliadina. Los antirreticulina de clase IgA son altamente específicos22 y se encuentran en uno de cada cuatro pacientes con DH23, así como en enfermos con celiaquía; estos también disminuyen hasta desaparecer tras la instauración de la dieta sin gluten23. Tanto los antirreticulina de clase IgG como los antigliadina (IgA o IgG) son inespecíficos y aparecen frecuentemente en sujetos afectos de otras enfermedades ampollosas autoinmunes e incluso en sujetos sanos22,23.
En aquellos pacientes con sospecha clínica firme, en los que el estudio de estos autoanticuerpos de clase IgA es negativo, debemos solicitar una determinación de IgA total, puesto que esta situación puede deberse a un déficit selectivo de IgA. En estos casos, el diagnóstico serológico de sensibilidad al gluten se alcanza mediante la determinación de anticuerpos IgG antitransglutaminasa28,29.
Asociación con linfomas y otras enfermedades autoinmunesLa asociación de DH con el desarrollo de linfomas es controvertida. A diferencia de lo descrito en enfermos con celiaquía, donde la correlación entre la enteropatía con estas neoplasias hematológicas (sobretodo intestinales de tipo T) ha sido bien establecida30, la incidencia de linfomas —cualesquiera— en enfermos con DH es inferior al 2% en los diversos estudios disponibles9,31–34. Un estudio epidemiológico reciente con 846 pacientes con DH no ha logrado demostrar una mortalidad mayor ni tampoco un riesgo aumentado de fracturas, linfomas ni neoplasias gastrointestinales, con respecto a la población general35. Una de las explicaciones para estos hallazgos, aún no comprobada de forma definitiva, sería el menor grado de inflamación gastrointestinal de los pacientes con DH en comparación con los enfermos celíacos.
En cualquier caso y basándose en las series de pacientes con celiaquía36, es científicamente plausible pensar que la dieta exenta en gluten tiene un efecto protector sobre el desarrollo de linfomas también en los enfermos con DH31, dado el efecto curativo de la dieta sobre los fenómenos inflamatorios en el intestino.
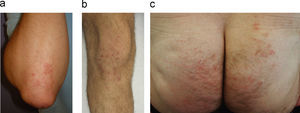
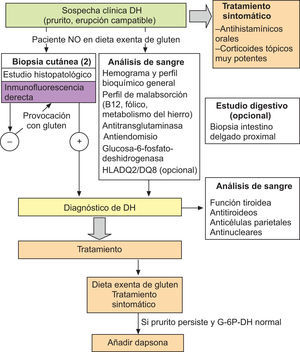
Es muy frecuente la asociación de la DH y la celiaquía con diversas enfermedades autoinmunes, entre las cuales destacan las tiroiditis, la diabetes mellitus y la anemia perniciosa11. La prevalencia de anticuerpos antitiroideos y anticélula parietal oscila alrededor del 20% de enfermos con patologías por sensibilidad al gluten. Por ello, se recomienda la determinación de estos autoanticuerpos, así como de los anticuerpos antinucleares, glucosa y función tiroidea, en todos los pacientes afectos de DH (fig. 4).
Diagnóstico diferencialSe realiza básicamente con la escabiosis, el eczema atópico, el eczema de contacto, y otras enfermedades ampollosas autoinmunes como la dermatosis IgA lineal y el penfigoide ampolloso.
En general, los hallazgos histopatológicos y de inmunofluorescencia directa suelen ser definitivos para llegar al diagnóstico de DH sin grandes dificultades.
Manejo terapéuticoLa DH se trata mediante dieta exenta en gluten y dapsona.
La dieta libre de gluten es el tratamiento de primera elección, imprescindible en cualquier enfermo con DH. Es eficaz en el tratamiento de las manifestaciones cutáneas —y digestivas, si las hubiera—, aunque la mejoría puede tardar en aparecer hasta 1–2 años tras la supresión de gluten de la ingesta11.
Los alimentos que contienen trigo, cebada o centeno están prohibidos, pero en cambio se permite la ingesta de arroz, maíz y avena37. Esta dieta debe mantenerse de por vida ya que la inmensa mayoría de pacientes con DH ven rebrotar la enfermedad al reintroducir el gluten en la dieta. Solo entre un 10 y un 20% de pacientes desarrollan tolerancia inmunológica y son capaces de seguir una dieta normal tras años de dieta exenta en gluten estricta (especialmente casos de debut infantil y/o tratados en algún momento con dapsona)14,38,39.
Los beneficios descritos de un buen cumplimiento a largo plazo de la dieta son los siguientes: sensación de bienestar general (de estar sano), reducción en las necesidades de medicación y el riesgo de linfomas intestinales, resolución de la erupción cutánea y de los síntomas y signos de enteropatía/malabsorción38.
La dapsona (Dapsone Fatol® 50mg comprimidos —solicitada como medicación extranjera— o en fórmula magistral: dapsona 50mg para una cápsula, n.o: 90) suprime eficazmente y en pocos días las manifestaciones cutáneas de la DH. Este fármaco se utiliza durante el período de tiempo que tarda la dieta en hacer efecto sobre la erupción cutánea11. La dapsona no es activa sobre la posible afectación intestinal, y tampoco se ha demostrado que disminuya el riesgo de desarrollo de linfoma. No tiene efectos curativos sobre la DH, y la erupción cutánea reaparece al suspender este fármaco. En el adulto, su administración debe comenzarse a dosis bajas de 50mg al día, que aumentaremos hasta 200mg según necesidad y tolerancia del paciente (dosis en niños: 1–2mg/kg/d). Previo al inicio, debemos solicitar niveles de glucosa-6-fosfato-deshidrogenasa, reticulocitos, hemograma y bioquímica general (perfil renal y hepático)40. Durante el tratamiento, debemos realizar controles regulares de hemograma, reticulocitos, biología renal y hepática40. La periodicidad ideal de estos controles sería: semanal-quincenal el primer mes, mensual hasta los 3 meses, y posteriormente cada 3–6 meses40.
Los efectos indeseables hematológicos (hemólisis y metahemoglobinemia) de la dapsona son dependientes de dosis, y son tolerables en cierto grado sin que sea siempre necesario suspender la medicación40,41 (tabla 2).
Contraindicaciones, interacciones clínicamente relevantes y efectos indeseables de la dapsona
| Contraindicaciones |
| Alergia a sulfonamidas, ácido paraaminobenzoico (PABA) |
| Porfirias agudas |
| Anemia o enfermedad cardiopulmonar graves |
| Déficit de glucosa-6-fosfato deshidrogenasa |
| Interacciones |
| Probenecid |
| Trimetoprim |
| Toxicidad dependiente de dosis |
| Hemólisis |
| Metahemoglobinemia |
| Toxicidad idiosincrática |
| Intolerancia digestiva |
| Reacciones de hipersensibilidad (urticaria, síndrome de DRESS) |
| Agranulocitosis |
| Hepatitis |
| Neuropatía (periférica, óptica) |
| Psicosis/ansiedad/depresión/letargia |
| Nefropatía/síndrome nefrótico |
| Disminución de la fertilidad |
| Síndrome de Stevens-Johnson/necrolisis epidérmica tóxica |
| Fotosensibilidad |
| Hipotiroidismo |
Los niveles de metahemoglobina deben solicitarse en caso de clínica sugestiva (mareos, disnea, fatiga o cefalea)40. Niveles de metahemoglobina por debajo del 20% no suelen acompañarse de síntomas y no precisan ningún cambio. Sin embargo, determinados enfermos pueden desarrollar clínica severa incluso con niveles bajos de metahemoglobina, en especial aquellos con enfermedades que comprometen el correcto aporte de oxígeno a los tejidos41. La dapsona debe suspenderse al alcanzar niveles superiores al 20%; a partir del 30%, debe considerarse el tratamiento con azul de metileno40.
La hemólisis es un fenómeno constante en los enfermos tratados con este fármaco, y en ciertos casos puede requerir una reducción de dosis. La solicitud de otros parámetros biológicos de hemólisis (bilirrubina, LDH, haptoglobina) está indicada en caso de clínica compatible y/o reducción significativa de los niveles de hemoglobina. La supresión total del medicamento estará indicada en los individuos que desarrollen una anemia hemolítica severa con repercusión clínica.
Algunos autores recomiendan la asociación de dapsona con vitamina E (800U/d)42 o cimetidina (1,2–1,6g/d)43 por vía oral para minimizar el riesgo de anemia hemolítica y metahemoglobinemia, respectivamente. Dividir la dosis diaria de dapsona en dos tomas reduce el pico de concentración sanguínea del fármaco, hecho que también podría reducir su toxicidad hematológica40.
Más raramente pueden aparecer otros efectos como reacciones de hipersensibilidad (1/100), agranulocitosis (<0,5×109neutrófilos/l), hepatitis, neuropatía periférica, psicosis, síndrome nefrótico y disminución de la fertilidad40 (tabla 2).
Las reacciones de hipersensibilidad son la complicación no hematológica más frecuente. Suelen aparecer a las 3–6 semanas del inicio del tratamiento, en forma de prurito, fiebre y dermatitis. En este caso, el fármaco debe ser retirado sin más dilación; casi todos los enfermos precisarán además tratamiento prolongado con glucocorticoides sistémicos, dada la vida media larga de la dapsona40.
Se calcula que la agranulocitosis puede aparecer entre 1/400 y 10.000 enfermos tratados40, suele aparecer en las primeras 12 semanas y es reversible en una semana tras suprimir la medicación. De producirse, el paciente puede desarrollar complicaciones infecciosas severas con compromiso vital41. Un cuadro febril puede ser el primer signo de infección, de modo que el enfermo debe estar informado de esta posibilidad y solicitar atención médica urgente en tal caso.
La administración de sulfona está contraindicada en pacientes con hipersensibilidad a este medicamento o relacionados (sulfonamidas, ácido paraaminobenzoico —PABA—), porfirias agudas, anemia grave y déficit de glucosa-6-fosfato-deshidrogenasa (tabla 2).
No se han descrito interacciones clínicamente significativas de la dapsona con otros medicamentos (ver ficha técnica). El uso simultáneo de probenecid o trimetoprim puede incrementar los niveles plasmáticos de dapsona, lo cual podría aumentar el riesgo de toxicidad hematológica40 (tabla 2).
Se incluye dentro del grupo C de la FDA para su uso en el embarazo, por lo que no se recomienda para el tratamiento de la DH en la gestación ni durante la lactancia40. Se permite su uso en niños, a las dosis citadas anteriormente40.
El uso de dapsona debe ser siempre complementario a la dieta libre de gluten, indicándose de forma temporal durante el tiempo que tarda la dieta en ser efectiva sobre la afectación cutánea (habitualmente entre 1 y 2 años), así como en aquellos pacientes que, por decisión propia, no cumplen las medidas dietéticas de forma estricta, y cuya sintomatología cutánea debemos controlar.
Finalmente, la prescripción de antihistamínicos orales y corticoides tópicos muy potentes (clobetasol propionato) son de relativa utilidad en el tratamiento sintomático. Los glucocorticoides sistémicos no están indicados en la DH.
Seguimiento a largo plazoUna vez controladas las manifestaciones y repercusiones orgánicas de la enfermedad, y ya sin dapsona, los pacientes con DH deben ser controlados anualmente, incluyendo:
- •
Anamnesis.
- •
Exploración física.
- •
Análisis de sangre (glucosa, perfil tiroideo, hemograma y bioquímica general, hierro, fólico y vitamina B12, anticuerpos antitiroideos, anticélula parietal, antinucleares, anti-TGt y antiendomisio).
La DH es una enfermedad que requiere una vigilancia constante de la dieta por parte del paciente. Los individuos afectos de esta enfermedad deben analizar cuidadosamente la composición de todos y cada uno de los alimentos que van a ingerir, hecho que supone un estrés psicológico notable, además de un gasto de tiempo y económico, considerables. En este sentido, el apoyo de un dietista resulta imprescindible.
El impacto social es también importante, en cuanto muchas actividades sociales de la vida diaria en nuestro medio se llevan a cabo en el contexto de comidas. Por ello, el paciente debe ser informado y mentalizado de las restricciones sociales que la enfermedad puede conllevar, con el fin de afrontarlas y adaptarse de la mejor manera posible desde el primer momento.
Por último, existen diversas asociaciones y webs en castellano (entre ellas: www.celiacos.org, www.celiacscatalunya.org/cas/index.php) para enfermos con celiaquía y/o DH que facilitan el acceso a información de interés (marcas de alimentos permitidos y prohibidos, recetas, establecimientos de compra y restauración, actividades, información para comedores escolares, ayudas económicas, etc.). El papel de estas entidades es fundamental para potenciar la adherencia de los pacientes a la dieta, por lo que es altamente recomendable que los facultativos informemos a nuestros enfermos con DH de la existencia de estos recursos desde el momento del diagnóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido elaborado con apoyo económico del Fondo de Investigación Sanitaria, Instituto de Salud Carlos III - FEDER (PI-06/1548, a Josep E. Herrero) y del IMIM (Ayudas de Intensificación, IMIM-Hospital del Mar).