INTRODUCCION
La sarcoidosis es una enfermedad multisistémica caracterizada por la formación de granulomas epitelioides no caseificantes en distintos órganos y tejidos1. Aproximadamente el 25 % de los pacientes con sarcoidosis desarrollan lesiones cutáneas, por lo general en los estadios iniciales2 y en ocasiones como única forma de manifestación de la enfermedad3. Estas lesiones cutáneas pueden ser específicas, es decir, secundarias a la infiltración de la piel por granulomas, dando lugar a formas clínicas muy diversas4, o bien reactivas como por ejemplo el eritema nudoso5. El diagnóstico de sarcoidosis se establece cuando se excluyen otras enfermedades granulomatosas y a los datos clínicos y/o radiológicos se suma el hallazgo histológico de granulomas sarcoideos en uno o más tejidos o bien una prueba de Kveim positiva6.
Aunque su causa permanece desconocida, se han implicado varios factores en su etiopatogenia. Parece que cuando un antígeno específico actúa sobre un individuo genéticamente predispuesto, se desencadena una respuesta aberrante de la inmunidad celular. Los macrófagos presentan el antígeno a los linfocitos T helper CD4 tipo 1 (Th1) y estos linfocitos se activan y liberan interferón γ(IFN-γ), interleuci-na-2 y otras citocinas. Como consecuencia de ello se produce una proliferación clonal de linfocitos y macrófagos, un reclutamiento de los linfocitos y monocitos circulantes en los tejidos y una diferenciación de los macrófagos en células epitelioides, que dan lugar a la formación de los granulomas7. Entre los antígenos ambientales que se han postulado como posibles desencadenantes de esta respuesta inmunitaria se encuentran fundamentalmente los agentes infecciosos y los cuerpos extraños.
En el caso clínico que presentamos a continuación se imbrican varios de los factores que se involucran en la formación de los granulomas sarcoideos, como son las alteraciones inmunológicas, inducidas en nuestro caso por el tratamiento con interferón alfa (IFN-α) y ribavirina, los cuerpos extraños y los agentes infecciosos.
DESCRIPCION DEL CASO
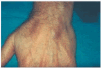
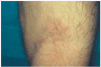
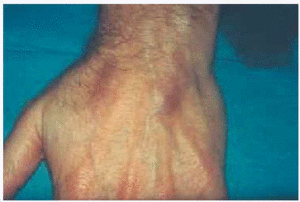
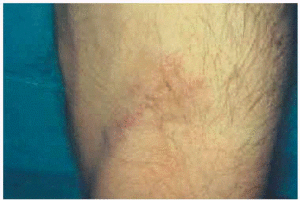
Un varón de 46 años de edad, carpintero, fumador de aproximadamente 30 paquetes/año, había padecido tuberculosis pulmonar en la juventud y presentaba actualmente una hepatitis C crónica activa para la cual recibía tratamiento con IFN-α2b pegilado (una inyección subcutánea de 1,5 μg/kg a la semana) y ribavirina (1 g/día) desde hacía aproximadamente 4 meses. El paciente había sido adicto a drogas por vía parenteral, hábito que según refería había abandonado hacía ya más de 10 años. Fue enviado a nuestra consulta procedente del Servicio de Gastroenterología por referir la aparición progresiva, desde hacía 15 días, de unas lesiones cutáneas discretamente dolorosas localizadas en ambos antebrazos, acompañadas de una llamativa astenia, pero sin otros síntomas generales asociados. En la exploración dermatológica se podían palpar varios nódulos de 2-3 cm de diámetro, bien delimitados y con una superficie discretamente eritematosa localizados en el dorso de las muñecas y en la superficie de extensión de los antebrazos. Llamaba la atención que los nódulos seguían una distribución que coincidía con el trayecto de las venas (fig. 1) y que en su superficie se observaba una pequeña cicatriz deprimida que se correspondía con los antiguos pinchazos para la inyección parenteral de las drogas (fig. 2). No existían lesiones cutáneas en otras partes del tegumento y tampoco se palpaban adenopatías en ninguna de las cadenas ganglionares.
Fig. 1.--Nódulos en el dorso de la mano coincidiendo con el trayecto de las venas.
Fig. 2.--Pequeñas cicatrices en la superficie de uno de los nódulos en la flexura antecubital.
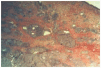
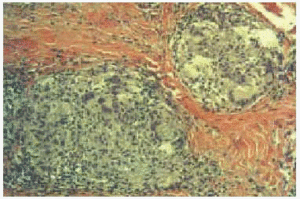
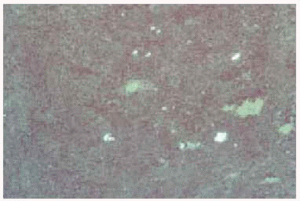
Se realizó biopsia de uno de los nódulos y el estudio histopatológico mostró, bajo una epidermis normal, la presencia en la dermis media y profunda y tejido celular subcutáneo de numerosos granulomas epitelioides no caseificantes con escaso infiltrado linfocitario en la periferia (fig. 3). Estos granulomas estaban constituidos por células epitelioides y células gigantes multinucleadas tipo Langhans y cuerpo extraño (fig. 4), muchas de ellas dispuestas alrededor de un material que resultó ser birrefringente cuando se visualizó con el microscopio de luz polarizada (fig. 5). Mediante la técnica de la reacción en cadena de la polimerasa (PCR) en el material de la biopsia se detectó genoma de Mycobacterium tuberculosis en las lesiones cutáneas; sin embargo, la tinción de Ziehl-Neelsen y los cultivos, tanto para micobacterias como para hongos, fueron negativos.
Fig. 3.--Múltiples granulomas epitelioides no caseificantes en dermis media y profunda (hematoxilina-eosina, x50).
Fig. 4.--Células gigantes multinucleadas de cuerpo extraño y tipo Langhans alrededor de partículas de material extraño (hematoxilina-eosina, x400).
Fig. 5.--Partículas birrefringentes (microscopio de luz polarizada, x200).
Dentro de los estudios complementarios realizados destacaba una discreta leucopenia (leucocitos 2.760/μl) atribuible al tratamiento con IFN-α. El estudio de coagulación, el proteinograma, las pruebas de función hepática y renal y el calcio en sangre y en orina estaban dentro de los límites de la normalidad. La enzima conversora de la angiotensina en sangre estaba algo elevada (83 U/l; normal, 8-52). En los estudios radiológicos realizados (radiografía de tórax y tomografía computarizada [TC] pulmonar) no se encontraron hallazgos patológicos. La exploración oftalmológica y el electrocardiograma fueron rigurosamente normales.
Con el diagnóstico de granulomas sarcoideos cutáneos con ausencia de afectación sistémica, desarrollados alrededor de cuerpos extraños e inducidos por el tratamiento con IFN-α y ribavirina, se procedió a suspender este tratamiento. Al cabo de varias semanas las lesiones cutáneas regresaron por completo y se normalizó la cifra de leucocitos.
DISCUSION
Los interferones son citocinas que actúan activando la respuesta inmunitaria mediada por linfocitos Th1 y se usan para el tratamiento de distintas enfermedades por sus propiedades antivirales, antiproliferativas e inmunomoduladoras. El tratamiento con IFN-α en pacientes con hepatitis crónica por el virus de la hepatitis C (VHC) puede producir distintos tipos de reacciones adversas cutáneas, las cuales son más frecuentes aún cuando se administra combinado con la ribavirina8. Entre otras, puede producir eritema y necrosis en el lugar de la inyección, xerosis, prurito, eccemas, erupciones liquenoides, acné, alopecia transitoria, alteraciones ungueales, fotosensibilidad e, incluso, necrólisis epidérmica tóxica9,10. Además, el tratamiento con IFN-α y la infección crónica por el VHC se han implicado en el desarrollo y exacerbación de distintas enfermedades de base autoinmune11, como hipertiroidismo e hipotiroidismo, púrpura tombocitopénica, anemia hemolítica, lupus eritematoso sistémico, artritis reumatoide, enfermedad de Behçet, psoriasis, y sarcoidosis. Desde la primera descripción por Abdi et al12 de una sarcoidosis pulmonar inducida por el interferón β (IFN-β) en un paciente con carcinoma renal, cada vez son más los casos publicados de esta enfermedad desencadenados o agravados por este tratamiento. Probablemente la activación de los linfocitos T helper, provocada por el IFN-α y potenciada por su combinación con la ribavirina, sea la que induzca la formación de granulomas en individuos genéticamente predispuestos. Las formas de presentación más frecuentes son la pulmonar y la cutánea, que aparece hasta en el 50 % de los casos en sus distintas formas clínicas (como placas, nódulos o infiltración de cicatrices), aunque también pueden verse afectados otros órganos y tejidos como corazón, hígado y otros13. El tiempo medio de aparición entre el inicio del tratamiento y la aparición de la enfermedad varía entre las 2 semanas y los 49 meses14 y es característico su buen pronóstico, con tendencia espontánea a la resolución tras suspender éste o reducir la frecuencia de su administración, tal y como ha sucedido en nuestro paciente.
En lo que se refiere al hallazgo de cuerpos extraños en los granulomas sarcoideos, es bien conocida la tendencia de la sarcoidosis a afectar zonas donde previamente ha habido una lesión cutánea, como las cicatrices o los tatuajes15,16. Parece que en esta enfermedad la capacidad del sistema inmunitario para eliminar partículas de material extraño, muchas veces inaparentes o no detectables, está alterada y éstas actuarían como un estímulo o «foco de atracción» para la formación de los granulomas en individuos predispuestos. Así pues, hoy ya no se acepta la teoría tradicional en la que la demostración de cuerpos extraños en las lesiones granulomatosas cutáneas excluía el diagnóstico de sarcoidosis17,18. Marcoval et al18 identificaron cuerpos extraños en las lesiones granulomatosas cutáneas en 14 de 65 pacientes (22 %) con sarcoidosis sistémica. Las formas cutáneas más frecuentes en su estudio fueron la sarcoidosis papulosa de las rodillas, la subcutánea y la sarcoidosis de las cicatrices. Existe un caso muy similar al nuestro en la bibliografía inglesa, descrito por Eberlein-König et al, en el que, 4 meses después de haber iniciado tratamiento con IFN-α2a en un paciente con hepatitis crónica C, aparecieron granulomas sarcoideos alrededor de cuerpos extraños en zonas de piel previamente dañadas por un traumatismo. En el caso que hemos presentado, la presencia de los cuerpos extraños encontrados en la biopsia de las lesiones cutáneas se relacionó con la antigua adicción del paciente a drogas parenterales contaminadas.
Por último, es interesante recordar que varios estudios han intentado involucrar a distintos microorganismos, como Propionibacterium spp.19 y herpes virus tipo 820, pero fundamentalmente a las micobacterias (Mycobacterium avium y complex) en la patogenia de la sarcoidosis. Varios autores han detectado mediante PCR, al igual que en nuestro paciente, ADN de M. avium y de M. tuberculosis tanto en las lesiones cutáneas21 como en otros tejidos de pacientes diagnosticados de sarcoidosis, llegando hasta el 71,7 % de los casos en un estudio reciente22. Se postula que, al igual que sucede con los cuerpos extraños, la formación de los granulomas sarcoideos podría ser el resultado de una respuesta inmunitaria de hipersensibilidad retardada iniciada frente a los antígenos de las micobacterias. Otros autores, sin embargo, no han conseguido identificar micobacterias en las lesiones tisulares de los pacientes con sarcoidosis23, y se apoyan además en otros datos adicionales para discutir este papel de los agentes infecciosos en la patogenia de esta enfermedad. Así, la técnica de la PCR no distingue entre microorganismos vivos o muertos y es una técnica fácilmente contaminable; por otra parte, no se ha conseguido el crecimiento de micobacterias tras el cultivo de los tejidos afectados por la sarcoidosis; y finalmente ni la vacunación frente a la micobacteria ha conseguido disminuir la incidencia de esta enfermedad ni el tratamiento antituberculoso es efectivo para su curación25,26. Así pues, no existen aún datos concluyentes al respecto y serán precisos más estudios estandarizados para poder aclarar este hecho.
Por tanto, y como conclusión, el caso presentado ha servido para hacer unas consideraciones generales sobre la etiopatogenia todavía tan poco aclarada y probablemente multifactorial de la sarcoidosis. Es importante recordar la posible aparición de esta enfermedad durante el tratamiento cada vez más utilizado con IFN-α y ribavirina, y que todos los pacientes en los que se encuentren granulomas sarcoideos cutáneos, incluso en presencia de partículas de material extraño, deben ser evaluados para descartar una afectación sistémica. Además, por las razones anteriormente expuestas, el hallazgo de ADN de micobacterias en las biopsias cutáneas debe ser interpretado con cautela y siempre de forma individualizada en el contexto de la enfermedad.