La hiperhidrosis (HH) es una condición muy prevalente que supone una repercusión importante en la calidad de vida. Entre las opciones terapéuticas disponibles, la oxibutinina oral consigue buenas tasas de respuesta aunque con frecuentes efectos secundarios que condicionan en muchas ocasiones el abandono del tratamiento. Tras la comercialización en nuestro país de la oxibutinina en presentación transdérmica, realizamos un estudio preliminar para valorar el control de la HH y el perfil de efectos secundarios de este tratamiento.
Material y métodosSe realizó un estudio prospectivo con 25 pacientes que recibieron tratamiento con 2 parches semanales de oxibutinina transdérmica durante 10 semanas. La respuesta terapéutica se valoró mediante 2 escalas subjetivas: Hyperhidrosis Disease Severity Scale (HDSS) y escala analógica visual (EAV).
ResultadosUn 60% de los pacientes consiguieron una reducción en la puntuación de la HDSS. Todos los casos obtuvieron una disminución en la puntuación de la EAV, siendo esta de 3 puntos o superior en el 68% de los pacientes. Solo 2 pacientes (8%) presentaron efectos adversos relacionados con el tratamiento, en ambos casos en forma de dermatitis irritativa en la zona de aplicación del parche.
ConclusionesAunque se trata de una experiencia limitada, los resultados de nuestro estudio sugieren que la oxibutinina transdérmica podría tener utilidad en el manejo de la HH, con un excelente perfil de seguridad y tolerancia.
Hyperhidrosis is very common and has a considerable impact on patients’ quality of life. While oral oxybutynin is associated with good response rates, adverse effects are common and frequently cause patients to stop treatment. Following the recent launch of oxybutynin in a transdermal patch formulation in Spain, we undertook a preliminary study to assess treatment response and adverse effects in patients with hyperhidrosis.
Material and methodsThis prospective study of 25 patients treated twice weekly with transdermal oxybutynin patches over 10 weeks assessed treatment response on 2 subjective scales: the Hyperhidrosis Disease Severity Scale (HDSS) and a visual analog scale (VAS) for sweating.
ResultsSixty percent of patients showed an improvement in HDSS scores. VAS scores improved in all cases, and 68% of patients achieved a reduction of 3 points or more. Just 2 patients (8%) experienced treatment-related adverse effects (irritant dermatitis at the patch application site in both cases).
ConclusionsAlthough our results are based on a small sample, they suggest that transdermal oxybutynin could be a useful option for the treatment of hyperhidrosis and that it has an excellent safety and tolerability profile.
La hiperhidrosis (HH) es una entidad en la que se produce una sudoración superior a la necesaria para una adecuada termorregulación. Se distinguen 2 tipos de HH: primaria y secundaria. En la HH primaria (HHP) no existe patología subyacente que justifique el exceso de sudoración, mientras que en la forma secundaria la hipersudoración es atribuible a diferentes situaciones (alteraciones endocrinológicas, neurológicas, neoplásicas, tratamientos farmacológicos, etc.)1.
La HHP se define por la presencia de sudoración excesiva de al menos 6 meses de duración sin causa justificable (criterio mayor) y 2 o más de los siguientes criterios menores: 1)distribución bilateral y simétrica; 2)al menos un episodio de hipersudoración a la semana; 3)interferencia con las actividades diarias; 4)cese de la sudoración durante el sueño; 5)inicio del cuadro antes de los 25años de edad, y 6)antecedentes familiares de HHP2. Las localizaciones más frecuentemente implicadas son axilas y palmas, seguidas de plantas y región facial. Con cierta frecuencia la HHP afecta a varias localizaciones en un mismo paciente (multifocal) e incluso puede ser generalizada3.
Se estima que la HHP afecta aproximadamente a un 2-3% de la población, y aunque no se trata de una patología grave, su repercusión en la calidad de vida de los pacientes es muy significativa, equiparándose en escalas de calidad de vida a patologías mucho más graves como la diabetes4.
Existen múltiples opciones terapéuticas en el manejo de la HHP: tratamientos farmacológicos (tópicos y sistémicos), procedimientos intervencionistas no quirúrgicos (iontoforesis, toxina botulínica, etc.) y tratamientos quirúrgicos (simpatectomía selectiva, cirugía escisional)5.
La oxibutinina es un fármaco anticolinérgico cuya eficacia en el control de la HHP ha sido documentada en múltiples estudios, aunque su uso en esta enfermedad se realiza fuera de ficha técnica6-9. Es importante señalar que ninguno de los tratamientos sistémicos empleados en la HHP tiene actualmente indicación aprobada para esta patología en nuestro país. A pesar de la buena respuesta de la HH al tratamiento con oxibutinina oral, con frecuencia se producen efectos secundarios (principalmente xerosis orofaríngea) que resultan incómodos para el paciente y pueden conducir al abandono del tratamiento.
En 2014 se comercializó en España una presentación transdérmica de la oxibutinina con indicación en ficha técnica de tratamiento de vejiga inestable (al igual que la oxibutinina oral). Este modo de administración evita el primer paso de metabolismo hepático y con ello disminuye teóricamente los efectos secundarios, así como las posibles interacciones medicamentosas10.
Con la hipótesis de lograr una mejoría de la HHP minimizando los efectos adversos que encontramos con la oxibutinina oral, planteamos un estudio preliminar en el que empleamos la oxibutinina transdérmica en pacientes con HHP. El objetivo primario de este trabajo fue valorar la efectividad del tratamiento; el objetivo secundario fue describir el perfil de tolerancia.
Material y métodosRealizamos un estudio prospectivo desde febrero hasta septiembre de 2015 en el que se incluyeron 25 pacientes con HHP que no habían conseguido un control adecuado con tratamientos tópicos. Fueron excluidos del estudio los casos que habían realizado terapia con toxina botulínica en los 2años previos o algún tratamiento quirúrgico para la HHP (simpatectomía selectiva, cirugía escisional). Todos los pacientes fueron informados de forma exhaustiva sobre la oxibutinina transdérmica y otras alternativas terapéuticas, así como de las condiciones del estudio, dando su consentimiento por escrito. La cuantificación de la efectividad del tratamiento se realizó mediante 2 escalas subjetivas: una escala analógica visual (EAV), en la que se valoró de 1 a 10 el grado de sudoración (siendo 10 el grado máximo de sudoración y 0 el grado mínimo), y la escala validada Hyperhidrosis Disease Severity Scale (HDSS)11 (tabla 1).
Hyperhidrosis Disease Severity Scale (traducción al castellano). «¿Cómo calificaría la intensidad de su hiperhidrosis?»
| Puntuación | Respuesta del paciente |
|---|---|
| 1 | Mi sudoración nunca es perceptible y nunca interfiere con mis actividades diarias |
| 2 | Mi sudoración es tolerable pero en ocasiones interfiere con mis actividades diarias |
| 3 | Mi sudoración apenas es tolerable y con frecuencia interfiere con mis actividades diarias |
| 4 | Mi sudoración es intolerable y siempre interfiere con mis actividades diarias |
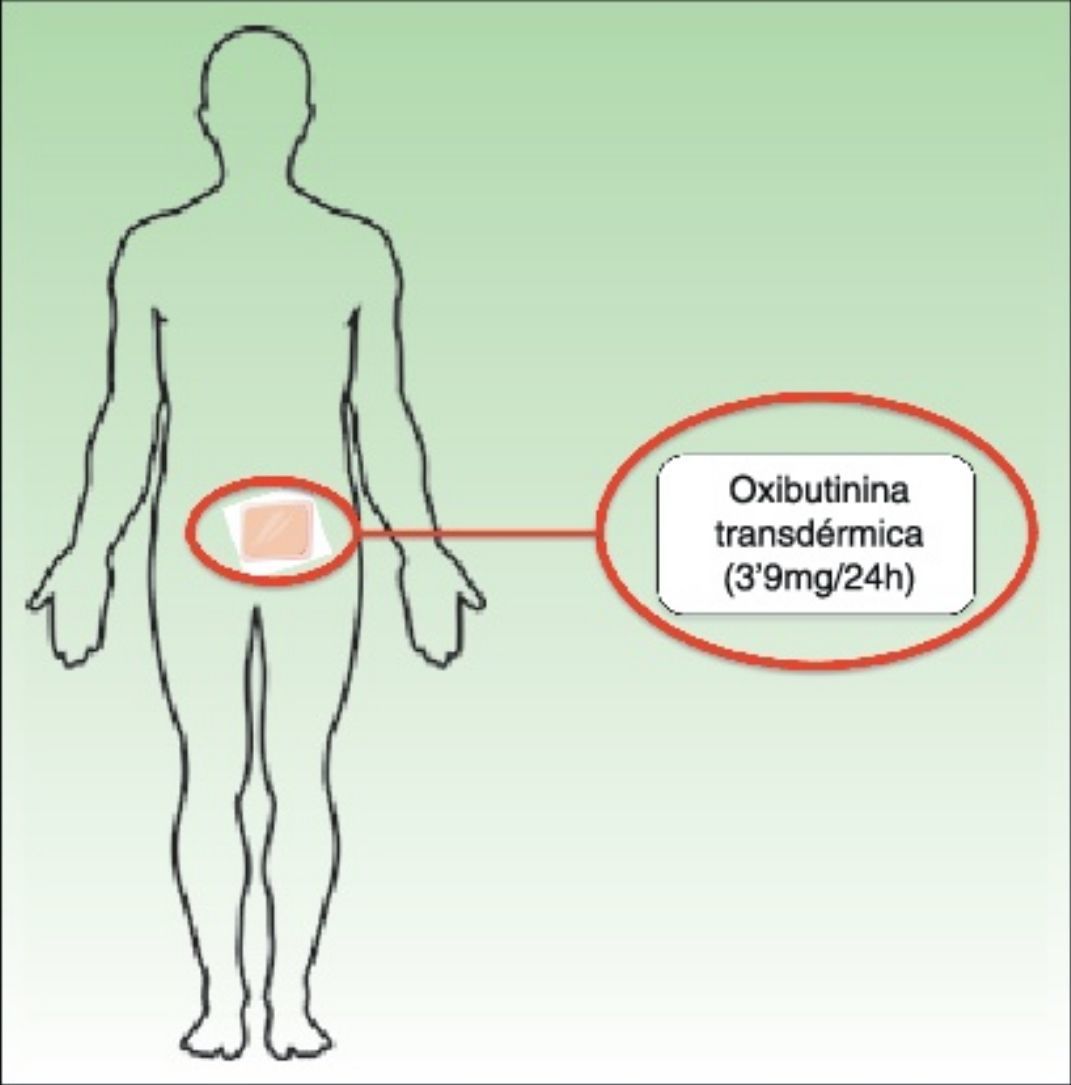
Durante 10 semanas se realizó tratamiento con oxibutinina transdérmica (Kentera. Lab. Gebro Pharma, España), empleando 2 parches semanales de 36mg cada uno, aplicados de forma rotatoria en piel de muslos, caderas y abdomen. Se decidió este intervalo de tiempo de observación dado que en estudios realizados con oxibutinina oral en HHP a largo plazo, la falta de respuesta tras 6 semanas de tratamiento se considera fracaso terapéutico6.
El estudio se diseñó en 3 visitas. En la visita inicial (visita1), tras informar al paciente y obtener el consentimiento informado, se realizó una valoración basal de la HH mediante las escalas HDSS y EAV, y se inició el tratamiento según la pauta descrita. La visita 2 se realizó 6 semanas tras el inicio del tratamiento y la visita 3 a las 10 semanas, manteniéndose el tratamiento hasta esta última. Tanto en la visita 2 como en la visita 3 se realizaron valoraciones mediante HDSS y EAV, así como una recogida de los efectos secundarios presentados. En la visita final (visita3), cada paciente realizó una valoración global del control de su enfermedad con el tratamiento como «sin mejoría», «mejoría discreta no significativa» o «mejoría significativa».
Las características demográficas de los pacientes incluidos y la localización de la HHP se recogen en la tabla 2.
Características demográficas y descripción de resultados
| Paciente | Edad | Zona | Tratamientos previos | EAV semana 0 | EAV semana 10 | Mejoría EAV | HDSS semana 0 | HDSS semana 10 | Mejoría HDSS | Efectos adversos |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 21 | Axilas | Sales aluminio | 7 | 4 | 3 | 3 | 2 | 1 | No |
| 2 | 19 | Palmas | Sales aluminio Iontoforesis | 6 | 4 | 2 | 2 | 2 | 0 | No |
| 3 | 26 | Palmas Plantas | Sales aluminio | 8 | 4 | 4 | 4 | 2 | 2 | No |
| 4 | 37 | Cefálica | Sales aluminio | 6 | 3 | 3 | 3 | 2 | 1 | No |
| 5 | 24 | Axilas Palmas | Sales aluminio | 7 | 4 | 3 | 3 | 2 | 1 | No |
| 6 | 21 | Axilas | Sales aluminio | 6 | 5 | 1 | 3 | 3 | 0 | No |
| 7 | 18 | Axilas | Sales aluminio | 8 | 5 | 3 | 4 | 3 | 1 | No |
| 8 | 38 | Cefálica | Sales aluminio | 7 | 3 | 4 | 3 | 1 | 2 | No |
| 9 | 31 | Axilas Palmas | Sales aluminio Iontoforesis | 6 | 3 | 3 | 2 | 2 | 0 | No |
| 10 | 28 | Axilas Palmas | Sales aluminio | 6 | 3 | 3 | 3 | 2 | 1 | No |
| 11 | 24 | Axilas | Sales aluminio | 7 | 3 | 4 | 3 | 1 | 2 | No |
| 12 | 32 | Palmas Plantas | Sales aluminio Iontoforesis | 7 | 4 | 3 | 3 | 3 | 0 | No |
| 13 | 26 | Axilas | Sales aluminio Toxina botulínica | 6 | 2 | 4 | 3 | 2 | 1 | No |
| 14 | 23 | Cefálica | Sales aluminio | 8 | 6 | 2 | 3 | 3 | 0 | No |
| 15 | 29 | Axilas | Sales aluminio | 7 | 5 | 2 | 3 | 3 | 0 | No |
| 16 | 24 | Axilas | Sales aluminio Toxina botulínica | 8 | 4 | 4 | 4 | 2 | 2 | No |
| 17 | 40 | Palmas | Sales aluminio Iontoforesis | 7 | 4 | 3 | 3 | 2 | 1 | Sí: eccema leve |
| 18 | 21 | Axilas | Sales aluminio | 8 | 7 | 1 | 4 | 4 | 0 | No |
| 19 | 34 | Cefálica | Sales aluminio | 8 | 5 | 3 | 4 | 3 | 1 | No |
| 20 | 28 | Palmas Plantas | Sales aluminio Iontoforesis | 8 | 6 | 2 | 3 | 3 | 0 | No |
| 21 | 24 | Axilas | Sales aluminio | 9 | 5 | 4 | 4 | 2 | 2 | No |
| 22 | 33 | Palmas | Sales aluminio | 8 | 5 | 3 | 3 | 2 | 1 | Sí: eccema moderado |
| 23 | 24 | Palmas Plantas | Sales aluminio Iontoforesis | 7 | 5 | 2 | 3 | 3 | 0 | No |
| 24 | 33 | Axilas | Sales aluminio Toxina botulínica | 7 | 6 | 1 | 3 | 3 | 0 | No |
| 25 | 42 | Axilas | Sales aluminio Toxina botulínica | 8 | 3 | 5 | 4 | 1 | 3 | No |
EAV: escala analógica visual; HDSS: Hyperhidrosis Disease Severity Scale.
Se incluyeron un total de 25 pacientes (16 mujeres y 9 hombres), con una edad media de 28años (18-42). Todos ellos habían recibido previamente algún tratamiento para la HH (tabla 2).
Las valoraciones del control de los síntomas realizadas mediante EAV y HDSS tras 10 semanas de tratamiento se recogen en la tabla 2. En ningún paciente se produjo empeoramiento de los síntomas durante el estudio.
Todos nuestros pacientes presentaron una disminución en la puntuación en la EAV: esta fue de 1 punto en 3 pacientes, de 2 puntos en 5 pacientes, de 3 puntos en 10 pacientes, de 4 puntos en 6 pacientes y de 5 puntos en 1 paciente.
En cuanto a la escala HDSS, se consiguió una disminución de 3 puntos en 1 paciente, de 2 puntos en 5 pacientes y de 1 punto en 9 pacientes; en 10 pacientes no se modificó la valoración en la HDSS tras el tratamiento.
No existieron variaciones en estas escalas entre las semanas 6 (visita2) y 10 (visita3).
Respecto a la valoración global del tratamiento recogida en la visita 3, ningún paciente definió la respuesta como «sin mejoría»; 8 pacientes (32%) consideraron haber presentado una «mejoría discreta no significativa» y 17 pacientes (68%) valoraron la respuesta al tratamiento como «mejoría significativa».
Se describieron efectos secundarios en 2 pacientes (8%). En ambos casos, el efecto adverso desarrollado fue irritación local en la zona de aplicación del parche, que se cuantificó como leve (eritema y descamación) en el paciente 17 y moderada (eritema, edema y descamación) en el paciente 22. En ninguno de los 2 casos este efecto colateral provocó el abandono del tratamiento, ya que se controló con la modificación de la zona de aplicación del fármaco en el paciente 17 y con la aplicación de corticoides tópicos de baja potencia en el paciente 22.
DiscusiónLa sudoración tiene como función fundamental la regulación de la temperatura en respuesta a diferentes estímulos, como el calor o el ejercicio. Las glándulas sudoríparas son activadas por el sistema nervioso simpático: las señales termorreguladoras emitidas desde el hipotálamo se transmiten mediante las terminaciones nerviosas pre y posganglionares simpáticas hasta la glándula sudorípara. El principal neurotransmisor implicado es la acetilcolina, que ejerce su acción a través de receptores nicotínicos (fibras pre y posganglionares) y muscarínicos (glándula sudorípara). La HHP es consecuencia de una disfunción autonómica neuronal, sin que se hayan objetivado alteraciones ni morfológicas ni cuantitativas en las glándulas sudoríparas5.
Actualmente no existe un algoritmo terapéutico consensuado en el manejo de la HHP, y en cada caso debemos decidir la opción más adecuada. Para ello, debemos tener en cuenta las características del paciente y de la enfermedad, el perfil de seguridad de los diferentes tratamientos, los recursos disponibles y su coste, comenzando por los tratamientos más económicos y/o con menos efectos secundarios potenciales. En consecuencia, se aceptan como primera línea de tratamiento los productos tópicos que actúan de forma directa sobre la glándula sudorípara, fundamentalmente las sales de aluminio12.
También de forma tópica, se han empleado algunos anticolinérgicos, principalmente glicopirrolato13-16. Este principio activo no está actualmente comercializado en nuestro país, aunque se puede conseguir como medicación extranjera. El glicopirrolato se ha utilizado a diferentes concentraciones (0,5-4%) y vehículos (solución, gel y crema) con resultados variables en función de la localización de la HHP y de la concentración del principio activo17. Cuando se ha empleado en zonas amplias, se han descrito efectos secundarios atribuibles a la absorción sistémica del fármaco18.
La oxibutinina está comercializada en formulación tópica (gel) en otros países para tratamiento de alteraciones vesicales, pero no existen referencias en la literatura científica sobre el uso de esta presentación en el manejo de la HHP.
Entre las opciones terapéuticas sistémicas los anticolinérgicos son los fármacos que han conseguido mejores resultados. Existe experiencia documentada con oxibutinina, glicopirrolato y bromuro de metantelina por vía oral. De todos ellos, la oxibutinina es el principio activo con el que más estudios se han realizado10,11,13,14.
La oxibutinina oral es metabolizada en el hígado por la isoenzima CYP3A4 del citocromo P450, por lo que puede presentar interacciones medicamentosas con otros fármacos que inhiban este sistema (antifúngicos azólicos, macrólidos, etc.). Su principal limitación en el tratamiento de la HHP es la frecuencia de efectos secundarios que, si bien no suelen ser graves, son molestos para el paciente y pueden llegar a provocar el abandono del tratamiento. El efecto adverso más habitual es la xerosis orofaríngea, seguido de alteraciones gastrointestinales, cefalea, mareo y visión borrosa19.
La oxibutinina transdérmica (Kentera. Lab. Gebro Pharma, España) se presenta en parches con una superficie de 39cm2 que contienen 36mg de oxibutinina, liberando una cantidad nominal de 3,9mg de principio activo cada 24h. La posología recomendada en ficha técnica son 2 parches semanales que se deben aplicar de forma rotatoria en piel de muslo, abdomen o cadera.
Los resultados de nuestro estudio reflejan una mejoría de los síntomas de la HHP durante el tratamiento con oxibutinina transdérmica en un porcentaje aceptable de los pacientes, con una tasa muy baja de efectos adversos.
A la hora de valorar la intensidad de los síntomas en la HHP, las escalas de medida subjetivas se consideran más apropiadas que los métodos objetivos, dado que la repercusión sobre la calidad de vida no solo depende de la gravedad «cuantitativa» de la HH, sino también de la adaptación de cada paciente a ella20. La HDSS es un método validado en lengua inglesa (no en castellano) en el que se otorga una puntuación de 1 a 4 según la intensidad de la sudoración y su interferencia con las actividades diarias. Sin embargo, debido a que es una escala de solo 4 puntos, puede ser poco sensible para detectar modificaciones discretas y, por tanto, puede no reflejar ciertas variaciones en la sintomatología21. En el estudio de Solish et al. se estimó que una mejoría en 1 punto en la escala HDSS correspondería aproximadamente a un 50% de reducción en la sudoración, y que una disminución de 2 puntos equivaldría a un 80% de disminución11. Por esta razón, decidimos emplear de forma concomitante una EAV en la que el paciente valorase de 1 a 10 la intensidad de su HH (1: grado mínimo, 10: grado máximo), con el fin de poder matizar de forma más precisa el grado de mejoría que pudiera presentar y aumentar de esta manera la sensibilidad en la valoración de la respuesta al tratamiento. Al analizar los resultados de nuestro estudio apreciamos que pacientes que no modificaron su puntuación en la HDSS sí señalaron una mejoría en la EAV, lo que es concordante con la estimación de que disminuciones en la sudoración de hasta el 50% no se verán reflejadas en la HDSS.
Un 60% de nuestros pacientes consiguieron disminuir la puntuación en la HDSS durante el tratamiento: 60% en 1 punto, 33,3% en 2 puntos y 6,6% en 3 puntos. Schollhammer et al.20, en un estudio prospectivo frente a placebo realizado con 62 pacientes con HPP tratados con oxibutinina oral a dosis de 7,5mg/24h, obtuvieron una mejoría en la escala HDSS del 60% (28% 1 punto; 61% 2 puntos; 11% 3 puntos). Se describieron efectos secundarios en un porcentaje importante de los casos: boca seca (43%), visión borrosa (13%), alteraciones gastrointestinales (9%), cefalea (3%), astenia (3%) y dificultad urinaria (3%). Nuestros pacientes tratados con oxibutinina transdérmica, si bien no alcanzaron unas tasas de mejoría tan elevadas como las descritas con la forma oral, presentaron un mejor perfil de efectos secundarios, con solo un 8% de efectos adversos en forma de dermatitis irritativa de contacto leve-moderada.
Debemos tener en cuenta que las dosis empleadas habitualmente para el tratamiento de la HHP con oxibutinina oral descritas en la literatura oscilan entre 2,5 y 10mg diarios19. En el caso de la oxibutinina transdérmica la dosis liberada se estima en 3,9mg diarios, lo cual estaría dentro del rango adecuado aunque equivaldría a dosis bajas. Esta baja dosificación podría condicionar una menor respuesta de la hipersudoración en comparación con los estudios realizados con dosis mayores de oxibutinina oral, pero aun así nuestros datos apuntan hacia una eficacia aceptable con la «baja dosis» liberada en los parches transdérmicos. Existen estudios publicados en el manejo de la vejiga inestable que emplean mayores dosis del fármaco (un parche diario o 2-3 parches aplicados de manera simultánea con 2 recambios semanales), consiguiendo un mejor control de los síntomas y manteniendo un buen perfil de seguridad22,23. Si extrapolamos esos datos, se podría plantear el aumento de dosis del fármaco en aquellos casos de HHP que no se controlasen con dosis inferiores, aunque es probable que esta intensificación del tratamiento aumentase también la incidencia de efectos secundarios.
Desde el punto de vista económico, las sales de aluminio, de las que existen diferentes presentaciones comerciales, suponen un gasto mensual aproximado de 12-18€ y no están financiadas por nuestro Sistema Nacional de Salud. El coste del tratamiento mensual con oxibutinina transdérmica supone 40,59€, frente a los 4,4€ de la oxibutinina oral (a dosis de 10mg/día), estando ambas presentaciones financiadas, aunque con otras indicaciones.
Las limitaciones fundamentales de este estudio son el número de casos incluidos, así como la falta de un grupo control con el que comparar los resultados del tratamiento.
Tras una revisión bibliográfica exhaustiva, no hemos encontrado otros casos reportados en la literatura científica sobre tratamiento con oxibutinina transdérmica en HHP.
Aunque se trata de una experiencia muy limitada y se precisan estudios más amplios controlados frente a placebo que confirmen o refuten los datos obtenidos, los resultados de nuestra experiencia preliminar apuntan hacia la posibilidad de contemplar la oxibutinina transdérmica como una opción terapéutica con un excelente perfil de seguridad en el manejo de la HHP.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.