Etanercept es uno de los nuevos fármacos biológicos surgidos para el tratamiento de la psoriasis. Ha demostrado ser una opción eficaz en un alto porcentaje de pacientes, provocando mejoras en el Pasi (Psoriasis Assessment and Severity Index) que se mantienen en el tiempo. Además, resulta igualmente adecuado para el control de la artritis psoriásica. Por otra parte, el perfil de seguridad es excelente, con una toxicidad órgano específica mucho menor que los fármacos clásicos y la aparición de escasos efectos secundarios. Muchos de los datos publicados hasta el momento proceden de los distintos estudios clínicos que se han realizado con esta medicación, pero se necesitan trabajos que reflejen la experiencia en la práctica clínica diaria con el manejo de esta terapia en condiciones normales.
MétodosEstudio observacional, retrospectivo, en el que se recogen los 36 pacientes con psoriasis a los que administramos etanercept durante el período de tiempo comprendido entre marzo de 2004 y marzo de 2006. Exponemos la experiencia de nuestro centro en la utilización de este fármaco, con la evolución clínica y los problemas a los que nos hemos enfrentado.
ResultadosEl PASI se evaluó antes de comenzar el tratamiento y a los tres y seis meses de seguimiento de los pacientes. A los tres meses de tratamiento 13 de los pacientes (36,11 %) habían alcanzado el PASI 50, y 16 pacientes (44,44 %) habían alcanzado el PASI 75. Dos de los pacientes (5,56 %) experimentaron una mejoría de su psoriasis, sin alcanzar el PASI 50, y sólo 4 pacientes (11,11 %) no mostraron mejoría clínica o incluso empeoraron. A los 6 meses se observó un aumento de la eficacia, con 27 pacientes (75 %) que alcanzaron el PASI 75 y 6 pacientes (16,67 %) que llegaron a obtener el PASI 50, 2 pacientes (5,56 %) no mostraron ningún beneficio tras la terapia. A los 6 meses 13 de los pacientes (36,1 %) habían alcanzado el PASI 90. En ninguno de los casos se presentaron acontecimientos adversos de importancia que obligaran a suspender el tratamiento. Once de los pacientes siguen en tratamiento con etanercept en el momento actual, ya que se ha mantenido la eficacia y no han presentado efectos adversos importantes.
ConclusionesExponemos nuestra experiencia clínica con la utilización de etanercept para el tratamiento de la psoriasis en placas, con un perfil muy favorable de eficacia y seguridad. Proponemos la estandarización de la visita clínica al paciente con psoriasis, con recogida exhaustiva de datos en cada visita y la creación de un sistema nacional de registro de datos de pacientes con tratamientos biológicos.
Etanercept is one of the new biologic agents available for treating psoriasis. It has proved an effective option in a high percentage of patients, leading to sustained improvements in the psoriasis area severity index (PASI). Likewise, it is effective at controlling psoriatic arthritis, and its safety profile is excellent, with a much lower specific organ toxicity than traditional drugs and few side effects. Many of the data published to date are derived from clinical trials with this medication, but further studies are needed on the use of this therapy to manage patients in daily clinical practice.
MethodsThis was a retrospective observational study of 36 patients with psoriasis who received etanercept between March 2004 and March 2006. We describe the experience of using this agent at our hospital, with the clinical outcomes and the problems we have faced.
ResultsThe PASI score was assessed before treatment and at 3 and 6 months of patient follow-up. After 3 months of treatment, 13 patients (36.11 %) had achieved a 50 % improvement in PASI score (PASI50), and 16 patients (44 %) had achieved a 75 % improvement (PASI75). Two of the patients (5.56 %) experienced an improvement in their disease without reaching PASI50 and only 4 patients (11.11 %) did not show clinical improvement or deteriorated. After 6 months, efficacy improved, with 27 patients (75 %) achieving PASI75, 6 patients (16.67 %) achieving PASI50, and 2 patients (5.56 %) showing no benefit from treatment. After 6 months, 13 of the patients (36.1 %) had achieved a 90 % improvement in PASI score. No adverse events of sufficient significance to warrant discontinuation of treatment were reported. At present, 11 of the patients remain on etanercept treatment as efficacy has been sustained and they have not experienced any adverse events of note.
ConclusionsOur clinical experience with the use of etanercept for treating plaque psoriasis shows a favorable efficacy and safety profile. We propose a standardized procedure for consultations with psoriasis patients involving extensive data collection on each visit and the creation of a national surveillance system for patients under treatment with biologic agents.
La psoriasis es una enfermedad inflamatoria crónica de distribución mundial1. En nuestro país se calcula que el número de enfermos es de 600.000, de los cuales aproximadamente un cuarto están afectos de manera moderada-intensa2, alcanzando una puntuación de 10 o más en el PASI (Psoriasis Assessment and Severity Index), lo que causa importantes repercusiones psicológicas en los pacientes, como se ha demostrado, además de incomodidad física e interferencias con la vida privada y profesional3.
Además, en un 5-42 % de los pacientes la afectación cutánea se acompaña de afectación articular, con una artritis destructiva que afecta preferentemente a las articulaciones interfalángicas y sacroilíacas4.
Los tratamientos clásicos empleados (metotrexate, ciclosporina, fototerapia, etretinato) no están exentos de efectos secundarios y toxicidad, y no se han mostrado completamente satisfactorios en el control de la enfermedad a largo plazo. Debido a esto, los pacientes se ven obligados a seguir terapias rotacionales, es decir, tratamientos secuenciales con el objetivo de minimizar los efectos tóxicos de estos fármacos. Además, los pacientes deben ser sometidos a una monitorización estrecha por la toxicidad órgano-específica acumulativa y los efectos adversos que éstos provocan.
En estos últimos años hemos observado cómo los avances en biología molecular y en inmunología, así como la mejor comprensión de los fenómenos inmunopatológicos que causan la psoriasis, han permitido que un nuevo grupo de fármacos se añadan al arsenal terapéutico tradicional. Son los llamados fármacos biológicos, que actúan de manera más selectiva que los clásicos sobre las moléculas causantes de la enfermedad5.
El factor de necrosis tumoral (TNF) es una glucoproteína proinflamatoria que ha demostrado desempeñar un papel principal en la activación de la cascada inflamatoria y en la aparición y perpetuación de varias enfermedades inflamatorias crónicas, entre las que se encuentra la psoriasis6. Esta molécula está implicada en la proliferación de los queratinocitos, en la inflamación dérmica, en la expresión de moléculas en las células endoteliales que facilitan la adhesión y extravasación de los linfocitos T activados y en la angiogénesis7. Además, se han detectado niveles altos de TNF-α en las placas psoriásicas y en el suero de los pacientes con psoriasis, correlacionándose su nivel con la actividad de la enfermedad8.
El etanercept es una proteína recombinante humana formada por la fusión de dos receptores solubles humanos del TNF y la fracción constante de la IgG1 humana. Esta molécula se une de manera competitiva al TNF-α y β, evitando que éstos interactúen con sus receptores de membrana e impidiendo, por tanto, que ejerza sus efectos pro-inflamatorios5. Está indicado en la actualidad para el tratamiento de la artritis reumatoide, la artritis reumatoide juvenil, la espondilitis anquilosante, la artritis psoriásica y la psoriasis.
Se han realizado distintos estudios para valorar la eficacia y la seguridad del etanercept en todo el mundo, con resultados muy positivos. Con una terapia de 24 semanas de duración, alcanzaban el PASI 75 el 44 y el 59 % de los pacientes que habían sido tratados con 25 y 50 mg dos veces por semana, respectivamente. Estudios realizados con una duración del tratamiento de hasta un año no muestran una pérdida de eficacia en el tiempo, ni cuando se suspende el tratamiento y se reintroduce más tarde5,9.
Con respecto a la seguridad, el etanercept ha mostrado un buen perfil, con una buena tolerancia y escasos efectos adversos. El efecto adverso más frecuentemente descrito es la reacción local en el punto de inyección, que se describe hasta en un 16 % de los pacientes y que tiende a desaparecer a partir del segundo mes de tratamiento10.
Sin embargo, como sabemos, los resultados obtenidos en los ensayos clínicos no se corresponden en ocasiones con la realidad, ya que se realizan en pacientes ideales y en condiciones muy seleccionadas. Por eso queremos presentar aquí nuestra experiencia clínica personal con el uso de este fármaco en pacientes con psoriasis moderada-extensa en pacientes en los que las otras terapias sistémicas estaban contraindicadas o habían resultado poco efectivas. Evaluaremos así la eficacia del fármaco en nuestros pacientes, y los problemas con los que nos hemos enfrentado durante la utilización del fármaco en la práctica clínica diaria.
Material y métodosSe revisaron de manera retrospectiva las historias clínicas de 36 pacientes adultos que recibieron tratamiento con etanercept en nuestro Servicio desde marzo de 2004 hasta marzo de 2006, 26 eran hombres y 10 mujeres. De ellos, 24 pacientes habían sido objeto de estudio previamente11. Se recoge el tiempo de evolución y el tipo de psoriasis que presentaban, junto con la gravedad de la misma observada mediante el PASI. Escogimos el PASI como índice de eficacia clínica por ser el más usado actualmente a escala internacional, pese a sus limitaciones. Para valorar la eficacia clínica del fármaco utilizamos el PASI 50 que corresponde a una reducción del 50 % del PASI inicial y el PASI 75 que refleja una reducción del 75 % del PASI basal.
Todos los pacientes habían recibido tratamiento previamente con una o varias de las denominadas terapias clásicas, sin alcanzar un control satisfactorio de la enfermedad cutánea o articular.
Los pacientes habían sido informados de los posibles efectos secundarios de la medicación. Aquellos en los que la terapia se instauró antes de septiembre de 2004, fecha en la que el uso del fármaco se aprobó para la psoriasis moderada o extensa refractaria a otros tratamientos, firmaron un documento de consentimiento informado.
Se realizó un estudio previo de todos los pacientes, que comprendió un recuento sanguíneo incluyendo poblaciones linfocitarias, bioquímica, Mantoux con booster en los pacientes con resultado negativo, y estudio radiográfico de tórax. Además, se evaluó la intensidad de la afectación cutánea mediante el PASI.
Ninguno de los pacientes estudiados presentaba insuficiencia cardíaca, neoplasias o infecciones activas, historia de enfermedades desmielinizantes o conectivopatías, ni posibilidad de embarazo. Un paciente con prueba de Mantoux positiva realizó quimioprofilaxis tuberculosa antes de comenzar el tratamiento.
Se administró etanercept a razón de 25 mg de forma subcutánea, dos veces por semana hasta septiembre de 2004. Después de esta fecha los pacientes recibieron 50 mg de forma subcutánea dos veces por semana durante los primeros tres meses, y 25 mg de forma subcutánea dos veces por semana durante el resto del tiempo que duró el tratamiento. El reducido número de pacientes de la serie que aquí presentamos hace que evaluemos en conjunto a estos dos grupos de pacientes, hayan recibido 25 o 50 mg de fármaco durante los primeros meses, ya que las diferencias estadísticas obtenidas no resultarían significativas. El fármaco se administró en monoterapia en todos los casos, sólo estando permitido el uso de emolientes, corticoides tópicos de clase I-II y helioterapia durante el tratamiento.
La duración del tratamiento fue variable, con 11 de los pacientes aún en tratamiento en la actualidad por su buena respuesta y la falta de efectos adversos importantes. Se analizó el tiempo libre de enfermedad tras la suspensión del etanercept y la existencia o no de efecto rebote. Asimismo, se recogen los efectos adversos acontecidos, incluyendo infecciones y neoplasias.
Éste es un estudio observacional basado en la revisión retrospectiva de las historias clínicas de los pacientes, que no están protocolizadas. Esto provoca varios defectos en el estudio, que sólo pretende ser una comunicación de nuestra experiencia clínica personal con el fármaco en un momento determinado.
ResultadosLos pacientes estudiados tenían edades comprendidas entre los 19 y 72 años (media 46,1). Veintiséis eran hombres (72 %) y 10 mujeres (28 %). El tiempo de evolución de su psoriasis variaba entre los 3 y los 61 años (media 20 años, desviación típica 12,9).
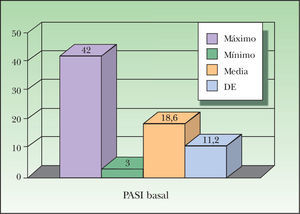
La mayor parte de los pacientes (29) estaban afectados de una psoriasis en placas moderada-grave (PASI > 10). En dos de los casos no se recogía este parámetro en la historia clínica. Sin embargo, había grandes variaciones en los PASI basales que ocupaban un rango entre 3 y 42 (media 18,6; desviación típica 11,2) (fig. 1). Cinco pacientes obtuvieron una puntuación inferior a 10 en el PASI previo al tratamiento con etanercept. El uso del fármaco se justificaba en estos casos por la existencia de lesiones de psoriasis de escasa extensión pero muy invalidantes, como por ejemplo psoriasis palmoplantar o lesiones inveteradas y refractarias a múltiples tratamientos previos.
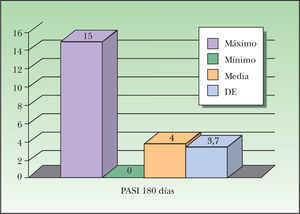
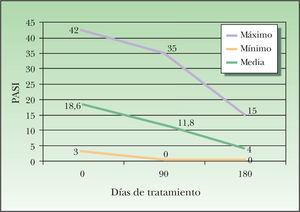
El PASI se evaluó antes de comenzar el tratamiento y a los tres y seis meses de seguimiento de los pacientes. Los resultados obtenidos del estudio comparativo de las tres medidas permiten atribuir a etanercept un magnífico índice de eficacia. Así, a los tres meses de tratamiento 13 de los pacientes (36,11 %) habían alcanzado el PASI 50, es decir, habían mejorado en un 50 % el valor inicial del PASI y 16 pacientes (44,44 %) habían alcanzado el PASI 75 en este período de tiempo. Dos de los pacientes (5,56 %) experimentaron una mejoría en su psoriasis, sin alcanzar el PASI 50, y sólo 4 pacientes (11,11 %) no mostraron una mejoría clínica o incluso empeoraron de su afección. Con la evaluación a los 6 meses se observó un aumento de la eficacia, con 27 pacientes (75 %) que alcanzaron el PASI 75 y 6 pacientes (16,67 %) que llegaron a obtener el PASI 50, mientras que 2 pacientes (5,56 %) no mostraron ningún beneficio tras la terapia. A los 6 meses, 13 de los pacientes (36,1 %) habían alcanzado el PASI 90 (fig. 2)
Evolución del PASI (Psoriasis Assessment and Severity Index) máximo, mínimo y la media a los 6 meses de tratamiento. Vemos cómo tras la terapia los valores han disminuido considerablemente y cómo la muestra se ha homogeneizado, convergiendo y descendiendo los valores del PASI. DE: desviación estándar.
Con respecto a la evolución de los pacientes, 11 de ellos siguen en tratamiento con etanercept en el momento actual, ya que han mantenido la eficacia y no han presentado ningún efecto adverso destacable, y el período medio libre de enfermedad entre los pacientes a los que se les retiró el fármaco, definido como el tiempo en que volvían a alcanzar un PASI igual al basal, fue de 4,22 meses. No se dio ningún fenómeno de rebote, definido como la consecución de un PASI superior o igual a 125 en los tres meses siguientes al cese del tratamiento (fig. 3).
Sólo se registraron 7 acontecimientos adversos durante el tratamiento, todos ellos leves, y que no requirieron la retirada del fármaco. Curiosamente, la reacción local en el punto de inyección, el efecto más frecuente según los estudios clínicos realizados, no se recoge en ninguna de las historias, probablemente por su frecuencia y su inocuidad. Los efectos indeseados registrados fueron 2 infecciones del tracto urinario, 2 episodios de fiebre, un herpes zóster y una reacción local en el punto de inyección del fármaco.
DiscusiónLa psoriasis es una enfermedad crónica en cuyo desarrollo es básica la infiltración de la epidermis por parte de los linfocitos T. Estas células producen citocinas inflamatorias de forma excesiva, y contribuyen a la proliferación anómala de los queratinocitos y a la perpetuación de la inflamación. El TNF es una de estas citocinas. Varios estudios han demostrado que su concentración es mucho mayor en las lesiones psoriásicas que en la piel no afecta del mismo paciente o en la piel de individuos sanos. También se observa un aumento de esta citocina inflamatoria en las articulaciones afectas de artritis psoriásica9.
El etanercept actúa antagonizando los efectos del TNF al inhibir competitivamente su unión a los receptores celulares de superficie impidiendo, por tanto, que se desencadenen las respuestas celulares mediadas por esta molécula4,5,12.
La relativamente reciente incorporación de los agentes biológicos al arsenal terapéutico que manejaba hasta ahora el dermatólogo para tratar la psoriasis hace que algunos facultativos aún presenten reticencias ante el uso de estos fármacos. Son muchos los estudios clínicos realizados para la evaluación de estos agentes, con una gran cantidad de pacientes incluidos, pero éstos se limitan a estudiar a pacientes ideales en condiciones muy determinadas. Por ello consideramos de gran importancia la realización de estudios prospectivos que permitan a los distintos profesionales comunicar su experiencia clínica personal, en pacientes no seleccionados, que reflejen los problemas cotidianos en el manejo de los biológicos, así como la eficacia de los mismos. La aparición de trabajos de este tipo puede ayudar a normalizar el uso de fármacos como etanercept, y dar al dermatólogo un margen de confianza en el producto.
La experiencia clínica de nuestro servicio respalda las cifras de eficacia y la evolución descrita por los estudios clínicos anteriormente realizados, así como su buen perfil de eficacia y seguridad, señalando a etanercept como una buena alternativa para el tratamiento de la psoriasis resistente a otros tratamientos, seguro y eficaz.
En cuanto a la eficacia, las cifras arrojadas por varios estudios en fase II y dos ensayos aleatorizados en fase III que incluían a más de 1.000 pacientes correspondían al 34 % de los pacientes que habían recibido 25 mg dos veces por semana, alcanzando el PASI 75 a las 12 semanas de tratamiento. Si la dosis de fármaco era de 50 mg dos veces por semana las cifras aumentaban hasta el 49 %. Al prolongar el tiempo de tratamiento a 24 semanas, alcanzaban el PASI 75 el 44 % y el 59 % de los pacientes que habían sido tratados con 25 y 50 mg dos veces por semana respectivamente9.
Las cifras obtenidas en nuestro grupo de estudio resultaron aún mejores que en los ensayos clínicos, ya que un 44,44 % de los pacientes tratados alcanzaron el PASI 75 a las 12 semanas de tratamiento, y el porcentaje se elevó a 75 % cuando se reevaluó a los pacientes a las 24 semanas.
Sin embargo, debemos recordar que, pese a que el PASI es la forma de valoración estandarizada y más utilizada en los ensayos clínicos y estudios, ésta es una medida imperfecta. El PASI 75 es un punto de corte arbitrario que no refleja el estado clínico del paciente, sino sólo la evolución de un paciente en el tiempo, con respecto a su situación basal. Además, resulta poco útil para comparar distintos pacientes entre sí, sobre todo cuando, como en nuestro caso, se incluyen pacientes con valores de PASI muy dispares. En estos casos, quizá, la manera más fidedigna de reflejar la realidad clínica sea el estudio de las medias de los valores de PASI.
Los efectos adversos registrados durante el uso de etanercept en nuestra experiencia han sido leves, de manera que, en ocasiones, ni siquiera eran registrados en la historia clínica. No encontramos durante el tratamiento en nuestros pacientes signos de infección tuberculosa, en parte debido al cribado previo que se realizó en todos ellos, que como es sabido disminuye la incidencia de procesos granulomatosos13.
En los pacientes tratados con etanercept no se ha detectado una mayor incidencia de infecciones graves o tumores que en la población general. En pacientes que reciben esta terapia y padecen una artritis reumatoide de base, sí se ha observado una incidencia mayor de la esperada en el desarrollo de linfomas; sin embargo, debemos recordar que en este grupo poblacional la aparición de estas neoplasias hematológicas es mayor que en la población de referencia, aunque no hayan recibido etanercept10.
Tampoco apareció ninguna neoplasia entre el grupo de pacientes que tratamos con etanercept. Aunque es cierto que el período de seguimiento transcurrido hasta el momento es, tal vez, insuficiente para poder haber desarrollado alguna complicación oncológica.
Como hemos comentado anteriormente, el carácter retrospectivo del estudio y la elaboración poco exhaustiva de las historias clínicas en la práctica diaria provocan ciertas limitaciones a la hora de analizar y comparar los resultados del tratamiento. Por ello queremos resaltar la necesidad de protocolizar las visitas de los pacientes afectos de psoriasis, incluyendo en cada visita parámetros como el PASI o índices de calidad de vida, y recogiendo cuidadosamente las posibles incidencias que se desarrollen a lo largo de las distintas terapias que realicen estos enfermos, con el fin de poder ofrecer, posteriormente, toda esta información de manera concisa y ordenada, lo que repercutirá positivamente en la asistencia, el seguimiento y la evolución de los pacientes, y permitirá la extrapolación y la comparación de los resultados.
Consideramos que es clara la necesidad de un sistema central de información y comunicación de los casos de pacientes tratados con terapias biológicas en el ámbito estatal, lo cual permitirá comprender mejor los perfiles de seguridad y el manejo de estos pacientes, así como el análisis de los datos de manera global y a largo plazo. En este sentido habría sido creado BIOBADADERM, un registro de acontecimientos adversos a nivel nacional, avalado por la Academia y presentado en el pasado Congreso Nacional de Granada, que pretende ayudar a evaluar la seguridad a largo plazo de las terapias biológicas en las enfermedades dermatológicas.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.