Los estudios de citogenética convencional realizados en el carcinoma escamoso cutáneo (CEC) son escasos. La introducción de las técnicas de citogenética, como la de hibridación genómica comparada (HGC), solventan algunos de los inconvenientes planteados por las técnicas de citogenética convencional. El objetivo de este estudio es analizar la presencia de alteraciones genéticas mediante la técnica de array-HGC en una serie de CEC.
Material y métodosSe estudiaron un total de 8 pacientes (7 varones/una mujer; edad media: 75 años) diagnosticados de CEC primario. Se realizó extracción de ADN a partir de material congelado y se realizó la técnica de array-HGC.
ResultadosTodos los casos mostraron alteraciones genéticas, siendo más frecuentes las ganancias que las pérdidas. Las regiones cromosómicas en las que se observaron ganancias, en orden decreciente, fueron 5p15.2, 9q31.3-q33.2, 13q, 18q22, 1p21-p22, 1q24-q25, 3p13, 4q33-q34 (HMGB2, SAP30), 20p12.2 (JAG1), 21q21.1, Xq21.33. La región 9p13.1-p13.3 fue la única que mostró una pérdida recurrente. No se detectó una correlación entre la presencia de ganancias o pérdidas y las características clínico-patológicas de los tumores.
ConclusionesEste estudio es el primero descrito en el que se utiliza la técnica de array-HGC con el fin de analizar las alteraciones genéticas del CEC. El hallazgo de algunas aberraciones ya descritas (ganancia de 5p) muestra la posibilidad de que existan lesiones recurrentes. Asimismo, la observación de pequeñas regiones alteradas (cromosoma 1) demuestra la sensibilidad de esta técnica en la detección de alteraciones de pequeño tamaño. Su aplicación en una serie amplia de casos podrá proporcionar un mayor conocimiento de las alteraciones genéticas implicadas en el proceso de tumorogénesis del CEC.
Few conventional cytogenetic studies of squamous cell carcinoma (SCC) have been performed to date. The introduction of cytogenetic techniques such as comparative genomic hybridization (CGH) has resolved some of the problems associated with conventional cytogenetics. The aim of this study was to analyze the presence of genetic abnormalities in a series of patients with SCC using the technique of array CGH.
Material and methodsThe study included 8 patients (7 men and 1 woman; mean age, 75 years) diagnosed with primary SCC. DNA was extracted from frozen tissue and analyzed by array CGH.
ResultsAll cases had genetic alterations, with gains more frequent than losses. The chromosomal regions with gains, in descending order of frequency, were as follows: 5p15.2, 9q31.3-q33.2, 13q, 18q22, 1p21-p22, 1q24-q25, 3p13, 4q33-q34 (HMGB2, SAP30), 20p12.2 (JAG1), 21q21.1, and Xq21.33. The region 9p13.1-p13.3 was the only one to display recurrent loss. No correlation was observed between the presence of gains or losses and the clinical and pathological characteristics of the tumors.
ConclusionsThis is the first study to use the technique of array CGH to analyze genetic alterations in SCC. The finding of certain previously described aberrations (gain of 5p) suggests the existence of recurrent abnormalities. Likewise, the observation of alterations in small regions of chromosome 1 highlights the sensitivity of the technique to detect small changes. Application of the technique to a larger series of cases will provide greater insight into the genetic abnormalities implicated in the process of tumorigenesis in SCC.
El carcinoma escamoso cutáneo (CEC) o espinocelular constituye aproximadamente un 20 % de todas las neoplasias malignas cutáneas. Su incidencia está en aumento y algunos estudios la sitúan entre 40 y 200 casos por 100.000 habitantes/año.
El CEC suele observarse en individuos de edad avanzada. Se considera que el 14 % de los hombres y el 8-9 % de las mujeres sufrirá un CEC a lo largo de su vida. Posee una potencial capacidad de diseminación a distancia con una mortalidad global estimada de 2.500 casos/año en Estados Unidos. Su etiología es multifactorial, y se halla condicionada por factores tanto ambientales como dependientes del huésped.
Entre los factores extrínsecos o ambientales el más importante es la exposición solar crónica (radiaciones ultravioleta [RUV]). La exposición a radiaciones ionizantes (rayos X), arsénico, hidrocarburos, tabaco (carcinoma escamoso labial), procesos inflamatorios crónicos (cicatrices de quemaduras, úlceras crónicas, lesiones fistulosas crónicas, etc.) y algunas infecciones víricas (virus del papiloma humano) son otras causas menos frecuentes implicadas en el desarrollo del CEC.
La edad, el fototipo, la situación inmunológica y/o la presencia de algunas alteraciones genéticas constitutivas son factores relevantes. Los individuos sometidos a una inmunosupresión crónica (receptores de órganos) presentan un mayor riesgo (3-4 veces sobre la población general) de desarrollar carcinomas escamosos cutáneos.
Lesiones genéticas y carcinoma escamoso cutáneoEl desarrollo del CEC y de sus metástasis es un proceso complejo que incluye el proceso de transformación, proliferación, neovascularización e invasión. A pesar de los incuestionables avances experimentados en los últimos años sobre el conocimiento de los mecanismos patogénicos implicados, desconocemos las lesiones genéticas responsables del CEC. La identificación de alteraciones genéticas en regiones concretas del genoma en esta neoplasia puede favorecer la futura identificación de los genes (oncogenes y genes supresores tumorales) implicados en su patogénesis.
Se ha demostrado que un 25-80 % de los CEC corresponden a lesiones aneuploides1, con una escasa variación en el valor aneuploide (en contraste con sus lesiones precursoras), lo que sugiere un origen clonal. Diversos hallazgos experimentales y epidemiológicos han establecido una correlación directa entre el desarrollo del CEC y la exposición a RUV2-4. Las RUV dan lugar a mutaciones puntuales características en el ADN y pequeñas delecciones. La exposición de cultivos de queratinocitos a dosis bajas de RUV A (UVA) y B (UVB)5 induce la aparición de micronúcleos, cuerpos citoplasmáticos de naturaleza nuclear que corresponden a material genético no incorporado correctamente a las células hijas durante la división celular. Este fenómeno es responsable de la aparición de aberraciones cromosómicas que se originan por roturas cromosómicas, por errores durante la replicación y posterior división celular del ADN y/o por la exposición a agentes genotóxicos. Todos estos hallazgos apoyarían el papel patogénico de las RUV en la iniciación y promoción de la transformación neoplásica, así como en el aumento de inestabilidad genómica6 y la pérdida de heterocigosidad7, tanto en el CEC como en sus lesiones precursoras.
Con el objetivo de identificar las alteraciones genéticas características de los CEC se han utilizado distintas aproximaciones metodológicas con técnicas citogenéticas de complejidad variable:
Citogenética convencionalLa citogenética convencional es una herramienta frecuentemente utilizada en la identificación de alteraciones genéticas en neoplasias hematológicas8, en las que pueden obtenerse metafases con facilidad. En el campo de la hematología esta técnica es muy útil en la detección de aberraciones cromosómicas recurrentes, que determinan tanto el diagnóstico como el pronóstico y la progresión de muchas de dichas neoplasias. Las dificultades en la obtención de metafases a partir de células tumorales9 de CEC en cultivo explican que hasta el momento el número de estudios citogenéticos en neoplasias cutáneas haya sido muy limitado.
Casalone et al10 analizaron tres pacientes con CEC mediante citogénetica convencional con cultivos directos (24 horas) y cultivos cortos (10 a 28 días). Mediante el primer tipo de cultivo observaron la ganancia total de los cromosomas 6, 8, 9, 11, 16, 21 y la pérdida de los cromosomas 1 y 14, no observándose dichas alteraciones en cultivos celulares cortos. Sin embargo, Jin et al11, en cultivos cortos de células neoplásicas, identificaron numerosas alteraciones citogenéticas, siendo las más frecuentes la pérdida de los cromosomas 2, 4, 8p, 9, 11, 13, 14, 18, 21, X e Y, y la ganancia de los cromosomas 1q, 7 y 8q.
Junto con las alteraciones numéricas (ganancias o pérdidas) cromosómicas, otros autores12,13 han observado reordenamientos estructurales de las regiones centroméricas de los cromosomas 1, 8 y 9, incluyendo la formación de isocromosomas, i(1p), i(1q), i (8q), i(9p) e i(9q), así como deleciones y translocaciones implicando todo un brazo cromosómico.
Hibridación in situ fluorescenteLa técnica de la hibridación in situ fluorescente (FISH) permite la detección y localización de secuencias específicas de ADN sobre cromosomas, células o tejidos. Esta metodología se basa en la hibridación de una secuencia específica de ADN (sonda) previamente marcada con moléculas fluorescentes sobre el ADN de la muestra a estudiar.
Los estudios realizados aplicando las técnicas de FISH interfásica en el CEC son escasos, probablemente como consecuencia de problemas técnicos de procesado de las muestras (presencia de la queratina, tejido adiposo, etc.). Utilizando esta tecnología se ha descrito un caso con presencia de trisomía 7 en CEC14. En otro estudio15 se identificó la deleción de 3p21 en un 67 % de los casos y una ganancia sorprendente del 17p13 (TP53) en el 27 % de los casos de CEC estudiados.
Hibridación genómica comparadaEsta técnica de citogenética molecular16 se basa en la metodología de la FISH de doble color que permite realizar un análisis global de las ganancias y las pérdidas de material genómico en una única hibridación, sin necesidad de obtener células en división.
La hibridación genómica comparada (HGC) consiste en la hibridación competitiva entre ADN tumoral (test) y ADN normal (referencia) sobre metafases normales en presencia de un exceso de ADN Cot-1 humano. El ADN tumoral de las regiones cromosómicas que tienen un número incrementado de copias (ganancias y amplificaciones) se unen a las metafases proporcionalmente más que el ADN normal, mientras que el ADN de las regiones que están presentes en un número bajo de copias (pérdidas) se une proporcionalmente menos a los cromosomas normales. Previamente, el ADN tumoral y el normal han sido marcados con dos fluorocromos diferentes (por ejemplo, el ADN tumoral con un fluorocromo verde y el normal con uno rojo), lo que permite la posterior identificación de los colores verde y rojo mediante un microscopio de fluorescencia. El análisis digital de las metafases capturadas cuantifica la proporción de verde y de rojo en todos los cromosomas, de manera que si existe una ganancia de material genómico se producirá un aumento de la fluorescencia verde a ese nivel, y si hay una pérdida de material genómico se dará una disminución de la fluorescencia verde, y por tanto un incremento relativo de la fluorescencia roja. El cariotipaje posterior se realiza sobre la base de la tinción de los cromosomas con el fluorocromo DAPI.
Esta técnica ha sido muy útil en la caracterización citogenética de los tumores sólidos, de los cuales es difícil obtener metafases para realizar un cariotipo convencional y estudios de FISH multicolor sobre cromosomas. Los estudios mediante técnicas de HGC comparada de los CEC han permitido detectar ganancias genómicas en los brazos cromosómicos 3q, 17q, 4p, 14q, Xq, 5p, 9q, 8q, 17p y 20q, así como pérdidas en 9p, 3p, 13q, 17p, 11p, 8q y 18p17.
Micromatrices de hibridación genómica comparadaEn los últimos años se ha desarrollado la técnica de las micromatrices de HGC18,19 (array-HGC), la base de la cual es la misma que la HGC convencional, pero con la utilización de secuencias genéticas impresas para hibridar sobre un portaobjetos de cristal (secuencias genómicas procedentes de cromosomas artificiales de P1 o PAC, de cromosomas artificiales de bacterias o BAC, etc.), en lugar de extensiones citogenéticas normales. Sobre ellas se cohibridan los ADN de la muestra y del control marcados con dos fluorocromos de diferentes colores (generalmente Cy3 y Cy5) y posteriormente se analizan los resultados utilizando un sistema informático. Con esta técnica se obtiene una mayor resolución (resolución de 1Mb en contraste con una resolución de unas 10Mb obtenida con la HGC convencional). Por otra parte, esta técnica es mucho más sensible que la HGC convencional, ya que permite definir con mayor exactitud las zonas de ganancia o pérdida genética.
En este trabajo se describe el análisis de 8 CEC primarios usando la técnica de array-HGC para intentar identificar nuevos genes o regiones cromosómicas implicadas en el desarrollo y la evolución de esta neoplasia cutánea.
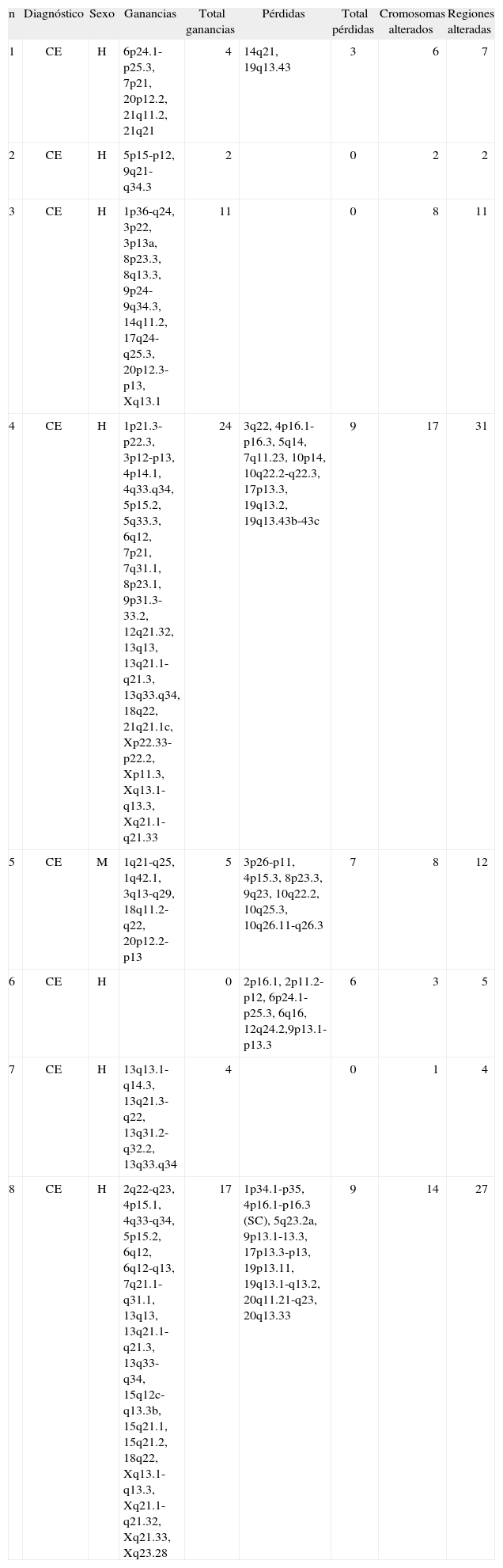
Material y métodosMaterialPacientesUn total de 8 pacientes diagnosticados de CEC primario fueron incluidos en el estudio. Correspondían a 7 varones y una mujer de edades comprendidas entre los 61 y los 97 años (media: 75 años). Las características clínico-patológicas de las lesiones se detallan en la tabla 1.
Características clínico-patológicas de los pacientes
| n | Edad | Sexo | Diagnóstico | Localización | Área fotoexpuesta | Patrón morfológico | Queratosis actínicas | Tamaño (cm) | Profundidad (mm) |
| 1 | 78 | H | CE | Mano | Sí | Multinodular | No | 1,8 | 4 |
| 2 | 73 | H | CE | Cuero cabelludo | Sí | Multinodular | No | 2 | 4 |
| 3 | 68 | H | CE | Pierna | No | Similar a queratoacantoma | NC | 0,7 | 2 |
| 4 | 97 | H | CE | Mandíbula | Sí | Multinodular | Sí | 3 | 3 |
| 5 | 79 | M | CE | Mejilla | Sí | Multinodular | No | 0,8 | 1,5 |
| 6 | 61 | H | CE | Pierna | No | Similar a queratoacantoma | NC | 8 | 2 |
| 7 | 74 | H | CE | Sien | Sí | Multinodular | No | 1 | 2 |
| 8 | 75 | H | CE | Parietal | Sí | Multinodular | No | 1 | 2,5 |
H: hombre; M: mujer.
Las lesiones se localizaban en zonas fotoexpuestas en 6 pacientes y en zonas no fotoexpuestas en dos individuos (extremidades inferiores). El tamaño medio de los tumores era de 2,2cm de diámetro mayor.
Desde un punto de vista morfológico 6 lesiones presentaban un patrón histológico multinodular, y las dos restantes mostraban características morfológicas crateriformes (queratoacantoma-líke). En 6 lesiones se objetivaron cambios compatibles con queratosis actínica en la epidermis adyacente a la proliferación tumoral. La profundidad histológica media tumoral era de 3,14mm. Ningún tumor mostraba infiltración perineural, vascular ni anexial.
Muestras para estudioDe cada paciente se recogió una muestra tumoral que fue incluida en OCT (Tissue Tek OCT, Sakura, Zoeterwoede, Netherlands) y se almacenó en el Banco de Tejidos. De cada uno de los tumores se realizó un corte histológico que fue teñido con hematoxilina-eosina para corroborar la presencia de más del 70 % de células tumorales, indispensable para el análisis de array-HGC.
MétodosExtracción de ADNPara la extracción de ADN genómico se realizaron 10-14 cortes de 14μm y se almacenaron en un tubo estéril de 1,5ml. Se utilizó el QiaAmp DNA Tissue Kit (Qiagen, GmbH, Hilden, Germany) con el protocolo establecido por el fabricante. En caso de tener muestras contaminadas por restos de ARN o proteínas se procedió a la purificación por el método tradicional de precipitación de ADN con fenol-cloroformo-isoamilacohol (Sigma-Aldrich, St Louis, MO, USA). La cuantificación de ADN fue determinada por espectrofotometría (Nanodrop, Wilmington, DE, USA). Se estableció una concentración mínima de 50ng en 50μl, para obtener la cantidad de nanogramos imprescindible para realizar el estudio.
Array-HGCLas muestras de ADN de los 8 pacientes seleccionados fueron colocadas por separado en una micromatriz (microarray) que consiste en un portaobjetos de cristal que contiene impresos 2.621 clones de BAC con un promedio de resolución de 1Mbp (Spectral Chip 2600; Spectral Genomics, Houston, TX, USA). Todos los clones están representados en la micromatriz por duplicado, y su localización es proporcionada por Spectral Genomics. Se utilizaron para la hibridación 2μg de ADN genómico tumoral y de ADN control (Promega, Madison, WI, USA). Cada ADN, tanto el tumoral como el control, se marcó por separado con los fluorocromos cianina-5 (Cy5-dCTP, AmershamBiosciences, UK) y cianina-3 (Cy3-Dctp, AmershamBiosciences, UK) dCTPs usando el Bioprime® Genomic Random Labeling Kit (Invitrogen, Carlsbad, CA, USA). Ambos ADN marcados (tanto el marcaje directo, ADN tumoral-Cy5 y ADN control-Cy3, como el inverso [dye-swap], ADN tumoral-Cy3 y ADN control-Cy5) se mezclaron, coprecipitaron con isopropanol, se lavaron y resuspendieron en solución de hibridación (Spectral Genomics, Houston, TX, USA). La mezcla de ADN fue desnaturalizada a 72°C durante 10 minutos, prehibridada a 37°C durante 30 minutos e hibridada en las micromatrices un mínimo de 16 horas a 37°C, siguiendo las recomendaciones del fabricante. Después de la hibridación las micromatrices fueron lavadas en 50 % formamida/2XSSC, 2XSSC/NP-40, y 0.2xSSC.
Las imágenes y la intensidad de la señal se obtuvieron usando el escáner G2565BA (Agilent Techonologies, CA, USA) junto con el software de imagen, GenePix 6.0 (Axon Instruments, CA, USA). Los datos crudos se filtraron y normalizaron usando la herramienta BacAnal, un servidor web local donde se encuentra implementado el paquete estadístico Limma (Bioconductor).
Los límites para la consideración de estos valores como significativos de ganancia o pérdida se establecieron de manera independiente para cada uno de los pacientes que entraron en el estudio, y los valores de referencia finales se establecieron a partir del valor de la media ± 2 desviaciones estándar de las proporciones de todos los BAC.
ResultadosTodos los tumores eran carcinomas escamosos primarios cutáneos, seis en localización fotoexpuesta y dos en localización no fotoexpuesta. Los tumores presentaban variaciones tanto en el tamaño como en la profundidad de la lesión y en el patrón histológico.
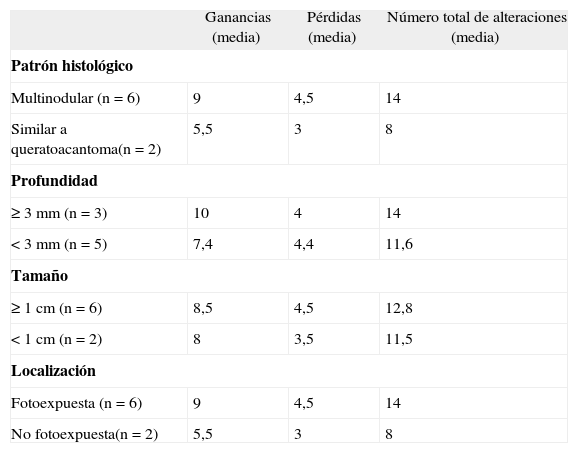
El análisis de array-HGC reveló que las ganancias y pérdidas a nivel genómico eran una característica de todas las muestras hibridadas, aunque no afectaba a todos los pacientes por igual (tabla 2).
Resultados del análisis del array-CGH
| n | Diagnóstico | Sexo | Ganancias | Total ganancias | Pérdidas | Total pérdidas | Cromosomas alterados | Regiones alteradas |
| 1 | CE | H | 6p24.1-p25.3, 7p21, 20p12.2, 21q11.2, 21q21 | 4 | 14q21, 19q13.43 | 3 | 6 | 7 |
| 2 | CE | H | 5p15-p12, 9q21-q34.3 | 2 | 0 | 2 | 2 | |
| 3 | CE | H | 1p36-q24, 3p22, 3p13a, 8p23.3, 8q13.3, 9p24-9q34.3, 14q11.2, 17q24-q25.3, 20p12.3-p13, Xq13.1 | 11 | 0 | 8 | 11 | |
| 4 | CE | H | 1p21.3-p22.3, 3p12-p13, 4p14.1, 4q33.q34, 5p15.2, 5q33.3, 6q12, 7p21, 7q31.1, 8p23.1, 9p31.3-33.2, 12q21.32, 13q13, 13q21.1-q21.3, 13q33.q34, 18q22, 21q21.1c, Xp22.33-p22.2, Xp11.3, Xq13.1-q13.3, Xq21.1-q21.33 | 24 | 3q22, 4p16.1-p16.3, 5q14, 7q11.23, 10p14, 10q22.2-q22.3, 17p13.3, 19q13.2, 19q13.43b-43c | 9 | 17 | 31 |
| 5 | CE | M | 1q21-q25, 1q42.1, 3q13-q29, 18q11.2-q22, 20p12.2-p13 | 5 | 3p26-p11, 4p15.3, 8p23.3, 9q23, 10q22.2, 10q25.3, 10q26.11-q26.3 | 7 | 8 | 12 |
| 6 | CE | H | 0 | 2p16.1, 2p11.2-p12, 6p24.1-p25.3, 6q16, 12q24.2,9p13.1-p13.3 | 6 | 3 | 5 | |
| 7 | CE | H | 13q13.1-q14.3, 13q21.3-q22, 13q31.2-q32.2, 13q33.q34 | 4 | 0 | 1 | 4 | |
| 8 | CE | H | 2q22-q23, 4p15.1, 4q33-q34, 5p15.2, 6q12, 6q12-q13, 7q21.1-q31.1, 13q13, 13q21.1-q21.3, 13q33-q34, 15q12c-q13.3b, 15q21.1, 15q21.2, 18q22, Xq13.1-q13.3, Xq21.1-q21.32, Xq21.33, Xq23.28 | 17 | 1p34.1-p35, 4p16.1-p16.3 (SC), 5q23.2a, 9p13.1-13.3, 17p13.3-p13, 19p13.11, 19q13.1-q13.2, 20q11.21-q23, 20q13.33 | 9 | 14 | 27 |
La tabla 3 ilustra las características de las lesiones estudiadas en relación con las distintas características clínico-patológicas.
Análisis del numero de aberraciones (media) en relación con las características clínico-patológicas
| Ganancias (media) | Pérdidas (media) | Número total de alteraciones (media) | |
| Patrón histológico | |||
| Multinodular (n = 6) | 9 | 4,5 | 14 |
| Similar a queratoacantoma(n = 2) | 5,5 | 3 | 8 |
| Profundidad | |||
| ≥ 3mm (n = 3) | 10 | 4 | 14 |
| < 3mm (n = 5) | 7,4 | 4,4 | 11,6 |
| Tamaño | |||
| ≥ 1cm (n = 6) | 8,5 | 4,5 | 12,8 |
| < 1cm (n = 2) | 8 | 3,5 | 11,5 |
| Localización | |||
| Fotoexpuesta (n = 6) | 9 | 4,5 | 14 |
| No fotoexpuesta(n = 2) | 5,5 | 3 | 8 |
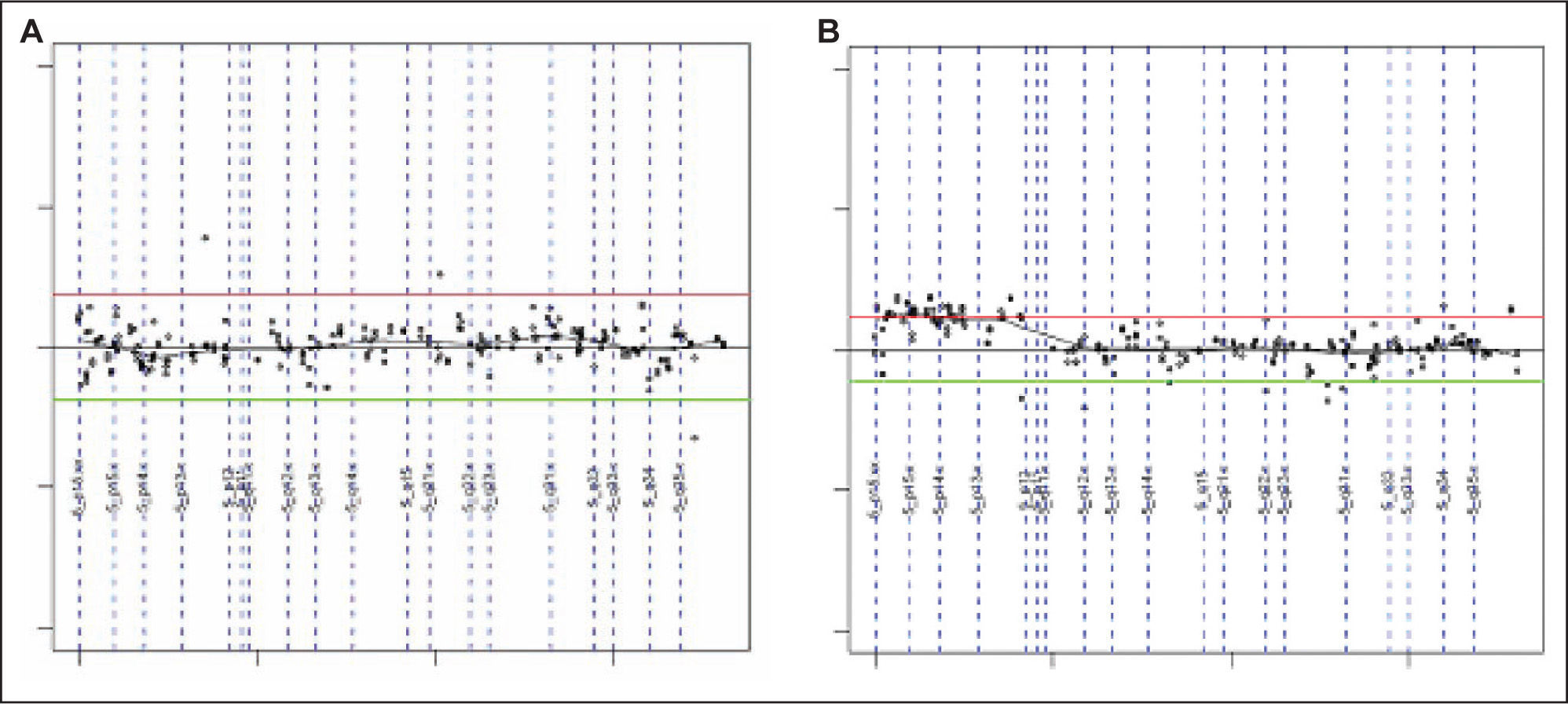
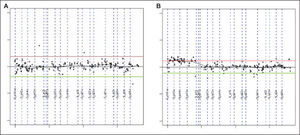
Las ganancias halladas más frecuentemente afectaban a los clones mapeados en 5p15.2 (fig. 1), 9q31.3-q33.2, 13q, 18q22, 1p21-p22, 1q24-q25, 3p13, 4q33-q34 (HMGB2, SAP30), 20p12.2 (JAG1), 21q21.1, Xq21.33. La región de 9p13.1-p13.3 fue la única pérdida recurrente (tabla 4).
Los estudios de análisis citogénetico convencional realizados en tumores sólidos son escasos, probablemente como consecuencia de las dificultades técnicas (obtención de células en división). La introducción de las técnicas de HGC, que permiten detectar la variación en el número de copias a lo largo de todo el genoma en un solo experimento, solventan algunos de los inconvenientes planteados por las técnicas de citogenética convencional16. La HGC precisa cantidades pequeñas de ADN y detecta ganancias o pérdidas de material genético sin la necesidad de disponer de células en cultivo. La pérdida o ganancia de fragmentos de material genético puede implicar una alteración funcional crítica de genes implicados en una gran variedad de mecanismos fisiológicos de proliferación y diferenciación celular. Por todo ello el estudio de las alteraciones genéticas puede proporcionar información valiosa sobre los genes implicados, tanto en el inicio como en la progresión tumoral.
Estudios mutacionales del gen supresor tumoral TP53 (17p13) han permitido identificar una alta frecuencia de mutaciones inducidas por radiaciones ultravioletas, tanto en las queratosis actínicas (30-53 %) como en los carcinomas escamosos (58-69 %)20. También se han observado otros loci cromosómicos (3p, 9p, 9q, 13q y 17q) de pérdida genómica con frecuencias similares en las queratosis actínicas y los carcinomas escamosos21.
En los carcinomas escamosos también se han detectado aberraciones cromosómicas numéricas en los cromosomas 1,11,8,9,5,3 y 7 e isocromosomas de 1q, 8q, 5p, 1p,9p y 9q. El análisis mediante técnica de FISH interfásica de los carcinomas escamosos ha permitido detectar una deleción frecuente de 3p21 en el 67 % de los casos, y una ganancia sorprendente del 17p13 (TP53) en el 27 % de los casos15. Ashton et al17, mediante técnicas de HGC, detectaron ganancias genómicas en los brazos cromosómicos 3q, 17q, 4p, 14q, Xq, 5p, 9q, 8q, 17p y 20q, así como pérdidas en 9p, 3p, 13q, 17p, 11p, 8q y 18p. En este estudio se observó asimismo una pérdida significativa de 18q sólo en carcinomas escamosos y no en queratosis actínicas.
En estudios con micromatrices de cADN realizados con líneas celulares de carcinoma escamoso se ha observado un aumento de la expresión de los genes regulados por NF-kB22. La activación de NF-kB se ha relacionado con el aumento del potencial agresivo y metastásico del carcinoma escamoso23. La inactivación de los genes CDKN2A, localizados en la región cromosómica 9p21, por pérdida alélica o por mutaciones (inducida por la luz ultravioleta) puede tener un efecto relevante en las formas agresivas de carcinoma escamoso mediante la inactivación de las proteínas p16 y p1424.
En algunas localizaciones particulares (carcinoma escamoso de pene) se han observado ocasionalmente ganancias en 8q24, 16p11-12,20q11 13,22q,19q13,5p15 y deleciones en 13q21-22,4q21-32 y en el cromosoma X25.
El desarrollo de la técnica de array-HGC ha permitido aumentar la resolución de análisis comparado con la técnica de HGC convencional. Otra de las ventajas de esta técnica es la rápida ubicación dentro de la complejidad del genoma, que facilita la búsqueda de posibles genes candidatos con potencial valor patogénico.
En nuestro estudio, realizado en una serie reducida de pacientes con CEC, hemos observado que todos los casos presentaron el doble de ganancias que de pérdidas. Debido al reducido número de casos no pudo establecerse una relación inequívoca entre el subtipo histológico y la profundidad de la lesión con la presencia de un número aumentado o disminuido de alteraciones genéticas. Asimismo, en los pacientes con lesiones de un tamaño superior a 1cm tampoco se detectó un mayor número de alteraciones genéticas que en los que presentaban lesiones menores de 1cm.
El hallazgo de alteraciones genéticas descritas previamente (ganancia de 5p) evidencía la posibilidad de que existan lesiones recurrentes que pueden ser informativas. Por otro lado, la detección de pequeñas alteraciones citogenéticas como las que implican al cromosoma 1, no descritas mediante técnicas de HGC convencional en estudios previos, resalta la capacidad de esta técnica en la detección de alteraciones de pequeño tamaño.
El estudio que presentamos supone una primera aproximación a la técnica de array-HGC en la caracterización citogenética del CEC. El análisis detallado de cada una de las lesiones descritas, tanto en los pacientes estudiados como en nuevos casos, debe facilitar la identificación de las lesiones genéticas subyacentes responsables y de los genes implicados en el desarrollo neoplásico del CEC, y proporcionar un mejor conocimiento de los mecanismos patogénicos implicados en su desarrollo.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Proyecto de investigación financiado por una beca del Fondo de Investigación Sanitaria (FIS)-Ministerio de Salud- (Beca PI041728).