El carcinoma cutáneo de células escamosas (CEC) es la segunda causa de fallecimientos por cáncer de piel en Europa. Existen pocos estudios que hayan analizado las distintas vías de progresión de este tumor en su historia natural. El objetivo principal del presente estudio ha sido analizar las diferentes vías metastásicas, así como de progresión, y su aparición temporal en la evolución del CEC.
Material y métodoEstudio observacional retrospectivo multicéntrico de los CEC consecutivos de alto riesgo englobados en el proyecto SQUAMATA.
ResultadosDe los 1.346 pacientes incluidos, tuvieron recaída 222 pacientes. La vía de progresión más frecuente fue la vía linfática (62,6%). El 20,2% de los casos con progresión linfática desarrollaron metástasis a distancia. Un solo caso (3,1%) de metástasis a distancia fue tras recidiva local sin metástasis linfáticas previas. La mediana del tiempo hasta el exitus por la enfermedad fue mayor en los pacientes que desarrollaron metástasis sistémicas que en aquellos fallecidos por progresión locorregional.
ConclusionesEl fallecimiento de los pacientes con CEC es mayoritariamente por progresión regional de sus metástasis linfáticas. La aparición de metástasis a distancia se asocia prácticamente siempre (96,9%) a la progresión metastásica linfática previa. En el futuro, por tanto, se hacen necesarios nuevos estudios que valoren el manejo regional del CEC tanto en su manejo quirúrgico como adyuvante.
Cutaneous squamous cell carcinoma (cSCC) is the second leading cause of skin cancer mortality in Europe. Few studies have analyzed the different pathways of this tumor progression in its natural history. The main objective of this study was to analyze the different metastatic and progression pathways and their temporal occurrence in the evolution of cSCC.
Material and methodWe conducted a multicenter, retrospective, and observational study of consecutive high-risk sSCCs included in the SQUAMATA project.
ResultsA total of 222 out of the 1346 patients included relapsed. The most frequent route of progression was the lymphatic one (62.6%). A total of 20.2% of the cases with lymphatic progression developed distant metastases. Only 1 case (3.1%) of distant metastasis followed local recurrence without previous lymphatic metastasis. The median time to disease-related mortality was longer in patients who developed systemic metastases than in those who died of locoregional progression.
ConclusionsThe mortality of patients with cSCC is mostly due to the regional progression of their lymphatic metastases. The appearance of distant metastases is practically always (96.9%) associated with previous lymphatic metastatic progression. Therefore, in the future, new studies will be needed to assess the regional management of cSCC in both surgical and adjuvant therapies.
El carcinoma epidermoide cutáneo (CEC) es la segunda neoplasia cutánea maligna en frecuencia tras el carcinoma basocelular en nuestro país1. También es la segunda causa de mortalidad por cáncer de piel tras el melanoma1. Es un tumor con un bajo potencial metastásico. El CEC metastatiza preferentemente por vía linfática en el 3-5% de los casos, dependiendo de la localización, del tamaño, de la invasión en profundidad, de la invasión perineural o de la afectación ósea2.
Por otro lado, la biopsia selectiva del ganglio centinela (BSGC) es una técnica quirúrgica que se desarrolló ampliamente en otros tumores, como el melanoma, en base a su propensión a las metástasis regionales linfáticas, sin que tuviera un impacto en la supervivencia de estos pacientes3. En el caso del CEC, la utilidad de la BSGC es aún desconocida, siendo su porcentaje de positividad del 8-10%4.
Existen pocos estudios publicados sobre la historia natural en términos de progresión del CEC5, o bien que se hayan focalizado en el tiempo de evolución de las distintas formas de recidiva en la progresión de este tumor.
Comprender y analizar cómo progresan los CEC ayudaría a diseñar estrategias diagnósticas, terapéuticas y de seguimiento de estos pacientes.
El objetivo primario de este estudio es analizar las diferentes vías de progresión del CEC (recurrencia local, satelitosis, recurrencia linfática regional o metástasis a distancia) junto con el tiempo de evolución de estas. Como objetivos secundarios se analiza la relación de las distintas variables clínicas y patológicas con las diferentes formas de progresión.
Material y métodoParticipantes y diseño del estudioSe diseñó un estudio multicéntrico observacional retrospectivo incluyendo pacientes de ocho hospitales de referencia que participan en el proyecto SQUAMATA. Este proyecto se focaliza en el estudio de factores pronósticos del CEC y ha sido descrito previamente6. Los hospitales participantes son el Hospital Universitario de Salamanca, Salamanca (España); el Instituto Valenciano de Oncología, Valencia (España); el Hospital Germans Trias i Pujol, Badalona (España); el Hospital Clínic, Barcelona (España); el Hospital Universitari Vall d’Hebron, Barcelona (España); el Hospital Universitario Central de Asturias, Oviedo (España); el Hospital San Cecilio, Granada (España), y la University Hospital Città della Salute e della Scienza di Torino, Turín (Italia).
Se incluyó a los pacientes diagnosticados de un CEC de alto riesgo entre el 1 de enero de 2000 y el 31 de diciembre de 2020. Se consideró como un CEC de alto riesgo aquel tumor con diámetro ≥2cm, un grosor tumoral ≥6mm, la presencia de invasión perineural o linfovascular, una mala diferenciación histológica, la invasión más allá de la grasa subcutánea, la localización en oreja o labio y la inmunosupresión del paciente (trasplante de órgano sólido, leucemia linfocítica crónica, tratamiento inmunosupresor crónico o insuficiencia renal crónica).
En el caso de la presencia de múltiples CEC, solo el tumor con características de mayor riesgo fue incluido en la base de datos.
El estudio fue aprobado por el comité ético del Hospital Universitario Reina Sofía de Córdoba (registro n.° 3958).
El seguimiento de los distintos centros es similar y se basa fundamentalmente en las guías de la NCCN7, con un seguimiento de los pacientes cada 3-6meses los dos primeros años y cada 6-12meses a partir del tercer año, siendo anual a partir del quinto año. En caso de enfermedad regional, los controles son cada 2-3meses el primer año, cada 4-6meses hasta el tercer año y cada 6-12meses a partir del cuarto año. Las pruebas de imagen usadas en los controles son la ecografía, la tomografía axial computarizada (TAC) y, en casos donde se quería valorar la extensión local de tejidos, la resonancia magnética (RM).
Para el propósito del estudio se registró la primera vía de progresión. En función de esta se definieron cuatro grupos: recurrencia local (RL), recurrencia linfática regional (L), satelitosis/metástasis en tránsito (S) y metástasis a distancia (M).
La implicación de estas cuatro vías de progresión puede definir distintos patrones de diseminación, similar a como se han descrito clásicamente para el melanoma8,9.
Para aquellos pacientes que terminaron en exitus por la enfermedad, se describieron siete patrones o rutas de diseminación: patrón RL-Ex, desarrollo de RL y exitus (Ex); patrón RL-M-EX, desarrollo de RL, posteriormente M y Ex; patrón RL-L-Ex, desarrollo de RL, posteriormente L y posterior Ex; patrón RL-L-M-EX, desarrollo de RL, posteriormente L, M y finalmente Ex; patrón L-Ex, desarrollo directamente de L y posterior Ex; patrón L-M-Ex, desarrollo de L, posteriormente M y posterior Ex, y finamente patrón S-Ex, con el desarrollo de S y posterior Ex.
Se usó el test de chi-cuadrado para comparar las diferencias entre las distintas vías metastásicas (RL, L, S y M) y las distintas variables clínicas y patológicas categóricas (género, inmunosupresión, localización en cabeza/cuello, tronco/extremidades y manos/pies, diámetro ≤20mm vs. >20mm, grosor tumoral ≤6 vs. >6mm, invasión perineural, invasión linfovascular, grado de diferenciación, clasificación de la American Joint Committee on Cancer (AJCC)10 y clasificación del Brigham and Woman Hospital (BWH)11. La edad fue evaluada con la prueba de Kruskas-Wallis. Las pruebas significativas fueron evaluadas con análisis post hoc, con valores de p ajustados mediante el método de Holm. Se comparó mediante las curvas de Kaplan-Meier (KM) y la prueba del logaritmo de los rangos el tiempo hasta la observación de las diferentes formas de progresión. De forma similar, se compararon las curvas de KM para las metástasis linfáticas regionales como primera recidiva o tras recurrencia local por un lado, y las mismas metástasis linfáticas regionales en función de si progresaban regionalmente a metástasis sistémicas o bien si permanecía vivo el paciente. Por último, se valoró el tiempo hasta progresión en función del tipo de recidiva local, regional o a distancia. Se consideró un nivel de significación de p<0,05. Se utilizó el programa estadístico SPSS (IBM Corp. Released 2011. IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.).
ResultadosSe incluyeron un total de 1.346 pacientes con CEC primario de alto riesgo, de los cuales el 16,5% (n=222) experimentó algún tipo de recaída en su seguimiento. La mediana de seguimiento fue de 33meses. La tabla 1 refleja las características clínicas y patológicas de la población en función de las distintas vías de progresión. Únicamente se hallaron diferencias estadísticamente significativas en cuanto al estado de inmunosupresión, el diámetro tumoral y la probabilidad de exitus tanto por la neoplasia como por cualquier causa. La vía de diseminación más frecuente tanto en inmunocompetentes como en inmunodeprimidos fue la diseminación linfática (71,8% y 51%, respectivamente), mientras que las recurrencias locales y la diseminación mediante satelitosis fueron relativamente más frecuentes en los pacientes inmunodeprimidos (40% vs. 24,6% en inmunocompetentes). Las recidivas linfáticas fueron algo más frecuentes en los pacientes inmunocompetentes (71,8% vs. 51,1%). Los tumores que hicieron diseminación linfática fueron de mediana 5mm mayores en su diámetro que los que recurrieron localmente (25mm vs 20mm, p=0,01). En cuanto a los tumores que hicieron satelitosis como primera vía de diseminación, se observó que la mayoría fueron tumores ≤20mm (77,8%), a diferencia de los que hicieron recidiva linfática, que en su mayoría fueron superiores a los 2cm (61,0%).
Características clínicas y patológicas de los carcinomas cutáneos de alto riesgo en función de las distintas vías de diseminación (n=222)
| Características de la muestraa | Vía diseminación recurrencia local (RL) (n=74) | Vía diseminación satelitosis (S) (n=9) | Vía diseminación linfática (L) (n=139) | Total (n=222) | pb |
|---|---|---|---|---|---|
| Edad al diagnóstico | 0,615 | ||||
| Mediana (Q1, Q3) | 80,0 (72,0, 86,0) | 79,0 (73,0, 80,0) | 78,0 (72,0, 83,0) | 78,0 (72,0, 84,0) | |
| Sexo | 0,090 | ||||
| Hombre | 52 (70,3%) | (38,8%) | 5 (55,6%) | (3,7%) | 77 (55,4%) | (57,5%) | 134 (60,4%) | |
| Mujer | 22 (29,7%) | (25,0%) | 4 (44,4%) | (4,5%) | 62 (44,6%) | (70,5%) | 88 (39,6%) | |
| Inmunosupresión | 0,024 | ||||
| No | 35 (64,8%) | (24,6%) | 5 (55,6%) | (3,5%) | 102 (81,0%) | (71,8%) | 142 (75,1%) | NSc |
| Sí | 19 (35,2%) | (40,4%) | 4 (44,4%) | (8,5%) | 24 (19,0%) | (51,1%) | 47 (24,9%) | |
| ND | 20 | 0 | 13 | 33 | |
| Localización | 0,839 | ||||
| Cabeza y cuello | 63 (85,1%) | (35,0%) | 8 (88,9%) | (4,4%) | 109 (78,4%) | (60,6%) | 180 (81,1%) | |
| Tronco/Extremidades | 9 (12,2%) | (26,5%) | 1 (11,1%) | (2,9%) | 24 (17,3%) | (70,6%) | 34 (15,3%) | |
| Manos/Pies | 2 (2,7%) | (25,0%) | 0 (0%) | (0%) | 6 (4,3%) | (75,0%) | 8 (3,6%) | |
| Diámetro tumoral (mm) | 0,005 | ||||
| Mediana (Q1,Q3) | 20,0 (10,0, 30,0) | 18,0 (15,0, 20,0) | 25,0 (16,5, 37,0) | 22,0 (15,0, 34,0) | 0,01c RL vs L |
| ND | 0 | 0 | 3 | 3 | |
| Diámetro tumoral (mm) | 0,027 | ||||
| ≤20 | 38 (51,4%) | (38,8%) | 7 (77,8%) | (7,1%) | 53 (39,0%) | (54,1%) | 98 (44,7%) | NSc |
| > 20 | 36 (48,6%) | (29,8%) | 2 (22,2%) | (1,7%) | 83 (61,0%) | (68,6%) | 121 (55,3%) | |
| ND | 0 | 0 | 3 | 3 | |
| Grosor tumoral (mm) | 0,438 | ||||
| ≤6 | 31 (48,4%) | (36,5%) | 2 (28,6%) | (2,4%) | 52 (40,6%) | (61,2%) | 85 (42,7%) | |
| > 6 | 33 (51,6%) | (28,9%) | 5 (71,4%) | (4,4%) | 76 (59,4%) | (66,7%) | 114 (57,3%) | |
| ND | 10 | 2 | 11 | 23 | |
| Invasión perineural | 0,538 | ||||
| Ausente | 40 (80,0%) | (29,0%) | 6 (66,7%) | (4,3%) | 92 (74,8%) | (66,7%) | 138 (75,8%) | |
| Presente | 10 (20,0%) | (22,7%) | 3 (33,3%) | (6,8%) | 31 (25,2%) | (70,5%) | 44 (24,2%) | |
| ND | 24 | 0 | 16 | 40 | |
| Invasión linfovascular | 0,240 | ||||
| Ausente | 68 (93,2%) | (33,8%) | 7 (77,8%) | (3,5%) | 126 (90,6%) | (62,7%) | 201 (91,0%) | |
| Presente | 5 (6,8%) | (25,0%) | 2 (22,2%) | (10,0%) | 13 (9,4%) | (65,0%) | 20 (9,0%) | |
| ND | 1 | 0 | 0 | 1 | |
| Grado de diferenciación | 0,291 | ||||
| Bien | 9 (15,0%) | (27,3%) | 0 (0%) | (0%) | 24 (18,2%) | (72,7%) | 33 (16,5%) | |
| Moderado | 31 (51,7%) | (26,7%) | 7 (87,5%) | (6,0%) | 78 (59,1%) | (67,2%) | 116 (58,0%) | |
| Pobre | 20 (33,3%) | (39,2%) | 1 (12,5%) | (2,0%) | 30 (22,7%) | (58,8%) | 51 (25,5%) | |
| ND | 14 | 1 | 7 | 22 | |
| Estadificación AJCC8 | 0,121 | ||||
| T1 | 18 (24,3%) | (47,4%) | 1 (11,1%) | (2,6%) | 19 (13,8%) | (50,0%) | 38 (17,2%) | |
| T2 | 4 (5,4%) | (23,5%) | 0 (0,0%) | (0,0%) | 13 (9,4%) | (76,5%) | 17 (7,7%) | |
| T3 | 52 (70,3%) | (32,9%) | 8 (88,9%) | (5,1%) | 98 (71,0%) | (62,0%) | 158 (71,5%) | |
| T4 | 0 (0%) | (0%) | 0 (0%) | (0%) | 8 (5,8%) | (100,0%) | 8 (3,6%) | |
| ND | 0 | 0 | 1 | 1 | |
| Estadificación BWH | 0,424 | ||||
| T1 | 21 (28,4%) | (42,0%) | 2 (22,2%) | (4,0%) | 27 (19,6%) | (54,0%) | 50 (22,6%) | |
| T2a | 22 (29,7%) | (27,8%) | 3 (33,3%) | (3,8%) | 54 (39,1%) | (68,4%) | 79 (35,7%) | |
| T2b | 31 (41,9%) | (38,3%) | 4 (44,4%) | (4,9%) | 46 (33,3%) | (56,8%) | 81 (36,7%) | |
| T3 | 0 (0%) | (0%) | 0 (0%) | (0%) | 11 (8,0%) | (100,0%) | 11 (5,0%) | |
| ND | 0 | 0 | 1 | 1 | |
| Exitus por la enfermedad | <0,001 | ||||
| No | 57 (77,0%) | (41,6%) | 7 (77,8%) | (5,1%) | 73 (52,5%) | (53,3%) | 137 (61,7%) | <0,001 RL vs Lc |
| Sí | 17 (23,0%) | (20,0%) | 2 (22,2%) | (2,4%) | 66 (47,5%) | (77,6%) | 85 (38,3%) | |
| Exitus por otras causas | 0,280 | ||||
| No | 37 (68,5%) | (26,8%) | 5 (55,6%) | (3,6%) | 96 (76,2%) | (69,6%) | 138 (73,0%) | |
| Sí | 17 (31,5%) | (33,3%) | 4 (44,4%) | (7,8%) | 30 (23,8%) | (58,8%) | 51 (27,0%) | |
| ND | 20 | 0 | 13 | 33 | |
| Exitus por cualquier causa | 0,001 | ||||
| No | 41 (55,4%) | (46,6%) | 3 (33,3%) | (3,4%) | 44 (31,7%) | (50,0%) | 88 (39,6%) | <0,005 RL vs Lc |
| Sí | 33 (44,6%) | (24,6%) | 6 (66,7%) | (4,5%) | 95 (68,3%) | (70,9%) | 134 (60,4%) | |
AJCC-8: 8.a Clasificación del American Joint Committee on Cancer; BWH: clasificación del Brigham and Woman Hospital; L: linfática; ND: no disponible; NS: no estadísticamente significativo; Q1,Q2: primer y tercer cuartiles; RL: recurrencia local; S: satelitosis.
En referencia a la estadificación, destaca como la totalidad de los tumores T4 de la AJCC y T3 de la BWH se diseminaron de forma preferente a los ganglios linfáticos (100%). Por otra parte, los tumores de bajo riesgo T1 que progresaron lo hicieron casi en igual medida en forma de recurrencias locales o bien ganglionares (tabla 1).
En cuanto a mortalidad según las vías, se observó que los tumores que debutaron con una recidiva local presentaban menor porcentaje de mortalidad específica que los que lo hicieron en los ganglios (23% vs 47,5%, p<0,001) y también una menor mortalidad global (44.6% vs 68,3%, p<0,005) (tabla 1).
Es de remarcar que ni la edad, el sexo, la localización, el grado de diferenciación, el grosor tumoral, la invasión perineural o linfovascular ni la estadificación se distribuyeron de forma significativamente distinta entre las distintas vías de diseminación.
La figura 1 refleja las distintas vías metastásicas en la progresión del CEC primario. La vía de progresión más frecuente fue la linfática (n=139 [62,6%]), seguida de las recurrencias locales (n=74 [33,3%]) y las satelitosis (n=9 [4,4%]). En 12 casos de recurrencia local (16,2% de RL) hubo progresión linfática posterior.
Tipo de recidiva y diferentes vías metastásicas de los 222 pacientes con carcinoma cutáneo de células escamosas de alto riesgo que tuvieron recaídas durante su seguimiento. () Indica porcentaje (%) de pacientes, en los nodos es el % sobre el total de pacientes con recaída y en las flechas indica el % sobre el nodo superior.
En conjunto, de todos los casos con recidiva regional linfática, en 31 casos (20,5% de L) progresaron a metástasis sistémicas. Solo se describió un caso de recurrencia local y que desarrolló metástasis sistémicas directamente. No se hallaron metástasis sistémicas como primera vía de progresión, ni metástasis linfáticas tras satelitosis.
Los exitus de los pacientes con CEC fueron en su mayoría debidos a progresión regional linfática de su enfermedad (n=47 [54,6% de los exitus]) seguido de las metástasis sistémicas (n=27 [31,4% de los exitus]). Las progresiones locales fueron el motivo de exitus en el 11,6% (n=10) de los exitus. Finalmente, se registraron 2 fallecimientos por satelitosis (2,3% de los exitus).
Las distintas vías metastásicas y de progresión del CEC de los casos con resultado de exitus se representan en la figura 2. La vía metastásica más frecuente fue la ruta L-Ex (n=42 [49,4%]), seguida por la L-M-Ex (n=24 [28,2%]). La siguiente en frecuencia es la ruta RL-Ex (n=9 [10,6%]). El resto de las vías metastásicas y de progresión fueron de 5 o menos casos. Llama la atención que, con independencia de la vía metastásica, todas las recidivas regionales linfáticas aparecieron de media entre los 13 y los 18meses de seguimiento, así como los exitus por la enfermedad ocurrieron entre los 26 y 35meses de media desde el diagnóstico para las distintas vías metastásicas más frecuentes. Curiosamente, se observó una tendencia a un mayor tiempo hasta exitus en aquellos casos con metástasisL y posterior desarrollo de metástasis sistémicas (ruta L-M-Ex) con respecto a aquellos casos que únicamente progresaron a nivel local (ruta RL-Ex), por satelitosis (ruta S-Ex) o a nivel regional (ruta L-Ex).
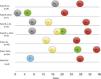
El análisis de supervivencia hasta la recaída en función del tipo de vía (RL, L y S) no mostró diferencias entre estas (fig. 3). Tampoco se apreciaron diferencias en el tiempo de supervivencia hasta la aparición de metástasis linfáticas en función de si eran la primera recidiva o bien tras recidiva local (fig. 4). Por último, el tiempo transcurrido hasta la aparición de las metástasis linfáticas no se correlacionó con el pronóstico, determinado como ausencia de posteriores progresiones respecto a progresión a metástasis sistémicas o progresión regional hasta el fallecimiento del paciente (fig. 5).
El presente estudio muestra que la progresión más frecuente para los CEC de alto riesgo es la vía linfática, y que esta vía es prácticamente obligatoria antes del desarrollo de metástasis sistémicas.
El proceso metastásico es un complejo proceso en el que unas células genéticamente inestables se adaptan a un microambiente tisular diferente a su tejido de origen12. Este proceso no es aleatorio, sino que las células tumorales generalmente tienen cierta apetencia por tejidos determinados en función de la estirpe tumoral en un modelo de diseminación denominado originalmente «semilla y terreno» por Paget en el sigloxix13. Este modelo explica por qué ciertos tumores como el cáncer de mama frecuentemente metastatizan en pulmón, hueso, hígado o cerebro, mientras que otros, como el cáncer de próstata, lo hace más en hueso. O bien que el melanoma uveal característicamente metastatice más a hígado, o bien los sarcomas a pulmón12.
En el caso de los CEC, la implicación más importante de estos hallazgos sería el manejo locorregional de la enfermedad. Más de la mitad de los pacientes en el estudio fallecen por progresión de las metástasis regionales linfáticas, lo que plantea si una disección linfática electiva podría beneficiar a estos pacientes, como en el caso del carcinoma de células escamosas de la cavidad oral14. Sin embargo, los estudios observacionales disponibles presentan resultados contrapuestos. Amit et al.15 no demostraron en un estudio observacional beneficio de la disección ganglionar electiva en pacientes con CEC frente a la observación. Por el contrario, Xiao et al.16, en otro estudio observacional, sí observaron mejoría en la supervivencia en los pacientes sometidos a una disección ganglionar electiva y parotidectomía superficial.
Esta progresión ordenada y gradual que muestra el CEC desde el tumor primario al ganglio linfático regional y de aquí a la diseminación metastásica es la base teórica ideal que avala la utilización terapéutica de la biopsia selectiva del ganglio centinela (BSGC). Es precisamente lo que hace décadas se denominó «hipótesis de la incubadora»17 por los defensores de la BSGC en el melanoma, en contraposición con la «hipótesis del marcador», que establecía que la presencia de metástasis en los ganglios linfáticos regionales constituye no un paso previo, sino un marcador de que el tumor ya se habría diseminado a otros órganos18,19. La observación de que el tiempo medio de supervivencia es mayor para las vías metastásicas que implican la aparición de metástasis sistémicas (fig. 2) con respecto a las mismas vías pero sin la diseminación sistémica apoya en cierta medida esta «hipótesis de la incubadora», hecho que no se observa en estudios similares para el melanoma8,9.
De forma paradójica, mientras que en el melanoma se dispone de un ensayo clínico que ha evaluado el papel de la BSGC3, sin que este haya demostrado un beneficio en la supervivencia, no se dispone aún de un ensayo que haya evaluado lo mismo en el CEC. Existen, no obstante, algunos estudios observacionales que han comparado a pacientes con CEC sometidos a BSGC con pacientes solo con observación sin que se haya observado diferencia en la supervivencia. En esta línea, nuestro grupo ha encontrado diferencias en un reciente estudio observacional cuando se ha estratificado por estado inmunológico del paciente, observándose una clara ventaja en la supervivencia libre de progresión únicamente en pacientes inmunocompetentes sometidos a BSGC (datos no publicados).
El problema para la indicación de esta técnica, así como la predicción en general de metástasis linfáticas y sistémicas, está lejos de ser resuelto, ya que solo el 4-5% de los pacientes desarrollarán metástasis linfáticas, y de ellos solo una cuarta parte, metástasis sistémicas. En una revisión sistemática reciente, la positividad de la BSGC en el CEC ronda el 8%, sin que se hayan identificado aún claros factores predictores de afectación4. La evidencia actual sobre las alteraciones genéticas en la regulación del ciclo celular, la supresión tumoral, la invasión tisular y microambiente y la interacción con el sistema inmune está aún lejos de ofrecer dianas concretas que puedan predecir con más exactitud los pacientes que van a progresar20.
En nuestra serie, el 11,6% de las muertes específicas fueron por progresión local. Estos datos muestran la importancia del control local de CEC. En una reciente revisión sistemática, la invasión profunda más allá de la grasa, o bien, y en menor medida, la desmoplasia son los factores histológicos que más predicen esta recurrencia21, siendo la cirugía de Mohs la opción preferida para el control local del CEC21. En una reciente revisión, el éxito de la BSGC en el CEC cutáneo no se vio afectada tanto si se hizo de forma sincrónica como asincrónica con la cirugía, incluyendo cirugía de Mohs22. Esto es importante en el contexto actual, en el que la cirugía de Mohs es un procedimiento cada vez más frecuente y la realización de la BSGC tendría que ser llevada a cabo tras el procedimiento23.
Como conclusión, la vía metastásica más frecuente de diseminación para el CEC es la vía linfática. Esta vía es prácticamente necesaria para la diseminación sistémica. La progresión regional de las metástasis linfáticas es también la causa principal de fallecimiento. Las medidas enfocadas al control regional de este tumor, como la BSGC, la disección ganglionar electiva o la radioterapia adyuvante, podrían tener un papel en la mejora de la supervivencia en esta enfermedad.
FinanciaciónEste estudio ha sido financiado por la Fundación Piel Sana de la Academia Española de Dermatología y Venereología. La investigación de JC está parcialmente financiada por el Instituto de Salud CarlosIII (cofinanciado por la Unión Europea) a través del proyecto PI21/1207, por la Gerencia Regional de Salud de Castilla y León (GRS2549/A/22).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.