La epidermólisis bullosa distrófica recesiva (EBDR) es una de las enfermedades raras (ER) de la piel más graves y que mayor interés ha suscitado en cuanto al desarrollo de estrategias avanzadas de intervención terapéutica. La EBDR es debida a la deficiencia de colágeno vii como consecuencia de mutaciones en el gen COL7A1, y los distintos abordajes terapéuticos buscan la reposición de colágeno vii para restituir la adhesión dermo-epidérmica. La variedad de terapias en evaluación incluyen tanto la proteica como diversas estrategias celulares y génicas. Algunas de estas estrategias tienen un potencial terapéutico que va más allá del defecto cutáneo, pudiendo corregir el problema también a nivel de las mucosas internas. En los próximos años se espera que estos nuevos abordajes brinden una mejora sustancial en la calidad de vida de los pacientes con EBDR.
Recessive dystrophic epidermolysis bullosa (RDEB) is among the most serious rare skin diseases. It is also the rare skin disease for which most effort has been expended in developing advanced therapeutic interventions. RDEB is caused by collagen VII deficiency resulting from COL7A1 mutations. Therapeutic approaches seek to replenish collagen VII and thus restore dermal-epidermal adhesion. Therapeutic options under development include protein therapy and different cell-based and gene-based therapies. In addition to treating skin defects, some of these therapies may also target internal mucosa. In the coming years, these novel therapeutic approaches should substantially improve the quality of life of patients with RDEB.
Las enfermedades hereditarias raras de piel, también conocidas como genodermatosis, constituyen en su conjunto una parte relevante de la patología y clínica dermatológica. Actualmente las bases genéticas de alrededor de 400 genodermatosis, en su mayoría enfermedades monogénicas, han sido dilucidadas, lo cual permite una clasificación precisa, su diagnóstico molecular y, en buena medida, la comprensión del mecanismo patogénico. Sin embargo, a pesar de este conocimiento, en la inmensa mayoría de los casos no existe un tratamiento curativo, sino fundamentalmente paliativo para estas enfermedades.
Las genodermatosis se agrupan en anormalidades de la adhesividad epitelial, la queratinización/cornificación, la pigmentación, la reparación del ADN, el tejido conectivo y las displasias ectodérmicas. En esta revisión nos centraremos en el primer grupo al que pertenece la epidermólisis bullosa (EB). La EB comprende un conjunto de genodermatosis que se caracterizan por fragilidad de la piel y mucosas, así como por la formación de ampollas por traumatismo mecánico o incluso sin él. La EB abarca un amplio espectro de fenotipos que va desde manifestaciones cutáneas y extracutáneas graves causadas por una adhesión dermoepidérmica muy comprometida, hasta rasgos discretos causados por defectos moleculares sutiles. La prevalencia de esta familia de enfermedades se estima entre 8 y 25 casos por millón1. Los pacientes con EB tienen necesidad de cuidados médicos específicos para tratar tanto las manifestaciones primarias de la enfermedad como las posibles complicaciones de las mismas que, en algunos casos, pueden resultar mortales.
En los últimos años, y gracias a la identificación de mutaciones en genes (hasta ahora 18) que codifican para proteínas de la zona de unión dermoepidérmica, se ha ido adquiriendo un mejor conocimiento de las formas de herencia y de las correlaciones genotipo-fenotipo de las diversas formas de la EB. Esto ha permitido una mejor clasificación de los diferentes tipos de EB. Para una revisión actualizada de la clasificación de EB, el lector puede acudir al reciente artículo de Fine et al.2. Lo más destacable es que la adquisición de todo este conocimiento sobre la EB a nivel molecular ha promovido el desarrollo de innovadoras y variadas estrategias terapéuticas3. Esta revisión se centrará en las nuevas terapias para la forma distrófica recesiva de la EB (EBDR).
La epidermólisis bullosa distrófica recesiva a nivel molecularTanto la EBDR como la forma dominante de la enfermedad (EBDD) son causadas por mutaciones en el gen COL7A1 que codifica para la proteína colágeno vii (C7). Esta proteína es el componente principal de las fibrillas de anclaje que engarzan el colágeno de tipo i de la dermis con proteínas de la membrana basal subepidérmica, tales como la laminina 332 (anteriormente conocida como laminina 5) actuando como un verdadero adhesivo dermoepidérmico, no solo en la piel, sino en mucosas como la esofágica. Estas fibrillas pueden observarse como tales a través de microscopia electrónica o detectarse como una banda continua situada en la membrana basal utilizando inmunofluorescencia con anticuerpos específicos contra C7 en biopsias de piel normal. La ausencia o disminución pronunciada de C7 es la característica principal de la EBDR y su determinación establece un diagnóstico molecular primario de la enfermedad que debe ser confirmado a nivel genético. La reposición de C7 constituye, por tanto, el leitmotiv de todos los abordajes terapéuticos actuales para EBDR aunque como veremos diversas fuentes de la proteína pueden ser empleadas.
El C7 es sintetizado tanto por los queratinocitos epidérmicos (o mucosos) como por los fibroblastos dérmicos, aunque en este tipo celular se produce en menor proporción (se estima que un tercio de lo que producen los queratinocitos). El C7 sintetizado se secreta y tiene la capacidad de dirigirse con facilidad hacia su localización habitual en la membrana basal. Este concepto es importante a la hora de diseños terapéuticos basados en manipulación genética o celular, ya que no es estrictamente necesario que todas las células produzcan C7, sino que exista un suministro mínimo suficiente que garantice la adhesividad dermoepidérmica.
Recientemente el grupo de los autores de esta revisión ha descrito el espectro de mutaciones en el gen COL7A1 en una cohorte de pacientes españoles que padecen tanto EBDR como EBDD4. Hasta la publicación de ese trabajo existía la noción de que cada mutación era exclusiva de la familia en que se había originado con poca o nula recurrencia. Ello era debido en parte a la gran cantidad de mutaciones descritas a lo largo de toda la secuencia de nucleótidos del gen. Sin embargo, en el trabajo de los autores, sorprendentemente se encontró que una mutación particular, la c.6527insC en el exón 80 del COL7A1, tiene lugar en un alto porcentaje de los casos de EBDR estudiados en España, dando cuenta de casi un 50% de los alelos identificados4. En estudios posteriores se encontró que existe un efecto fundador de esta mutación en población española5. Esta inserción de un nucleótido altera el marco de lectura del ARNm y ocasiona la aparición de un codón de parada prematura de la transcripción. El efecto final, en los pacientes homocigotos para la mutación, es la ausencia total de proteína C7 en la unión dermoepidérmica que ocasiona la grave fragilidad mucocutánea observada. El alto número de pacientes que presentan esta mutación en homocigosis hace que el desarrollo de una terapia dirigida pueda ser clínicamente relevante.
Otro de los eventos moleculares relacionados con el COL7A1, importantes en cuanto al desarrollo de estrategias terapéuticas, es el mosaicismo de reversión. En el caso de la EBDR este fenómeno, que da lugar a zonas o parches de piel clínicamente normales, se debe a la reexpresión de C7 como consecuencia de la aparición de mutaciones secundarias adquiridas que revierten la mutación primigenia en COL7A1. El grupo de los autores fue uno de los primeros en identificar este fenómeno en pacientes con EBDR6. Las causas de la reversión no se conocen. En el caso de la EB se piensa que la cicatrización exacerbada, que conlleva un exceso de proliferación celular, podría inducir nuevas mutaciones que cuando tienen lugar en un gen mutado como COL7A1, en el caso de la EBDR, podrían ser beneficiosas al contrarrestar el efecto de la mutación causal de la enfermedad. Por su mayor adherencia, los queratinocitos que sufren la mutación revertante podrían adquirir una ventaja selectiva, dando lugar a los parches clínicamente normales. Estos parches pueden servir como fuente de células autólogas corregidas para estrategias de terapia celular, como se describe más adelante.
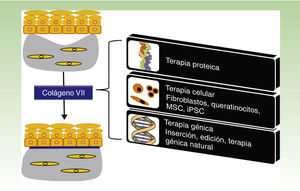
Una enfermedad, varias terapiasLa figura 1 esquematiza las diversas estrategias terapéuticas para EBDR que se están evaluando en la actualidad y que se describen en detalle a continuación.
Estrategias terapéuticas para epidermólisis bullosa distrófica recesiva. Los abordajes mediante proteínas, terapia celular y terapia génica (recuadros a la derecha) convergen en la producción de colágeno vii a nivel de la unión dermoepidérmica para corregir el fenotipo ampolloso de la piel (panel superior a la izquierda) que recupera su adherencia (panel inferior a la izquierda).
A priori, la forma más evidente para corregir un déficit proteico como el de C7 parecería la administración de la proteína ausente o disminuida. Dadas sus características moleculares, de solubilidad y localización tisular, no parecía que C7 pudiese administrarse fácilmente ni que alcanzase su zona específica de expresión. Sin embargo, estudios preliminares del grupo de los Dres. Woodley y Chen demostraron que el monómero de la proteína era lo suficientemente soluble para preparar soluciones que pueden administrarse tanto de forma subcutánea en las zonas heridas como sistémica (por vía intravenosa). Se demostró en modelos de EBDR en ratón que la proteína inyectada tenía la capacidad de migrar hacia la membrana basal y corregir el fenotipo ampolloso7. La ventaja de la administración sistémica es que permitiría no solo una mejora de la enfermedad a nivel cutáneo, sino también a nivel de los epitelios internos, cuya afectación trae aparejadas dificultades para la ingesta de alimentos sólidos en los pacientes con EBDR. En función de estos trabajos en la actualidad existe una compañía (Lotus Tissue Repair Inc, adquirida recientemente por Shire Biopharmaceuticals) produciendo C7 recombinante, aunque aún no se ha formalizado un ensayo clínico para su uso.
Terapia celularTanto los queratinocitos como los fibroblastos dérmicos son capaces de secretar C7. En condiciones de homeostasis los queratinocitos son la fuente principal del C7 que se localiza en la unión dermo-epidérmica. Sin embargo, existen varios abordajes de terapia celular para la EBDR en mayor o menor grado de implementación clínica, en los cuales las células suministradoras de C7 son de origen mesenquimal. Un protocolo basado en el trasplante de médula ósea o sangre de cordón umbilical de un donante sano histocompatible HLA-idéntico fue postulado como de gran potencial curativo. Este abordaje sistémico tiene la ventaja añadida de que, tal como se comentó para las inyecciones de proteína, podría inducir mejoría en epitelios internos además de sobre la piel. Hasta ahora se han tratado más de 10 pacientes (ClinicalTrials.gov referencia NCT01033552) y los resultados parecen prometedores8,9. Queda pendiente valorar la persistencia de los efectos terapéuticos, así como elucidar sus mecanismos subyacentes, ya que aún no hay certeza sobre el tipo celular que media el efecto terapéutico. Existen evidencias de que las células con tropismo hacia las zonas afectas no serían células de estirpe hematopoyética (CD34+), sino fundamentalmente precursores mesenquimales positivos para el receptor de PDGF10. Esto último es alentador, ya que el trasplante de células CD34+ es una terapia que no está exenta de importantes efectos adversos, inherentes al abordaje (acondicionamiento de los pacientes y enfermedad injerto contra huésped) e incrementados por el hecho de tratarse de pacientes mórbidos.
Otra opción terapéutica es el empleo de fibroblastos alogénicos de donantes sanos, que a diferencia de los queratinocitos puedan ser relativamente bien tolerados por el sistema inmune del paciente. Como se comentó anteriormente los fibroblastos, aunque en menor grado, son también capaces de producir C7. El grupo de Bruckner-Tuderman en Alemania reportó que cuando se administraban por inyección intradérmica fibroblastos sanos en un modelo murino de EBDR estos eran capaces de producir C7 in vivo, y que este migraba a la membrana basal restituyendo la adhesión dermoepidérmica11,12. La estrategia se trasladó a pacientes y en este contexto los resultados confirmaron el efecto observado a nivel preclínico: los niveles de C7 producidos por los fibroblastos de donante sano aportados de forma local (30-40% de los niveles encontrados en la membrana basal de individuos controles) resultaron en una mejoría de la fragilidad cutánea. Sin embargo, en estos estudios el efecto fue de corta duración, probablemente por la desaparición de los fibroblastos alogénicos debido a un rechazo inmunológico silente13,14.
Una mención especial merecen los tratamientos con células madre mesenquimales (MSC). Las MSC son células multipotentes que pueden aislarse de la médula ósea, la grasa subcutánea, la sangre del cordón umbilical y la placenta15, siendo las de lipoaspirado las más fáciles tanto de aislar como de cultivar y expandir16. La capacidad de las MSC de migrar a zonas de daño y facilitar la regeneración tisular se ve ahora como un componente esencial de su potencial terapéutico. Por ello, existe un gran interés en valorar en el contexto de investigación clínica el potencial terapéutico de las MSC en enfermedades degenerativas e inflamatorias. El efecto terapéutico de las MSC administradas de forma sistémica y local está siendo investigado actualmente en más de 200 ensayos clínicos en distintas fases y para diversas enfermedades, tales como artritis reumatoide, enfermedad de Crohn, EICH, infarto de miocardio, esclerosis múltiple, daños de la médula espinal y otras17. El hallazgo de que la población celular responsable del efecto terapéutico observado después del trasplante de médula ósea en pacientes con EBDR sería de origen mesenquimal ha llevado a proponer el trasplante de MSC para el tratamiento de EBDR, en lugar de un trasplante convencional de médula ósea. Tal aproximación por un lado eliminaría el peligro del EICH y la necesidad de acondicionamiento mieloablativo, y por el otro abriría la posibilidad de llevar a cabo trasplantes alogénicos sin necesidad de buscar donantes histocompatibles, ya que se ha demostrado en diversos estudios clínicos que las MSC, por los efectos inmunosupresores/inmunomoduladores que ejercen, resultan invisibles para el sistema inmune del receptor del trasplante. La administración intradérmica de MSC de donante sano ha demostrado ser capaz de producir C7, al menos por 4 meses, en la unión dermoepidérmica y reducir la aparición de ampollas e inducir la reepitelización de las heridas crónicas en 2 pacientes con EBDR18. Existen 19 ensayos clínicos registrados en la base de datos del National Institutes of Health para EBDR (www.clinicaltrials.gov). Dos de estos ensayos clínicos tienen por objeto determinar la seguridad y eficacia de MSC alogénicas (de donante sano) para el tratamiento de la EBDR y están empezando a reclutar pacientes. Uno de ellos se está realizando en Japón y consiste en la administración intradérmica de MSC derivadas de médula ósea (UMIN000006723). El otro ensayo se realiza en el Reino Unido y se basa en la infusión sistémica de MSC alogénicas derivadas de médula ósea (ISRCTN46615946). En España el grupo de los autores en colaboración con profesionales del Hospital La Paz en Madrid está en proceso de solicitar los permisos correspondientes para un ensayo clínico basado en la infusión de MSC de lipoaspirado. La terapia celular local con MSC también representa una estrategia atractiva para las úlceras en EBDR, ya que las MSC han demostrado ser capaces de controlar la inflamación característica de algunos lechos crónicos, un obstáculo trascendental para la regeneración cutánea. Se ha reportado, además, que las MSC ejercen también una variedad de efectos pleiotrópicos (citoprotectores, antifibróticos y antimicrobianos) que actuarían sinérgicamente con la producción de C7, promoviendo una cicatrización eficiente19. Finalmente la duración del efecto terapéutico podría ser considerable, dada la larga vida media del C7 in vivo.
Dentro de las terapias celulares podemos incluir también algunos ensayos basados en productos de ingeniería tisular para aplicación directa sobre las heridas. A día de hoy, sin embargo, los resultados publicados con diversos tipos de productos organotípicos 3D conteniendo solo fibroblastos o fibroblastos y queratinocitos han sido modestos20,21. Un abordaje llevado a cabo por los autores, basado en el empleo de trasplantes de pieles bioingenierizadas conteniendo fibroblastos y queratinocitos histocompatibles (HLA-idénticos) ha dado buenos resultados en un número reducido de pacientes con EBDR (del Río et al., resultados no publicados). Nuevas aproximaciones con potencial terapéutico, como las que incluyen MSC en combinación con matrices de fibrina u otros biomateriales, están aún por evaluarse clínicamente.
Terapia génicaPor tratarse de enfermedades monogénicas la terapia génica se plantea como una posible estrategia curativa para la EB y otras genodermatosis. En los últimos 12 años se han realizado numerosos estudios preclínicos exitosos de terapia génica ex vivo para distintas formas de EB, incluyendo algunos en España por el grupo de los autores utilizando modelos de ratón con piel humanizada de EBDR y otras formas de EB22,23. Hasta el momento el único ensayo clínico exitoso publicado es el llevado a cabo por Mavilio et al. en Italia24, en un paciente de EB juntural (EBJ). En este ensayo se obtuvieron queratinocitos del paciente de EBJ a los que se transfirió, mediante un vector retroviral convencional, el cADN de la cadena β3 de la laminina 332. Los queratinocitos modificados genéticamente se trasplantaron en forma de epitelio simple cultivado a sendas lesiones de unos pocos cm2 de ambas piernas del paciente. El resultado fue el injerto de estas pieles modificadas con recuperación de su adhesividad dermo-epidérmica. Por otra parte, la larga duración del injerto (más de 8 años desde el trasplante) demostró que el gen curativo había sido transferido a la población de células madre epidérmicas. En cuanto a la EBDR varios laboratorios, incluido el de los autores, han demostrado la posibilidad de corrección ex vivo de células de la piel de pacientes (queratinocitos y fibroblastos) en diferentes estudios preclínicos, utilizando vectores virales integrativos (retro y lentivirus) y no virales que incluyen el cADN silvestre del gen COL7A122,25,26. Dos protocolos de terapia génica para EBDR se encuentran en fase de ensayo clínico, uno en Estados Unidos (ClinicalTrials.gov referencia NCT01263379) y otro en Europa (www.genegraft.eu). En el ensayo de Estados Unidos se emplea un vector retroviral convencional25 y el trasplante del epitelio cultivado de forma similar al protocolo de EBJ24. En el ensayo europeo, financiado por la UE y en el que participan los autores, se utiliza un vector retroviral autoinactivante26 y combina la terapia génica ex vivo con la ingeniería tisular de piel, ya que se trasplantará una piel bioingenierizada portadora tanto de queratinocitos como de fibroblastos modificados genéticamente. Existen también otros abordajes basados en la transferencia génica no viral mediante el sistema transposón/transposasa27 o por corrección vía ARN del gen mutado que se encuentran en fase experimental28,29. Asimismo, se ha visto que algunos antibióticos de la familia de los aminoglucósidos son potencialmente capaces de inducir un bypass del codón prematuro de terminación de la transcripción del ARNm que se produce como consecuencia de algunas mutaciones en el COL7A1, con lo que una aplicación tópica de este tipo de fármacos podría utilizarse in vivo para corregir de forma transitoria el efecto de la mutación con producción concomitante de C730.
Debido a los efectos adversos registrados en protocolos clínicos de terapia génica para la inmunodeficiencia ligada al cromosoma X (X-SCID) en los que se observó que el vector retroviral de transferencia génica utilizado inducía la activación de un oncogén conduciendo al desarrollo de leucemias31 en algunos pacientes, el devenir de la terapia génica ha transcurrido en los últimos años sobre una búsqueda de nuevas estrategias más bioseguras. Se trataba de utilizar protocolos que minimizaran los riesgos debidos a la mutagénesis por inserción del vector portador del gen curativo, y hasta hace relativamente poco los esfuerzos se centraron sobre todo en mejorar los vectores de transferencia génica23,31. Sin embargo, en los últimos 4 años se produjo una revolución en el campo con la llegada de herramientas moleculares que facilitan la edición del genoma32, minimizando riegos genotóxicos. Estas herramientas moleculares corresponden a enzimas que cortan el ADN (nucleasas), pero que no actúan al azar, sino sobre secuencias genómicas específicas. Esto se consigue gracias a la acción de otras proteínas o ARN que dirigen a las nucleasas al sitio diana de corte buscado. El corte en el ADN desencadena procesos de reparación que facilitan, por ejemplo a través de recombinación homóloga, el reemplazo del gen defectuoso por uno sano apropiadamente suministrado. El pasado año se describió la corrección, mediante una de estas estrategias, de una mutación en el gen COL7A133. Las herramientas moleculares utilizadas en ese caso sobre fibroblastos de un paciente EBDR fueron las Transcription Activator-Like Effector Nucleases33. Otra herramienta en uso actualmente es el sistema Clustered Regularly Interspaced Short Palindromic Repeats y se basa en un sistema que está constituido por un ARN que reconoce específicamente una secuencia de ADN y actúa como guía de una nucleasa (Cas9), que corta el híbrido en la posición marcada por el ARN guía. Este sistema Clustered Regularly Interspaced Short Palindromic Repeats/Cas9ha sido utilizado para favorecer la recombinación homóloga para la corrección de mutaciones34 o la modificación genética en células madre35,36. Como se mencionó previamente, la mutación de COL7A1 c.6527insC crea un codón de terminación prematuro de la transcripción, por lo que el ARNm no codifica para C7. Además de la recombinación homóloga, existen otras aproximaciones para corregir el marco de lectura del ARNm de COL7A1. Una de ellas, que se está ensayando en el laboratorio de los autores, consiste en conseguir que la maquinaria de procesamiento del ARN mensajero excluya al exón 80 portador de la mutación. Esto daría como resultado la restauración del marco de lectura (perdido por la inclusión de una C de más en el exón 80) y que la transcripción del ARNm de COL7A1 llegue hasta el final. Por tanto, se recuperaría la producción de proteína, que mantiene su funcionalidad a pesar de carecer de los 12 aminoácidos codificados por el exón 80 (Larcher, resultados no publicados). Este tipo de ensayos se han realizado con éxito sobre células de distrofia muscular de Duchene37.
Los recientes avances en ingeniería de tejidos de la piel y en procedimientos quirúrgicos experimentales han hecho posible analizar el potencial in vivo de células madre epidérmicas individuales modificadas, genéticamente seleccionadas sobre la base de su capacidad proliferativa en cultivo. De hecho, el grupo de los autores fue capaz de regenerar la piel humana a largo plazo utilizando clones de células madre epidérmicas genéticamente modificadas conocidos como holoclones38. Enfoques similares serán necesarios para poner a prueba las capacidades regenerativas de células portando el locus COL7A1 corregido mediante edición génica.
Terapia génica naturalEl fenómeno de reversión génica descrito previamente puede considerarse como una forma de terapia génica natural y espontánea, sin mediar manipulación alguna. Las células revertidas pueden obtenerse a partir de una biopsia de la zona revertida y utilizarse para producir equivalentes de piel autóloga cultivada trasplantable, tal como se hace en grandes quemados. La idea, sin embargo, no es producir grandes extensiones de piel, sino la suficiente como para tratar heridas concretas que no cicatrizan y con propensión a desarrollar carcinomas, como es el caso de los pacientes con EBDR severa generalizada. Este abordaje ha sido probado con éxito de forma preclínica utilizando trasplantes de pieles bioingenierizadas conteniendo queratinocitos revertidos de un paciente con EBJ a ratones inmunodeficientes. En este estudio pudo demostrarse que a pesar de contar solo con un 20% de células revertidas la piel humana regenerada en los ratones era clínicamente normal39. Recientemente, el grupo de Jonkman et al. ha demostrado la validez de la estrategia, aunque sin hacer uso de producción de piel por ingeniería tisular, en un paciente con EBJ. Estos autores llevaron a cabo con éxito simplemente el trasplante de biopsias (punch) de piel de la zona revertida a heridas crónicas del paciente. Se pudo demostrar tanto la persistencia de la piel trasplantada como la mejoría clínica, ya que las zonas trasplantadas no producían ampollas40.
Terapias para el futuroAsí como el campo de la terapia génica está avanzando gracias a nuevas alternativas como las de corrección mediante edición génica, la regeneración de tejidos está viviendo una verdadera revolución con el advenimiento de las células madre pluripotentes inducidas o iPSC. Estas células, con características casi idénticas a las células madre embrionarias, pueden generarse a partir de células adultas de la piel o de otros tejidos mediante la expresión de los llamados factores de Yamanaka41. En condiciones adecuadas, que en algunos casos no han sido aún determinadas, las iPSC pueden diferenciarse a cualquier estirpe celular deseada y en cantidades ilimitadas41. El campo de la dermatología no es ajeno a estos avances, ya que una de las posibilidades de las iPSC es la producción de piel autóloga cuando la oferta de células cutáneas (en particular de células madre epidérmicas) está restringida, como es en el caso de la EB u otras enfermedades42. Diversos grupos han reportado la generación de iPSC a partir de células de pacientes con EBDR antes o después de su corrección genética33,43. Un trabajo reciente demostró la posibilidad de corregir fibroblastos EBDR mediante recombinación homóloga facilitada por Transcription Activator-Like Effector Nucleases, su reprogramación a iPSC y finalmente la diferenciación de estas a queratinocitos, combinando así las tecnologías más punteras33. Recientemente también se han obtenido iPSC de células EBDR naturalmente corregidas por reversión, lo que permitiría derivar tanto células epiteliales como mesenquimales autólogas para terapias cutáneas y/o sistémicas44.
Consideraciones finalesEn los últimos años las ER en su conjunto han pasado a tener un reconocimiento y difusión inéditos previamente en esferas sociales, políticas y sanitarias gracias a la acción fundamental de las asociaciones de pacientes y otros organismos sin ánimo de lucro. Esta nueva consideración de las ER ha permitido incrementar los fondos destinados a su investigación. En su nuevo programa, H2020, la UE potencia la investigación en ER de manera formidable. En España los nuevos programas de investigación 2013-2016 siguen esa línea con las restricciones locales. La iniciativa CIBERER (www.cibere.es) del Instituto de Salud Carlos III, que agrupa a un número importante de laboratorios que investigan en ER, ha sido fundamental para el progreso del campo. Los avances en genodermatosis, que incluyen la EBDR y que comparativamente superan a los de otras ER, se deben en gran medida a ese nuevo impulso. En los próximos años veremos los frutos de estos avances, pero para ello debe seguir promoviéndose la inversión en ER tanto pública como privada.
FinanciaciónLos autores agradecen la financiación del Ministerio de Economía y Competitividad de España a través de los proyectos SAF2013/43475-R (MDR) y PI14/00931 del ISCIII (FL) y de la Comunidad de Madrid a través de los proyectos S2010/BMD-2420 (MDR) y S2010/BMD-2359 (FL).
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Los autores agradecen a todos los integrantes de los grupos Termeg (www.uc3m.termeg.es) y de la División de Biomedicina Epitelial del CIEMAT que han contribuido a la realización de los trabajos referenciados en esta revisión.