El queratoacantoma es considerado hoy día un carcinoma epidermoide in situ que aparece principalmente en pacientes mayores de 70 años. Se trata de un tumor de buen pronóstico que, en algunos casos, muestra resolución espontánea.
El tratamiento de este tipo de tumoración es la exéresis simple. Sin embargo, la localización preferente en las regiones facial y acral, el tamaño y su rápido crecimiento son factores que hacen que la cirugía sea en algunos casos agresiva y antiestética.
ObjetivoEl objetivo principal del estudio es evaluar la eficacia de la infiltración intralesional de metotrexato en la reducción del tamaño prequirúrgico de la lesión y del correspondiente defecto quirúrgico resultante de la intervención.
Material y métodosSe realizó un estudio prospectivo aleatorizado en el que se incluyeron todos aquellos pacientes atendidos en nuestro Servicio diagnosticados de queratoacantoma de al menos 1,5cm de tamaño entre enero de 2009 y enero de 2010. Se establecieron dos grupos, uno en el que los pacientes recibieron una infiltración de metotrexato previamente al acto quirúrgico y otro en el que se realizó directamente la cirugía.
ResultadosDe los 25 pacientes incluidos en el estudio, 10 casos recibieron neoadyuvancia con metotrexato intralesional (grupo A) y 15 casos fueron intervenidos mediante cirugía aislada (grupo B).
Los pacientes del grupo A mostraron una reducción en el tamaño tumoral en el momento de la cirugía que osciló entre un 50 y un 80%. Ninguno de los pacientes presentó complicaciones relacionadas con la inoculación del metotrexato ni con la intervención quirúrgica.
En el grupo B sólo uno de los casos mostró una discreta disminución de sus dimensiones en el momento del acto quirúrgico. El resto de las lesiones mostraron una estabilidad (4 casos; 26%) e incluso un aumento de las dimensiones del tumor (10 casos; 66%) en el momento de la intervención. Cinco de los casos incluidos en este último grupo requirieron ingreso hospitalario en relación con la intervención quirúrgica.
ConclusionesEl metotrexato intralesional como terapia neoadyuvante es una medida bien tolerada, que permite evitar cirugías agresivas en pacientes de edades avanzadas que presentan un queratoacantoma de diámetro superior a 1,5cm localizado en la región facial y acral.
Keratoacanthoma is currently considered to be an in situ squamous cell carcinoma that mainly affects patients over 70 years of age. The tumor has a good prognosis and, in some cases, can resolve spontaneously. Treatment involves simple excision. However, since the tumors generally occur on the face or extremities and display rapid growth, aggressive surgery may be required and the cosmetic results may be poor.
ObjectiveThe primary study objective was assessment of the efficacy of presurgical intralesional methotrexate infiltration to reduce the size of the tumor and the corresponding surgical defect.
Material and methodsA prospective, randomized study was undertaken in patients with a diagnosis of keratoacanthoma of at least 1.5cm who were seen in our service between January 2009 and January 2010. Two groups were established: one receiving a single infiltration of methotrexate prior to surgery and another that did not receive methotrexate.
ResultsOf the 25 patients included in the study, 10 received neoadjuvant intralesional methotrexate (group A) and 15 underwent surgery without prior infiltration of methotrexate (group B). The patients in group A displayed a reduction of between 50% and 80% in the size of the lesion prior to surgery. No complications were observed either in relation to methotrexate infusion or surgery. In group B, only 1 patient had a slight reduction in the dimensions of the lesion prior to surgery. In the remaining cases, the lesions remained similar (4 cases, 26%) or had increased in size (10 cases, 66%) at the time of surgery. Five patients in this group required hospital admission following surgery.
ConclusionsNeoadjuvant intralesional methotrexate is well tolerated and reduces the need for aggressive surgery in elderly patients with keratoacanthoma measuring more than 1.5cm on the face or extremities.
El queratoacantoma (QA) es una tumoración cutánea que aparece comúnmente como una lesión solitaria localizada en áreas fotoexpuestas de pacientes de edades avanzadas. Desde el punto de vista clínico se caracteriza por un crecimiento rápido, en ocasiones seguido de un período de involución parcial y, más raramente, completa1,2. Los QA muestran unos hallazgos histológicos característicos que incluyen un cráter relleno de queratina delimitado por un epitelio escamoso proliferante atípico. Existe suficiente evidencia como para considerar que el QA es una variante clínica característica de carcinoma epidermoide bien diferenciado, aunque todavía hoy día es motivo de debate1,2.
A pesar de que algunos casos pueden involucionar, la clasificación de QA como un carcinoma epidermoide cutáneo bien diferenciado con potencial capacidad metastática hace que esta tumoración deba ser tratada de forma definitiva.
El tratamiento de elección es la exéresis quirúrgica, bien estándar1,2, bien en fresco procesada mediante la técnica micrográfica de Mohs3,4. Como tratamientos alternativos se han utilizado los retinoides sistémicos5, la radioterapia6,7, el curetaje-electrocoagulación8–10, la utilización de 5 fluorouracilo intralesional11–14 y metotrexato intralesional (MTX il)15–24. En menor medida se ha utilizado interferón alfa-2b intralesional25 e imiquimod tópico26.
Desde el punto de vista quirúrgico, en muchas ocasiones los QA se localizan en áreas en las que el tamaño tumoral supone un riesgo de alteración funcional y/o estética importante.
La utilización de alguna técnica neoadyuvante a la cirugía, que permitiera reducir las dimensiones tumorales en el momento de la intervención, conllevaría una cirugía más sencilla con mejores resultados funcionales y estéticos.
El objetivo principal del estudio es evaluar la eficacia de la infiltración intralesional de metotrexato en la reducción del tamaño prequirúrgico de la lesión y del correspondiente defecto quirúrgico resultante de la intervención. Como objetivos secundarios se incluyen la evaluación del porcentaje de pacientes que requieren técnicas de reconstrucción avanzadas, el grado de tolerancia a la técnica por parte del paciente y las complicaciones que se asocian al tratamiento con metotrexato intralesional.
Material y métodosSe realizó un estudio unicéntrico, prospectivo, doble ciego, sin control con placebo y de grupos paralelos. Los pacientes incluidos proceden del Servicio de Dermatología de la Fundación Instituto Valenciano de Oncología, en los que se estableció el diagnóstico clínico e histológico de QA entre el 1 de enero de 2009 y el 1 de febrero de 2010.
Pacientes incluidos en el protocoloPara el estudio se consideraron los siguientes criterios de inclusión: a) edad del paciente superior a 18 años; b) localización de la lesión en la región facial o en partes acras; c) tamaño de la lesión superior a 1,5cm; y d) ausencia de alteraciones en las funciones hepática, hemática y/o renal.
El estudio fue aprobado por el comité ético del hospital de origen y los pacientes firmaron previamente un consentimiento informado.
Definición de los grupos de estudioSe dividió al conjunto de pacientes en dos grupos, A y B, de forma aleatorizada, en la primera consulta mediante cuartillas con las letras A (equivalente a grupo A) o B (equivalente a grupo B) contenidas en sobres cerrados preparados por un observador ajeno al estudio. En los pacientes incluidos en el grupo A se procedió a la realización de una infiltración de MTX- intralesional (il). El grupo B no recibió ningún tipo de tratamiento. En ambos grupos se llevó a cabo la exéresis de las tumoraciones en un intervalo comprendido entre 30 y 35 días tras la primera consulta.
Se realizó un cuaderno de recogida de datos en el que se incluyó de forma detallada la información clínica y quirúrgica más relevante de los pacientes del estudio, así como los efectos secundarios asociados a esta técnica. Junto a ello se objetivaron los cambios producidos en el aspecto y en el tamaño de la tumoración mediante la obtención de imágenes fotográficas en la visita inicial y en el momento del acto quirúrgico.
Cuaderno de recogida de datosEl cuaderno recogió, en primer lugar, todos los datos personales del paciente (edad y sexo). En segundo lugar se incluyeron las características clínicas de la lesión en la primera consulta del paciente (tiempo de evolución, localización, tamaño). Para objetivar el aspecto clínico de la lesión se tomó una imagen fotográfica en la primera visita.
En un tercer apartado se recogieron datos referentes a la administración del MTX-il. Dentro de ellos se incluyeron la cantidad en mililitros de MTX-il necesaria para conseguir la coloración amarillenta completa de la tumoración, así como la aparición de molestias durante su infiltración (sí/no).
En un cuarto apartado se recogieron los datos relativos a la intervención quirúgica: tamaño de la lesión (en centímetros), tamaño del defecto quirúrgico (en centímetros), la forma de cierre del defecto (cierre directo/colgajo/injerto). Se obtuvo una imagen fotográfica el día de la exéresis quirúrgica para objetivar el tamaño de la lesión final y del defecto quirúrgico.
Variables analizadas en el estudioLa variable principal del estudio fue el grado de reducción de la tumoración problema, obtenido mediante los datos del tamaño recogidos en el cuaderno de recogida de datos. De forma secundaria se evaluaron las diferencias en el tamaño del defecto quirúrgico, el porcentaje de pacientes que requirieron técnicas de reconstrucción avanzadas, el porcentaje de casos que requirió ingreso hospitalario, así como el porcentaje de pacientes que presentaron complicaciones.
Aplicación de metotrexato intralesionalEstudios analíticosTodo paciente sometido al tratamiento neoadyuvante con MTX-il fue sometido previamente a la infiltración del fármaco a un análisis de sangre, que incluyó un hemograma, un perfil hepático y un perfil renal. Se realizó una segunda analítica 7 días después de la administración del MTX-il con la finalidad de descartar posibles repercusiones sistémicas del fármaco.
Material utilizado para el tratamiento neoadyuvanteSe administró MTX en solución inyectable procedente de viales de 40ml que contienen 1.000mg del fármaco (25mg/ml de MTX en excipiente de cloruro de sodio, hidróxido de sodio, ácido clorhídrico y agua para inyectable). Estos viables son estables a temperatura ambiente, y si se manipulan asépticamente y protegidos de la luz pueden ser utilizados durante los siguientes tres años desde su apertura.
Se utilizaron jeringuillas de 5ml y agujas de 30 gauge para la infiltración de la tumoración.
Método de infiltración de la tumoraciónSe realizó la infiltración del MTX-il en la base de la lesión, hasta conseguir que esta adquiriera una coloración amarillenta (fig. 1).
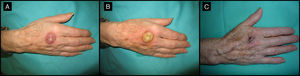
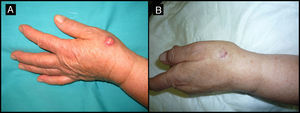
Mujer de 80 años con lesión clínica e histológicamente compatible con QA de 4 meses de evolución (caso 5, tabla 1). A. Lesión de 2,5cm de tamaño, localizada en el dorso de la mano derecha. B. Aspecto amarillento de la lesión tras infiltración de MTX-il. C. En el momento de la cirugía reducción de la lesión a una pequeña tumoración de 1cm de diámetro.
El desarrollo de efectos secundarios por MTX il fue recogido en el cuaderno de datos. Se evaluaron tanto las complicaciones derivadas de la técnica de inyección como las propias del MTX. Respecto a las primeras se evaluó la existencia de molestia en la inoculación del MTX, así como el desarrollo de necrosis o cualquier otro tipo de complicación local. Las posibles complicaciones sistémicas del MTX fueron evaluadas mediante un análisis de sangre realizado tras 7 días de su administración intralesional, que incluyó un hemograma, un perfil hepático y renal, así como un perfil lipídico y un sedimento de orina.
Metodología de evaluación de resultados y análisis estadísticoEl cuaderno de recogida de datos, que incluyó soporte fotográfico, fue evaluado por un investigador externo ajeno al método de aleatorización y a la elaboración del estudio.
No se realizó un cálculo previo del tamaño muestral, ya que los casos incluidos en el presente trabajo son poco frecuentes. Por ello se decidió incluir a los mismos en función de un criterio temporal, es decir, todos aquellos pacientes diagnosticados desde enero de 2009 a febrero de 2010.
Estadísticamente se compararon las variables cuantitativas mediante el test de la «t» de Student. Las variables cualitativas se compararon mediante tablas de contingencia y la prueba de la Ji-cuadrado o la F de Fisher. Se estableció la significación estadística para p<0,05. El estudio estadístico se realizó con el programa SPSS versión 15.0.
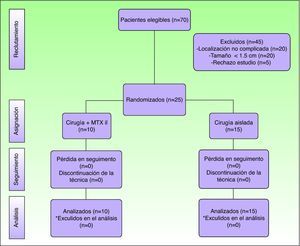
ResultadosSe incluyeron en el estudio un total de 70 pacientes en los que se estableció el diagnóstico clinicopatológico de QA. De ellos, 25 (36%) cumplieron los criterios de inclusión del estudio. El resto de los casos fueron descartados por las siguientes causas (fig. 2): tamaño inferior a 1,5cm (20 casos), localizaciones diferentes a la región facial o acra (20 casos) y pacientes que rechazan el estudio (5 casos).
Los pacientes válidos fueron divididos de forma aleatorizada en dos grupos, grupo A (tratados con MTX-il neoadyuvante, 10 casos) y grupo B (sin MTX-il neoadyuvante, 15 casos).
Las características de los pacientes incluidos en el estudio se recogen en las tablas 1 (grupo A) y 2 (grupo B).
Características de los pacientes tratados con metotrexato neoadyuvante a la cirugía, grupo A
| N°/edad/sexo | Características iniciales lesión problema | Metotrexato | Características de la lesión en la cirugía | Problemas secundarios a MTX il/ingreso | |||||
| Tiempo evolución (meses) | Localización | Tamaño inicial (cm) | Cantidad infiltrada (ml) | Molestia en la infiltración (sí/no) | Tamaño final (cm) | Modificación tamaño respecto visita inicial (cm) | Tamaño del defecto quirúrgico (cm) | ||
| 1/79/H | 2 | Sien izquierda | 2 | 0,5 | No | 0,4 | -1,6 (-80%) | 0,8 | No/no |
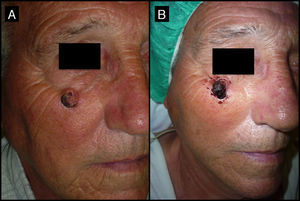
| 2/71/H (fig. 3) | 4 | Infrapalpebral derecho | 2 | 0,5 | No | 1 | -1 (50%) | 1,5 | No/no |
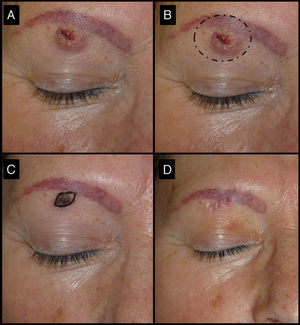
| 3/52/M (fig. 5) | 3 | Región ciliar derecha | 1,5 | 0,3 | No | 0,5 | -1 (67%) | 0,9 | No/no |
| 4/88/M | 1 | Sien derecha | 1,7 | 0,3 | No | 0,8 | -0,9 (53%) | 1,2 | No/no |
| 5/80/M (fig. 1) | 4 | Dorso de la mano derecha | 2,5 | 0,5 | No | 1 | -1,5 (-60%) | 1,5 | No/no |
| 6/66/M | 2 | Dorso de la mano izquierda | 2 | 0,5 | No | 0,7 | -1,3 (-65%) | 1 | No/no |
| 7/70/H | 2 | Aleta nasal derecha | 2,5 | 0,5 | No | 1 | -1,5 (-60%) | 1,5 | No/no |
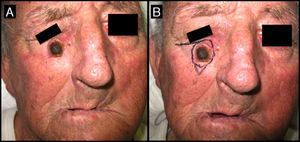
| 8/72/H (fig. 4) | 1 | Dorso de la mano izquierda | 2 | 0,5 | No | 0,9 | -1,1 (-55%) | 1 | No/no |
| 9/75/M | 2 | Sien derecha | 2,2 | 0,5 | No | 0,7 | -1,5 (-68%) | 1,1 | No/no |
| 10/65/H | 2 | Sien izquierda | 1,8 | 0,5 | No | 0,8 | -1 (-55%) | 1 | No/no |
H: hombre; M: mujer.
Características de los pacientes tratados con cirugía aislada, grupo B
| N°/edad/sexo | Características iniciales de la lesión problema | Características de la lesión en la cirugía | Necesidad de ingreso Sí/no (días) | |||||
| Tiempo de evolución (meses) | Localización | Tamaño inicial (cm) | Tamaño final (cm) | Modificación de tamaño respecto a visita inicial (cm) | Tamaño del defecto quirúrgico (cm) | Cierre del defecto | ||
| 1/62/H | 2 | Sien izquierda | 2 | 2,2 | + 0,2 (+10%) | 2,7 | Directo | No |
| 2/65/H | 3 | Frente | 2 | 2,3 | + 0,3 (+15%) | 2,9 | Colgajo | No |
| 3/58/M | 2 | Dorso de la mano izquierda | 1,5 | 2 | + 0,4 (+20%) | 2,5 | Directo | No |
| 4/74/H | 1 | Mejilla derecha | 2,7 | 2,7 | 0 (0%) | 3,3 | Colgajo | Sí (2) |
| 5/70/M | 2 | Mejilla izquierda | 2 | 2,1 | + 0,1 (5%) | 2,5 | Directo | No |
| 6/71/H (fig. 6) | 2 | Mejilla derecha | 2,3 | 2,4 | + 0,1 (5%) | 2,8 | Colgajo | Sí (2) |
| 7/70/H | 2 | Dorso de la mano izquierda | 1,8 | 2 | + 0,2 (10%) | 2,6 | Directo | No |
| 8/78/M | 3 | Sien izquierda | 2,2 | 2,4 | + 0,2 (10%) | 2,9 | Colgajo | Sí (2) |
| 9/75/M | 2 | Mejilla derecha | 2,5 | 2,5 | 0 (0%) | 3 | Colgajo | Sí(2) |
| 10/70/H | 1 | Mejilla izquierda | 2 | 2 | 0 (0%) | 2,4 | Directo | No |
| 11/71/H | 2 | Dorso de la mano izquierda | 1,8 | 2 | + 0,2 (10%) | 2,5 | Directo | No |
| 12/68/H | 3 | Sien derecha | 1,8 | 2 | + 0,2 (10%) | 2,5 | Directo | No |
| 13/59/M | 3 | Aleta nasal derecha | 1,7 | 2 | + 0,3 (+15%) | 2,4 | Directo | No |
| 14/65/M | 2 | Dorso de la mano derecha | 1,5 | 1,5 | 0 (0%) | 2 | Directo | No |
| 15/67/M | 4 | Sien derecha | 1,5 | 1,4 | -0,1 (-10%) | 2 | Directo | Sí (1) |
H: hombre; M: mujer.
El grupo A (10 casos, tabla 1) estaba formado por 5 hombres y 5 mujeres con una media de 72 años de edad. El QA en este grupo de pacientes presentaba un tiempo de evolución de 2,3 meses de media. La lesión se encontraba en la región facial en 7 casos (4 localizados en la sien, dos en el área periocular y uno en la aleta nasal), y en región acral en tres casos (todos ellos en el dorso de la mano) (figs. 1, 3–5). La tumoración tenía un tamaño de 2cm de mediana (intervalo: 1,5-2,5). Este grupo de pacientes recibió tratamiento neoadyuvante a la cirugía con MTX-il, alcanzando la coloración completa de la lesión tras la infiltración de una mediana de 0,5ml de solución (intervalo de dosis comprendido entre 0,3 y 0,5ml). No hubo ninguna complicación reseñable durante la administración del MTX-il.
Varón de 71 años que presenta un QA de 4 meses de evolución en la región infrapalpebral derecha (caso 2, tabla 1). A. En la consulta inicial la lesión presentaba 2cm de diámetro mayor. B. Tras un mes de la neoadyuvancia con MTX-il la lesión presenta un tamaño de 1cm.
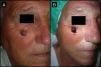
Varón de 72 años que presentaba un QA en el dorso de la mano izquierda (caso 8, tabla 1) A. Lesión de 2cm de tamaño previamente a la infiltración con MTX-il. B. Tras un mes de la neoadyuvancia con MTX-il la lesión se redujo hasta un 65% de su tamaño inicial.
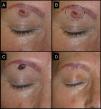
Mujer de 52 años que presentaba un QA de tres meses de evolución en la región ciliar derecha (caso 3, tabla 1). A. En la visita inicial la lesión presentaba 1,5cm de diámetro mayor. B. Su exéresis con estas dimensiones hubiera provocado un acortamiento de la ceja. C. Tras un mes de la infiltración con MTX-il la lesión se redujo a una pequeña pápula de 0,5cm. D. Un pequeño huso permitió extirpar la lesión sin necesidad de alterar la apariencia física, con muy buen resultado funcional y estético final.
El grupo B (15 casos, tabla 2) estaba constituido por 8 hombres y 7 mujeres con una media de edad de 70 años (intervalo: 58 y 78 años) (fig. 6). El tiempo de evolución de la tumoración en este segundo grupo fue de dos meses de mediana (intervalo: 1-4). La lesión se localizaba en la región facial en 11 casos (5 localizados en la mejilla, 4 en la sien, uno en la frente y uno en la aleta nasal) y la región acral en 4 casos (en el dorso de la mano). El tamaño de la tumoración en este segundo grupo fue de 2cm de mediana (intervalo: 1,5-2,7).
Varón de 71 años que desarrolló un QA en la mejilla derecha (caso 6, tabla 2). A. La lesión en la visita inicial presentaba 2,3cm de diámetro mayor. B. Tras un mes de espera para el acto quirúrgico la lesión, que no fue tratada de forma neoadyuvante con MTX-il, medía 2,8cm de diámetro. Su exéresis precisó de un colgajo de avance para el cierre del defecto quirúrgico.
El estudio comparativo entre ambos grupos se detalla en la tabla 3. Se trata de dos poblaciones homogéneas en relación con la edad, el tiempo de evolución de la lesión y el tamaño inicial. Se encontró una diferencia en el tamaño final de la lesión en el momento del acto quirúrgico de 1,3cm de media menor en el grupo tratado con MTX-il (intervalo de confianza del 95% [IC 95%]: 1,1-1,6). Esta reducción del tamaño representó una disminución de un 69% mayor en el grupo tratado con MTX-il respecto al tratado sólo con cirugía (IC 95%: 62-77%). El defecto quirúrgico resultante de la cirugía fue 1,45cm de media (IC 95%: 1,18-1,72) menor en el grupo tratado previamente con MTX-il.
Comparación de los grupos A y B previo al tratamiento y con posterioridad al tratamiento quirúrgico
| Grupo A (MTX-il + cirugía) | Grupo B (cirugía) | pa | |
| N=10 | N=15 | ||
| Previo al tratamiento | |||
| Género | |||
| Masculino | 5 | 8 | NS |
| Femenino | 5 | 7 | |
| Edad (en años) | |||
| Media (DE) | 72 (10) | 68 (6) | NS |
| Tiempo de evolución de la lesión (en meses) | |||
| Media (DE) | 2,3 (1) | 2,27(0,8) | NS |
| Tamaño inicial de la lesión (en cm) | |||
| Media (DE) | 2,02(0,32) | 2 (0,36) | NS |
| Defecto previsto sin técnica neoadyuvante (en cm) | |||
| Media (DE) | 2,94 (0,5) | 2,86 (0,52) | NS |
| Con posterioridad al tratamiento quirúrgico | |||
| Cambio de tamaño respecto a visita inicial (en cm) | |||
| Media (DE) | -1,24 (0,27) | 0,15 (0,16) | < 0,0001 |
| Porcentaje de cambio (en %) | |||
| Media (DE) | -61 (8,9) | 8 (9,7) | < 0,0001 |
| Defecto previsto sin técnica neoadyuvante (en cm) | |||
| Media (DE) | 2,94 (0,5) | 2,86 (0,52) | NS |
| Tamaño defecto quirúrgico (en cm) | |||
| [Media (DE) | 1,15 (0,3) | 2,6 (0,35) | < 0,0001 |
| Necesidad de ingreso hospitalario | |||
| N° casos/porcentaje | 0/0% | 5/33,3% | < 0,0001 |
| Necesidad de técnica de reconstrucción compleja en la cirugía | |||
| N° de casos/porcentaje | 0/0% | 5/33,3% | < 0,0001 |
DE: desviación estándar; NS: no significativo.
En un análisis post-hoc se comparó la diferencia entre el defecto resultante teórico previsto a partir del tamaño tumoral inicial y según los márgenes quirúrgicos establecidos (CEC menor de 2cm, margen de seguridad de 4mm; CEC mayor de 2cm, margen de seguridad de 6mm)27 y el defecto resultante real, y se constató que en el grupo tratado con MTX-il el defecto final real fue 1,53cm de media (IC 95%, 1,26-1,8), menor que en el grupo tratado sólo con cirugía.
El método de cierre del defecto quirúrgico en el grupo A fue la sutura directa por planos en todos los casos. Ninguno de los pacientes incluidos en este grupo precisaron de ingreso ni sufrieron complicaciones clínicas y/o analíticas derivadas de la administración de MTX il. Por el contrario, en el grupo B, mientras 10 de los casos fueron resueltos mediante cierre directo por planos, los 5 restantes precisaron de la realización de un colgajo cutáneo. Cinco de los pacientes incluidos en este segundo grupo necesitaron ingreso hospitalario entre uno y dos días.
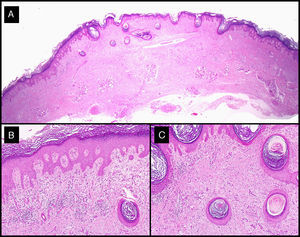
El análisis histológico de las piezas extirpadas en el acto quirúrgico mostró hallazgos comunes de QA. En el caso de aquellos tumores que recibieron neoadyuvancia con MTX-il, resultó llamativa la existencia de un denso infiltrado inflamatorio linfohistiocitario, con un número variable de células gigantes a cuerpo extraño (fig. 7).
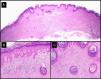
Hallazgos histológicos de la lesión residual extirpada tras la administración de MTX-il en el caso 3 (tabla 1). A-C. Presencia de una epidermis displásica asociada a un denso infiltrado inflamatorio linfohistiocitario, con alguna célula gigante a cuerpo extraño que se correspondía con el fenómeno de la regresión del QA desencadenado por el MTX-IL (hematoxilina-eosina; A: x10; B: x40; C: x100).
El QA, también conocido con el nombre de molluscum sebaceum, es una tumoración cutánea de crecimiento rápido, posiblemente procedente del infundíbulo folicular, que se desarrolla en áreas fotoexpuestas de la piel1,2. Se trata de una lesión que ha generado controversia en el momento de encuadrarla dentro de un determinado tipo de lesiones cutáneas, y se ha descrito en la literatura como un tumor benigno, una lesión pseudomaligna, como una tumoración maligna autoinvolutiva y como subtipo dentro de los carcinomas de células escamosas1,2,28–35. Ello se debe a su comportamiento clínico, tan característico como diferente a las diferentes variantes descritas del carcinoma epidermoide, con un crecimiento marcadamente acelerado, que en algunos casos se sigue de una regresión parcial.
Ocasionalmente, puede regresar completamente de forma espontánea en un período de tiempo variable de unos pocos meses, generalmente en unas 8 semanas36,37. Esta tumoración, aunque en un escaso número de casos, ha mostrado un comportamiento maligno, con desarrollo de invasión perineural e incluso de enfermedad a distancia28–35. Para Ackerman este hecho justifica considerar al QA como un carcinoma epidermoide de bajo potencial metastático29. En una línea parecida, autores como Weedon y Sánchez-Yus consideran el QA de la misma forma que a la enfermedad de Bowen, es decir, como una tumoración premaligna con riesgo de degeneración a carcinoma epidermoide en hasta un 25% de los casos36,37. En contraste, Mandrell et al consideran que el QA es una lesión benigna autoinvolutiva. Este autor justifica los QA metastatizantes afirmando que probablemente fueran errores diagnósticos, y que realmente esas tumoraciones eran carcinomas epidermoides38.
En nuestra opinión, el QA es un carcinoma epidermoide bien diferenciado con bajo potencial metastático. La ausencia de regresión en la mayoría de los casos en el grupo tratado exclusivamente con cirugía parece respaldar este concepto. De hecho, 10 de los 15 casos (66%) mostraron un incremento del tamaño de la lesión tras 30-35 días de espera del acto quirúrgico, que osciló entre un 5 y un 20% del tamaño total, 4 permanecieron estables y sólo uno mostró una reducción de un 10% respecto a sus dimensiones iniciales medidas en la primera consulta.
El tratamiento de elección del QA es la exéresis completa de la lesión por dos razones: en primer lugar, porque para establecer el diagnóstico definitivo de QA debe analizarse toda la lesión para descartar focos de invasión tumoral dérmica36; en segundo lugar, asumiendo que el QA es una tumoración maligna dentro del grupo de los carcinomas epidermoides cutáneos, la opción terapéutica más adecuada, según lo establecido recientemente en la guía terapéutica de la The National Comprehensive Cancer Network (NCCN), es la exéresis con márgenes de seguridad, que oscilan entre 4mm cuando la lesión es menor de 2cm de diámetro a 6mm en caso de tumores de mayores dimensiones37.
La cirugía puede conllevar una morbilidad importante, especialmente cuando los tumores tienen grandes dimensiones (lesiones mayores de 1,5cm de diámetro) y se localizan en la región facial debido al compromiso estético y/o funcional, o en el dorso de las manos y/o pies, en donde el defecto funcional puede ser importante (fig. 5). Además, puede ser necesaria la realización de colgajos y/o injertos, lo que conlleva un incremento del tiempo quirúrgico y de las complicaciones potenciales.
En este estudio se demuestra que la administración de MTX-il como tratamiento neoadyuvante a la exéresis quirúrgica del QA en pacientes sin contraindicación para el mismo permite, sin modificar la rutina habitual de una consulta dermatológica, reducir de forma significativa el tamaño de la tumoración. En nuestro análisis una sola infiltración con MTX-il realizada 30 días antes de la intervención quirúrgica redujo entre un 50 y un 80% el tamaño tumoral inicial (figs. 1, 3-5). Por el contrario, en el grupo que no recibió MTX-il neoadyuvante únicamente uno de los casos mostró una reducción leve del tamaño, mientras que el resto de los casos mostraron un mantenimiento o un incremento de sus dimensiones (fig. 6). Consecuentemente, se consiguió reducir de forma significativa 1,45cm de media el defecto quirúrgico resultante de la extirpación. Desde un punto de vista teórico se calculó en un análisis post-hoc que para el grupo tratado con MTX-il se consiguió reducir el defecto 1,7cm de media. Por último, se constató una simplificación del acto quirúrgico. Así, todos los defectos quirúrgicos en pacientes tratados con MTX-il fueron solventados mediante cierre directo. En contraste, 5 de los pacientes (30%) precisaron para el cierre quirúrgico la realización del un colgajo cutáneo.
Además del MTX-il se podría considerar el uso de 5-fluorouracilo para la misma finalidad. Sin embargo, creemos conveniente utilizar el primero por varias razones: 5 fluorouracilo precisa anestesia local para ser infiltrado, dado el intenso dolor que genera su inoculación; se requieren dosis semanales del fármaco para conseguir el efecto deseado, lo cual obligaría a un mayor número de visitas del paciente a su dermatólogo, y su efectividad va acompañada de la necrosis de la tumoración, que dificultaría la posterior exéresis quirúrgica11–14,24. Por el contrario, a tenor de las observaciones obtenidas en nuestro estudio, la administración de MTX-il no precisa de anestesia local, y una única infiltración de la lesión conseguiría nuestro objetivo de reducción del tamaño tumoral, sin generar necrosis de la lesión y sin modificar el número de visitas del paciente al dermatólogo ni el tiempo de demora habitual entre el diagnóstico inicial de la tumoración y el acto quirúrgico, que oscila entre 26 y 60 días39. El único inconveniente respecto al 5-fluorouracilo es que la administración de MTX-il debe ir precedida de un estudio analítico para descartar alteraciones hematológicas, de la función hepática y renal15–24.
Este estudio, con interesantes conclusiones, presenta sin embargo varias limitaciones. En primer lugar, la ausencia de ocultación del tratamiento podría haber generado una tendencia subjetiva a obtener resultados más prometedores de los reales. Para intentar controlar este sesgo se objetivaron los cambios mediante fotografías digitales, que fueron examinadas por los observadores ajenos a la elaboración del estudio. En segundo lugar, resulta llamativa la exclusión de muchos pacientes con queratoacantoma. Esto es debido a que el grupo de pacientes que se pretendió incluir en el presente estudio eran aquellos que realmente pudieran obtener beneficio de una terapia neoadyuvante. El hecho de que el queratoacantoma no es una tumoración habitual en la clínica diaria, unido a que el presente estudio intenta reunir un subgrupo minoritario que sería el realmente beneficiario de un tratamiento previo a la cirugía, hace que nuestro grupo de pacientes analizados y las conclusiones obtenidas a partir de ellos permitan obtener resultados relevantes. Sin embargo, no se puede olvidar que el bajo número de pacientes deriva en un escaso poder estadístico para detectar algunos de los objetivos secundarios, principalmente el de la seguridad de uso del MTX il. No obstante, el perfil de seguridad de este fármaco puede ser refrendado en función de datos ya conocidos24. Desde el punto de vista del posible riesgo de absorción sistémica del fármaco, las dosis máximas utilizadas en nuestro trabajo corresponden a las dosis que habitualmente se administran vía sistémica en múltiples patologías, principalmente en la psoriasis. Por otra parte, el uso del MTX de forma intralesional ha sido utilizado en ocasiones previas, sin ningún tipo de complicación asociada.
Para concluir, dada la sencillez y la seguridad de la técnica, la utilización de MTX-il como terapia neoadyuvante a la cirugía debería de ser considerada en el tratamiento de los QA de más de 1,5cm, especialmente para aquellos localizados en la región facial o acral.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.