La enfermedad inflamatoria intestinal es una entidad compleja que incluye la enfermedad de Crohn y la colitis ulcerosa, y se caracteriza por un estado proinflamatorio crónico con un curso oscilante y que en muchas ocasiones conlleva una gran morbilidad a estos pacientes. En la última década se han identificado distintas dianas terapéuticas que permiten el uso de fármacos biológicos, en particular los anticuerpos dirigidos contra el factor de necrosis tumoral alfa, que se asocian en un 5% de los casos con reacciones paradójicas psoriasiformes, que requieren una estrecha colaboración entre el dermatólogo y el gastroenterólogo en la toma de decisiones. La enfermedad inflamatoria intestinal se asocia, asimismo, a otras diversas manifestaciones dermatológicas y reumatológicas, y presenta una asociación genética y patogénica con la psoriasis, que justifica tanto el abordaje interdisciplinario de estos pacientes como la presente revisión.
Inflammatory bowel disease (IBD) is a complex entity that includes Crohn disease and ulcerative colitis. It is characterized by a chronic proinflammatory state of varying intensity that often leads to considerable morbidity. In the last decade, several therapeutic targets have been identified that are susceptible to the use of biological agents, including anti-tumor necrosis factor alpha antibodies, which are associated with paradoxical psoriasiform reactions in 5% of patients. Decision-making in the management of these cases requires close collaboration between the dermatologist and gastroenterologist. Inflammatory bowel disease is also associated with various other dermatologic and rheumatologic manifestations, and presents a genetic and pathogenic association with psoriasis that justifies both the interdisciplinary approach to these patients and the present review.
Las enfermedades inflamatorias mediadas inmunológicamente (IMID) incluyen entidades con afectación predominante de diferentes órganos, pero con vías patogénicas comunes y caracterizadas por la presencia de un estado inflamatorio crónico y la respuesta al tratamiento con agentes inhibidores del factor de necrosis tumoral (anti-TNF) alfa. Las IMID incluyen la psoriasis en el ámbito de la Dermatología, la artritis reumatoide y diversas espondiloartropatías en Reumatología, y la enfermedad inflamatoria intestinal (EII), que incluye la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), en el ámbito de la Patología Digestiva. En su conjunto, las IMID afectan a un 5-7% de la población occidental, y comparten una predisposición genética, por lo que pueden asociarse en un mismo paciente.
La artritis psoriásica y la aparición de reacciones paradójicas al tratamiento anti-TNF justifican la colaboración entre dermatólogos y reumatólogos, además de la atención conjunta a los pacientes de mayor complejidad. En el caso de la EC y la CU, la presencia de frecuentes manifestaciones dermatológicas (eritema nudoso, dermatosis neutrofílicas o hidradenitis, por ejemplo) y las reacciones paradójicas, junto con el posible desarrollo de manifestaciones reumatológicas, justifican una estrecha colaboración entre especialistas en Dermatología, Reumatología y Patología Digestiva, con especial dedicación a estas enfermedades y experiencia en el empleo de inmunosupresores y fármacos biológicos.
El 21 de noviembre de 2014, en el Hospital de la Santa Creu i Sant Pau, se desarrolló la primera reunión de gastroenterólogos, reumatólogos y dermatólogos expertos en IMID. Los diferentes especialistas, procedentes de los principales hospitales de Aragón, Baleares y Catalunya, se reunieron con el objetivo de abordar temas de interés conjunto. Los aspectos patogenéticos comunes y diferenciales de la EII y la psoriasis; el manejo de otras manifestaciones inflamatorias generalmente asociadas a la actividad de la EII (eritema nudoso, pioderma gangrenoso, artritis); las manifestaciones paradójicas en el contexto del tratamiento anti-TNF y las estrategias actuales y futuras de tratamiento en la EII fueron algunos de los temas debatidos en forma de seminario, cuyo contenido hemos considerado interesante transcribir dada la escasez de bibliografía en este tema.
Etiopatogenia, genética y comorbilidades: paralelismos entre el tracto grastrointestinal y la pielExiste un marcado paralelismo entre el tracto digestivo y la piel, al ser extensas superficies de interfase con exposición permanente a diversos antígenos y a un microbioma individual cuyas alteraciones pueden tener implicaciones patogénicas, así como por tener un sistema inmune complejo asociado a órgano en el que tienen un importante papel tanto la inmunidad innata como la adaptativa.
La etiopatogenia de la EII se explica por la interacción entre factores ambientales y la flora gastrointestinal en un individuo genéticamente susceptible. En la EII se han identificado 163 loci genéticos de susceptibilidad, siendo la gran mayoría comunes en la EC y la CU1. Muchos de los polimorfismos y las mutaciones identificadas desempeñan un posible papel patogenético al implicar a las correspondientes proteínas en las vías de la activación linfocitaria, la inmunidad adaptativa, la función de barrera intestinal, el sistema de reparación del epitelio intestinal y la tolerancia inmunológica1.
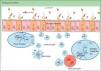
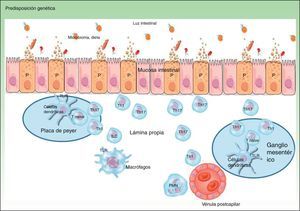
Clásicamente se consideraba que la EC se caracterizaba por una polarización Th1, y la CU, por una polarización Th2 asociada a un déficit de apoptosis linfocitaria2,3; en la actualidad se considera que inicialmente predomina la inmunidad innata con alteración de la mucosa intestinal, secreción de péptidos antimicrobianos como las defensinas y activación de los sistemas de reconocimiento de los antígenos bacterianos en la luz intestinal. Los antígenos bacterianos son captados por células presentadoras que migran a los órganos linfoides secundarios (placas de Peyer) para su presentación a los linfocitos T naive, que dependiendo del fenotipo y de las citocinas del medio se diferenciarán a linfocitos Th1, Th2, Th17 y T reguladores que modularán la respuesta frente a estos antígenos3. En presencia de determinadas citocinas como TNF, IL12 o IL2 se produce una expansión clonal de los linfocitos T y un reclutamiento de linfocitos T circulantes hacia la lámina propia, condicionando una perpetuación del proceso inflamatorio, aunque todavía no se ha identificado el fenómeno inicial que lo determina. Disponemos de datos que evidencian que en una fase inicial de la EC predominaría la respuesta Th14 con aumento de IL2 o IL12, mientras que en la EC evolucionada podría predominar una respuesta Th17 exagerada5; estas observaciones podrían tener implicaciones en cuanto a la estrategia terapéutica a plantear en el paciente según el tiempo de evolución de la enfermedad. En la EC precoz se ha descrito una mutación del receptor de IL106 que puede tener implicaciones etiopatogénicas pero que no determina las decisiones terapéuticas, que vienen determinadas por el fenotipo y no el genotipo. Por otra parte, tan solo un tercio de los pacientes con EII presentan alguno de los polimorfismos descritos hasta la fecha6, lo que evidencia que el componente ambiental es mucho más importante que el genético y que el desarrollo de la EC se debe a la interacción entre la carga genética, el ambiente, el microbioma y los propios genes6 (fig. 1).
La psoriasis también tiene una base genética, atribuible en un 30-50% al locus de susceptibilidad PSORS1, localizado en el cromosoma 67, aunque en algunos subgrupos de pacientes la carga genética es aún más grande (100% en el caso de la psoriasis guttata)3. Se han identificado más de 40 loci de susceptibilidad, cuyos productos génicos se relacionan con la síntesis de proteínas de la epidermis, la inmunidad innata y adquirida y los procesos de transcripción intracelular8.
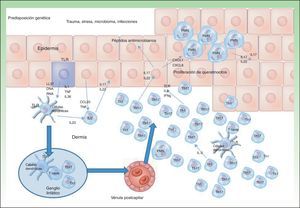
En la actualidad se cree que la principal molécula efectora con importancia patogénica en la psoriasis es la IL179,10, que puede ser sintetizada o liberada por diversos tipos celulares implicados en la inmunidad innata (polimorfonucleares, mastocitos y linfocitos T gamma-delta residentes) y en la adquirida: linfocitos T cooperadores (Th17) y linfocitos CD 8+ (Tc17, predominantes en la epidermis de las lesiones de psoriasis)11–13. Los avances en nuestro conocimiento genético de la psoriasis pueden permitir un abordaje personalizado (estratificación genética) identificando factores pronósticos de respuesta al tratamiento, como, por ejemplo, en el caso del haplotipo HLACw6, cuyos portadores tienen una mayor probabilidad de responder a ustekinumab que los que no lo presentan14 (fig. 2).
Respecto a los factores ambientales, en la EII se han descrito el tabaco y fármacos tales como los antiinflamatorios no esteroideos y los anticonceptivos orales, siendo de todos ellos el tabaco el único con un potencial patogénico y de rasgo diferencial en EC respecto a CU. Así, en la EC el tabaquismo activo aumenta la susceptibilidad de presentar dicha enfermedad, incluso en los exfumadores. Contrariamente, en la CU los fumadores activos tienen menos susceptibilidad de padecer la enfermedad y los exfumadores presentan un riesgo incrementado incluso con respecto a los individuos que nunca han fumado previamente15. Otros factores que recientemente se han relacionado con el desarrollo de EII, y en especial de EC, son la administración de antibióticos en los primeros años de vida16, la contaminación ambiental17,18 y el déficit de vitamina D19–21.
Uno de los factores patogénicos que actualmente están siendo objeto de mayor investigación en el ámbito de la EII es el microbioma o microbiota intestinal. Cada individuo tiene su propia flora intestinal, que puede ser influida por la carga genética, los alimentos ingeridos, los patógenos intestinales o los fármacos, y se han identificado alteraciones características en pacientes con EII: un incremento de Escherichia coli enteroinvasivo22–24 acompañado de un déficit de Faecalibacterium prausnitzii25–27, que tendrían implicaciones patogénicas y en el curso evolutivo de la enfermedad27.
También se discute el papel del microbioma cutáneo en la patogénesis de la psoriasis28 y la artritis psoriásica29.
Otro aspecto importante en las IMID es la presencia de comorbilidades. En la EII, encontramos las asociadas propiamente al tabaquismo (cáncer de pulmón), a la inmunosupresión, a la inflamación crónica intestinal (carcinogénesis secundaria) y a otras IMID, siendo, entre ellas, la psoriasis la más frecuente30. El estado proinflamatorio en la EII podría tener repercusión sistémica y se ha visto que tratando el brote de EC se reducen los niveles séricos de proteína C reactiva, aunque en general se acepta que el estado inflamatorio en la EII es más local que sistémico31.
En el caso de la psoriasis, las comorbilidades mejor estudiadas son las relacionadas con enfermedad cardiovascular, asociada a factores de riesgo clásicos como los diversos componentes del síndrome metabólico, sobre todo en el caso de la artritis psoriásica. La obesidad abdominal tendría un papel determinante, ya que los adipocitos funcionan como un órgano endocrino que actúa liberando citocinas proinflamatorias y adipocinas que tienen un efecto sinérgico, promoviendo un estado inflamatorio persistente y favoreciendo la resistencia periférica a la insulina, la ateroesclerosis o la aparición de esteatosis hepática32. También existe en la psoriasis un aumento en la prevalencia de tabaquismo, que se ha visto relacionado con la estimulación de la inmunidad innata y de la expresión de genes relacionados con la susceptibilidad de la psoriasis33.
Diagnóstico de enfermedad inflamatoria intestinal en pacientes con psoriasisDebemos sospechar una EII ante la aparición de algunos de los siguientes signos y/o síntomas con carácter recurrente en nuestros pacientes afectos de psoriasis: dolor abdominal, pérdida de peso, episodios de diarrea con o sin sangre, tenesmo o urgencia defecatoria y presencia de lesiones anogenitales y de determinadas manifestaciones extraintestinales (cutáneas, articulares, oculares). Cabe destacar que cualquier manifestación extraintestinal puede preceder en años al diagnóstico de la EII; en otros casos estas se presentan en el contexto de un brote inflamatorio y también pueden seguir un curso independiente34.
El diagnóstico de EII se establecerá según la definición de Lennard-Jones, que incluye 4 grupos de criterios diagnósticos: clínicos, radiológicos, endoscópicos y anatomopatológicos. Se requiere, al menos, la presencia de 2 criterios para el diagnóstico, siendo el anatomopatológico el definitivo34.
Es por ello que a todos los pacientes con sospecha clínica se les indicará la práctica de una endoscopia (colonoscopia+ileoscopia) con toma de biopsias. En los casos en que mediante esta primera prueba no se alcance el diagnóstico, se indicaría una exploración mediante cápsula endoscópica con la finalidad de detectar lesiones en tramos proximales. Una vez la cápsula detecta lesiones, deberemos indicar una enteroscopia para la toma de biopsias y así establecer el diagnóstico de EII.
En cuanto a las pruebas de imagen (enterorresonancia y TAC), son herramientas para el diagnóstico de complicaciones transmurales de la EC, pero no de la EII34.
Por otra parte, algunos de los síntomas descritos que nos deben llevar a una sospecha clínica son altamente prevalentes en población general, es por ello que la implementación de la determinación de la calprotectina en heces es muy sensible para el diagnóstico diferencial entre enfermedad orgánica y funcional, reduciendo el número de endoscopias a realizar35.
En pacientes con un diagnóstico de EII, la calprotectina fecal es útil para su monitorización, dada la buena correlación con los hallazgos endoscópicos.
Reacciones paradójicas y nuevos tratamientos en la enfermedad de CrohnUna reacción paradójica es un efecto del tratamiento médico, por lo general un fármaco, opuesto al que normalmente se esperaría, como, por ejemplo, aparición de psoriasis de novo inducida por un tratamiento indicado para la psoriasis, empeoramiento de una psoriasis preexistente o aparición de granuloma anular, sarcoidosis y pioderma gangrenoso. Puede presentarse en pacientes con IMID de forma secundaria al tratamiento con diferentes agentes biológicos, en especial con antagonistas del TNF alfa.
Las reacciones paradójicas que podemos observar en las EII en tratamiento con anti-TNF pueden ser la aparición de psoriasis, pustulosis palmoplantar, afectación de pliegues o de cuero cabelludo, onicopatía o dermatosis psoriasiforme, siendo esta última la más frecuente. Estas lesiones presentan una histología diversa en la que podemos encontrar reacción psoriasiforme, pústula subcórnea±eosinófilos, reacción eccematosa y/o reacción liquenoide. La afectación pustulosa palmoplantar puede ser queratodérmica, incapacitante y presenta poca respuesta al tratamiento tópico y sistémico. La patogenia de estas reacciones se desconoce, pero la principal hipótesis apunta a un desequilibrio entre TNF alfa e interferón alfa. Este fenómeno se considera un efecto de clase, por lo que pueden producirlos todos los anti-TNF con una latencia media de 10,5 meses (2 semanas y 80 meses) tras el inicio del tratamiento. Las reacciones paradójicas en EII afectan por igual a hombres y mujeres, el 70% no tienen antecedentes personales ni familiares de psoriasis y se produce con aparente mayor frecuencia en pacientes tratados con infliximab, adalimumab y certolizumab, pero la incidencia es proporcional al número de pacientes y los años de tratamiento36. Estos pacientes tienen un 50% de posibilidades de desarrollar nuevamente una reacción paradójica si se reintroduce un fármaco anti-TNF, aunque sea diferente al causante37. Recientemente se ha descrito la implicación de la IL12/23 y la vía Th17 en la patogenia de la EII, lo que explicaría su buena respuesta a ustekinumab, y podría considerarse un posible tratamiento en estos casos de reacciones paradójicas por anti-TNF36.
Entre los factores de riesgo para desarrollar reacciones paradójicas en los pacientes con EII se encuentran la EC y condiciones tales como el tabaquismo, la obesidad o el tratamiento con infliximab, aunque este dato puede ser sesgado al haber sido el primer anti-TNF que se empleó38.
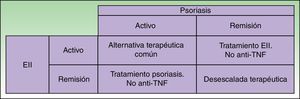
Dado que algunos pacientes pueden desarrollar un nuevo brote de EII al retirar el fármaco anti-TNF y que la substitución a otro anti-TNF produce muchas veces recurrencia o empeoramiento, se intenta mantener el fármaco anti-TNF si la reacción paradójica no es muy intensa e iniciar tratamientos tópicos y/o sistémicos, generalmente inmunosupresores39, de común acuerdo con el dermatólogo. Pero en algunos casos este abordaje curativo es insuficiente, siendo necesario cambiar de clase terapéutica, idealmente con un fármaco eficaz tanto para las manifestaciones dermatológicas de la reacción paradójica como para el control de la EII, por lo que ustekinumab parece la mejor alternativa en el momento actual38 (fig. 3).
Otras manifestaciones dermatológicas en pacientes con EIIAlrededor de un 30% de los pacientes con EII desarrolla lesiones cutáneas, ya sean específicas de la EII, reactivas como EN y PG en los que se ha identificado una susceptibilidad genética en TRAF31P2 que interviene en inmunidad humoral y la respuesta a IL17, o bien secundarias a los tratamientos, como el cáncer cutáneo no melanoma40.
Espondiloartropatía asociada y abordaje terapéuticoLa afectación articular en pacientes con EII y psoriasis es frecuente, haciendo necesaria en muchas ocasiones la colaboración con reumatólogos expertos. Una anamnesis dirigida exhaustiva es crucial para poder ofrecer el mejor tratamiento en cada caso. La afectación inflamatoria axial y/o periférica resulta determinante del esquema terapéutico. En la EII encontramos 3 formas de artritis41. La tipo i es una forma de afectación fundamentalmente periférica, asociada a un brote de la enfermedad intestinal. Es aguda, asimétrica y afecta a menos de 6 articulaciones. La tipo ii es una forma poliarticular, migratoria y con tendencia a la simetría. En esta, los síntomas no guardan ningún paralelismo con la actividad de la enfermedad intestinal. Tanto la forma tipo i como la tipo ii se presentan como artritis no erosivas. Por último, la tipo iii o forma espondilítica cursa como una lumbalgia inflamatoria con rigidez matutina, aunque la sacroileítis puede ser asintomática en un 4-18% de los pacientes. En caso de sospecha clínica con radiología de sacroilíacas no concluyente, la resonancia magnética nuclear se considera la prueba de elección para detectarla en fases precoces42,43.
En el tratamiento de la artritis asociada a EII pueden ser útiles los antiinflamatorios no esteroideos, aunque deben utilizarse con precaución, dado que pueden agravar la EII (CU). El único antiinflamatorio no esteroideo para el que no se ha observado una exacerbación de la EII es celecoxib44,45. Los corticoides a dosis bajas también pueden controlar la afectación articular periférica, pero los inmunosupresores como sulfasalazina y metotrexato son las opciones terapéuticas más empleadas, en especial cuando existe afectación periférica46. Sin embargo, metotrexato no ha demostrado ser eficaz en la afectación axial y, por tanto, no se recomienda47,48. En caso de afectación periférica refractaria o afectación axial están indicados los antagonistas del TNF, como infliximab49–51.
Similitudes y diferencias en el tratamiento de las IMID en Dermatología y Patología DigestivaEn ambas especialidades se pueden emplear tratamientos por vía tópica, inmunomoduladores sistémicos como metotrexato y fármacos biológicos, pero con algunas características terapéuticas, así como azatioprina como primera opción terapéutica sistémica en la EII y ante la inefectividad de etanercept en el tratamiento de esta. Vale la pena mencionar que en el caso de la EII se dispone de una panoplia más limitada, ya que tan solo disponemos de algunos fármacos anti-TNF efectivos (infliximab y adalimumab; golimumab solo en la CU), si bien en un futuro próximo se prevé la aprobación de otras moléculas no anti-TNF (ustekinumab, tofacitinib, vedolizumab) para las que en distintos estudios se han reportado resultados favorables52,53. En el tratamiento de la EC clásicamente se optaba por una estrategia escalonada, iniciando con corticoides, añadiendo inmunomoduladores y, por último, sumando fármacos anti-TNF si no se alcanzaba la remisión. Sin embargo, en la actualidad el tratamiento se plantea según la localización, el patrón y la gravedad de la enfermedad, optando por una estrategia escalonada, escalonada acelerada o directamente intensiva52,53. Esta estrategia hace que actualmente más pacientes reciban tratamiento con anti-TNF para el control de los brotes. Tanto en la EII como en el ámbito de la artritis psoriásica resulta muy importante iniciar el tratamiento en el período de «ventana de oportunidad», definido como el tiempo en el que la intervención terapéutica modificará la evolución de la enfermedad y el potencial desarrollo de complicaciones54,55.
Así como en la EII es frecuente el uso de tratamientos combinados con azatioprina y/o 6-mercaptopurina y fármacos anti-TNF, en la psoriasis generalmente se sigue un esquema de monoterapia, ya sea con fármacos biológicos o clásicos, aunque la combinación con fototerapia o metotrexato aumenta la eficacia del tratamiento y, en el caso del segundo, puede prevenir el desarrollo de inmunogenicidad56.
ConclusiónLas IMID presentan similitudes patogénicas que justifican la convergencia en el abordaje terapéutico con anti-TNF, pero también diferencias relacionadas con las características propias de los órganos diana. La presencia de antígenos microbianos, la destrucción de la mucosa y las secuelas resultantes en el caso de la EII determinan una «ventana de oportunidad» terapéutica. Las manifestaciones dermatológicas y reumatológicas son frecuentes en los pacientes con EII y requieren un abordaje conjunto con dermatólogos y reumatólogos de referencia, entrenados en el tratamiento sistémico de la psoriasis y las espondiloartropatías, y con especial experiencia en el manejo de agentes biológicos. Es, por tanto, prioritaria la formación transversal entre especialidades y el establecimiento de circuitos de derivación e interconsulta rápida, con el objetivo de ofrecer una atención integral al paciente, hacer frente a las reacciones paradójicas y salvaguardar en lo posible el tratamiento biológico, dada la escasez de alternativas terapéuticas efectivas en pacientes con EII.
FinanciaciónLa reunión recibió soporte logístico por parte de Janssen-Cilag.
Conflicto de interesesJanssen-Cilag ha facilitado la reunión y el soporte técnico y metodológico pero ninguno de sus miembros ha participado en el desarrollo y elaboración del material científico, las discusiones o el texto escrito. Lluís Puig ha recibido honorarios por consultoria por parte de Merck, AbbVie i Janssen.
Dado que hay un límite en el número de autores, queremos agradecer a todos los participantes de la reunión su asistencia y colaboración:
Ponentes: S. Calvet (Servicio de Patología Digestiva, Hospital Parc Taulí, Sabadell, España), J. M. Carrascosa (Servicio de Dermatología, Hospital Germans Trias i Pujol, Badalona, España), E. Domènech (Servicio de Patología Digestiva, Hospital Germans Trias i Pujol, Badalona, España), J. Guardiola (Servicio de Patología Digestiva, Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat, España), S. Khorrami (Servicio de Patología Digestiva, Hospital Universitari de Son Espases, Palma de Mallorca, España), A. Laiz (Servicio de Reumatología, Hospital de la Santa Creu i Sant Pau, Barcelona, España), J. Luelmo (Servicio de Dermatología, Hospital Parc Taulí, Sabadell, España), J. Notario (Servicio de Dermatología, Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat, España)
Discusores: X. Aldeguer (Servicio de Patología Digestiva, Hospital Universitari de Girona Doctor Josep Trueta, Girona, España), M. Alsina (Servicio de Dermatología, Hospital Universitari de Girona Doctor Josep Trueta, Girona, España), M. Andreu (Servicio de Patología Digestiva, Hospital del Mar, Barcelona, España), G. Aparicio (Servicio de Dermatología, Hospital Universitari Vall d’Hebron, Barcelona, España), M. Ara (Servicio de Dermatología, Hospital Clínico Universitario Lozano Blesa, Zaragoza, España), M. T. Arroyo (Servicio de Patología Digestiva, Hospital Clínico Universitario Lozano Blesa, Zaragoza, España), N. Borruel (Servicio de Patología Digestiva, Hospital Universitari Vall d’Hebron, Barcelona, España), D. Busquets (Servicio de Patología Digestiva, Hospital Universitari de Girona Doctor Josep Trueta, Girona, España), M. Esquius (Servicio de Dermatología, Hospital Sant Joan de Déu, Manresa, España), F. Gallardo (Servicio de Dermatología, Hospital del Mar, Barcelona, España), J. Llao (Servicio de Patología Digestiva, Hospital Sant Joan de Déu, Manresa, España), L. Márquez (Servicio de Patología Digestiva, Hospital del Mar, Barcelona, España), M. Piqueras (Servicio de Patología Digestiva, Consorci Sanitari de Terrassa, Terrassa, España), A. Pol (Servicio de Dermatología, Consorci Sanitari de Terrassa, Terrassa, España), M. Ribera (Servicio de Dermatología, Hospital Parc Taulí, Sabadell, España), E. Ricart (Servicio de Patología Digestiva, Hospital Clínic, Barcelona, España), A. Sanso (Servicio de Patología Digestiva, Hospital de Manacor, Mallorca, España), A. Sapiña (Servicio de Patología Digestiva, Hospital de Manacor, Mallorca, España), D. Vila (Servicio de Dermatología, Hospital Sant Joan de Déu, Manresa, España).