La electroquimioterapia (EQT) es una modalidad de tratamiento de lesiones cutáneas y subcutáneas originadas por melanoma u otros tumores. El procedimiento consiste en la administración de agentes antineoplásicos, seguido de impulsos eléctricos locales, para conseguir un efecto conocido como electroporación, que permite la entrada al citosol de medicamentos que no difunden a través de la membrana celular. El objetivo de esta revisión es establecer la evidencia que sustenta la incorporación de la EQT como estrategia terapéutica en el melanoma.
Además, se ha llevado a cabo una revisión sistemática de la literatura con síntesis cualitativa. Se ha realizado una búsqueda cualificada de la literatura en bases de datos referenciales y a texto completo. Fueron seleccionados 7 estudios: 3 revisiones sistemáticas y 4 series de casos.
La calidad de la evidencia encontrada no es buena, pero la coincidencia de sus resultados en algunas las variables le da consistencia. Los metaanálisis muestran resultados a favor de la EQT frente a la quimioterapia.
La EQT parece un procedimiento efectivo en el tratamiento local de nódulos tumorales malignos (nivel medio o bajo de calidad de la evidencia). Es un tratamiento fácil de administrar, económico y bien tolerado con el que se consigue respuesta objetiva en circunstancias determinadas. No hay evidencia de que pueda afectar el curso natural de la enfermedad, por lo que debe considerarse un tratamiento paliativo.
Con un nivel de la evidencia 1– (1 menos), puede recomendarse la incorporación de la EQT para el tratamiento paliativo del melanoma locorregionalmente avanzado irresecable (fuerza de la recomendación: B).
Electrochemotherapy is a therapeutic option for the treatment of cutaneous and subcutaneous metastases from melanoma and other tumors. The procedure consists of the administration of anticancer drugs followed by locally applied electrical impulses to achieve an effect known as electroporation, which facilitates entry into the cytosol of drugs that cannot cross the cell membrane. The aim of this review is to evaluate the evidence that supports the use of electrochemotherapy as a therapeutic strategy in melanoma. We conducted a qualitative systematic review of the literature using advanced searches of bibliographic databases and full text reviews. Seven studies (3 systematic reviews and 4 cases series) were selected. The quality of the evidence was not good, but the coincidence of results for certain variables supports their consistency. Results of the meta-analyses favored electrochemotherapy over chemotherapy. Electrochemotherapy appears to be an effective procedure for the local treatment of malignant tumor nodules (evidence of intermediate or low quality). This inexpensive method is simple to apply, well tolerated, and achieves objective responses under certain circumstances. There is no evidence that electrochemotherapy alters the natural course of the disease and it should therefore be considered a palliative treatment. With an evidence level of 1- (minus), electrochemotherapy can be recommended for the palliative treatment of unresectable, locoregionally advanced melanoma (grade B recommendation).
En el aspecto epidemiológico el melanoma cutáneo ha evolucionado en nuestro país según una curva de incidencia muy característica. Durante las 3 últimas décadas del siglo xx asistimos a un incremento acelerado, que pasó de 0,3 y 0,2 (tasas por 100.000, hombres y mujeres, respectivamente) en 1972 a 3 y 3,8, en 19921, y a 5,85 y 7,50 en 19982. Después de este período la curva parece atravesar una etapa de meseta, con tasas de incidencia de 6,6 y 7,2, según la fuente GLOBOCAN para 20123, con una mortalidad global de 1/100.000 habitantes.
No siendo el tumor más frecuente, ni el que mayor mortalidad provoca, en los casos avanzados su manejo de complica. El tratamiento estándar actual de los nódulos tumorales, tanto sencillos como múltiples, es la escisión quirúrgica, la perfusión del miembro aislado o la radioterapia. Algunas alternativas terapéuticas descritas en el tratamiento de las lesiones metastásicas incluyen la crioterapia, la ablación por láser o la ablación por radiofrecuencia, cuyo uso varía de acuerdo con la naturaleza de la lesión. Tras el tratamiento adecuado la recurrencia local del tumor resulta difícil de abordar4.
La electroquimioterapia (EQT)5,6 surge como una modalidad de tratamiento de lesiones tumorales cutáneas y subcutáneas originadas por melanoma u otros tumores primarios y metastásicos. El procedimiento consiste en la administración de agentes citotóxicos (bleomicina y cisplatino) por vía intravenosa o intratumoral seguida de impulsos eléctricos cortos e intensos a nivel local, para conseguir un efecto llamado electroporación o electropermeabilización. La aplicación local de impulsos eléctricos de determinada intensidad, amplitud y frecuencia desestabiliza temporalmente la membrana de la célula y permite la formación transitoria y reversible de poros no selectivos de tamaño del orden de 1 Angström, sin afectar a la viabilidad celular y aumentando la permeabilidad. La exposición de la membrana celular a impulsos eléctricos puede originar una necrosis celular debido a cambios irreversibles en la membrana, sin embargo los pulsos eléctricos intensos, pero de corta duración, inducen una electroporación reversible manteniendo la viabilidad de la membrana celular. De esta forma se permite la entrada, desde el espacio intercelular al citosol, de medicamentos citotóxicos que, debido a su estructura o a su peso molecular, no difunden con facilidad a través de la membrana celular, aumentando así su citotoxicidad y reduciendo la dosis de aplicación.
El objetivo de esta revisión es establecer la evidencia que sustenta la incorporación de la EQT como estrategia terapéutica para el abordaje del melanoma cutáneo locorregionalmente avanzado irresecable.
MetodologíaRevisión sistemática de la literatura con síntesis cualitativa. Se ha realizado una búsqueda de la literatura en las bases de datos referenciales Embase, Medline, Science Citation Index expanded, así como Cochrane Library y Centre for Research and Dissemination (CRD). Las consultas a las bases documentales se realizaron durante el mes de febrero de 2015.
La selección de artículos se ha llevado a cabo por 2 investigadores de manera independiente. La evaluación de la calidad global de la evidencia, para cada variable de resultado, se ha realizado valorando el diseño de los estudios, la validez interna, la consistencia y la precisión de los resultados, así como otros factores como el posible sesgo de publicación. Para la clasificación de evidencia y grados de recomendación, se utilizó la clasificación SIGN7 y, adicionalmente, se aplicó el checklist de Amstar para revisiones sistemáticas8.
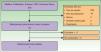
Los criterios de inclusión y exclusión previamente definidos para selección sobre abstracts se muestran en la tabla 1. Los artículos que cumplieron criterios de inclusión por título y abstract fueron revisados a texto completo por 2 investigadores de forma independiente.
Criterios de inclusión y exclusión para la selección (sobre abstract) de los artículos y pregunta de investigación según formato PICO
| Criterios de inclusión | |
| Tipos de estudio | Ensayos clínicos, estudios de cohortes, RSL, metaanálisis que midan alguno de los resultados especificados en la pregunta de investigación. En caso de no recuperar estudios con estos criterios se considerará la inclusión de no analíticos o casos y controles |
| Idiomas | Inglés, castellano, francés y alemán |
| Otras condiciones | Se incluyeron los informes de evaluación de tecnologías que analizasen detalles acerca de la estrategia de búsqueda y la valoración metodológica de los estudios. Los informes de evaluación de agencias debían cumplimentar el listado de comprobación elaborado por el grupo de expertos en la reunión de INAHTA 2001 |
| Criterios de exclusión | |
| Tipos de estudio | Experimentación animal o in vitro, revisión narrativa, series, casos y controles publicados en fecha anterior a estudios de nivel de evidencia superior Estudios de cualquier diseño que no hubiesen medido las variables especificadas en la pregunta de investigación o cuya fecha de publicación sea anterior al año 2000 |
| Formato PICO de la pregunta de investigación | |
|---|---|
| Población | Pacientes con edad superior a 18 años con: metástasis de melanoma (en tránsito, satelitosis, a distancia) cutáneas y/o subcutáneas irresecables en cualquier localización anatómica. Estadios IIIB (N2c), IIIC (N2c y N3) y IV (M1a por metástasis cutánea-subcutánea) de la TNM Melanoma cutáneo primario con criterios de irresecabilidad (afectación vasculonerviosa u otras estructuras) o resecable mediante cirugía mutilante Paciente con metástasis viscerales como tratamiento paliativo, para mejorar la calidad de vida |
| Intervención | EQT en monoterapia y en terapia combinada con perfusión del miembro aislado en pacientes con alta carga tumoral |
| Comparador | Los melanomas que cumplen el criterio de irresecabilidad son candidatos a 3 estrategias terapéuticas: Perfusión hipertérmica del miembro aislado Administración intralesional de interleuquina 2, bleomicina o perilesional de GM-CSF Radioterapia locorregional Tratamiento sistémico: quimioterapia, bioquimioterapia, inmunoterapia |
| Resultado | Efectividad Respuesta clínica que puede medirse como, respuesta completa (RC), respuesta parcial (RP), periodo libre de enfermedad (PLE o similares), supervivencia total (ST) y tasas de recurrencia (TR), enfermedad estable sin cambios (NC) Seguridad Efectos adversos asociados al procedimiento Toxicidad local o regional o toxicidad sistémica |
En este trabajo se han utilizado los criterios de irresecabilidad y TNM correspondientes al melanoma locorregionalmente avanzado de acuerdo con la clasificación del American Joint Committee of Cancer (AJCC).
GM-CSF: granulocyte-macrophage colony-stimulating factor; INAHTA: International Network of Agencies of Health Technology Assessment; PICO: population (P), intervention (I), comparison (C) and outcome(s) (O); RSL: revisión sistemática de la literatura.
La pregunta de investigación fue redactada así: ¿es la EQT efectiva y segura para el tratamiento del melanoma (primario y metastásico) irresecable de cualquier localización en adultos? Esta pregunta fue analizada y trasladada a formato Poblation Intervention Comparator Outcome) (tabla 1).
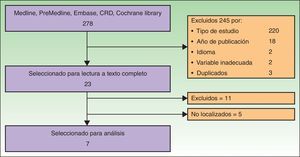
ResultadosResultado de la búsquedaTras la lectura de títulos y abstracts, y aplicando los criterios ya descritos, fueron seleccionados 37 artículos para lectura a texto completo. Siete trabajos cumplieron los criterios de inclusión, fueron considerados adecuados y relevantes y fueron analizados para esta revisión. El diagrama de flujo de la gestión y selección documental se muestra en la figura 1. Las referencias de los estudios incluidos fueron codificadas para facilitar su manejo en la redacción: Spratt_20149, AETS_20114, Mali_201310, Caracó_201311, Riccoti_201312, Solari_201413 y Skarlatos_201114.
Al no existir ensayos clínicos ni estudios de cohortes que analizaran la efectividad de la EQT, decidimos considerar las series de casos no incluidas en las revisiones sistemáticas ni en los informes de evaluación seleccionados para su evaluación.
En la búsqueda recuperamos un informe de NICE de 201315 que, aunque no cumplió nuestros criterios de inclusión, por tratarse de una guía de procedimiento, la utilizamos para el desarrollo de este informe. Seis trabajos estaban incluidos en el metaanálisis Spratt_2014. Los restantes fueron excluidos por idioma o tipo de estudio. Cinco artículos no pudieron ser localizados.
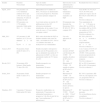
Resultados de los estudiosEn la tabla 2 se resumen los datos más relevantes de los estudios analizados y su grado de evidencia.
Tabla de evidencia de los artículos analizados
| Estudio | Pacientes N/sexo/edad | Tipo de estudio (metodología)/seguimiento | Intervención (vía de administración y quimioterápico) | Resultados/nivel de evidencia |
|---|---|---|---|---|
| Spratt _2014 | 915 pacientes con 4.313 metástasis cutáneas de los que 3.591 (83,3%) eran de melanoma. 61 años de mediana de edad | Metaanálisis de 47 estudios (8 ECA, 38 ensayos no aleatorizados y una serie prospectiva). Pacientes con tumor primario maligno de piel | Varios tratamientos 11 estudios realizados con EQT | Tasa de RC: 61,7% (52,5-70,1%, IC 95%) (tras ajustar por sesgos); tasa de RO: 60,2% (50,6-69%, IC 95%) Nivel de evidencia 2++ |
| AETS_2011 | 693 pacientes con 2.730 nódulos tumorales. Edad media 56,9±11,3 años | La revisión incluye un total de 26 publicaciones de las 195 referencias inicialmente identificadas, de las cuales 13 son series de casos y 13 son estudios con grupo control | El tratamiento más frecuente fue bleomicina (76%) IT 48%, IV 36% y conjunta 16% | Tras seguimiento de 9,7±1,39 meses se obtuvo RC en el 60% de los nódulos, RP en 22,8%, sin cambios en 10,5% y progresión en 5,6% Nivel de evidencia 2++ |
| Mali_2013 | 197 pacientes (1.466 tumores), el 17,2% con diámetro≥3cm y 82,8%<3cm | RSL sobre efectividad de EQT en distintos tamaños entre enero de 1991 y noviembre de 2011. De los 132 estudios relevantes, se incluyeron 9 en el metaanálisis | Una sola aplicación de EQT | RC 59% y RO 85% en≥3cm frente a 33,3 y 68%, respectivamente, en<3cm Nivel de evidencia 1– |
| Caracò_2013 | 60 pacientes. Edad media 62 años (27 a 89) | Estudio descriptivo retrospectivo de una serie de 60 pacientes a los que se administró una media de 73 aplicaciones de EQT y se hizo un seguimiento medio de 27,5 meses (6 a 67) | De una a 5 sesiones de EQT con bleomicina IV 15.000UI seguidas de pulsos de EP a los 8 y 28min | A los 3 meses el 38,3% (23 pacientes) RP y el 48% (29) RC. Ocho pacientes tuvieron progresión de la enfermedad o ninguna respuesta Nivel de evidencia 3 |
| Ricotti_2013 | 30 pacientes (654 lesiones). Edad media 75 años (56 a 85) | Estudio prospectivo no aleatorizado. Seguimiento 20 meses | Bleomicina IV 15.000UI seguido de pulsos de EP a los 8 y 28min | RC en 20% (6 pacientes). RP en 80% (24 pacientes) Nivel de evidencia 3 |
| Solari_2014 | 20 pacientes. Edad media 72 años (47 a 91) | Estudio prospectivo no aleatorizado Seguimiento 6 meses | Bleomicina IV 15.000UI seguido de pulsos de EP a los 8 y 30min Se describen efectos adversos no graves | RC 10% (2 pacientes), RP 45% (9), sin respuesta 15% (3), progresión 30% (6) Nivel de evidencia 3 |
| Skarlatos_2011 | 5 pacientes (7 lesiones). Edad media 69,8 años | Prospectivo multicéntrico no aleatorizado 52 pacientes con enfermedad metastásica y progresiva, 9 de ellos de piel de los que 5 eran melanomas (7 aplicaciones) | Bleomicina IV 15.000UI/cm2 de 1.000UI/cm3 seguido de pulsos de EP a los 8 y 20min | RC 3 pacientes, RP 2 pacientes No se describieron efectos secundarios Nivel de evidencia 3 |
CI: intervalo de confianza; ECA: ensayo clínico aleatorizado; EP: electroporación; IT: intratumoral; IV: intravenosa; RC: respuesta completa; RO: respuesta objetiva; RP: respuesta parcial; RSL: revisión sistemática de la literatura.
Hemos recuperado 3 revisiones sistemáticas4,9,10 que fueron analizadas de acuerdo con los criterios SIGN7 y AMSTAR8.
La revisión Spratt_2014 encuentra una tasa de respuesta alta, aunque heterogénea y mejora en la calidad de vida. Recomienda la definición de algoritmos de trabajo y la realización de estudios que establezcan las bases de las características específicas de los pacientes y las metástasis cutáneas.
Todos los metaanálisis realizados en la revisión de AETS_2011 muestran resultados claramente favorables al tratamiento con EQT versus quimioterapia (QT). Los estudios consideran como medida de resultado el porcentaje de respuesta completa (RC) frente a otros tipos de respuestas. Los mejores resultados se obtuvieron en la evaluación ulterior de EQT (bleomicina o cisplatino) frente a QT (bleomicina o cisplatino), con un riesgo relativo (RR)=8,05 (IC 95%: 3,43-18,88), así como en la evaluación ulterior (seguimiento medio: 9,7 meses) de EQT (bleomicina) frente a QT (bleomicina), con un RR=8,48 (IC 95%: 3,46-20,79). En las evaluaciones tempranas (seguimiento medio: 2,2 meses) los valores de RR fueron más bajos: 5,01 (IC 95%: 2,70-9,32) y 7,56 (IC 95%: 2,64-21,60), respectivamente. En los metaanálisis realizados en pacientes con diagnóstico único de melanoma se encontraron resultados igualmente a favor de la EQT versus la QT. En la evaluación temprana de EQT (bleomicina o cisplatino) frente a QT (bleomicina o cisplatino), el resultado global fue de RR=4,03 (IC 95%: 2,05-7,92) a favor de la EQT. Igualmente, en la evaluación ulterior el resultado fue de RR=5,95 (IC 95%: 1,83-19,33) favorable a la EQT versus la QT en los pacientes solo con melanoma. En relación con la seguridad de la EQT, de los 26 estudios 2 de ellos no informan sobre la aparición de complicaciones. En los restantes 24 se describen complicaciones y efectos secundarios leves.
La revisión sistemática de la literatura (RSL) Mali_2013 se centra en la correlación del tamaño del tumor y la efectividad. Los datos se obtienen de estudios no aleatorizados. Los resultados mostraron menor efectividad en los tumores mayores de 3cm que en los menores (RC y RO [respuesta objetiva] de 59% y 85% frente a 33,3% y 68%, respectivamente). Los autores sugieren que la explicación podría ser la inferior concentración del medicamento por tiempo insuficiente de aplicación. Los pulsos se aplicaron 2min después la bleomicina o cisplatino intratumoral, o dentro de la ventana terapéutica de 8 a 28min tras la bleomicina intravenosa. La administración de bleomicina en el espacio intersticial que rodea el tumor alcanza concentraciones suficientemente altas, pero la concentración plasmática declina biexponencialmente con una distribución media de vida media de 24-30min y eliminación media de 2-4h16. La segunda explicación podría ser la insuficiente exposición del tumor en los mayores de 3cm por la irregular vascularización, y la tercera puede ser un requerimiento de campo eléctrico superior.
Con nivel de evidencia 3 hemos encontrado 4 estudios observacionales, con seguimiento prospectivo11–14. Caracò_2013 y Solari_2014 encuentran una correlación significativa de la respuesta tanto con el número de lesiones (menor o mayor de 10) como con el tamaño (menor o mayor de 2cm), mientras Ricotti_2013 obtiene datos aparentemente contradictorios, ya que la mayor tasa de RC se asocia con mayor número de lesiones tras la segunda sesión.
Son estudios retrospectivos, con muestra pequeña (n entre 5 y 60) y sin grupo comparador. Solari_2014 aporta datos demográficos sobre el sexo y la edad de los pacientes, y vemos que son más los hombres tratados, posiblemente por ser una enfermedad más prevalente en este sexo. Todos los pacientes tuvieron una edad avanzada en el momento de recibir el tratamiento a estudio.
En Solari_2014 y en Riccoti_2013 se establecen criterios de administración según el tamaño tumoral y sobre el número de nódulos a tratar.
Utilizan todos un protocolo de actuación similar: administración de bleomicina 15.000UI/m2IV previa a los pulsos de EQT, únicamente Skarlatos_2011 la emplea también por vía intratumoral en lesiones de gran tamaño.
Todos obtienen respuesta tras el tratamiento con RC entre 10% y 48%, y respuesta parcial entre 38,3% y 80%. Solari_2014 comunica un porcentaje de pacientes que no respondió al tratamiento (15%) o cuya enfermedad progresó (30%). Por su parte, Caracò_2013 presenta un porcentaje conjunto de ambas variables del 13,3%.
Ninguno describe efectos secundarios graves, los que presentan son leves y tolerables. Los seguimientos fueron cortos: de 6 a 20 meses.
DiscusiónLos estudios evaluados en esta revisión, 4 series de casos y 3 RSL, obtuvieron calificaciones de medio y bajo en sus niveles de evidencia, según la clasificación SIGN que hemos seguido (nivel 3 para todas las series de casos y de 1– a 2++ para las RSL). Las series no aportaron un grupo control ni estuvieron analizadas en el mismo periodo de tiempo, las poblaciones estudiadas fueron pequeñas, no fueron diseñadas para comparar la efectividad frente a otras alternativas y estuvieron, por lo tanto, sometidas a los sesgos de este tipo de estudio. El seguimiento fue, en general, corto, y por eso tal vez no se registraron todas las complicaciones que realmente existieron. La validez interna pudo verse afectada por el sesgo del observador, ya que no se describió el cegamiento en la lectura de los resultados en ninguno de los estudios. No se describió ni cuantificó ninguna variable de resultado sobre calidad de vida, aspectos que influyen en el consumo de recursos sanitarios y en la capacidad de elección del paciente. Tampoco hemos encontrado estudios que comparen la EQT con otras alternativas terapéuticas locales o regionales, lo que sería de gran interés para valorar la relevancia clínica del procedimiento. No obstante, la coincidencia de sus resultados en algunas de las variables analizadas les da consistencia. De hecho, los metaanálisis realizados muestran resultados a favor de la electroquimioterapia frente a la quimioterapia, por lo que estos resultados podrían ser aplicables a nuestro medio.
En esta revisión no hemos encontrado estudios que evalúen el impacto organizativo ni económico del uso de la EQT en la práctica clínica. No obstante, la literatura resalta la factibilidad, rapidez y sencillez de la EQT, la buena aceptación por parte del paciente y el coste aceptable del tratamiento, por lo que la técnica se considera de gran potencial terapéutico.
Las conclusiones de esta revisión sistemática son:
- •
La electroquimioterapia podría constituir un procedimiento efectivo en el tratamiento local de los nódulos tumorales malignos en términos de respuesta objetiva, completa o parcial. Nivel de evidencia 3 (bajo, series de casos) y 1– a 2++ (medio, RSL).
- •
Es un tratamiento fácil de administrar, económico y bien tolerado en el que se consigue una respuesta objetiva en un alto porcentaje de pacientes, sobre todo si hay menos de 10 lesiones y con un tamaño inferior a 2cm. Puede repetirse el procedimiento según la respuesta del paciente. Nivel de evidencia 1– (medio, RSL).
- •
Aunque los resultados muestran que la electroquimioterapia resulta efectiva en el control local de la lesión tumoral, no hemos encontrado evidencia de que pueda afectar el curso natural de la enfermedad o a la supervivencia del paciente, por lo que debe considerarse como un tratamiento paliativo. Nivel de evidencia 3 (bajo, series de casos) y 2++ (medio, RSL).
- •
La electroquimioterapia constituye un procedimiento seguro, sin efectos adversos graves para el paciente. Las complicaciones más frecuentes son dolor, eritema, contracciones musculares y edema local. Nivel de evidencia 1– a 2++ (medio, RSL).
Basados en estos niveles de evidencia podemos recomendar la incorporación de la electroquimioterapia para el tratamiento paliativo del melanoma metastásico no resecable (fuerza de la recomendación: B).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.