La artritis psoriásica es una enfermedad inflamatoria crónica que afecta al sistema musculoesquelético, se asocia a psoriasis y suele producir destrucción articular con pérdida de función y calidad de vida. Su presentación clínica es heterogénea, con extremos fenotípicos que pueden solaparse con la artritis reumatoide o la espondilitis anquilosante. La psoriasis suele preceder a la artritis psoriásica, y la consulta de dermatología es el lugar clave para su detección precoz. Muchos tratamientos utilizados en psoriasis también se utilizan en artritis psoriásica, por tanto las recomendaciones terapéuticas para la psoriasis deben realizarse teniendo en cuenta el tipo y la gravedad de la artritis psoriásica, y viceversa. El objetivo de este documento es establecer pautas para el manejo coordinado (reumatólogo/dermatólogo) de la artritis psoriásica. Ha sido elaborado mediante la técnica Delphi por un grupo multidisciplinar (6reumatólogos, 6dermatólogos y 2epidemiólogos) y contiene recomendaciones, tablas y algoritmos para diagnóstico, criterios de derivación y tratamiento de la artritis psoriásica.
Psoriatic arthritis, a chronic inflammatory musculoskeletal disease that is associated with psoriasis, causes joint erosions, accompanied by loss of function and quality of life. The clinical presentation is variable, with extreme phenotypes that can mimic rheumatoid arthritis or ankylosing spondylitis. Because psoriasis usually presents before psoriatic arthritis, the dermatologist plays a key role in early detection of the latter. As many treatments used in psoriasis are also used in psoriatic arthritis, treatment recommendations should take into consideration the type and severity of both conditions. This consensus paper presents guidelines for the coordinated management of psoriatic arthritis by rheumatologists and dermatologists. The paper was drafted by a multidisciplinary group (6rheumatologists, 6dermatologists, and 2epidemiologists) using the Delphi method and contains recommendations, tables, and algorithms for the diagnosis, referral, and treatment of patients with psoriatic arthritis.
La artritis psoriásica (APs) es una enfermedad musculoesquelética inflamatoria crónica que se asocia a la psoriasis (Ps). La prevalencia de la Ps en la población general oscila del 0,1 al 2,8%1, y entre el 6 y el 42% de los pacientes con Ps presentan artritis2. Aproximadamente en el 70% de los casos de APs la afectación cutánea precede a la aparición de síntomas musculoesqueléticos, mientras que estos son el primer síntoma de la enfermedad en el 15% de los casos, produciéndose ambos simultáneamente en otro 15%3. El riesgo de APs permanece constante desde el diagnóstico inicial de Ps, llegando al 20,5% tras 30años del diagnóstico. Se ha estimado que el tiempo medio desde el diagnóstico de Ps hasta la aparición de APs es de 17±11años4,5.
Inicialmente la APs se consideró de curso más benigno que la artritis reumatoide (AR); sin embargo, posteriormente se ha evidenciado que tiene un curso progresivo que ocasiona erosiones articulares y pérdida de la función articular, comparable al de la AR6. Su expresión clínica es muy heterogénea, pudiendo manifestarse como espondiloartritis, artritis periférica, dactilitis o entesitis7. La forma más frecuente de presentación es la artritis oligoarticular periférica, junto con la forma poliarticular simétrica, similar a la de la AR. La forma axial pura, similar a la espondilitis anquilosante, es mucho menos frecuente. Alrededor del 20-30% de los pacientes pueden tener manifestaciones axiales (sacroileítis, espondiloartritis) y periféricas (artritis)8. Durante la evolución de la enfermedad puede ocurrir que una forma oligoarticular evolucione a poliarticular, o viceversa.
En 1973, Moll y Wright9 fueron los primeros que consideraron la APs como una entidad clínica diferente a otras enfermedades reumatológicas, definiéndola como una artritis inflamatoria seronegativa para el factor reumatoide (FR–) asociada a Ps. En 2006, el Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA) desarrolló los criterios CASPAR (ClASsification criteria for Psoriatic ARthritis)10. Entre sus principales ventajas se encuentra el hecho de que permiten clasificar tanto a pacientes sin Ps como a pacientes con FR+. Estas características, junto con su aplicación rápida y fácil, hace que actualmente sean los más utilizados para establecer el diagnóstico de APs11.
Debido a su asociación con la Ps, y a que esta precede a la aparición de la APs en la mayoría de los casos, la consulta de dermatología es clave para su detección precoz. Sin embargo, los datos no son demasiado alentadores. Un reciente estudio mostró que casi el 30% de los pacientes con Ps seguidos en una consulta de dermatología tenían una APs sin diagnosticar12. Por todos esos motivos, el diagnóstico precoz de la APs y su pronta derivación a reumatología constituyen un reto importante para el dermatólogo, ya que hay evidencia de que el manejo precoz puede frenar la progresión del daño articular y el número de articulaciones afectadas13.
Como manifestación clínica predictora de APs, clásicamente se ha asociado la presencia de onicopatía psoriásica con artritis (80-90% en APs comparado con un 40-50% de pacientes sin artritis)14. Por otro lado, aunque no se ha apreciado correlación entre la gravedad de la Ps y la APs, sí se ha encontrado asociación entre la gravedad de la Ps y la posibilidad de desarrollarla12. Las localizaciones de Ps en el cuero cabelludo, retroauricular y del surco interglúteo se asocian más frecuentemente a APs. También se ha descrito asociación entre la obesidad y el desarrollo de APs15-17.
La realización del diagnóstico de APs puede resultar difícil en la consulta dermatológica, ya que además de precisar el examen cuidadoso de entesis, articulaciones y raquis, se requieren pruebas de imagen de difícil valoración en este medio. Por otro lado, es inviable una valoración por el reumatólogo de todos los pacientes con Ps. Por ello es necesario que el dermatólogo pueda establecer un diagnóstico de sospecha mediante la exploración y la anamnesis del paciente con Ps. Con el objeto de poder establecer un diagnóstico de sospecha de APs en pacientes con Ps se han diseñado cuestionarios de cribado de APs (PASE18, PEST19,ToPAS20, PASQ21 y EARP22), pero su sensibilidad y especificidad caen muy por debajo del 50% cuando se excluyen la formas poliarticulares12, presentando el inconveniente de que aún no se dispone de versiones validadas en español. En una guía de práctica clínica reciente para el manejo de la comorbilidad en pacientes con Ps23,24 se recomienda la aplicación de criterios CASPAR10, pero simplificándolos y adaptándolos al ámbito dermatológico, como herramienta para establecer la sospecha diagnóstica de APs. Los pacientes con sospecha de APs serían derivados a reumatología para confirmación del diagnóstico.
El manejo clínico de la Ps y de la APs debería ser coordinado, ya que la mayoría de los tratamientos sistémicos utilizados en Ps como los fármacos modificadores de la enfermedad (FAME) y la terapia biológica también se utilizan en el tratamiento de la APs. Las recomendaciones terapéuticas de la Ps deberán realizarse teniendo en cuenta el tipo y la gravedad de la APs, y viceversa. Por esta razón, con este documento se pretende elaborar pautas y criterios para el manejo conjunto (reumatólogo/dermatólogo) de la APs, dentro del marco de las recomendaciones de las guías actuales23-32 más utilizadas en nuestro medio.
ObjetivosGeneralEstablecer una serie de recomendaciones sobre el manejo de APs con un enfoque eminentemente práctico, dirigido tanto a reumatólogos como a dermatólogos.
Específicos- 1.
Seleccionar herramientas de cribado, evaluación y clasificación de APs recomendadas en las principales guías, señalando las más adecuadas para cada especialidad (reumatología o dermatología) y situación clínica.
- 2.
Desarrollar algoritmos diagnósticos y terapéuticos enfocados al manejo conjunto de la APs por dermatólogos y reumatólogos.
- 3.
Establecer pautas o recomendaciones para el manejo coordinado de la APs.
Para la elaboración de este estudio se ha constituido un grupo de trabajo formado por una serie de expertos clínicos (6reumatólogos y 6dermatólogos) y 2epidemiólogos con experiencia en la elaboración de guías de práctica clínica y documentos de consenso. La iniciativa partió de los 2investigadores principales (LP, dermatólogo, y JDC, reumatólogo), y cada uno de ellos invitó a participar al resto de los panelistas, en su especialidad correspondiente, teniendo en consideración su experiencia en el tema. Se ha realizado una revisión no sistemática de trabajos recientes, propuestos por los panelistas, sobre recomendaciones para el manejo de APs23-32. Partiendo del documento de consenso elaborado por la Sociedad Española de Reumatología (SER) sobre el uso de terapias biológicas en la APs29 y del trabajo de consenso sobre «Abordaje Integral de la Comorbilidad del Paciente con Psoriasis» del Grupo de Trabajo en Comorbilidades asociadas a la Psoriasis de la Asociación Española de Dermatología y Venereología (AEDV)23,24, se han diseñado los esquemas iniciales de los algoritmos y de las herramientas de evaluación, pronóstico y tratamiento. Sobre ellos se han ido incorporando recomendaciones extraídas de los otros trabajos revisados, especialmente en los casos en que la información no era lo suficientemente explícita o precisa. El grupo de expertos clínicos ha dirigido y supervisado todas las fases del estudio y ha participado en la formulación de criterios para los que no se ha encontrado suficiente evidencia y en el establecimiento de recomendaciones para el manejo coordinado de la APs.
Una vez obtenido el primer borrador del documento, mediante una encuesta Delphi con metodología RAND/UCLA modificada, los expertos han votado en escala 1 a 9 (1=totalmente en desacuerdo, 9=totalmente de acuerdo) las nuevas recomendaciones. Se han incluido en el documento las recomendaciones en las que ≥70% de los panelistas ha puntuado ≥7. Las recomendaciones que no alcanzaron un grado de acuerdo (GA) ≥70% fueron reformuladas y sometidas a una nueva puntuación. En caso de no llegar a alcanzar este acuerdo, fueron desestimadas.
En las nuevas recomendaciones elaboradas por el panel de expertos se presenta el nivel de evidencia (NE), el grado de recomendación según el Center for Evidenced Based Medicine de Oxford33 y el GA entre los expertos, es decir, el porcentaje de expertos que puntuó ≥7.
ResultadosEn las tablas 1 y 2 se resumen las recomendaciones del panel para cribado, plan terapéutico y seguimiento conjuntos de los pacientes con APs. La tabla 1 recoge las recomendaciones dirigidas a dermatólogos y la tabla 2, las dirigidas a reumatólogos.
Recomendaciones dirigidas a dermatólogos
| 1. Los dermatólogos deben incluir periódicamente el cribado de APs, y de forma muy especial en aquellos pacientes en los que hay factores asociados como presencia de onicopatía, obesidad, afectación cutánea extensa (>3áreas afectadas por Ps) o localizaciones como el cuero cabelludo o el pliegue interglúteo (NE: 5; GR: D; GA: 83%). |
| 2. Los dermatólogos explicarán al paciente que el tabaquismo y la obesidad pueden dificultar el manejo de su Ps, así como predisponer al desarrollo de APs (NE: 5; GR: D; GA: 83%). |
| 3. Los dermatólogos deben investigar la presencia de APs, al menos una vez al año en pacientes con Ps en tratamiento tópico y cada 6meses en pacientes con Ps en tratamiento sistémico o con afectación ungueal y/o de pliegues (NE: 5; GR: D; GA: 83%). |
| 4. En un paciente con Ps se sospechará APs si se cumple alguna de las siguientes condiciones: dolor inflamatorio o tumefacción articular periférica; dolor inflamatorio o nocturno en el esqueleto axial; evidencia de entesitis (sobre todo en el tendón de Aquiles o las fascias plantares); dactilitis actual, definida como hinchazón de todo el dedo, o historia previa de dactilitis recogida por un reumatólogo (NE: 5; GR: D; GA: 100%). |
| 5. Si existe sospecha de APs, el dermatólogo deberá derivar el paciente a reumatología incluyendo un informe con la puntuación del PASI, el área de superficie corporal afectada (% BSA, Body Surface Area) y el tratamiento actual de Ps, así como una propuesta de manejo conjunto (NE: 5; GR: D; GA: 100%). |
| 6. Ante un paciente remitido por un reumatólogo con diagnóstico de APs para valoración de Ps, el dermatólogo explorará la existencia actual o no de Ps, incidiendo especialmente en las localizaciones más típicamente asociadas a la APs (uñas, pliegues, cuero cabelludo…). En caso de confirmarse Ps actual, informará al reumatólogo, adjuntándole PASI, BSA (%) y propuesta de tratamiento para la Ps (NE: 5; GR: D; GA: 100%). |
| 7. Si el paciente remitido por el reumatólogo para valoración de Ps no presentara Ps actual, se informará al paciente sobre la posibilidad de que en el futuro desarrolle un cuadro de Ps y se le recomendará que solicite cita ante la presencia de lesiones cutáneas/ungueales (NE: 5; GR: D; GA: 83%). |
| 8. Ante un paciente con pustulosis palmoplantar y dolor musculoesquelético, el dermatólogo hará el estudio de las lesiones cutáneas y derivará al reumatólogo para completar el diagnóstico diferencial con el síndrome SAPHO (NE: 5; GR: D; GA: 92%). |
| 9. El plan terapéutico del paciente con APs debe trazarse conjuntamente por el reumatólogo y dermatólogo, basándose en la afectación articular/axial/entesis al cutánea (NE: 5; GR: D; GA: 100%). |
| 10. Se recomienda revisar al menos una vez al año a los pacientes con APs si están controlados y no precisan otra monitorización farmacológica (NE: 5; GR: D; GA: 92%). |
| 11. En la valoración de la efectividad del tratamiento pautado deben participar ambos especialistas (NE: 5; GR: D; GA: 92%). |
| 12. Las decisiones de modificación o mantenimiento del tratamiento deben ser consensuadas por ambos especialistas (NE: 5; GR: D; GA: 100%). |
| 13. Si el dermatólogo confirma la presencia de psoriasis paradójica en un paciente con APs en tratamiento con terapia biológica, instaurará el tratamiento tópico o sistémico oportuno según la gravedad o la extensión de las lesiones. Así mismo, propondrá al reumatólogo el mantenimiento, el cambio o la supresión de la terapia biológica de acuerdo con la gravedad de la afectación dermatológica y con la respuesta al tratamiento instaurado (NE: 5; GR: D; GA: 100%). |
APs: artritis psoriásica; BS: Body Surface Area; GA: grado de acuerdo; GR: grado de recomendación; NE: nivel de evidencia; PASI: Psoriasis Area Severity Index; Ps: psoriasis.
En negrita, recomendaciones comunes a dermatólogos y reumatólogos.
Recomendaciones dirigidas a reumatólogos
| 1. Para el diagnóstico inicial de la APs en reumatología se recomienda la utilización de los criterios CASPAR ante sospecha de APs periférica y complementar con estudio radiológico de sacroilíacas, movilidad vertebral y anamnesis sobre el dolor, ante sospecha de APs axial (tabla 6) (NE: 5; GR: D; GA: 100%). |
| 2. Ante sospecha de APs axial, si el paciente presenta dolor lumbar inflamatorio junto con dolor en nalga alternante, y la radiología convencional es normal o equívoca, se recomienda la realización de estudios de resonancia magnética (sacroilíacas y/o columna lumbar) (NE: 5; GR: D; GA: 100%). |
| 3. Para hacer la evaluación inicial pronóstica de la APs en reumatología, se recomienda medir la actividad inflamatoria, la afectación de la función y el daño estructural. Para ello se recomienda la medición de los parámetros de las tablas 7 y 8 (NE: 5; GR: D; GA: 100%). |
| 4. Ante la coexistencia de lesiones cutáneas del tipo pustulosis palmoplantar y dolor musculoesquelético, el reumatólogo deberá hacer diagnóstico diferencial con el síndrome SAPHO (NE: 5; GR: D; GA: 100%). |
| 5. Si se confirma la existencia de APs en un paciente sin diagnóstico de Ps, el reumatólogo debe derivar el paciente a dermatología para su estudio, con un informe clínico de la APs y propuesta de manejo conjunto (NE: 5; GR: D; GA: 75%). |
| 6. Si se confirma la existencia de APs en un paciente con diagnóstico de Ps, el reumatólogo, si no dispone de él, solicitará al dermatólogo un informe clínico sobre la situación actual de la Ps (PASI y BSA) y el tratamiento que recibe. Una vez obtenida la información, completará la evaluación pronóstica, la clasificación de la APs y el plan de tratamiento. Informará de ello al dermatólogo con una propuesta de manejo conjunto (NE: 5; GR: D; GA: 100%). |
| 7. Si no se confirma la existencia de APs en un paciente con diagnóstico de Ps y sospecha de APs, en la valoración por el reumatólogo se recomienda la realización de ecografía de la entesis (aquílea/cuadricipital/rotuliana). Si en ausencia de otras causas mecánicas u ocupacionales se encuentran hallazgos patológicos (alteración de la ecogenicidad, erosión, calcificación o bursitis), se recomienda valoración del paciente por el reumatólogo cada 6meses. Si no se encuentran hallazgos patológicos en la ecografía se recomienda valoración del paciente en un plazo no superior a 12meses (NE: 5; GR: D; GA: 92%). |
| 8. Este documento recomienda seguir las pautas de tratamiento para la APs recomendadas por la SER descritas en este apartado y que están incorporadas en los algoritmos terapéuticos de las figuras 3 y 4 (NE: 5; GR: D; GA: 100%). |
| 9. Se recomienda realizar un seguimiento sistematizado de los pacientes con APs que incluya la recogida de datos sociolaborales, clínicos, analíticos, radiológicos y de respuesta/toxicidad del tratamiento. Para ello se recomienda la medición de los parámetros de las tablas 7 y 8 (NE: 5; GR: D; GA: 100%). |
| 10. El plan terapéutico del paciente con APs debe trazarse conjuntamente por el reumatólogo y dermatólogo, basándose en la afectación articular/axial/entesis y en la cutánea (NE: 5; GR: D; GA: 100%). |
| 11. Se recomienda revisar al menos una vez al año a los pacientes con APs si están controlados y no precisan otra monitorización farmacológica (NE: 5; GR: D; GA: 92%). |
| 12. Los pacientes con APs en los que se deba evaluar la efectividad, el cumplimiento terapéutico o los efectos adversos de los fármacos, o que precisen una monitorización específica, deberán ser evaluados cada 4-6semanas durante 3-4meses (NE: 5; GR: D; GA: 75%). |
| 13. Los pacientes con APs y reagudización grave, efectos adversos inesperados al tratamiento, fiebre o rápido deterioro en su condición general deben ser evaluados en el menor tiempo posible, no más allá de una semana (NE: 5; GR: D; GA: 92%). |
| 14. El reumatólogo deberá remitir al dermatólogo, por sospecha de psoriasis paradójica, a los pacientes en tratamiento con terapia biológica que desarrollen nuevas lesiones en la piel o presenten empeoramiento de las preexistentes (NE: 5; GR: D; GA: 100%). |
| 15. En la valoración de la efectividad del tratamiento pautado deben participar ambos especialistas (NE: 5; GR: D; GA: 92%). |
| 16. Las decisiones de modificación o mantenimiento del tratamiento deben ser consensuadas por ambos especialistas (NE: 5; GR: D; GA: 100%). |
APs: artritis psoriásica; BSA: Body Surface Area; GA: grado de acuerdo; GR: grado de recomendación; NE: nivel de evidencia; PASI: Psoriasis Area Severity Index; Ps: psoriasis; SER: Sociedad Española de Reumatología.
En negrita se destacan, recomendaciones comunes a dermatólogos y reumatólogos.
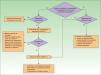
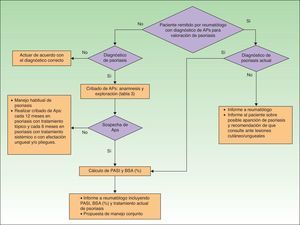
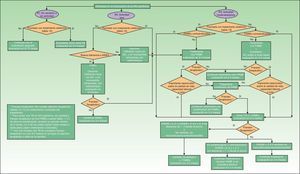
En la figura 1 se presenta un algoritmo con las actuaciones del dermatólogo en el cribado de la APs.
Dentro de la exploración clínica del paciente con Ps, el dermatólogo debe incluir periódicamente el cribado de APs, y de forma muy especial en aquellos pacientes en los que hay factores que aumentan la probabilidad de esta asociación, tales como presencia de onicopatía, obesidad o extensa afectación cutánea (>3áreas afectadas por Ps) o localizaciones como el cuero cabelludo o el pliegue interglúteo.
Tal como se menciona en las publicaciones del Grupo de Trabajo en Comorbilidades asociadas a la Psoriasis23,24, el diagnóstico de artritis inflamatoria o la constatación de evidencia radiográfica de neoformación ósea yuxtaarticular (excluidos los osteófitos), hacen difícil la aplicación de los criterios CASPAR en la práctica clínica fuera de la consulta de reumatología, por lo que proponen unos criterios de derivación a reumatología basados en una simplificación de los criterios CASPAR (tabla 3). Estos criterios serían indicativos únicamente de sospecha de APs.
Criterios de sospecha de artritis psoriásica (APs) (basados en una simplificación de los criterios CASPAR)
| En pacientes con psoriasis se sospechará artritis psoriásica ante alguno de las siguientes: |
| Dolor inflamatorio o tumefacción articular periférica |
| Dolor inflamatorio o nocturno en esqueleto axial |
| Entesitis (sobre todo en tendón de Aquiles o fascias plantares) |
| Dactilitis |
Fuente: Dauden et al.23.
Para aplicar esta simplificación de los criterios CASPAR, el dermatólogo realizará la anamnesis sobre la presencia de dolor musculoesquelético inflamatorio (tabla 4) o tumefacción articular actual periférica (especialmente en rodillas, tobillos y pequeñas articulaciones de las manos) y la existencia de dolor inflamatorio o nocturno en el esqueleto axial (tabla 5), así como en zonas de inserción tendinosa, sobre todo en talones (tendón de Aquiles) y fascia plantar (plantas de los pies)34. Se inspeccionarán y explorarán las articulaciones e inserciones tendinosas sospechosas, en busca de rubor, calor, limitación de movilidad, tumefacción y dolor. Se inspeccionarán las extremidades en busca de onicopatía psoriásica (distrofia, onicólisis, pitting, hiperqueratosis) y de dactilitis (tumefacción de todo un dedo, de manos o pies, «dedo en salchicha»)23.
Características del dolor inflamatorio de la artritis periférica (según opinión del panel de expertos)
| Predominio nocturno, sobre todo en la segunda mitad de la madrugada |
| Asocia rigidez matinal articular importante (>30-45 min) |
| Alivia o mejora con la actividad y/o ejercicio físico |
| Empeora con el reposo prolongado |
| Suele mejorar con antiinflamatorios no esteroideos |
Características del dolor inflamatorio axial (según criterios del grupo GRAPPA)
| Edad de inicio <45años |
| Duración >3 meses |
| Rigidez matutina >30 min |
| Inicio insidioso |
| Mejoría con el ejercicio |
| Dolor alternante en nalgas |
| Puede acompañarse de limitación de la movilidad vertebral |
Habitualmente el dolor y la limitación son menores que en la espondilitis anquilosante.
Fuente: Ritchlin et al.27.
Cuando un paciente con diagnóstico de APs sea remitido al dermatólogo, este evaluará la presencia de Ps, con búsqueda exhaustiva de sus formas más frecuentemente asociadas a la APs (uñas, cuero cabelludo, pliegue interglúteo…). El dermatólogo informará al reumatólogo de la situación clínica del paciente en relación a la Ps, incluyendo una propuesta de manejo conjunto.
Determinadas lesiones cutáneas, especialmente la pustulosis palmoplantar asociada a dolor musculoesquelético (principalmente si es de localización torácica anterior, aunque también puede ser de columna dorsal, articulación sacroilíaca unilateral o una monoartritis en una articulación grande), requiere la realización de diagnóstico diferencial con el síndrome sinovitis, acné, pustulosis, hiperostosis y osteítis (SAPHO). El dermatólogo hará el estudio de las lesiones cutáneas y remitirá al reumatólogo para el estudio y la filiación de las manifestaciones musculoesqueléticas.
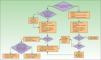
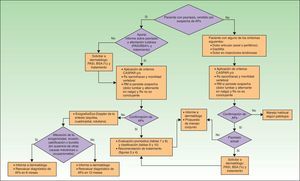
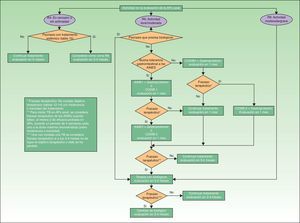
Cribado de artritis psoriásica en consulta de reumatología, evaluación pronósticaEn la figura 2 se presenta un algoritmo con las actuaciones del reumatólogo en el cribado de la APs.
La sospecha de APs en consulta de reumatología puede darse, bien ante un paciente con Ps remitido para estudio desde dermatología, o bien en un paciente (con o sin Ps) que consulta a reumatología por dolor articular (axial o periférico), dactilitis y/o entesitis. Los criterios CASPAR, especialmente si se sospecha APs periférica29, unidos a radiografía de sacroilíacas y exploración de la movilidad vertebral (para detectar APs axial)27, pueden ser de utilidad en el diagnóstico inicial. En la tabla 6 se presentan los criterios del grupo GRAPPA para el diagnóstico de APs axial27. Si se sospecha entesitis, además del examen clínico de tendones, ligamentos y cápsulas de inserción (dolor, sensibilidad o inflamación a la palpación/presión) pueden ser de utilidad la ecografía Doppler y la resonancia magnética29. La dactilitis, presente en el 16-48% de los casos de APs, es un indicador de gravedad de la APs35. En ocasiones, una dactilitis aislada recurrente puede ser la única manifestación clínica de APs.
Criterios diagnósticos de artritis psoriásica axial
| 1. Dolor vertebral inflamatorio: edad de inicio <45años, duración >3 meses, rigidez matutina >30 min, inicio insidioso, mejoría con el ejercicio, dolor alternante en nalgas |
| 2. Limitación de la movilidad cervical, torácica o lumbar en los planos sagital y frontal |
| 3. Al menos, sacroileítis unilateral ≥ grado2 en radiografía simple, presencia de sindesmofitos, en RM de articulaciones sacroilíacas: edema en médula ósea, erosiones o disminución del espacio articular |
Deberá cumplir el criterio1 y al menos otro de los criterios.
RM: resonancia magnética.
Fuente: Ritchlin et al.27.
Entre los cuadros clínicos con los que el reumatólogo deberá hacer diagnóstico diferencial se encuentra el síndrome SAPHO. Se trata de una enfermedad reumática, seronegativa, de baja incidencia, que se asocia a lesiones cutáneas del tipo pustulosis palmoplantar. Preferentemente se localiza en las articulaciones esternoclaviculares y esternocostales de la pared torácica anterior, aunque también puede producir sacroileítis, afectación vertebral dorsal o sinovitis de grandes articulaciones. Entre sus características diferenciales con la APs destacan: su localización preferentemente torácica, afectación sacroilíaca unilateral, oligoartritis periférica no erosiva y la presencia de hiperostosis.
En caso de confirmarse el diagnóstico de APs, el reumatólogo deberá hacer la evaluación inicial, incidiendo en la forma clínica de la APs. La evaluación inicial debe incluir historia clínica, exploración física, pruebas de laboratorio y radiológicas, y herramientas de evaluación estandarizadas y validadas, como el DAS28 (Disease Activity Score basado en recuento de 28articulaciones) para la afectación periférica de la APs o el Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) para las manifestaciones axiales de la enfermedad. Las herramientas utilizadas deben permitir medir la actividad inflamatoria, la función y el daño estructural, así como la respuesta al tratamiento y la toxicidad del mismo. También resulta de interés medir aspectos fundamentales para el paciente como la calidad de vida. Los criterios de remisión y actividad se basarán en los resultados de la evaluación. En la tabla 7 se resumen los parámetros a tener en cuenta en la evaluación de la APs periférica. Esta tabla incluye los parámetros a medir inicialmente y los parámetros a tener en cuenta en la evaluación de la respuesta al tratamiento (tanto de AINE como de FAME o de biológicos). En la tabla 8 se presentan los parámetros a valorar en la APs axial. En ambas tablas se incluye una valoración de la afectación cutánea/ungueal que, en caso de que no esté disponible, se debe solicitar al dermatólogo, junto con el plan terapéutico de la afectación dermatológica.
Evaluación de la artritis psoriásica con manifestaciones periféricas. Parámetros a evaluar e instrumento(s) recomendados
| Parámetros | Recomendación |
| Valoración de artritis periférica y/o entesitis | Recuento de:NAT66, NAT28NAD68, NAD28Dactilitis/entesitis |
| Valoración global del dolor en la última semana por el paciente | EVA o EVN (0-10) |
| Valoración global de la enfermedad por el paciente | EVA o EVN (0-10) |
| Valoración global de la enfermedad por el médico | EVA o EVN (0-10) |
| Reactantes de fase agudaaAnalítica general | VSG/PCRHemograma, bioquímica |
| Índice compuesto de actividad clínica en las poliarticulares | Cálculo de DAS28 |
| Valoración de la astenia en la última semana | EVA o EVN (0-10) |
| Valoración de la capacidad funcional | HAQ |
| Valoración de la calidad de vida con cuestionarios validados | Genéricos (SF-36, SF-12 o EQ-5D) o específicos (PsAQol) |
| Valoración del daño estructural: técnicas de diagnóstico por la imagena | Radiografía de manos, pies y otras articulaciones afectadas (una vez al año durante los 3-4primeros años).Cálculo del Índice de Sharp-van der Heijde modificado para artritis psoriásicaEn la primera evaluación: radiografía de articulaciones sacroilíacas para descartar componente axial asintomáticoLa radiología no es útil para el diagnóstico precoz, especialmente de las afectaciones de la entesis. Recientemente se está dando importancia a la utilidad de la ecografía52,53, la resonancia magnética54,55, la gammagrafía56 y la tomografía axial por emisión de positrones57 para el diagnóstico precoz en fases asintomáticas |
| Valoración de la afectación cutánea/ungueala | PASI/NAPSIBSA (%) |
AP: anteroposterior; BSA: Body Surface Area; DAS28: Disease Activity Score; EQ-5D: European Quality of Life-5 Dimensions; EVA: escala visual analógica; EVN: escala visual numérica; HAQ: Health Assessment Questionnaire; NAD: número de articulaciones dolorosas; NAPSI: Nail Psoriasis Severity Index; NAT: número de articulaciones tumefactas; PASI: Psoriasis Area Severity Index; PsAQol: Psoriatic Arthritis Quality of Life Instrument; SF-36/12: Short Form-36/12 Health Survey; VSG/PCR: velocidad de sedimentación globular/proteína C reactiva.
Fuente: Ritchlin et al.27, Sociedad Española de Reumatología28 y Fernández-Sueiro et al.29.
Estos parámetros se estudiarán en la evaluación inicial, cuando se quiera evaluar la actividad de la enfermedad y cuando tenga que evaluarse la respuesta a tratamiento con FAME o con biológicos. No son necesarios en la evaluación en tratamiento con AINE, ya que no se espera que se modifiquen a causa de este tratamiento.
Evaluación de la artritis psoriásica con manifestación axial. Parámetros a evaluar e instrumento(s) recomendados
| Parámetros | Recomendación |
| Evaluación de la actividad | BASDAI (puntuación global) |
| Valoración global del paciente | EVA o EVN de la última semana (0-10) |
| Valoración global de la función física | BASFI |
| Valoración específica de la movilidad espinal | BASMI |
| Valoración de fatiga, dolor axial y rigidez | BASDAI (subescalas de dolor, fatiga y duración de rigidez con EVN 0-10) |
| Reactantes de fase agudaaAnalítica general | VSG/PCRHemograma, bioquímica |
| Valoración del daño estructural: radiologíaa | Radiografía AP de pelvis (sacroilíacas y caderas), radiografía AP y lateral de columna lumbar, y lateral de columna cervicalLa radiología no es útil para el diagnóstico precoz, especialmente de las afectaciones de la entesis. Recientemente se está dando importancia a la utilidad de la ecografía52,53, la resonancia magnética54,55, la gammagrafía56 y la tomografía axial por emisión de positrones57 para el diagnóstico precoz en fases aún asintomáticas |
| Valoración de artritis periférica y/o dactilitis/entesitis | Número de articulaciones periféricas tumefactas, dactilitis y/o entesitis |
| Valoración de afectación cutánea/ungueala | PASI/NAPSIBSA (%) |
AP: anteroposterior; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; BASFI: Bath Ankylosing Spondylitis Functional Index; BASMI: Bath Ankylosing Spondylitis Metrology Index; BSA: Body Surface Area; EVA: escala visual analógica; EVN: escala visual numérica; NAPSI: Nail Psoriasis Severity Index; PASI: Psoriasis Area Severity Index; VSG/PCR: velocidad de sedimentación globular/proteína C reactiva;
Fuente: Ritchlin et al.27, Sociedad Española de Reumatología28 y Fernández-Sueiro et al.29.
La forma clínica de la APs se basará en los resultados de esta evaluación. A efectos prácticos la APs se puede clasificar, en función del componente predominante, como APs de predominio periférico (con o sin componente axial) y APs de predominio axial (con o sin componente periférico). A su vez, cada una de ellas, de cara al pronóstico y al tratamiento, se estratifica basándose en la actividad clínica (signos y síntomas clínicos, reactantes de fase aguda), daño estructural, función y repercusión sobre la calidad de vida. En las tablas 9 y 10, y con fines prácticos para este documento, se presenta una propuesta de clasificación pronóstica de la APs, basada en las referencias revisadas27-29.
Clasificación clínica de la artritis psoriásica periféricaa
| Sin actividad o en remisión |
| En afectación poliarticular: DAS28<2,4 |
| En afectación oligoarticular (≤4 articulaciones): |
| Sin clínica de artritis/entesitis/dactilitisVGEm en EVN (0-10)<1VGEp en EVN (0-10)<1 |
| Sin elevación de PCR o VSG |
| Sin impacto sobre la calidad de vida, la capacidad laboral y el ocio |
| Actividad leve |
| En afectación poliarticular: DAS28≥2,4 y <3,2 |
| En afectación oligoarticular (≤4 articulaciones): |
| Clínica de artritis/entesitis/dactilitisVGEm en EVN (0-10)<4VGEp en EVN (0-10)<4 o elevación de PCR o VSG |
| Impacto leve sobre la calidad de vida, la capacidad laboral y el ocio |
| Actividad moderada/grave |
| En afectación poliarticular: DAS28≥3,2 |
| En afectación oligoarticular (4 articulaciones): |
| Clínica de artritis/entesitis/dactilitisVGEm en EVN (0-10)≥4VGEp en EVN (0-10)≥4 o elevación de PCR o VSG |
| Impacto moderado/grave sobre la calidad de vida, la capacidad laboral y el ocio |
BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; DAS28: Disease Activity Score; EVN: escala visual numérica; PCR: proteína C reactiva; VDNp: valoración del dolor nocturno axial por el paciente; VGEm: valoración global de la enfermedad por el médico; VGEp: valoración general de la enfermedad por el paciente; VSG: velocidad de sedimentación globular;
Clasificación clínica de la artritis psoriásica axiala
| Sin actividad o en remisión |
| BASDAI<2, y/o |
| Sin impacto sobre la calidad de vida, la capacidad laboral y el ocio |
| Actividad leve/moderada |
| BASDAI≥2 y <4 |
| VGEm en EVN (0-10)≥2 y <4 |
| Al menos uno de los siguientes criterios: |
| VDNp en EVN (0-10)≥2 y <4VGEp en EVN (0-10)≥2 y <4.Elevación discreta de PCR o de VSG |
| Impacto leve/moderado sobre la calidad de vida, la capacidad laboral y el ocio |
| Actividad moderada/grave |
| BASDAI≥4 |
| VGEm en EVN (0-10)≥4 |
| Al menos uno de los siguientes criterios: |
| VDNp en EVN (0-10)≥4VGEp en EVN (0-10)≥4Elevación moderada o alta de PCR o VSG |
| Impacto moderado/grave sobre la calidad de vida, la capacidad laboral y el ocio |
BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; EVN: escala visual numérica; PCR: proteína C reactiva; VDNp: valoración del dolor nocturno axial por el paciente; VGEm: valoración global de la enfermedad por el médico; VGEp: valoración general de la enfermedad por el paciente; VSG: velocidad de sedimentación globular.
Con frecuencia la gravedad de la APs no se corresponde con la de la Ps, por lo que en toda evaluación habrá que añadir el informe dermatológico para conocer el Psoriasis Area and Severity Index (PASI) y la Body Surface Area (BSA) (%) y el tratamiento dermatológico recomendado, ya que el plan terapéutico deberá hacerse de forma conjunta, contemplando tanto la situación articular como la cutánea.
Plan terapéutico conjunto (reumatólogo/dermatólogo) de la artritis psoriásicaEl objetivo del tratamiento de la APs es la remisión de la enfermedad o, en su defecto, la reducción al mínimo de la actividad inflamatoria (MAE; tabla 11) para alcanzar una mejoría significativa de los síntomas y signos, preservar la capacidad funcional, mantener una buena calidad de vida y controlar el daño estructural29,36. En las tablas 12–14 se muestran los objetivos terapéuticos según el tratamiento, en APs periférica y axial29.
Criterios de Mínima Actividad de la Enfermedad (MAE) en artritis psoriásica periférica
| Se considera que se ha llegado a una MAE si concurren, al menos, 5 de las siguientes circunstancias: |
| 1. NAD≤1 |
| 2. NAT≤1 |
| 3. PASI≤1 o BSA≤3% |
| 4. VDp en EVN (0-10)≤1,5 |
| 5. VGEp en EVN (0-10)≤2,5 |
| 6. HAQ≤0,5 |
| 7. Número de entesis dolorosas≤1 |
BSA: Body Surface Area; EVN: escala visual numérica; HAQ; Health Assessment Questionnaire; NAD: número de articulaciones dolorosas; NAT: número de articulaciones tumefactas; PASI: Psoriasis Area Severity Index; VDp:valoración del dolor por el paciente; VGEp: valoración general de la enfermedad por el paciente.
Fuente: Coates et al.58.
Objetivo terapéutico en artritis psoriásica de predominio periférico
| En poliartritis | Tras administración correcta de AINE o FAME no biológicos:DAS28<3,2 y/o se ha conseguido una MAETras administración correcta de tratamiento biológico:Deseable: DAS28<2,6Aceptable: DAS28 (<3,2 o un descenso de 1,2 desde el previo) y/o se ha conseguido una MAE |
| En oligoartritis o monoartritis | Desaparición completa de la inflamación, y/o se ha conseguido una MAE |
| Tanto en poliartritis como en monoartritis para conseguir el objetivo terapéutico NO pueden concurrir ninguna de las siguientes: | Progresión radiológica articular |
| Marcada impotencia funcional o alteración importante de la calidad de vida o de la actividad laboral | |
| Manifestaciones extraarticulares incontroladas o recurrentes (uveítis de repetición, manifestaciones gastrointestinales…) | |
| Extensa afectación cutánea | |
| Aumento de los reactantes de fase aguda |
AINE: antiinflamatorios no esteroideos; DAS: Disease Activity Score; FAME: fármaco modulador de la enfermedad; MAE: mínima actividad de la enfermedad.
La administración de tratamiento correcto con FAME no biológico supone tratamiento con FAME o combinación de ellos durante al menos 3meses, de los cuales al menos en 2meses debe ser a dosis plena (salvo que la intolerancia o la toxicidad limiten las dosis)
La administración correcta de tratamiento biológico implica mantenerlo a la dosis recomendada durante, al menos, 3-4meses.
Objetivo terapéutico en artritis psoriásica de predominio axial
| Tras administración de tratamiento correcto con AINEaSi no hay aumento de los reactantes de fase aguda y, además concurren todas las circunstancias siguientes: |
| 1. BASDAI<4 |
| 2. VGM<4 |
| 3. VGEp con EVN (0-10)<4 |
| 4. VDANp con EVN (0-10)<4 |
| Tras la administración de tratamiento correcto con biológicobDeben concurrir las 3 circunstancias siguientes: |
| 1. BASDAI, disminución en relación al previo del 50% o de 2 puntos |
| 2. VGEm, disminución en relación al previo del 50% o de 2 puntos |
| 3. Disminución del 50% en al menos uno de los siguientes si estaban elevados en el previo: |
| VGEp con EVN (0-10), si el previo≥4 |
| VDANp con EVN (0-10), si el previo≥4 |
| VSG y/o PCR, si las previas estaban elevadas |
AINE: antiinflamatorios no esteroideos; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; EVN: escala visual numérica; VDANp: valoración del dolor axial nocturno por el paciente; VGEm: valoración global de la enfermedad por el médico; VGEp: valoración general de la enfermedad por el paciente.
Objetivo terapéutico tras la administración correctaa de tratamiento biológico en dactilitis y/o entesitis
| Si tras el tratamiento correcto mejoran todos los siguientes: |
| La impotencia funcional |
| El dolor |
| Los signos de actividad inflamatoria |
| La alteración en la actividad laboral |
| La calidad de vida |
Los AINE, con o sin infiltraciones locales de glucocorticoides, son de utilidad en la APs periférica leve con una afectación dermatológica que responda bien a la terapia tópica (corticosteroides, análogos de la vitaminaD) o fototerapia con PUVA/UVB.
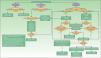
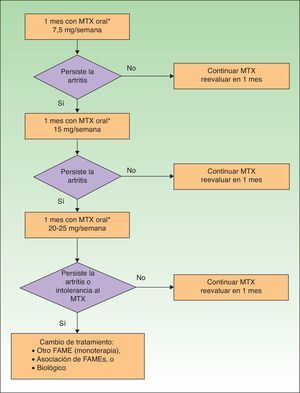
Si la afectación dermatológica no responde al tratamiento anterior o requiere terapia sistémica (tabla 15), es recomendable la utilización de FAME (solos o combinados). En pacientes con formas periféricas moderadas/graves se recomienda también la utilización de FAME (solos o en combinación) e incluso de corticoides sistémicos a dosis bajas. Si hay afectación dermatológica hay que tener cuidado con los corticoides sistémicos, ya que pueden producir un empeoramiento de la Ps27. En APs la terapia biológica está indicada en los casos en que existe intolerancia a los FAME, están contraindicados o han fracasado. En la figura 3 se presenta un algoritmo terapéutico para la APs periférica, basado en el documento SER de consenso sobre el uso de terapias biológicas en APs29. En él se incluyen los criterios de fracaso terapéutico y recomendaciones para la evaluación del tratamiento.
Indicación de tratamiento sistémico en psoriasis
| Está indicado tratamiento sistémico si se da alguna de las siguientes: |
| Enfermedad no controlada con tratamiento tópico y fototerapia |
| PASI>10 |
| Enfermedad extensa: BSA>5-10% |
| Rápido empeoramiento de la enfermedad |
| Lesiones en zonas visibles |
| Repercusión funcional por afectación palmoplantar o genital |
| Percepción subjetiva de severidad (DLQI>10) |
| Extensa eritrodermia o psoriasis pustular |
| Presencia de artritis psoriásica |
BSA: Body Surface Area; DLQI: Dermatology Life Quality Index; PASI: Psoriasis Area Severity Index.
Fuente: Puig et al.37.
Los FAME con eficacia demostrada en la APs periférica incluyen la sulfasalazina (SSZ), el metotrexato (MTX), la leflunomida (LEF) y la ciclosporinaA, si bien los más recomendados en APs por su perfil riesgo-beneficio son el MTX y la LEF29. Sin embargo, en Ps el MTX es el FAME más recomendado37, por lo que sería de elección en el caso de que concurrieran APs y Ps. Las pautas para cada FAME en el tratamiento de la APs se resumen en la tabla 16.
Artritis psoriásica periférica. Pauta inicial (3 primeros meses) de cada uno de los FAME
| FAME | Pauta |
| MTX | 7,5mg/semana. Si al mes no hay remisión, incrementar según pauta de escalada rápida |
| LEF | 20mg/día (si intolerancia: 10mg/día) |
| SSA | 2-3g/día |
| Ciclosporina A | 3-5mg/kg/día (si efectos adversos, dosis máxima tolerada) |
LEF: leflunomida; MTX: metotrexato; SSA: sulfasalazina.
Fuente: Fernández-Sueiro et al.29.
En APs de predominio periférico se considerará el uso de terapia biológica cuando no exista respuesta adecuada a un FAME o a la combinación entre ellos, durante al menos 3meses, de los cuales al menos 2meses deben ser a dosis plena (salvo que problemas de tolerancia o toxicidad limiten la dosis)29.
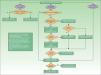
Los AINE y la fisioterapia son el tratamiento de elección en la APs axial leve/moderada, en donde la afectación dermatológica no precise tratamiento con FAME o biológicos. Sin embargo, los FAME no han demostrado ser eficaces en la APs axial, por tanto ante el fracaso de AINE, o en el caso de que la afectación dermatológica sea refractaria al tratamiento tópico o requiera terapia sistémica (tabla 15), está recomendada la terapia biológica. En APs de predomino axial se considerará el uso de terapia biológica ante el fallo de al menos 2 AINE con potencia antiinflamatoria demostrada durante un periodo de 4semanas cada AINE a la dosis máxima recomendada o tolerada, excepto que haya evidencia de toxicidad o contraindicación a los AINE29. El algoritmo terapéutico para APs axial, basado igualmente en el documento de la SER29, se presenta en la figura 4.
Actualmente hay 4fármacos biológicos con indicación aprobada por las agencias reguladoras para el tratamiento de los síntomas y signos de la APs activa refractaria a la terapia convencional (tabla 17): adalimumab (ADA), etanercept (ETN), golimumab e infliximab (IFX) (fig. 5).
Dosis y vía de administración de las terapias biológicas con indicación aprobada para la APs. Primeras 52 semanas de tratamiento
| Principio activo | Nombre comercial | Dosis ficha técnica | Vía de administración |
| Adalimumab | Humira® | 40mg cada 2semanas | s.c. |
| Etanercept | Enbrel® | 25mg 2veces/semana | s.c |
| 50mg cada semana | |||
| Golimumab | Simponi® | 50mg cada mes | s.c. |
| Infliximab | Remicade® | 5mg/kg, semanas 0, 2 y 6, y cada 8 semanas | i.v. |
i.v.: intravenosa; s.c.: subcutánea.
No hay datos de comparaciones directas que avalen la superioridad de un fármaco biológico sobre otro en el tratamiento de la APs38, por lo que la elección concreta dependerá del criterio médico, de las circunstancias particulares de cada paciente y de las diferentes estructuras, antigenicidad y mecanismos de acción de las diferentes terapias biológicas39. En base a datos de registros internacionales y estudios observacionales en pacientes con APs, ETN podría asociarse con una mayor supervivencia al comparar con los otros anti-TNF40-42.
Si a los 3-4 meses de iniciar la terapia biológica no hay respuesta (en poliarticulares, DAS28>3,2 o DAS28 entre 2,6 y 3,2 pero sin descenso de 1,2puntos desde el valor previo) o si la respuesta inicialmente alcanzada se pierde, no hay evidencia que avale un cambio en la dosificación de los agentes biológicos, por lo que se debería plantear un cambio en la estrategia terapéutica, cambiando a otro agente biológico. Si la respuesta es aceptable (en poliarticulares, DAS28 entre 2,6 y 3,2 y/o un descenso de 1,2puntos desde el valor previo) se recomienda continuar el tratamiento pudiendo asociarle un FAME. En caso de haberse obtenido el objetivo terapéutico, se recomienda continuar el tratamiento y evaluar a los 3-4meses29.
No hay suficiente evidencia actual en pacientes con APs que se encuentren en situación de remisión con terapia biológica que permita recomendar la reducción de dosis o alargamiento del periodo entre dosis, si bien, de forma individualizada, se puede considerar una desintensificación del tratamiento29. En este sentido se ha publicado alguna experiencia con terapia biológica43. Esta área se considera actualmente un objetivo prioritario de investigación36.
Seguimiento conjunto (reumatólogo/dermatólogo) de la artritis psoriásicaExiste muy poca información en la literatura acerca de la monitorización y el seguimiento que hay que realizar a los pacientes con APs44-46. Las recomendaciones están, por lo tanto, basadas en opiniones de expertos.
Como normal general, el seguimiento de la APs se realizará en la consulta de reumatología, pero si el dermatólogo detectara algún signo o síntoma que sugiriese un empeoramiento de la APs, remitirá al paciente a consulta de reumatología para revisión. El dermatólogo también consensuará con el reumatólogo cualquier cambio de tratamiento que pueda afectar directamente al curso de la APs (especialmente de FAME y/o terapia biológica). Igualmente, el reumatólogo consensuará con el dermatólogo cualquier cambio de tratamiento que pueda afectar directamente al curso de la Ps (especialmente de FAME y/o terapia biológica).
En las visitas de seguimiento de la APs, el reumatólogo realizará una evaluación más breve y dirigida que la realizada en la primera visita; en la historia debe constar una exploración física, análisis de laboratorio con hemograma, bioquímica general, PCR y VSG y una evaluación del pronóstico. Con la visita de seguimiento se pretende hacer una evaluación de la actividad de la APs que permita valorar la eficacia del tratamiento y la adherencia, así como monitorizar los posibles efectos adversos del tratamiento.
En las tablas 7 y 8 se presentan los parámetros a evaluar y los instrumentos recomendados en el seguimiento de la APs. Para evaluar la actividad de la enfermedad se recogerán datos objetivos como el número de articulaciones dolorosas e inflamadas, la presencia de dactilitis y entesitis y la valoración global de la enfermedad por el médico, y al mismo tiempo datos subjetivos como la evaluación de la actividad de la enfermedad por parte del paciente y del dolor en la última semana, mediante escala visual numérica (EVN); también se incluirán parámetros analíticos de inflamación (PCR y VSG), y evaluación sociolaboral (astenia, capacidad funcional, calidad de vida). Puede ser útil la recogida de información sobre el uso de tratamientos sintomáticos. Para valorar la respuesta al tratamiento, a pesar de sus limitaciones, es recomendable el cálculo del DAS28 en las formas poliarticulares. Aunque es un índice desarrollado para artritis reumatoide, la familiaridad que el reumatólogo tiene por su uso cotidiano y la buena capacidad para medir la respuesta a los tratamientos lo convierten en una herramienta atractiva en la práctica diaria para las formas poliarticulares. En la valoración del tratamiento de las formas axiales se recomienda el cálculo del BASDAI. Para la monitorización de los efectos adversos de los tratamientos se recomienda la realización de hemograma y bioquímica general, además de las evaluaciones específicas requeridas por cada fármaco.
Es necesario igualmente recoger datos sobre la evaluación de la piel y uñas, especialmente en las formas de Ps moderada/grave, con derivación al dermatólogo para que informe sobre el PASI, la BSA y el plan terapéutico propuesto, siempre que se crea clínicamente necesario.
Deben realizarse radiografías de las articulaciones sintomáticas durante el seguimiento del paciente. En el caso de las formas poliarticulares se deben realizar radiografías anteroposteriores de manos y pies. Se realizarán con periodicidad anual en artritis de reciente inicio (los primeros 3-4años), y posteriormente la frecuencia variará según la actividad de la enfermedad.
En pacientes sin clínica aguda, bien controlados y que no precisen otro tipo de evaluación especial por su tratamiento farmacológico u otras circunstancias, se les realizará seguimiento cada 6-12meses. Cuando sea preciso establecer la efectividad de una intervención terapéutica, vigilar el cumplimiento terapéutico, o si la situación clínica lo demanda, se realizará seguimiento cada 4-6semanas, hasta 3-4meses del inicio de la intervención terapéutica o estabilización del cuadro clínico.
En ocasiones el tratamiento con TB puede producir una reacción paradójica sobre la Ps produciendo una exacerbación de las lesiones o su aparición de novo en pacientes que no tenían Ps previa. Estos brotes de Ps asociados a la terapia biológica pueden aparecer al cabo de días o años del inicio del anti-TNF, y su forma de presentación más frecuente es la Ps palmoplantar, pustulosa o en placas. La actitud terapéutica en estos casos dependerá de la extensión de las lesiones y de la respuesta a su tratamiento tópico. Si las lesiones son tolerables con BSA<5-10%, se tratarán con terapia tópica (esteroides, queratolíticos y análogos de la vitaminaD). Si el problema no mejora, se considerará un cambio de TB o la supresión de este tipo de fármacos. En lesiones tolerables, pero con BSA>5-10% o con afectación palmoplantar, se considerará un cambio de TB y tratamiento tópico con corticoides oclusivos, asociando fototerapia, acitetrino y/o FAME (MTX, ciclosporinaA); si el problema no mejora, se considerará un cambio de TB o su supresión. Ante lesiones más severas o intolerables por el paciente, o si este prefiere interrumpir el TB, se suprimirá y se le aplicará tratamiento tópico. El reumatólogo deberá remitir al dermatólogo, para diagnóstico, a los pacientes en tratamiento con terapia biológica que desarrollen o empeoren de sus lesiones en la piel47,48. Si el dermatólogo confirma la naturaleza psoriásica de las lesiones de novo o la exacerbación de la Ps, propondrá un plan terapéutico al reumatólogo, de acuerdo con la gravedad o la extensión de la afectación dermatológica.
En cualquier caso, la comunicación entre atención primaria, dermatología y reumatología debe ser ágil y eficaz.
DiscusiónEn los últimos años ha surgido un interés creciente por el estudio de la APs y por su consideración como una entidad clínica independiente del resto de las espondiloartritis. Su asociación con la Ps, la afectación de articulaciones periféricas, la dactilitis y las peculiaridades de su afectación axial en relación con la espondilitis anquilopoyética hacen recomendable considerar a la APs como una enfermedad diferente que precisa de evaluación y manejo específicos.
Recientemente se han publicado 2revisiones monográficas sobre APs dirigidas a dermatólogos49,50 y multitud de guías y recomendaciones para su manejo, unas dirigidas al área de reumatología27-31 y otras a la de dermatología23-26. En las recientes publicaciones del Grupo de Trabajo en Comorbilidades asociadas a la Psoriasis23,24 se aborda cuál debe ser el papel del dermatólogo tanto en el diagnóstico como en la derivación hacia reumatología de los pacientes con APs. Sin embargo, no contemplan en profundidad cuál debe ser el papel del dermatólogo en el control de la APs y cómo deben interaccionar reumatólogos y dermatólogos para decidir el tratamiento más adecuado a cada caso y hacer la evaluación de la respuesta al tratamiento, en función de la situación clínica tanto de la Ps como de la APs.
En el estudio multicéntrico CALIPSO51, realizado en España hace unos años, se encontraron importantes diferencias en el manejo clínico y el seguimiento de los pacientes con APs, según sean atendidos en consultas de reumatología o de dermatología. Sus autores consideran que estas diferencias son indicativas de una falta de consenso en su abordaje, y recomiendan la elaboración de protocolos estandarizados de actuación con pautas diagnósticas, de clasificación y de manejo clínico y terapéutico, así como criterios de derivación entre dermatología y reumatología. El presente documento surge como una iniciativa dirigida a abordar este problema y supone un punto de vista complementario a las guías y documentos de consenso publicados, aportando recomendaciones específicas para unificar criterios y mejorar el manejo conjunto de la APs por ambas especialidades médicas.
El hecho de que este documento parta de una revisión no sistemática no debe suponer una limitación al mismo. La revisión se realiza para seleccionar herramientas usuales y aceptadas de diagnóstico, evaluación y manejo terapéutico de la APs, que sirvan de esquema y soporte al proyecto. Es decir, son el marco en el que se incluyen las recomendaciones elaboradas por los panelistas del estudio para el manejo coordinado de la APs.
Las recomendaciones se basan exclusivamente en la opinión de los expertos. Para dotarlas de robustez se ha empleado un criterio estricto de acuerdo entre los panelistas (>= 70% de puntuaciones en los 3valores extremos). Por otra parte, en la composición del panel han participado tanto reumatólogos como dermatólogos, por lo que las recomendaciones han sido consensuadas por ambos grupos de panelistas. Por estas razones, es de esperar que sean de utilidad en el manejo integral de la APs.
En conclusión, este documento contiene recomendaciones y pautas dirigidas a dermatólogos y reumatólogos, con el fin de mejorar el manejo coordinado de la APs, si bien son los dermatólogos, con su papel crucial en el diagnóstico precoz y derivación, así como en la evaluación de la Ps como información complementaria para el establecimiento pronóstico y terapéutico de la APs, quienes sin duda se podrán beneficiar más con su lectura.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo ha sido realizado con financiación independiente de Pfizer S.L.U.
Conflicto de interesesLos siguientes autores han recibido financiación por asesoramiento como experto, participación en ensayos clínicos o conferencias de las compañías: Abbott (Juan de Dios Cañete, Esteban Daudén, Gregorio Carretero, Lluís Puig, José Luis Sánchez-Carazo y José Luis López-Estebaranz); Celgene (Juan de Dios Cañete, Esteban Daudén y Lluís Puig); Janssen-Cilag (Juan de Dios Cañete, Esteban Daudén, Gregorio Carretero, Lluís Puig y José Luis López-Estebaranz); MSD y/o MSD-Schering-Plough y/o Merck Serono (Juan de Dios Cañete, Esteban Daudén, Gregorio Carretero, Lluís Puig, José Luis Sánchez-Carazo y José Luis López-Estebaranz); Pfizer y/o Wyeth y/o Pfizer-Wyeth (Juan de Dios Cañete, Esteban Daudén, Gregorio Carretero, Lluís Puig, José Luis Sánchez-Carazo y José Luis López-Estebaranz); Amgen (Esteban Daudén y Lluís Puig); Astellas (Esteban Daudén); Boehringer (Lluís Puig); Centocor Ortho Biotech Inc (Esteban Daudén y Lluís Puig); Galderma (Esteban Daudén); Glaxo y/o GSK (Esteban Daudén); Leo Pharma (Esteban Daudén, Gregorio Carretero y Lluís Puig); Novartis (Esteban Daudén, Gregorio Carretero y Lluís Puig), y VBL (Lluís Puig).
El resto de los autores declaran no presentar ningún potencial conflicto de intereses con el contenido del presente manuscrito. Todos los autores del manuscrito consideran que han actuado con total independencia en su elaboración.
A la memoria del Dr. José Luis Fernández Sueiro, reumatólogo pionero en la promoción de la colaboración entre dermatólogos y reumatólogos en el manejo y estudio de la artritis psoriásica.