La terapia biológica representa una alternativa bien establecida en el manejo de la psoriasis moderada y grave. Sin embargo, su elevado coste, la experiencia relativamente limitada en su empleo clínico y la abundancia de publicaciones existentes hacen necesario el desarrollo de unas directrices basadas en la evidencia científica disponible y en el consenso de un grupo de expertos. El objetivo ideal del tratamiento de la psoriasis es conseguir y mantener a largo plazo un blanqueamiento completo o prácticamente completo o, en su defecto, una mínima afectación localizada y controlable con tratamientos tópicos. Aunque la evidencia disponible permite comparar de forma directa o indirecta la eficacia y las posibilidades de fracaso terapéutico primario o secundario de los diferentes fármacos según parámetros objetivos, las limitaciones en la extrapolación de los ensayos clínicos a la clínica diaria condicionan que la elección del fármaco y de la pauta de administración se realicen de forma individualizada en función de las características de cada paciente. La presente actualización de las directrices para el tratamiento de la psoriasis con agentes biológicos de la Academia Española de Dermatología y Venereología (AEDV) incorpora la información más reciente disponible a este respecto.
Biologic therapy is a well-established strategy for managing moderate and severe psoriasis. Nevertheless, the high cost of such therapy, the relatively short span of clinical experience with biologics, and the abundance of literature now available on these agents have made evidence-based and consensus-based clinical guidelines necessary. The ideal goal of psoriasis treatment is to achieve complete or nearly complete clearing of lesions and to maintain it over time. Failing that ideal, the goal would be to reduce involvement to localized lesions that can be controlled with topical therapy. Although current evidence allows us to directly or indirectly compare the efficacy or risk of primary or secondary failure of available biologics based on objective outcomes, clinical trial findings cannot be directly translated to routine practice. As a result, the prescribing physician must tailor the treatment regimen to the individual patient. This update of the clinical practice guidelines issued by the Spanish Academy of Dermatology and Venereology (AEDV) on biologic therapy for psoriasis incorporates information from the most recent publications on this topic.
El Grupo Español de Psoriasis de la Academia Española de Dermatología y Venereología ha puesto en marcha un proyecto para desarrollar y mantener actualizadas las directrices basadas en la evidencia científica para el tratamiento sistémico de la psoriasis con agentes biológicos. El objetivo de las mismas es poner a disposición de todos los dermatólogos una herramienta de decisión terapéutica basada en la evidencia científica disponible, que contribuya al tratamiento óptimo de los pacientes con psoriasis moderada/grave y que pueda servir de referencia a los farmacéuticos y gestores hospitalarios y a las autoridades sanitarias.
AntecedentesLa psoriasis es una enfermedad cutánea crónica y recidivante que afecta a aproximadamente a un 1,4% de la población española, con diferencias geográficas (1,2 a 1,9%)1. En los últimos años se ha reconocido la asociación de la psoriasis con una serie de comorbilidades, lo que ha llevado a considerarla como una enfermedad sistémica con manifestaciones predominantemente cutáneas2, que determinan una significativa reducción de la calidad de vida3 con repercusiones en el ámbito físico, emocional, sexual y laboral-económico de los pacientes.
Entre dichas comorbilidades merece especial atención la artritis psoriásica, una artropatía inflamatoria frecuentemente incapacitante que por lo general aparece un promedio de 10 años después del diagnóstico de la enfermedad cutánea, y cuya prevalencia puede variar entre un 6 y un 26%, dependiendo de la población estudiada4. En España, según los resultados del primer estudio epidemiológico realizado en una población de 3.320 pacientes con psoriasis moderada/grave, el 13% tiene un diagnóstico confirmado de artritis psoriásica5.
Para definir la gravedad de la psoriasis en la práctica clínica dermatológica se utiliza normalmente el porcentaje de superficie corporal afectada (BSA) (considerando la palma de la mano como un 1% de dicha superficie) o el Psoriasis Area and Severity Index (PASI)6,7. Otras medidas que se han empleado como parámetros de gravedad de la psoriasis y para evaluar la eficacia de las intervenciones terapéuticas son el Physician's Global Assessment (PGA) y parámetros de calidad de vida, como el Dermatology Life Quality Index (DLQI). Existe una buena correlación entre el PASI y el PGA, pero el primero está mejor validado y es el parámetro de elección para determinar la respuesta en los ensayos clínicos8. Por lo que respecta a la evaluación de la calidad de vida relacionada con la salud, el DLQI es el índice más utilizado mundialmente; es fácil de utilizar y sensible al cambio, pero se ve limitado por su carácter unidimensional y su variable adaptación transcultural9.
La afectación cutánea objetivable, aunque resulta fundamental para la correcta valoración de la respuesta en los ensayos clínicos, es en muchos casos insuficiente como criterio de gravedad teniendo en cuenta las necesidades del paciente y, en la actualidad, existe consenso en España en establecer una definición operativa de psoriasis moderada/grave como la que presentan los pacientes que son candidatos a tratamiento sistémico y/o fototerapia10.
Existen diversos tratamientos sistémicos aprobados para su uso en la psoriasis moderada/grave: fototerapia (radiación ultravioleta: ultravioleta A, ultravioleta B [UVB] o UVB de banda estrecha), fotoquimioterapia (psoralenos más radiación ultravioleta A), agentes sistémicos clásicos (ciclosporina, metotrexato y acitretina) y agentes biológicos (adalimumab, etanercept, infliximab y ustekinumab). Estos tratamientos pueden ser empleados solos, en combinación con tratamientos tópicos o combinados entre sí (aunque algunas combinaciones pueden no ser apropiadas por el potencial aumento de toxicidad hepática, renal o metabólica o de inmunosupresión). La decisión terapéutica debe estar basada en una experiencia clínica amplia por parte del dermatólogo prescriptor, y en las características individuales del paciente y del curso y momento evolutivo de la enfermedad en cada caso.
Los tratamientos biológicos están diseñados para bloquear específicamente dianas moleculares relevantes en la patogenia de la psoriasis, y presentan un perfil de eficacia/riesgo favorable, demostrado en extensos estudios clínicos y poscomercialización en pacientes con psoriasis y en otras indicaciones.
JustificaciónEl elevado coste de los fármacos biológicos, la experiencia relativamente limitada en su empleo clínico y la abundancia de publicaciones existente hacen necesario el desarrollo de unas directrices basadas en la evidencia científica disponible y el consenso de un grupo de expertos, cuyo objetivo debe ser proporcionar el máximo beneficio terapéutico a los pacientes y servir de guía para la prescripción eficaz y segura por parte del dermatólogo. Existen en la literatura diversas directrices nacionales y europeas que abordan el manejo terapéutico de la psoriasis con agentes biológicos11–17, pero la retirada de efalizumab, la incorporación de ustekinumab y la aparición de nuevas evidencias científicas, junto con las críticas aparecidas a algunas directrices existentes18, justifican la presente publicación como actualización de las directrices españolas previamente publicadas12.
En estas directrices se revisan las evidencias científicas disponibles acerca de la eficacia y seguridad de adalimumab, etanercept, infliximab y ustekinumab en el tratamiento de la psoriasis moderada-grave, los criterios de selección de los pacientes candidatos a ser tratados con agentes biológicos y la actitud terapéutica en lo que se refiere al inicio del tratamiento, la respuesta o fracaso terapéuticos, así como el mantenimiento, la retirada, la reanudación y el posible ajuste del tratamiento en cada caso.
MétodosEn la redacción de estas directrices ha participado un panel de expertos integrantes del Grupo Español de Psoriasis de la Academia Española de Dermatología y Venereología (AEDV), con especial dedicación y experiencia en el tratamiento de la psoriasis moderada/grave, y han sido sometidas a la consideración de todos los miembros del Grupo Español de Psoriasis antes de su publicación.
Se han consultado las últimas ediciones de las directrices11–17,19, revisiones sistemáticas20–23, metaanálisis24–31 y análisis de eficiencia32–36 referidos al tratamiento de la psoriasis con agentes biológicos publicadas hasta la fecha y se ha efectuado una revisión en las bases de datos Medline y Cochrane de la literatura referente a ensayos clínicos con adalimumab, etanercept, infliximab y ustekinumab publicados hasta septiembre de 2012. Las referencias así obtenidas se han evaluado de acuerdo con criterios previamente establecidos17 para definir el nivel de evidencia y la fuerza de la recomendación en cada caso. Asimismo, se han revisado las correspondientes fichas técnicas de cada agente biológico37–40 y se ha hecho una revisión bibliográfica para complementar la información disponible.
Actualización y limitacionesLas presentes directrices contienen la mejor información disponible en el momento de su redacción, y está prevista su actualización periódica. Las conclusiones o recomendaciones que contienen pueden verse modificadas por nuevos datos que aparezcan en el futuro. Estas directrices están destinadas a proporcionar ayuda al dermatólogo en el tratamiento de la psoriasis moderada/grave con agentes biológicos, y no pretenden ser una guía estricta de tratamiento; en cada caso la decisión terapéutica debe ser individualizada con el objetivo de beneficiar al paciente, basada en la ficha técnica de cada fármaco y teniendo en cuenta las consideraciones farmacoeconómicas que procedan.
Pacientes candidatos a tratamiento con agentes biológicosLos tratamientos biológicos están indicados (según las correspondientes fichas técnicas de la European Medicines Agency [EMA]) de forma general en el tratamiento de pacientes adultos con psoriasis en placas moderada/grave que no han respondido, tienen contraindicación o presentan intolerancia/efectos adversos a otro tratamiento sistémico. En la mayoría de los ensayos clínicos con agentes biológicos efectuados y presentados a las agencias reguladoras con fines de autorización, los criterios de inclusión han sido la presencia de psoriasis en placas moderada/grave (con PASI≥10-12), sin otros calificativos, por lo que la Food and Drug Administration (FDA) no incluye el condicionante anteriormente enunciado.
En el Documento de consenso de la AEDV10 se define como psoriasis moderada/grave la que requiere (o ha requerido previamente) tratamiento sistémico, incluyendo fármacos convencionales, agentes biológicos y/o foto(quimio)terapia (tabla 1).
Recomendaciones: criterios de elegibilidad para el tratamiento biológico
| Está indicado el tratamiento sistémico (convencional o biológico) en pacientes con psoriasis moderada/grave, es decir que cumplan alguna de las siguientes condiciones: a) no controlable con tratamiento tópico; b) con formas extensas (BSA≥5-10%), PASI≥10; c) empeoramiento rápido; e) compromiso de áreas visibles; f) limitación funcional (palmoplantar, genital); h) con percepción de gravedad subjetiva (DLQI>10); o i) eritrodermia o psoriasis pustulosa extensa; j) asociada a artropatía psoriásica10. (Nivel de evidencia 4, consenso) |
| Según las fichas técnicas actualmente vigentes los tratamientos biológicos están indicados en el tratamiento de pacientes con psoriasis moderada/grave que no han respondido, tienen contraindicación o presentan intolerancia, efectos adversos o probable toxicidad —aguda o por dosis acumulada— a los tratamientos sistémicos clásicos, incluyendo acitretina, metotrexato, ciclosporina, fototerapia o foto(quimio)terapia, o de otros tratamientos biológicos e incluyen en esta definición10 (Nivel de evidencia 4, consenso): |
| 1. Pacientes en quienes no se consigue un control eficaz con los agentes sistémicos disponibles, solos o en combinación |
| 2. Pacientes que presentan recaídas rápidas (en menos de 3 meses) después de suspender cualquier tipo de tratamiento |
| 3. Pacientes que requieren dosis altas de tratamiento sistémico clásico (con riesgo de aparición de efectos adversos por toxicidad aguda o acumulada en un porcentaje significativo de pacientes) |
| 4. Pacientes con intolerancia a algún tratamiento sistémico (aparición de toxicidad o efectos adversos a dosis eficaces) o riesgo elevado (por la dosis o la duración del tratamiento, susceptibilidad individual, factores de riesgo individual —edad, sexo, comorbilidades o posibles interacciones medicamentosas—) de toxicidad acumulativa con metotrexato, ciclosporina, acitretina o foto(quimio)terapia, incluso en ausencia de alteraciones analíticas |
| 5. Pacientes que por razones laborales, de horario, desplazamiento o disponibilidad no sean susceptibles de recibir tratamiento con foto(quimio)terapia |
La elección del tratamiento biológico debe regirse por los criterios de uso de la ficha técnica y las guías terapéuticas diseñadas al respecto por grupos de expertos y, además, debe ser individualizada teniendo en cuenta factores como la presencia de enfermedades concomitantes, artritis psoriásica, edad, peso, expectativas y estilo de vida del paciente y riesgo de efectos adversos, así como las características de la enfermedad desde un punto de vista histórico (tratamientos previos) y del grado de actividad de la psoriasis en el momento de la prescripción.
Todos los agentes biológicos aprobados para el tratamiento de la psoriasis deben estar disponibles para todos los pacientes candidatos a tratamiento, sin retrasos innecesarios ni limitaciones de cualquier tipo que puedan implicar una falta de equidad para el paciente.
Prescriptores de tratamientos biológicos para pacientes con psoriasisLos tratamientos biológicos deben ser prescritos por dermatólogos con experiencia en el tratamiento de la psoriasis con agentes sistémicos. Hay que insistir en la conveniencia de documentar la medición de la afectación de la enfermedad en el paciente (PASI, BSA, PGA, DLQI, etc.), de forma que permita evaluar la respuesta en cada paciente y justificar el tratamiento ante posibles auditores.
Fases del tratamientoEl tratamiento sistémico de la psoriasis con agentes biológicos puede definirse en 2 fases: la fase de inducción y la fase de mantenimiento. La fase de inducción, de forma general, corresponde al período de tratamiento hasta la semana 16, aunque dependiendo del fármaco y la dosis este período puede extenderse hasta la semana 24, momento en que se alcanza la meseta de eficacia para todos los fármacos biológicos41,42. El tratamiento a partir de entonces se considera que entra en la fase de mantenimiento, y deben tenerse en cuenta las características especiales del tratamiento a largo plazo.
Definición de fracaso o fallo terapéuticoEl fracaso terapéutico es una consideración de gran relevancia en terapia biológica, ya que generalmente obliga a un cambio de agente biológico, con el consiguiente incremento del coste (el coste de adquisición del primer agente fallido más la diferencia entre el coste de adquisición de las dosis correspondientes a la fase de carga del sustituto y la de mantenimiento del primero)42.
El fracaso o fallo terapéutico primario se define por la incapacidad de alcanzar una respuesta PASI 50 (50% de mejoría con respecto al PASI basal) o «umbral de eficacia»14,43 durante la fase de inducción terapéutica. Aunque este se considera el criterio fundamental para decidir el fallo terapéutico, deberá confirmarse de forma individual, a partir del criterio conjunto del médico y el paciente en función del impacto subjetivo del beneficio, la historia terapéutica y las posibilidades alternativas.
Se entiende por fallo secundario la pérdida de respuesta PASI 50 durante la fase de mantenimiento del tratamiento, aunque se pueden establecer definiciones alternativas basadas en el PASI absoluto (5), el PGA o la combinación del PASI y una medida de calidad de vida10. Los miembros del Grupo Español de Psoriasis consideran que sería criterio de fracaso terapéutico para la mayoría de pacientes un valor absoluto de índice PASI>5 o un valor de PGA>2, aunque debe tenerse en cuenta el grado de aceptación por parte del paciente.
Según las fichas técnicas (Summary of Product Characteristics) de la EMA37–40 se debe tomar una decisión con respecto a la continuación del tratamiento (basada en el fracaso terapéutico) en momentos diferentes para cada biológico: a las 12 semanas del inicio del tratamiento en el caso de etanercept, a las 14 o 22 semanas en el caso de infliximab42, a las 16 en el caso de adalimumab y a las 28 antes de la cuarta inyección en el caso de ustekinumab. En la práctica clínica habitual la decisión referente al fracaso o éxito de tratamiento no tiene en cuenta estas diferencias y se realiza para todos ellos entre las semanas 16 y 24, una vez transcurrida la fase de inducción terapéutica41, y generalmente antes de prescribir la siguiente inyección o caja de tratamiento.
Actuación en caso de fallo terapéutico primario o secundarioTras la elección de un fármaco biológico determinado, y en el caso de fallo terapéutico primario o secundario, existen 3 alternativas posibles con vistas a optimizar los resultados: intensificación del tratamiento, cambio de biológico y combinaciones terapéuticas.
La intensificación del tratamiento (aumento de la dosis o acortamiento del intervalo de administración), aunque no está aprobada de forma explícita en la ficha técnica, se ha empleado durante ensayos clínicos y extensión en abierto para todos los fármacos biológicos disponibles44,45. En pacientes con fallo terapéutico primario o secundario frente a adalimumab se ha propuesto aumentar temporalmente la dosis de este fármaco a 40mg/semana, lo que permite alcanzar la respuesta PASI 75 o volver a la dosis habitual (40mg cada 15 días), en el 27% de los pacientes a las 12 semanas y el 38% a las 24 semanas46. Los pacientes con mayor probabilidad de respuesta a la intensificación de la dosis (48%) son los que presentan un fallo terapéutico secundario, con relativamente bajo peso y enfermedad de corta evolución. En una cohorte observacional prospectiva de pacientes con fallo terapéutico a adalimumab en los que se intensificó la dosis, el 25% de los pacientes alcanzaron una respuesta PASI 50 a las 12 semanas y el 35% a las 24 semanas, mientras que los porcentajes correspondientes al resultado del tratamiento combinado con metotrexato sin aumentar la dosis fueron del 9 y 18%, respectivamente47.
En la fase de seguimiento en abierto (OLE) del estudio PHOENIX 2 con ustekinumab, en la que se ofreció libertad para, de común acuerdo entre médico y paciente, modificar la pauta terapéutica (reducir de 12 a 8 semanas el intervalo y/o pasar de 45 a 90mg), se intensificó el tratamiento en el 28% de los casos entre las semanas 52 y 24448. En el 51% de los pacientes (230/454) los ajustes realizados durante la fase OLE tuvieron lugar cuando los pacientes ya presentaban respuesta PASI 75, y en el 12% (55/454) de los pacientes se había alcanzado la respuesta PASI 90. Entre los pacientes con respuesta<PASI 75 en el momento del ajuste de la dosis, la mayor parte (70-80%) alcanzó y mantuvo respuestas PASI 75 hasta 3 años más tarde.
Aunque no existen estudios específicos en psoriasis, la intensificación del tratamiento es habitual en el manejo clínico de infliximab, con reducción de los intervalos entre infusiones desde 8 semanas a 6 o incluso 4 semanas49.
La ficha técnica de etanercept recomienda el tratamiento con dosis de 50mg por semana a partir de las 12 semanas; sin embargo, la experiencia de la fase OLE de ensayos clínicos indica que algunos pacientes que pierden la respuesta tras la fase de inducción pueden recuperarla manteniendo la dosis de 100mg por semana50.
La estrategia alternativa (cambio de biológico) es preferible desde un punto de vista farmacoeconómico51.
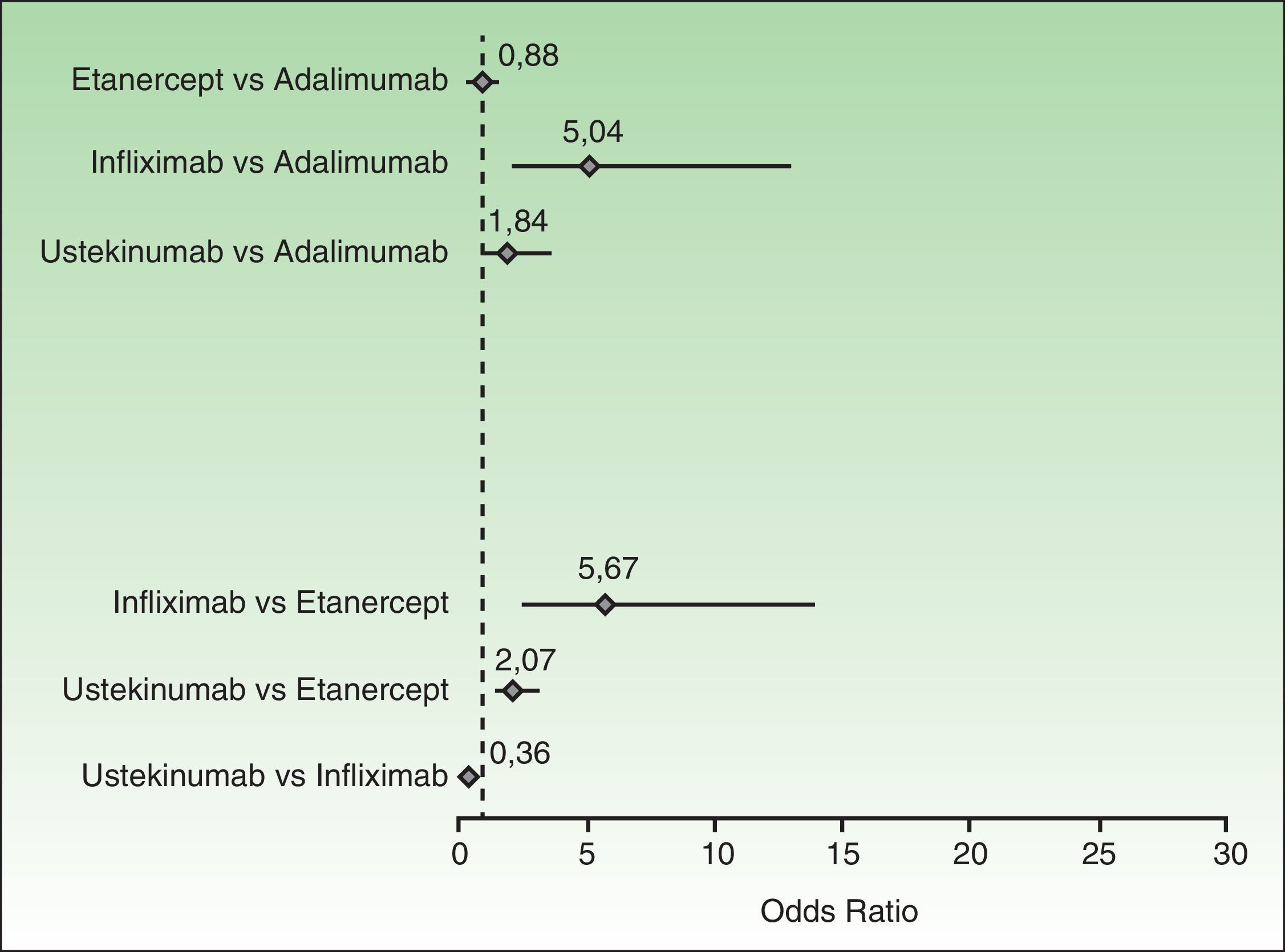
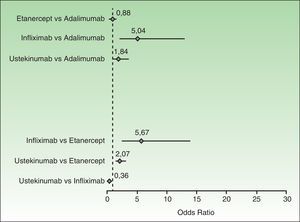
Cuando se plantee el cambio de un biológico por otro por fallo primario o secundario del primero, el prescriptor deberá tener en cuenta múltiples variables, incluyendo las comparaciones apareadas de las tasas de respuesta PASI 75 (fig. 1), la presencia o no de artritis psoriásica activa, las características clínicas del paciente (peso, riesgo de infecciones, comorbilidades o contraindicaciones relativas específicas de cada biológico), el mecanismo de acción, la conveniencia de la posología y la vía de administración, el sobrecoste de la inducción y consideraciones farmacoeconómicas, entre otras.
Estas mismas consideraciones deberán influir en la decisión cuando se plantee el cambio como consecuencia de un acontecimiento adverso, aunque en este caso adquieren especial importancia el riesgo relativo de infecciones, la inmunogenicidad o la posible especificidad de fármaco o «clase terapéutica» de las reacciones paradójicas o la inducción de respuestas autoinmunes, entre otros aspectos.
No existe, en el momento actual, información suficiente que permita establecer recomendaciones definitivas acerca de cuál es el biológico preferible frente a fracaso primario o secundario de otro. Se ha demostrado que en pacientes con fallo primario o secundario tras 3-6 meses de tratamiento con etanercept se consigue alcanzar una respuesta PGA<2 en el 49% de los tratados con adalimumab durante 16 semanas52 y en el 65% de los tratados con infliximab durante 10 semanas53; un 49% de los pacientes tratados con ustekinumab 90mg consiguieron una respuesta PASI 75 a las 12 semanas de la sustitución54. También existen publicaciones que indican buena respuesta tras el cambio de infliximab a etanercept55 o de antiTNF a ustekinumab56.
Hay datos que sugieren que la respuesta en pacientes previamente tratados con biológicos es algo inferior en el caso de etanercept, ustekinumab y adalimumab, mientras que la respuesta a infliximab no depende de la exposición previa a otro biológico19; sin embargo, la evidencia científica disponible es insuficiente para establecer el orden idóneo de preferencia cuando se plantea el empleo de un biológico como segunda línea terapéutica en pacientes con fracaso primario o secundario a un tratamiento previo con otro agente biológico.
El tratamiento combinado se emplea frecuentemente para mejorar la eficacia terapéutica de los agentes biológicos, incluso en ausencia de fracaso terapéutico, y se discute más adelante en un apartado propio.
Eficacia terapéuticaEl objetivo ideal del tratamiento de la psoriasis es conseguir y mantener a largo plazo un blanqueamiento completo o prácticamente completo (PGA≤1, con mínima extensión de la superficie afecta), o en su defecto una mínima afectación localizada y controlable con tratamientos tópicos (PGA≤2, PASI<5)10.
El objetivo terapéutico en la fase de inducción es alcanzar una mejoría de por lo menos el 75% con respecto al PASI basal (una respuesta ≥PASI 75), y una respuesta óptima sería una respuesta ≥PASI 90 (equivalente a la ausencia de manifestaciones clínicas —blanqueamiento— o mínimos signos de enfermedad) y un PASI absoluto <5 o incluso <310; el criterio de PASI absoluto ya se está empleando en la práctica clínica para evaluar la eficacia del tratamiento biológico a largo plazo57. En los pacientes con PASI basal ≥20 la respuesta PASI 75 puede ser insuficiente como objetivo terapéutico a largo plazo (más allá de 6 meses), ya que el PASI obtenido será superior a 5 en valor absoluto.
Cuando la respuesta es inferior a PASI 75 debe modificarse el tratamiento si el paciente no está satisfecho o la psoriasis tiene un impacto significativo sobre la calidad de vida del paciente (DLQI>5)41. Una respuesta inferior a PASI 50 se considera un fracaso terapéutico (primario durante la fase de inducción, secundario si antes se ha conseguido una respuesta adecuada), por lo que con frecuencia debe sustituirse el tratamiento, o una recaída (si se ha suspendido el tratamiento). Sin embargo, la consecución de una mejoría del 50% del PASI puede ser considerada como suficiente en algunos pacientes seleccionados en los que no existan otras alternativas, estas no sean eficaces o no puedan administrarse.
Los parámetros de eficacia basados en la evaluación del paciente (patient reported outcomes), o diferentes del PASI, cuando se someten a metaanálisis no permiten diferenciar adecuadamente los biológicos actualmente disponibles para el tratamiento de la psoriasis58. Si se considera como objetivo terapéutico alcanzar un DLQI de 0 o 1, la respuesta PASI 90 (90% o más de mejoría con respecto al PASI basal) se correlaciona mucho mejor con este objetivo que la respuesta PASI 7559 y la mejoría en el DLQI con respecto a su valor basal, también es superior en los pacientes con respuesta óptima60.
La máxima eficacia terapéutica de todos los agentes biológicos disponibles para el tratamiento de la psoriasis se consigue en un plazo inferior o igual a 6 meses en la mayoría de los pacientes. El objetivo terapéutico del tratamiento de mantenimiento debe ser mantener la eficacia a largo plazo, para lo que se deben tener en cuenta posibles ajustes de la dosis o de los intervalos de tratamiento durante períodos de tiempo adecuados, combinaciones con otras terapias (tratamientos tópicos, fototerapia o sistémico) y, si procede, modificar factores como la obesidad o el sedentarismo. Debe evaluarse el resultado de cualquier intervención en un plazo máximo de 3 meses.
Selección del agente biológicoEl principal factor determinante de la elección de un biológico o del cálculo de su cociente coste/beneficio es la eficacia del mismo, referida a la situación basal y evaluada a partir de la evidencia científica obtenida en los ensayos clínicos. Para ello, los criterios empleados con mayor frecuencia para la comparación son los porcentajes de pacientes que alcanzan la respuesta PASI 75, PASI 90 y PASI 50 para cada uno de los fármacos disponibles. No obstante, hay que tener en cuenta que, en la realidad clínica, las poblaciones de pacientes son muy diferentes a las de los ensayos clínicos61, y las tasas de respuesta permite hacer inferencias poblacionales, pero no predecir la respuesta individual de cada paciente.
El porcentaje de pacientes que alcanzan una respuesta PASI 75 en los diferentes ensayos clínicos es el parámetro de eficacia que se ha considerado como más relevante para su valoración por las autoridades sanitarias con vistas a la eventual aprobación del producto en los diferentes ensayos clínicos54,62–81, y es el que se emplea en la mayoría de metaanálisis25–30,36. Sin embargo, el momento en que se evalúa dicha respuesta (primary outcome) varía para cada fármaco biológico en función del diseño del correspondiente ensayo clínico. Con el objetivo de ofrecer una evaluación homogénea para todos los fármacos disponibles se han propuesto metaanálisis a las 24 semanas31, momento que corresponde al final de la fase de inducción de la respuesta terapéutica. Para todos los biológicos ya se ha alcanzado en este momento la meseta de respuesta PASI 75, a partir de la cual no aumenta el porcentaje de respondedores42; cuando la duración de la fase de asignación a placebo es inferior se arrastran los resultados de la última observación (last observation carried forward o LOCF).
Se han publicado algunos estudios comparativos directos entre biológicos54,68,69, de los que el más relevante es el estudio ACCEPT, por incluir en la comparación 2 biológicos actualmente comercializados54. En dicho ensayo se observó una respuesta PASI 75 en la semana 12 en el 72% de los pacientes tratados con ustekinumab 45mg (pacientes de peso menor o igual a 100kg) y en el 65% de los tratados con ustekinumab 90mg (pacientes de peso superior a 100kg), en comparación con el 57% de los pacientes que recibieron etanercept 50mg 2 veces por semana40. En este estudio la elección del punto temporal de comparación (12 semanas) se ha criticado, puesto que no permite evaluar la máxima capacidad de respuesta de etanercept18,82 ni tampoco de ustekinumab76,77, y la ausencia de un brazo control con placebo plantea problemas metodológicos al efectuar el metaanálisis.
Por los motivos anteriormente mencionados al hablar de objetivos terapeuticos tienen una especial relevancia clínica las tasas de respuesta PASI 90, en especial una vez transcurrida la fase de inducción terapéutica (16 a 24 semanas). La respuesta PASI 90 es especialmente relevante desde el punto de vista clínico ya que, por lo general, coincide con valores absolutos de PASI inferiores a 3, equiparables a blanqueamiento completo o casi completo, habitualmente satisfactorios tanto para el paciente como para el dermatólogo.
También es muy importante tener en cuenta la tasa de respuesta PASI 50, puesto que no alcanzarla o perderla define el fracaso (primario o secundario, respectivamente) que, habitualmente, obliga a sustituir el biológico, recurrir a combinaciones o intensificar el tratamiento.
A igualdad de eficacia (PASI 75) serán preferibles biológicos con una mayor tasa de respuesta PASI 50, o dicho de otra manera, una menor tasa de fracaso terapéutico primario (1-PASI 50). Cuanto menor sea la tasa de fracaso primario menor será la probabilidad de tener que sustituir el biológico durante la fase de inducción, con el consiguiente efecto contraproducente desde el punto de vista psicológico, de tiempo perdido y de coste asociado al cambio (switching), puesto que la fase de carga farmacocinética o inducción es más costosa que la fase de mantenimiento. Adalimumab es el biológico con un menor sobrecoste de la fase de inducción con respecto al mantenimiento (un 18% a las 16 semanas)51.
Teniendo en cuenta todo lo anteriormente mencionado, la consulta de las tablas 2 a 5 permitirá una comparación basada en metaanálisis recientes de las diversas tasas de respuesta PASI 50, PASI 75 y PASI 90 medidas en el momento de evaluación de la variable de respuesta principal. En la tabla 6 se recogen los resultados del metaanálisis que considera la respuesta a 24 semanas (con LOCF)31. Una limitación de los metaanálisis publicados es el empleo, para los cálculos, de los datos de ustekinumab globales según las dosis empleadas en los ensayos clínicos, y no solo los datos correspondientes a pacientes tratados según la ficha técnica, es decir, 45mg para los que pesan 100kg o menos y 90mg para los que pesan más de 100kg.
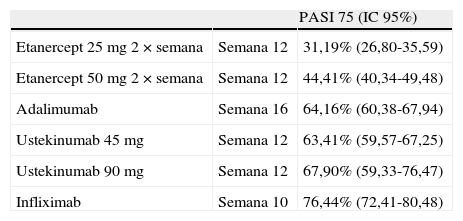
Resultados de eficacia incremental (porcentaje) medida en el momento de evaluación de la variable de respuesta principal en cada ensayo según el metaanálisis de Ferrándiz et al.36
| PASI 75 (IC 95%) | ||
| Etanercept 25mg 2×semana | Semana 12 | 31,19% (26,80-35,59) |
| Etanercept 50mg 2×semana | Semana 12 | 44,41% (40,34-49,48) |
| Adalimumab | Semana 16 | 64,16% (60,38-67,94) |
| Ustekinumab 45mg | Semana 12 | 63,41% (59,57-67,25) |
| Ustekinumab 90mg | Semana 12 | 67,90% (59,33-76,47) |
| Infliximab | Semana 10 | 76,44% (72,41-80,48) |
Los datos de ustekinumab proceden de ensayos clínicos en los que la asignación de dosis no concuerda con la ficha técnica vigente.
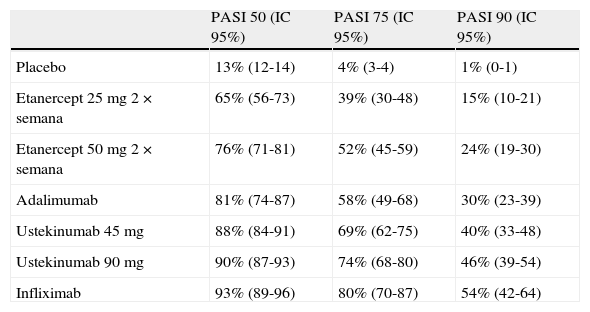
Resultados de eficacia (probabilidad de respuesta expresada en porcentaje) medida en el momento de evaluación de la variable de respuesta principal en cada ensayo según el metaanálisis en red de Reich et al.29
| PASI 50 (IC 95%) | PASI 75 (IC 95%) | PASI 90 (IC 95%) | |
| Placebo | 13% (12-14) | 4% (3-4) | 1% (0-1) |
| Etanercept 25mg 2×semana | 65% (56-73) | 39% (30-48) | 15% (10-21) |
| Etanercept 50mg 2×semana | 76% (71-81) | 52% (45-59) | 24% (19-30) |
| Adalimumab | 81% (74-87) | 58% (49-68) | 30% (23-39) |
| Ustekinumab 45mg | 88% (84-91) | 69% (62-75) | 40% (33-48) |
| Ustekinumab 90mg | 90% (87-93) | 74% (68-80) | 46% (39-54) |
| Infliximab | 93% (89-96) | 80% (70-87) | 54% (42-64) |
Los datos de ustekinumab proceden de ensayos clínicos en los que la asignación de dosis no concuerda con la ficha técnica vigente, pero en este metaanálisis se emplean datos correspondientes a la dosis ajustada a peso.
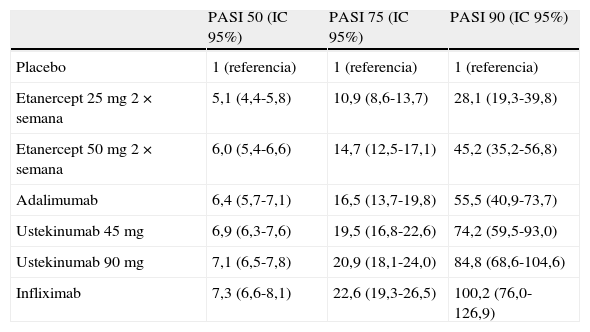
Resultados de eficacia (RR con respecto a placebo) medida en el momento de evaluación de la variable de respuesta principal en cada ensayo según el metaanálisis en red de Reich et al.29
| PASI 50 (IC 95%) | PASI 75 (IC 95%) | PASI 90 (IC 95%) | |
| Placebo | 1 (referencia) | 1 (referencia) | 1 (referencia) |
| Etanercept 25mg 2×semana | 5,1 (4,4-5,8) | 10,9 (8,6-13,7) | 28,1 (19,3-39,8) |
| Etanercept 50mg 2×semana | 6,0 (5,4-6,6) | 14,7 (12,5-17,1) | 45,2 (35,2-56,8) |
| Adalimumab | 6,4 (5,7-7,1) | 16,5 (13,7-19,8) | 55,5 (40,9-73,7) |
| Ustekinumab 45mg | 6,9 (6,3-7,6) | 19,5 (16,8-22,6) | 74,2 (59,5-93,0) |
| Ustekinumab 90mg | 7,1 (6,5-7,8) | 20,9 (18,1-24,0) | 84,8 (68,6-104,6) |
| Infliximab | 7,3 (6,6-8,1) | 22,6 (19,3-26,5) | 100,2 (76,0-126,9) |
Los datos de ustekinumab proceden de ensayos clínicos en los que la asignación de dosis no concuerda con la ficha técnica vigente, pero en este metaanálisis se emplean datos correspondientes a la dosis ajustada a peso.
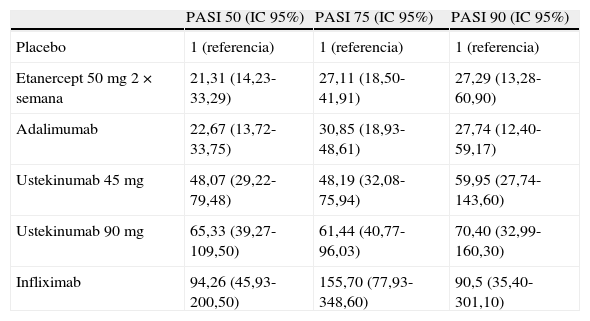
Resultados de eficacia (OR medianas e IC 95% con respecto a placebo) medida en el momento de evaluación de la variable de respuesta principal en cada ensayo según el metaanálisis bayesiano en red de Lin et al.30
| PASI 50 (IC 95%) | PASI 75 (IC 95%) | PASI 90 (IC 95%) | |
| Placebo | 1 (referencia) | 1 (referencia) | 1 (referencia) |
| Etanercept 50mg 2×semana | 21,31 (14,23-33,29) | 27,11 (18,50-41,91) | 27,29 (13,28-60,90) |
| Adalimumab | 22,67 (13,72-33,75) | 30,85 (18,93-48,61) | 27,74 (12,40-59,17) |
| Ustekinumab 45mg | 48,07 (29,22-79,48) | 48,19 (32,08-75,94) | 59,95 (27,74-143,60) |
| Ustekinumab 90mg | 65,33 (39,27-109,50) | 61,44 (40,77-96,03) | 70,40 (32,99-160,30) |
| Infliximab | 94,26 (45,93-200,50) | 155,70 (77,93-348,60) | 90,5 (35,40-301,10) |
Los datos de ustekinumab proceden de ensayos clínicos en los que la asignación de dosis no concuerda con la ficha técnica vigente.
Resultados de eficacia incremental (diferencia de riesgo [RD] multiplicada por 100 para expresarla en porcentaje) a las 24 semanas en el metaanálisis de Lucka et al.31
| PASI 75 (IC 95%) | |
| Etanercept 25mg 2×semana | 45% (34-56) |
| Etanercept 50mg 2×semana×12 semanas, luego 25mg 2×semana | 50% (42-57) |
| Etanercept 50mg 2×semana | 62% (52-72) |
| Adalimumab | 60% (45-74) |
| Ustekinumab 45mg | 70% (64-77) |
| Ustekinumab 90mg | 77% (71-83) |
| Infliximab | 78% (72-83) |
Los datos de ustekinumab proceden de ensayos clínicos en los que la asignación de dosis no concuerda con la ficha técnica vigente.
Los resultados se presentan en forma de probabilidad de respuesta, diferencia de riesgo (RD) o eficacia incremental (diferencia de las tasas de respuesta con respecto al placebo), riesgo relativo (RR) u odds ratio (OR) (razón de probabilidades). Es importante comprender la diferencia entre RR y OR. Si para un biológico determinado la tasa de respuesta PASI 75 es del 75%, es 75/25=3 veces más probable alcanzarla que no alcanzarla: las apuestas (odds) son 3 a 1; mientras que en el caso del placebo la respuesta PASI 75 es 5% y la probabilidad (odds) de conseguir la respuesta es 5/95, o 0,0526; el RR (fármaco con respecto a placebo) de alcanzar la respuesta PASI 75 es 75/5, o 15, mientras que la OR es 75×95/25×5=57.
En la interpretación de estas tablas se debe tener en cuenta que si los intervalos de confianza al 95% (IC 95%) se solapan no puede afirmarse que exista una diferencia estadísticamente significativa en cuanto a la eficacia entre 2 biológicos.
Finalmente, en la figura 1 se recogen los resultados de una comparación bilateral basada en un metaanálisis bayesiano en red30; cuando los IC 95% (en este tipo de metaanálisis se habla de «intervalos creíbles») no sobrepasan el valor 0 de las OR puede afirmarse la superioridad (a la derecha) o inferioridad (a la izquierda) del primer miembro del par.
Otros criterios de selecciónPara la selección de un biológico u otro hay que tener en cuenta múltiples aspectos relacionados con las características del paciente, la enfermedad y el tratamiento en sí. Por lo que se refiere al paciente habrá que tener en cuenta las comorbilidades que representan una contraindicación relativa en el caso de los agentes dirigidos contra el factor de necrosis tumoral alfa (anti-TNF), como son la existencia de insuficiencia cardíaca congestiva avanzada, lupus eritematoso y otras enfermedades autoinmunes, así como la presencia de enfermedad desmielinizante83. En estos casos ustekinumab sería la primera alternativa terapéutica.
Existen datos que sugieren que el riesgo de determinadas infecciones es algo menor con etanercept que con otros anti-TNF84,85, pero no disponemos de evidencias que permitan extrapolar posibles conclusiones (y recomendaciones) a pacientes con psoriasis. Aunque la experiencia es limitada, también existe mayor experiencia con este fármaco en el tratamiento de pacientes con infección crónica por el virus de la hepatitis C y la infección por el VIH, si bien la elección de un fármaco biológico en estos pacientes debe realizarse de forma individualizada y acompañarse de una monitorización adecuada y conjunta con el médico a cargo de la infección crónica86,87.
Por lo que se refiere a pacientes pediátricos, etanercept es el único biológico aprobado para el tratamiento de la psoriasis a partir de los 6 años.
En el caso de pacientes que puedan quedarse embarazadas hay que considerar cada caso de forma individual, teniendo en cuenta la gravedad de la psoriasis y la opinión de la paciente. Por lo general, se recomienda evitar la exposición del feto a partir del segundo trimestre de embarazo (cuando los anticuerpos pueden atravesar la barrera placentaria) y hay que tener en cuenta la vida media de cada biológico; puede afirmarse que si se suspende el tratamiento cuando la paciente detecta el embarazo es altamente improbable que se produzca ningún tipo de exposición fetal88.
En el caso de los pacientes obesos o con un peso superior a 90-100kg hay que tener en cuenta que en esta subpoblación cabe esperar tasas de respuesta algo inferiores (en especial por lo que se refiere a la respuesta óptima) y mayores tasas de fracaso primario cuando se prescriben biológicos a dosis fijas88, y también se debe considerar el incremento del coste asociado al tratamiento dependiente del peso en el caso de infliximab o ustekinumab.
En relación con la enfermedad, habrá que tener en cuenta la presencia o no de artropatía, la intensidad basal (medida por el PASI) y la necesidad de una respuesta más o menos veloz. En principio, aunque se ha demostrado el efecto de ustekinumab sobre la artritis psoriásica89, hay que tener en cuenta que, en la actualidad, solo están aprobados con esta indicación los anti-TNF; a falta de ensayos de comparación directa los metaanálisis no han demostrado que existan diferencias significativas entre ellos en lo que se refiere a la eficacia basada en parámetros tales como American College of Rheumatology 20 (ACR20), ACR50 y ACR7090. La mayoría de los estudios se han efectuado en pacientes con la variedad poliarticular de la artritis psoriásica, y existen menos datos acerca de la eficacia sobre el componente axial de la misma; pero hay evidencia de la eficacia de los agentes anti-TNF y ustekinumab sobre la entesitis y la dactilitis90.
Las características basales de gravedad (valor del PASI) no determinan a priori la selección del biológico, y no existe ninguna evidencia científica que avale la restricción del uso de un determinado biológico solo para los pacientes con psoriasis más grave o como segunda línea de tratamiento biológico28. Se ha propuesto un determinado perfil de paciente como idóneo para el tratamiento con infliximab91: en presencia de psoriasis grave, en particular si se asocia con onicopatía o artritis, cuando es urgente el blanqueamiento de la enfermedad y cabe esperar mala adherencia del paciente a la automedicación y cuando se prevé un tratamiento continuado a largo plazo. Sin embargo, no hay motivo para restringir el empleo de infliximab a pacientes con valores de PASI superiores a 20: no se han demostrado diferencias significativas en cuanto a la tasa de respuesta PASI 75 dependiendo de que el PASI basal sea o no superior a dicho valor de corte72. El mecanismo de acción de ustekinumab, distinto al de los anti-TNF, tampoco justifica su posicionamiento como biológico de segunda línea.
Hay que tener en cuenta las diferencias farmacocinéticas, de mecanismo de acción y perfil de seguridad entre los diferentes biológicos disponibles (tabla 7), circunstancias que dificultan una clasificación en «clases terapéuticas» con elementos intercambiables92; a estas diferencias hay que añadir aspectos tales como la vía y conveniencia de administración y las diferencias relativas en cuanto al coste de la fase de «carga farmacocinética» o tratamiento de inducción51.
Principales parámetros de farmacocinética, posología y seguridad de los tratamientos biológicos para la psoriasis moderada/grave
| Etanercept | Infliximab | Adalimumab | Ustekinumab | |
| Semivida de eliminación aproximada | 4 días | 9 días | 15 días | 21 días |
| Dosis | 50mg sc 1 vez por semana o 25mg 2 veces por semana durante un período máximo de 24 semanas; alternativamente 50mg 2 veces por semana las primeras 12 semanas. Terapia continua apropiada para algunos pacientes adultos | 5mg/kg iv inducción semanas 0, 2, 6 y luego cada 8 semanas | 80mg sc 1ª dosis, 40mg al cabo de una semana, luego 40mg cada 2 semanas | 45mg sc 1.a dosis, 45mg 4 semanas después y luego 45mg cada 12 semanas; en pacientes con peso superior a 100kg las dosis se duplican. La dosis de 45mg también ha demostrado ser eficaz. Sin embargo, la eficacia es mayor con la dosis de 90mg |
| Inicio de efecto clínico habitualmente en: | 4-8 semanas | 1-2 semanas | 2-4 semanas | 2-4 semanas |
| Principales riesgosa | Tuberculosis y otras infecciones; en registros reumatológicos menor riesgo de tuberculosis e infecciones serias que anticuerpos anti-TNF | Tuberculosis y otras infecciones | Tuberculosis y otras infecciones | Tuberculosis y otras infecciones. La ficha técnica no incluye consideraciones especiales en pacientes con insuficencia cardíaca, enfermedad desmielinizante o enfermedades autoinmunes, a diferencia de los anti-TNF |
| Consideraciones especiales | Aprobado en pacientes pediátricos a partir de 6 años de edad; 0,8mg/kg (hasta un máximo de 50mg por dosis) una vez a la semana durante un periodo máximo de 24 semanas. Aprobado para artritis psoriásica | Aprobado para artritis psoriásica | Aprobado para artritis psoriásica | Eficaz, pero no aprobado para artritis psoriásica |
En principio, el tratamiento de la psoriasis con agentes biológicos se plantea como tratamiento continuo; este es especialmente adecuado para los pacientes con recaídas rápidas al suspender cualquier tipo de tratamiento. En algunos pacientes puede plantearse la interrupción del tratamiento por diversas razones, tales como intervenciones quirúrgicas, embarazo, viajes o decisión del propio paciente. También en algunos enfermos con brotes intermitentes de la enfermedad sin respuesta a tratamientos sistémicos convencionales o con contraindicación para los mismos puede plantearse el tratamiento intermitente, como se discutirá para cada biológico en el apartado correspondiente.
En los pacientes que mantienen una respuesta óptima a largo plazo (más de un año) puede plantearse la reducción de la dosis o la frecuencia de administración44, o la interrupción del tratamiento de acuerdo con el paciente, según el criterio clínico.
Tratamiento a largo plazo: continuo, intermitente y a demandaLas extensiones abiertas de algunos ensayos clínicos han proporcionado datos de eficacia a largo plazo.
Los pacientes del estudio REVEAL (adalimumab) que obtuvieron respuesta PASI 75 a las semanas 16 y 33 mantuvieron dicha respuesta en un 83% de los casos a las 100 semanas y en un 76% a las 160 semanas de tratamiento (LOCF); las tasas correspondientes a la respuesta PASI 90 fueron del 59 y 50%93. Aunque buena parte de los pacientes que alcanzan los requisitos para ser considerados respondedores durante la fase de inducción son capaces de mantener la respuesta si continúan el tratamiento de forma continuada, las probabilidades de mantener la respuesta son mayores en aquellos que alcanzan mejores respuestas (respuesta PASI 90 o PASI 100) durante esta fase.
En el estudio PHOENIX I (ustekinumab) los pacientes con respuesta PASI 75 inicial que fueron realeatorizados en la semana 40 a continuar con el tratamiento cada 12 semanas, y mantuvieron los niveles de respuesta alcanzados hasta la semana 244 (5 años). La respuesta PASI 75 en este grupo de pacientes fue del 79 y 81% y la respuesta PASI 100 del 31 y 38% para las dosis de 45mg y 90mg, respectivamente, en dicha semana 24494.
En un estudio post hoc en el que se incluyeron pacientes tratados con etanercept a dosis diferentes durante un periodo de hasta 4 años el 67% de los respondedores durante el periodo de inducción (PGA 0/1) mantuvieron la respuesta a las 24 semanas, con apenas variaciones hasta la semana 4895.
Con respecto a infliximab los resultados a largo plazo son limitados y están condicionados a la duración de los ensayos clínicos (inferior al año) y sin extensión abierta. En el estudio EXPRESS II el 74% de los pacientes que obtuvieron la respuesta PASI 75 durante las primeras semanas fueron capaces de mantenerla cuando realizaron tratamiento continuado hasta la semana 5072.
Los datos procedentes de registros de pacientes con psoriasis indican que la eficacia global de los anti-TNF disminuye con el tiempo, disminuyendo progresivamente la retención del tratamiento («supervivencia» del fármaco) como consecuencia de la pérdida de eficacia y de la aparición de acontecimientos adversos. En un trabajo basado en una base de datos clínica (Dermbio) la tasa de supervivencia del tratamiento a los 4 años fue de un 40% para adalimumab y etanercept y de un 70% para infliximab45. Sin embargo, deben tenerse en cuenta sesgos no evaluados como son los criterios de selección del fármaco biológico por parte de los dermatólogos o diferencias en el manejo de los fármacos.
La experiencia en cuanto a la supervivencia de ustekinumab en el ámbito clínico es limitada debido a su más reciente introducción en el mercado. En un trabajo basado en el mismo registro, aunque limitado a un primer año (seguimiento máximo de 321 días), la supervivencia de ustekinumab fue del 95,5%, frente a la del 75% para el conjunto de los fármacos anti-TNF96.
Aunque el tratamiento biológico en general se plantea de forma continuada y a largo plazo, en casos seleccionados se puede considerar el tratamiento de forma intermitente o a demanda. En pacientes con respuesta óptima mantenida a largo plazo se puede plantear suspender el tratamiento o disminuir la dosis y/o la frecuencia de administración, aunque no existe evidencia científica suficiente que permita establecer el abordaje ideal en cada caso.
En el caso de adalimumab se dispone de datos de la fase de extensión del estudio REVEAL. A partir de la semana 33 los pacientes que habían presentado respuesta PASI 75 a las semanas 16 y 33 fueron asignados aleatoriamente a uno de 2 grupos: o bien seguían recibiendo tratamiento, o bien se les retiraba, reintroduciéndolo cuando se producía una «pérdida de respuesta adecuada» (pérdida de la respuesta PASI 50 o aumento de 6 puntos o más en la puntuación PASI en el momento de la retirada). El 28% de pacientes con respuesta PASI 75 realeatorizados a placebo en la semana 33 experimentaron una «pérdida de respuesta adecuada» comparado con el 5% que continuaron con adalimumab (p<0,001)38. De los pacientes que dejaron de responder adecuadamente después de la realeatorización a placebo y fueron incluidos en la extensión abierta del ensayo, el 38% (25/66) y el 55% (36/66) recuperaron la respuesta PASI 75 después de 12 y 24 semanas de tratamiento, respectivamente38. Las tasas de respuesta PASI 75 para los grupos de tratamiento continuo e interrumpido fueron 84 y 45% a la semana 52, 86 y 79% a la semana 76 y 75 y 73% a la semana 160 (LOCF)97. El retratamiento fue más efectivo en aquellos pacientes que lo iniciaron antes de perder la respuesta PASI 50.
Etanercept es el fármaco para el que existe mayor experiencia acumulada acerca del empleo intermitente, incluido en su ficha técnica. Aunque la eficacia del tratamiento intermitente (a demanda) con etanercept es inferior a la del tratamiento continuo98, un 83% de los pacientes recuperaron el objetivo terapéutico (PGA≤2) con el primer ciclo de retratamiento en el estudio CRYSTEL99.
En un estudio efectuado con infliximab los pacientes se asignaron aleatoriamente a recibir tratamiento cada 8 semanas o a demanda (cuando en la visita correspondiente a la infusión perdían la respuesta PASI 75 se administraba infusión; si no era así, placebo) a partir de la semana 1472. En los pacientes tratados con la dosis de 5mg/kg se observó una menor eficacia a la semana 50 en los pacientes tratados a demanda con respecto a los que recibían tratamiento continuo, tanto por lo que respecta a la tasa de respuesta PASI 75 (38,1% frente a 54,5%) como a la respuesta PASI 90 (10,4% frente a 34,3%). También fue superior en dicho grupo el porcentaje de pacientes en los que se detectaron anticuerpos contra el fármaco (41,5 frente a 35,8%) y la tasa de reacciones de infusión: 9,2 por 100 infusiones frente a 6,2%72. El tratamiento intermitente (con nuevas fases de inducción) no se recomienda por este último motivo: 8 reacciones de infusión graves (4%) en el grupo de tratamiento intermitente frente a 1 (<1%) en el grupo de mantenimiento, lo que determinó la interrupción de un ensayo clínico100.
Respecto al tratamiento intermitente con ustekinumab en el ensayo PHOENIX 1 la mediana de tiempo hasta la recaída tras la suspensión del tratamiento (asignada aleatoriamente a la semana 40) fue de 15 semanas (27 semanas después de la última dosis), y un 85% de los pacientes recuperaron la respuesta PASI 75 a las 12 semanas después de reiniciar el tratamiento, con independencia de la dosis76. En el estudio ACCEPT el tratamiento de los pacientes con puntuación PGA≤2 en la semana 12 se interrumpió hasta que la psoriasis alcanzó un PGA ≥3. La mediana de tiempo que transcurrió entre ambos momentos fue de 14,4 semanas entre los pacientes tratados con ustekinumab 45mg, 18,1 semanas entre los tratados con ustekinumab 90mg y 7,3 semanas entre los tratados con etanercept. De los 633 pacientes retratados con ustekinumab al alcanzar un PGA≥3, 534 (84%) presentaron un PGA≤2 en el transcurso de las 12 semanas siguientes al retratamiento54.
Según la ficha técnica no parece que exista relación entre el desarrollo de anticuerpos frente a etanercept y la respuesta clínica o los efectos adversos37. Existen datos que indican que la formación de anticuerpos contra adalimumab, infliximab y ustekinumab disminuye las concentraciones séricas del fármaco y la tasa de respuesta en pacientes con psoriasis40,101,102. Sin embargo, no se dispone de suficiente evidencia científica que permita establecer la conveniencia del tratamiento combinado con metotrexato ni la utilidad de la determinación de niveles del fármaco o anticuerpos dirigidos contra el mismo en el manejo terapéutico de pacientes con psoriasis; probablemente estas medidas sean útiles para alargar la «supervivencia» del fármaco (en el caso de la combinación con metotrexato) y tomar decisiones en cuanto a su sustitución (la presencia de anticuerpos indicaría que el mecanismo de resistencia es inmunológico y por tanto específico de fármaco)103.
Terapia combinada con otros tratamientos sistémicosSe han publicado diversos ensayos clínicos y estudios retrospectivos que indican que la combinación de agentes biológicos con tratamientos sistémicos convencionales aumenta la eficacia del tratamiento sin un incremento significativo de los acontecimientos adversos.
Etanercept parece especialmente apropiado para el tratamiento combinado104,105 y existe evidencia de la utilidad de la combinación con fototerapia106–110, metotrexato111–113 y ciclosporina114 para aumentar la eficacia del tratamiento, y con acitretina para disminuir la dosis de etanercept consiguiendo una eficacia equivalente115.
En el caso de adalimumab, con una experiencia publicada menos extensa, la combinación con fototerapia, metotrexato, fototerapia y otros fármacos también ha dado resultados favorables116,117,47.
Por lo que se refiere a infliximab, aunque las publicaciones son escasas118,119, la combinación con metotrexato es una práctica habitual, que se emplea en más del 50% de los pacientes en algunas series120,121.
Con respecto a ustekinumab se ha comprobado en una pequeña serie cómo la combinación con fototerapia UVB de banda estrecha podría acelerar y optimizar la respuesta durante las primeras semanas122.
En aquellos pacientes en tratamiento con alguna de las terapias sistémicas tradicionales, que no alcancen un PASI 50 o en los que se llegue a dosis tóxicas y que precisen de tratamiento biológico, puede ser necesario un periodo de transición en que la combinación de ambos fármacos durante unas semanas evite la recaída de la enfermedad que se podría producir en caso de suspender el tratamiento sistémico antes de la introducción del biológico123.
Para una explicación más detallada del empleo de fototerapia, metotrexato y acitretina en el tratamiento de la psoriasis se recomienda consultar los correspondientes Consenso124 y Directrices125,126 previamente publicados por el Grupo de Psoriasis de la AEDV.
ConclusionesEstas directrices representan un resumen de la evidencia científica disponible referida a la eficacia y criterios de selección de los tratamientos biológicos para la psoriasis comercializados en España en el momento de su publicación. En cualquier caso, los agentes biológicos deben seleccionarse con la ayuda del conocimiento de las tasas de respuesta publicadas en los ensayos clínicos y de acuerdo con las características del paciente: edad, sexo, peso, comorbilidades asociadas, presencia o no de artritis activa y características evolutivas de la enfermedad en el momento de la prescripción.
El principal factor determinante de la elección de un biológico o del cálculo de su cociente coste/beneficio es la eficacia del mismo, referida a la situación basal y evaluada a partir de la evidencia científica obtenida en los ensayos clínicos. Las tasas de respuesta PASI 50, PASI 75 y PASI 90 permiten hacer inferencias poblacionales, pero no predecir la respuesta individual de cada paciente.
Debe evaluarse el resultado de cualquier intervención en un plazo máximo de 3 meses. La máxima eficacia terapéutica de todos los agentes biológicos disponibles para el tratamiento de la psoriasis se consigue en un plazo inferior o igual a 6 meses en la mayoría de los pacientes.
Según un reciente metaanálisis31 la eficacia incremental (diferencia de riesgo con respecto a placebo) referida a conseguir una respuesta PASI 75 a las 24 semanas de los diferentes biológicos es: infliximab 78% (IC 95%: 72-83); ustekinumab 90mg 77% (71-83); ustekinumab 45mg 70% (64-77); adalimumab 60% (45-74); etanercept 100mg/semana durante 12 semanas, seguido de etanercept 50mg/semana 50% (42-57); etanercept 50mg/semana 45% (34-56).
En la decisión del tratamiento inicial también se tendrán en cuenta la probabilidad de fracaso terapéutico primario, la conveniencia de la vía y frecuencia de administración y aspectos económicos (coste de adquisición en la fase de inducción y mantenimiento) que quedan fuera del ámbito de estas directrices.
Otros aspectos a tener en cuenta en la prescripción, referentes a farmacocinética, vía de administración, seguridad, indicación pediátrica o en artritis psoriásica se resumen en la tabla 7.
La inmunogenicidad de los agentes biológicos determina la producción de anticuerpos contra el fármaco, depende de cada agente y se correlaciona con una menor adherencia al tratamiento, pérdida de respuesta y —en el caso de infliximab— un mayor riesgo de reacciones de infusión que desaconseja el tratamiento intermitente.
En caso de fallo primario o secundario de un agente biológico se puede plantear administrar tratamiento combinado con un agente sistémico o foto(quimio)terapia, o intensificar temporalmente la dosis del biológico pero, en general, se dará preferencia a la sustitución por otro biológico.
La combinación de agentes biológicos con tratamientos sistémicos convencionales aumenta la eficacia del tratamiento sin un incremento significativo de los acontecimientos adversos.
Nota finalLas presentes directrices no representan una revisión exhaustiva de la bibliografía y fichas técnicas de los fármacos en ella incluidos; se ha centrado la discusión en los aspectos prácticos del tratamiento y la selección del agente. Se recomienda que el prescriptor lea atentamente las instrucciones de la ficha técnica de cada producto y las compare con las recomendaciones de las directrices en lo que respecta a las dosis, contraindicaciones y posibles interacciones. Los autores agradecerán la colaboración de los lectores en la detección de posibles inexactitudes y en la actualización de las directrices conforme vaya estando disponible información adicional.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores han participado en ensayos clínicos, han efectuado asesorías y/o han recibido honorarios por conferencias, o financiación para asistir a actividades de formación con el patrocinio de Abbvie (antes Abbott), Janssen, MSD y/o Pfizer.